动静脉畸形脑出血与高血压脑出血患者术后预后比较及影响因素分析
夏 斌,李晓磊,王敏娟,孙 超,任天顺
(西安医学院第一附属医院,陕西 西安 710077)
高血压脑出血(Hypertensive intracerebral hemorrhage,HICH)指高血压引起成人脑部动、静脉和毛细血管破裂导致的脑实质内出血,其发病率、致残率及病死率均较高[1-3]。动静脉畸形脑出血(Arteriovenous malformation intracerebral hemorrhage,AVM-ICH)约占脑出血的2%~3%,虽然发病率远低于高血压脑出血,但也对社会经济和医疗保健系统带来了沉重的负担[4]。有研究[5]比较了AVM-ICH和HICH的致残率和病死率,结果显示AVM-ICH患者的预后优于HICH患者,因此本研究重点探讨经过手术治疗的AVM-ICH患者在术后3个月和1年预后方面是否优于HICH患者,并进一步探讨影响患者术后预后的因素。
1 资料与方法
1.1 一般资料 回顾性分析2017年12月至2020年12月在我院神经外科接受颅内血肿清除术的172例患者的临床资料。AVM-ICH患者30例(AVM-ICH组),其中男性18例,女性12例;年龄18~73岁,平均(45.2±16.5)岁;入院格拉斯哥昏迷量表(GCS)评分(9.1±2.9)分;左侧8例,右侧22例;浅部(额叶、顶叶、颞叶、枕叶)25例,深部(基底节、丘脑、脑干、小脑)5例;血肿体积<30 cm321例,≥30 cm39例;收缩压(153.9±25.5)mmHg,舒张压(89.7±19.0)mmHg;高血脂5例,出血破入脑室7例;住院时间<15 d 16例,≥15 d 14例。HICH患者142例(HICH组),其中男性84例,女性58例;年龄为26~96岁,平均(60.8±13.4)岁;入院GCS评分(8.01±2.5)分;左侧58例,右侧84例;浅部(额叶、顶叶、颞叶、枕叶)30例,深部(基底节、丘脑、脑干、小脑)112例;血肿体积<30 cm385例,≥30 cm357例;收缩压(164.2±18.9)mmHg,舒张压(97.7±18.2)mmHg;高血脂47例,出血破入脑室61例;住院时间<15 d 49例,≥15 d 93例。病例纳入标准:①均行手术治疗;②经术前头颅CT、MRI或数字减影血管造影(DSA)证实有颅内出血,其中AVM-ICH经头颅CT血管成像(CTA)或DSA证实为AVM,HICH符合高血压脑出血诊断标准[6];③手术前后均有完善的可供形态学测量及即刻评估显微手术结果的影像学资料。排除标准:①脑外伤者;②无血肿凝块的蛛网膜下腔出血者;③因肿瘤引起出血者;④未接受CT、MRI及血管造影成像和神经内科收治的患者。
1.2 影像学检查 所有患者术前均行头颅CT、MRI或DSA检查,明确为脑AVM并破裂出血及高血压脑出血。分析指标包括血肿位置、脑出血部位、血肿体积、是否破入脑室。血肿体积采用多田公式进行计算[7]。
1.3 手术方法
1.3.1 试验组:均在气管插管全身麻醉下行脑动静脉畸形血管团显微外科手术切除术。术前根据头颅CT、MRI或全脑血管DSA结果精确定位畸形血管团位置,包括最大层面和以外耳道为基线的前后距离,选择合适的手术入路。头架固定头部后,在定位位置逐层切开头皮、帽状腱膜及肌肉,牵开器牵开切口,颅骨钻钻孔,取下骨瓣,在显微镜下切开硬脑膜及缝合硬脑膜,通过锐性分离蛛网膜,进入脑沟、脑裂等自然裂隙内,然后行血肿清除,同时将畸形血管团一并切除。术中需先找到供血动脉并阻断以减少出血率,最后再游离切除引流静脉。
1.3.2 对照组:均在气管插管全身麻醉下行小骨瓣开颅术。术前定位方法同试验组。选择合适的手术入路,头架固定头部后,在定位位置逐层切开头皮、帽状腱膜及肌肉,牵开器牵开切口,颅骨钻钻孔,取下骨瓣,在显微镜下切开硬脑膜及缝合硬脑膜,通过锐性分离蛛网膜进入脑沟、脑裂等自然裂隙内。在血肿腔内采用吸引器将血肿吸出,配合双极电凝止血,放置硬膜外引流管一根另戳孔引出,骨瓣还原并复位,使用连接片固定。
1.4 术后随访与评估 随访方式包括回院复诊、电话咨询、微信随诊等多种形式,以了解患者恢复情况。采用改良Rankin量表评分对患者出院后3个月和1年的预后情况进行评估,改良Rankin评分≤3分为预后良好,>3分为预后不良。
1.5 观察指标 比较两组患者年龄、性别、入院GCS评分、血肿位置、脑出血部位、血肿体积、收缩压、舒张压、高血脂、是否破入脑室、住院时间及预后情况,分析术后3个月和1年影响预后的因素。
1.6 统计学方法 数据均采用SPSS 25.0统计学软件进行分析。计量资料采用均数±标准差表示,组间比较采用t检验。计数资料以[例(%)]表示,组间比较采用χ2检验。影响术后预后的因素采用Logistic回归模型分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 两组患者临床资料比较 见表1。两组患者年龄、入院GCS评分、收缩压、舒张压、脑出血部位、出血破入脑室等比较,差异有统计学意义(均P<0.05)。
2.2 两组患者术后不同时期预后情况比较 见表2。AVM-ICH组患者术后3个月和1年预后良好者占比均优于HICH组(χ2=5.206、6.356,均P<0.05)。
2.3 两组患者术后3个月和1年预后影响因素分析 见表3、4。Logistic回归分析结果显示,年龄、入院GCS评分、脑出血部位、出血破入脑室均是影响AVM-ICH和HICH患者术后3个月和1年预后的重要因素。
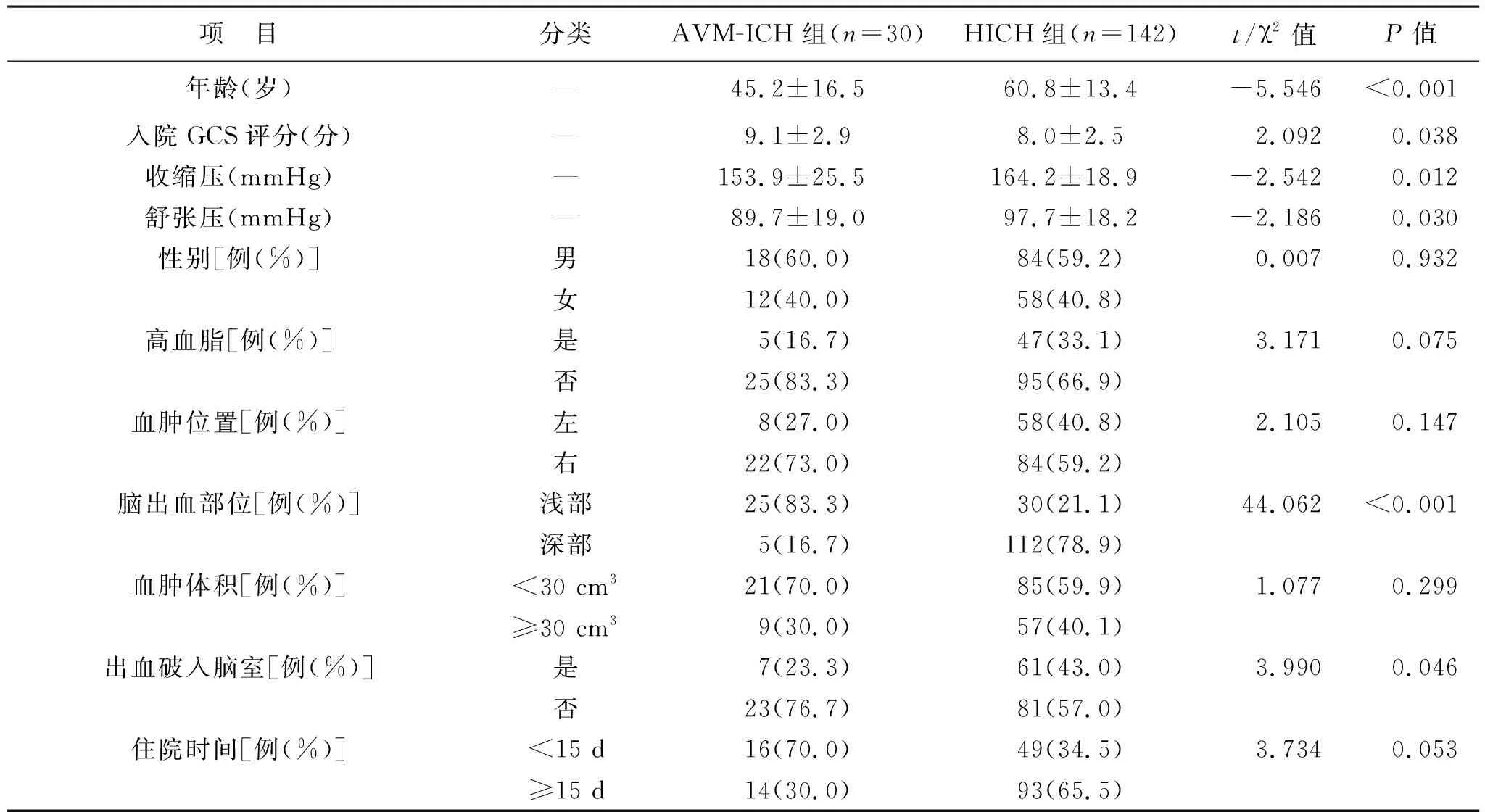
表1 两组患者临床资料比较

表2 两组患者术后不同时期预后情况比较[例(%)]
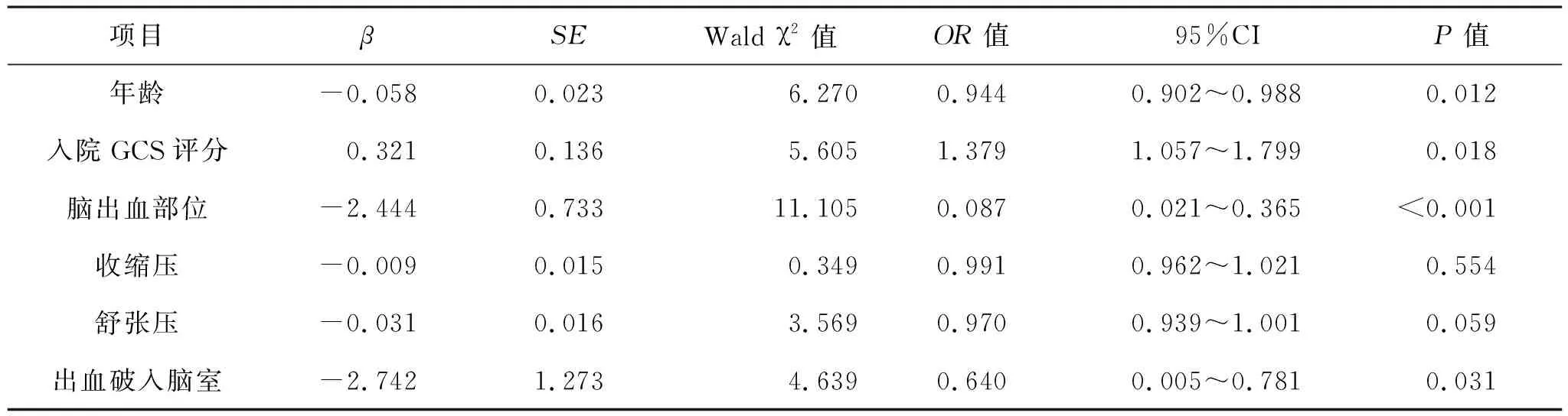
表3 两组患者术后3个月预后影响因素分析

表4 两组患者术后1年预后影响因素分析
3 讨 论
脑动静脉畸形是颅内常见的血管畸形疾病,具有较高的致死率和致残率。该病目前缺乏统一的治疗原则,主要包括保守治疗、血管内介入治疗、手术切除和立体定向放射治疗。HICH占急性脑血管病发病的10%,发病人群多见于老年人,病情危急,致残率和致死率高,预后差[8]。外科手术为治疗两种疾病的常见方式。
目前关于AVM-ICH与HICH患者术后预后情况对比的文献较少。近年来,大多数学者将关注点放在了两种疾病各自的术后预后情况方面。本研究发现,AVM-ICH患者术后3个月和1年的预后均优于HICH。此外,随着恢复时间的推移,AVM-ICH患者预后不良占比由术后3个月的66.7%下降到术后1年的53.3%,而HICH患者预后不良比例由术后3个月的84.5%下降到术后1年的76.1%。
年龄在疾病发展中起着至关重要的作用。在本研究中,HICH组患者发病年龄明显高于AVM-ICH组,术后3个月和1年预后均差于HICH组。许济[9]也认为高龄是HICH预后不良的危险因素。而王杰等[10]在脑出血小鼠模型中发现年龄的增长不足以加重小鼠预后。目前相关研究[11]显示,年龄是脑出血强大的独立危险因素,随着年龄的增加,高血压脑出血的发生率逐渐增高,机体机能退化,代偿能力减低,共病发生率升高,导致HICH患者预后较差,而AVM-ICH患者从上述几个影响因素来看,条件均优于HICH患者,所以年龄较小的AVM-ICH患者预后较好。
GCS评分由位于苏格兰的格拉斯哥大学学者所发明,主要用于评估颅脑损伤后的昏迷程度。入院GCS评分与颅脑损伤后出现的脑水肿及颅内压增高等因素有关,可以方便地估计损伤对患者神经功能的影响,从而帮助临床医生更好地判断患者的病情变化及预后。通常,术前GCS评分与患者昏迷程度成反比,分数越低,患者预后越差[12]。本研究显示,AVM-ICH组患者术前GCS评分高于HICH组,而在术后随访中发现前者术后3个月和1年的情况也明显好于后者,与Murthy等[5]研究结果一致。究其原因,可能是AVM-ICH患者较HICH患者更为年轻,对颅脑损伤的代偿功能较强,所以预后较为良好。另外,Chiu等[13]研究认为,HICH患者入院时GCS评分比较低,出现血肿扩大的概率更大,与本研究的数据特征基本符合。
本研究中,AVM-ICH组有83.3%的出血部位位于半球浅表的功能区,HICH组仅有21.1%位于浅表部位,与既往研究[14-15]基本一致。HICH患者出血部位多位于大脑深部,如基底节区、胼胝体、脑室旁等。吴燕等[16]报道,HICH出血部位以基底节区多见(68.95%),而脑叶部出血占全部脑出血的19.10%。王安帮等[17]发现,在120例因HICH行手术治疗的患者中,有91例(75.83%)出血部位位于基底节区、脑干、小脑等深部功能区,仅有29例(24.16%)为脑叶出血。大脑深部结构是大脑皮层与下级中枢联系的必经之路,深部出血的功能损伤较浅部出血功能损伤范围更广,与心跳、呼吸、运动及感觉等存在密切联系,一旦受损,将导致患者运动及感觉等神经功能障碍,甚至导致患者直接死亡[18]。本研究中,AVM-ICH患者在术后3个月和1年的预后均好于HICH,与赵常坤等[19]研究结果相似。
此外,本研究还发现脑出血是否破入脑室对预后的影响较为显著。黄伟等[20]研究表明,在神经内镜微创治疗HICH中,出血破入脑室是影响预后的危险因素。李根囤等[21]发现,在高血压脑出血合并破入脑室的重症患者中,病死率高达50%以上。出血本身对脑组织产生持续压迫效应,如果合并出血破入脑室,引发脑积水,将使颅内压进一步升高,导致脑组织压迫持续增加,大大降低患者预后,再加上血液本身刺激脑室上皮细胞产生炎症反应,炎症波及下丘脑会导致患者意识状态变差,脑灌注不足会进一步加大预后不良的风险。而另一项研究[22]发现,在高血压脑出血血肿清除后,置入激素缓释微粒可抑制炎症的进展,有助于神经功能的远期恢复。夏捷生等[23]研究认为,脑出血破入脑室患者预后总体差于未破入脑室者。
综上所述,AVM-ICH患者术后3个月及1年预后均优于HICH患者,年龄、入院GCS评分、脑出血部位、出血破入脑室均为其影响因素。

