多花黄精花粉萌发与传粉生物学特性*
李绪杰,盛雅娟,张彤,吴滢,解孟康,熊武建,廖文波,李晓红
1. 重要生物资源保护与利用研究安徽省重点实验室/安徽师范大学生命科学学院,安徽芜湖 241000
2. 有害生物控制与资源利用国家重点实验室/广东省热带亚热带植物资源重点实验室/中山大学生命科学学院,广东广州 510275
3. 上海市城市化生态过程与生态恢复重点实验室/华东师范大学生态与环境科学学院,上海 200241
多花黄精Polygonatum cyrtonemaHua 是天门冬科Asparagaceae 黄精属Polygonatum多年生草本植物,具有药用、食用、观赏等多种经济价值,为《中华人民共和国药典》(2020年版)规定3种药用黄精的基源植物之一[1]。黄精是我国传统中草药,最早记载于《名医别录》中,《证类本草》《本草纲目》《本草图经》等也有记载[2],药用历史悠久。传统中医药学认为黄精味甘平,具有补中益气、健脾润肺、益肾填精等功效。现代临床医学研究证明,黄精具有很好的调节血糖血脂、提高机体免疫力、抗菌、抗病毒、抗肿瘤、抗衰老等功效[3-6]。面对药材黄精市场的大量需求和野生资源的日渐枯竭,人工栽培多花黄精以满足市场需要已是势在必行。但目前多花黄精栽培主要以根状茎进行无性繁殖,不利于野生种群的遗传变异和栽培品种的优质化,且易引起药材品质退化,植株易感病虫害等问题[7-8]。多花黄精的有性繁殖栽培是满足市场需求和保护多花黄精野生资源的可持续发展之路。
在显花植物的有性繁殖栽培中,进行人工授粉需要保证花粉的活力及柱头的可授性。花粉活力测定方法多样,其中花粉离体萌发法是最真实可靠的检测花粉活力的方法[9]。花粉包含了高等植物的遗传信息,是植物种质资源库和基因库保存的重要材料,对花粉离体萌发条件的研究,有助于优化花粉的低温贮藏方法[10]。关于多花黄精种苗繁育的研究有很多[11-12],但对其传粉生物学的研究报道较少,仅刘佳等[13]对云南金平种植基地的多花黄精的传粉方式进行研究,另有学者对重庆市和浙江省移栽的多花黄精生殖生物学进行研究[14-15],安徽省地区多花黄精传粉生物学尚无系统性报道,前人均采用TTC 法测定多花黄精花粉活力,有关多花黄精的离体花粉萌发条件探究及花粉活力测定方法的比较研究未见报道。因此,本文以移栽自安徽省九华山地区的多花黄精为实验材料,对其花粉萌发条件进行试验探究,为花粉离体萌发法测定花粉活力提供理论支撑,同时对多花黄精的传粉生物学特性进行研究,以补全安徽省地区多花黄精传粉生物学研究资料,并为九华黄精的人工授粉提供建议。
1 材料与方法
1.1 试验材料及试验地概况
实验材料来自于芜湖安徽师范大学同质园(118°22'30.63″N, 31°20'9.92″E)移栽的多花黄精。研究所用的多花黄精为根状茎繁殖,移栽2 年,种茎来自安徽省池州市九华山地区(117°51'26.66″N, 30°33'43.17″E)。芜湖市位于安徽省东南部,地处长江下游,地理坐标介于东经117°40'~118°44'、北纬30°19'~31°34',该地区为亚热带湿润季风气候,年平均气温为15~16 ℃,日照时数约2 000 h,年降雨量约为1 200 mm,但年内降水分布不均,主要集中在春季、梅雨季节和初冬,无霜期每年达219~240 d。
1.2 开花物候观测
开花物候观测为2019 年5 月1 日至5 月28 日。单株观测:观察随机选定的7株多花黄精从第1朵花开放到最后1朵花凋谢的变化。记录始花期、终花期和花期持续时间。花序观测:随机选择7株花朵即将开放的多花黄精,每株分别随机标记5个花序,开花后每日统计各花序上新增开花数、花的开放顺序、花序开放的持续时间。单花观测:随机标记35 朵单花,记录单花开放的时间,同时观察其形态变化。开花振幅、同步指数计算方法:开花振幅代表所标记植株花序上单位时间的开花数,采用“花数·株-1·d-1”来表示;同步指数用Si表示,用于检测开花同步性高低
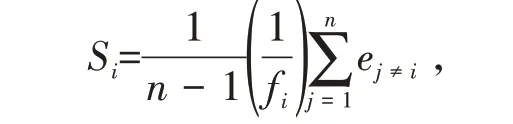
式中ej表示个体i和j花期重叠时间(d),fi表示个体i开花的总时间(d),n表示样地中个体总数。Si的变异范围为0~1,0表示种群内个体花期无重叠,1则表示完全重叠[16]。
1.3 花粉萌发条件探究
采用悬滴培养法,将不同开花时期的花粉与培养液充分混匀,在盖玻片中央滴入0.1 mL 的培养液,然后将其覆盖在单凹孔型载玻片上,使培养液液滴对准凹孔中央,盖玻片四周用凡士林封闭。将载玻片放入垫有湿滤纸的培养皿内,置于25 ℃恒温箱中培养24 h。在显微镜下观察统计花粉萌发率;花粉管长度大于等于花粉粒直径即认为其已萌发,每组处理制作3 枚载玻片作为3 次重复,每张载玻片随机观察3个视野,每个视野统计不少于30 粒花粉,若视野中花粉粒不足30 粒,则更换视野统计(图1)。
图1 悬滴培养法的花粉萌发率统计花粉管长度大于花粉粒直径视为已萌发。Fig.1 Statistics of pollen germination rate in hanging drop culture method
花粉萌发率=(萌发花粉粒数/花粉总数)×100%。
1.3.1 蔗糖、H3BO3、CaCl2单因子试验以多花黄精盛花期花朵的花粉为试验材料。蔗糖质量浓度梯度为50、100、150、200 g/L;H3BO3质量浓度梯度为50、100、200、300 mg/L; CaCl2质量浓度梯度为50、150、250、350 mg/L。用悬滴培养法进行花粉萌发试验,每组处理重复3 次,于25 ℃恒温箱中培养24 h,在显微镜下观察并统计花粉萌发率,筛选出多花黄精花粉萌发的适宜蔗糖、H3BO3和CaCl2质量浓度。
1.3.2 蔗糖、H3BO3、CaCl2正交试验以多花黄精盛花期花朵的花粉为试验材料。在单因素试验的基础上,确立蔗糖、H3BO3和CaCl2的质量浓度范围及梯度,进行L16(43)正交试验(表1)以寻求最佳的培养基配方,每组处理重复3次。
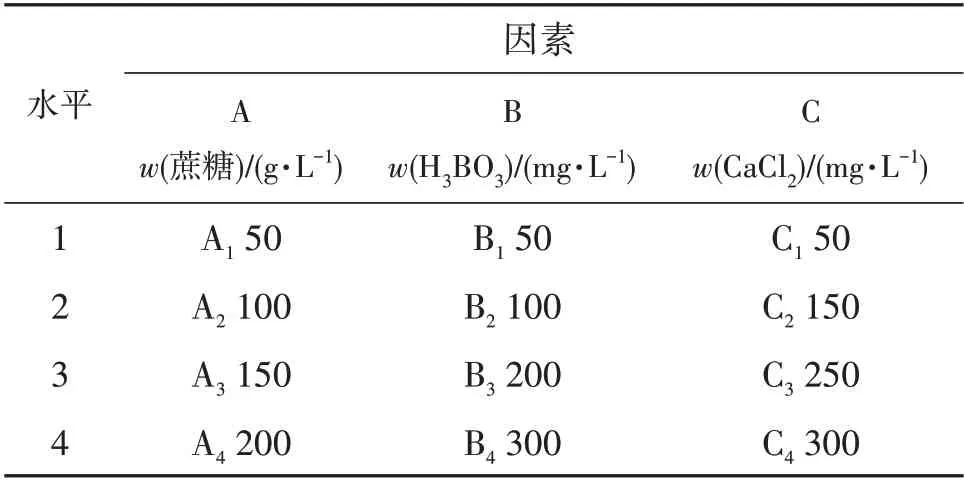
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test
1.4 化学染色法检测花粉活力的比较
以多花黄精盛花期花朵的花粉为试验材料,采用I2-KI 染色法[17]、MTT 染色法[18]和TTC 染色法[19]分别测定花粉活力,对结果进行比较分析,筛选出最适宜的多花黄精花粉活力的检测方法。
1.5 花粉活力及柱头可授性测定
采集花蕾期、含苞期、始花期、盛花期和枯萎前、后期6个时期的新鲜花朵(图2),将适量花粉与最适浓度的培养液混合,用悬滴培养法置于25 ℃恒温箱中培养24 h,之后在显微镜下观察并统计视野中萌发花粉粒所占比例。

图2 不同开花时期的多花黄精花朵Fig.2 The flowers of Polygonatum cyrtonema in different flowering stages
配制体积比为φ=1%联苯胺∶φ=3%过氧化氢∶水=4∶11∶22的联苯胺-过氧化氢溶液,采集花蕾期、含苞期、始花期、盛花期和枯萎前、后期6个时期的新鲜花朵,将各时期花朵的柱头置于滴有联苯胺-过氧化氢反应液的凹面载玻片中,使反应液浸没柱头,若柱头呈现蓝色并且周围反应液产生大量气泡,则说明柱头具有可授性,依据柱头染色深浅和气泡数量判断柱头可授性强弱。
1.6 传粉昆虫调查
调查时间为2019 年5 月11 日~5 月17 日,每天分8:00~10:00、12:00~14:00、15:00~17:00三个时间段进行。在同质园划分出多花黄精生长状况相近的南北两块区域(面积各约20 m²,相距约8 m),采用实时追踪法[20]和定时定点观察法相结合的调查方法对南北两个区域同时进行多花黄精传粉昆虫观察,记录昆虫访花时间、访问次数和传粉行为。
1.7 自然结实率统计
在同质园随机选定15 株多花黄精,对各植株的开花数和结实数进行监测,统计其自然结实率。
1.8 数据处理
试验数据均采用SPSS 22.0 进行单因素方差(ANOVA)分析,并用Duncan(α=0.05)分析法对数据进行多重比较。统计分析和制图通过Excel 2007实现。
2 结果与分析
2.1 多花黄精开花物候
2.1.1 单株开花物候多花黄精每年开花1 次,花期为4月末至6月初,盛花期在5月中旬。由表2可见,花期持续时间为(10.57 ± 2.19) d(平均值±标准差,N=7),花期同步指数为0.81±0.12,说明多花黄精在单株水平上具有较高的开花同步性。
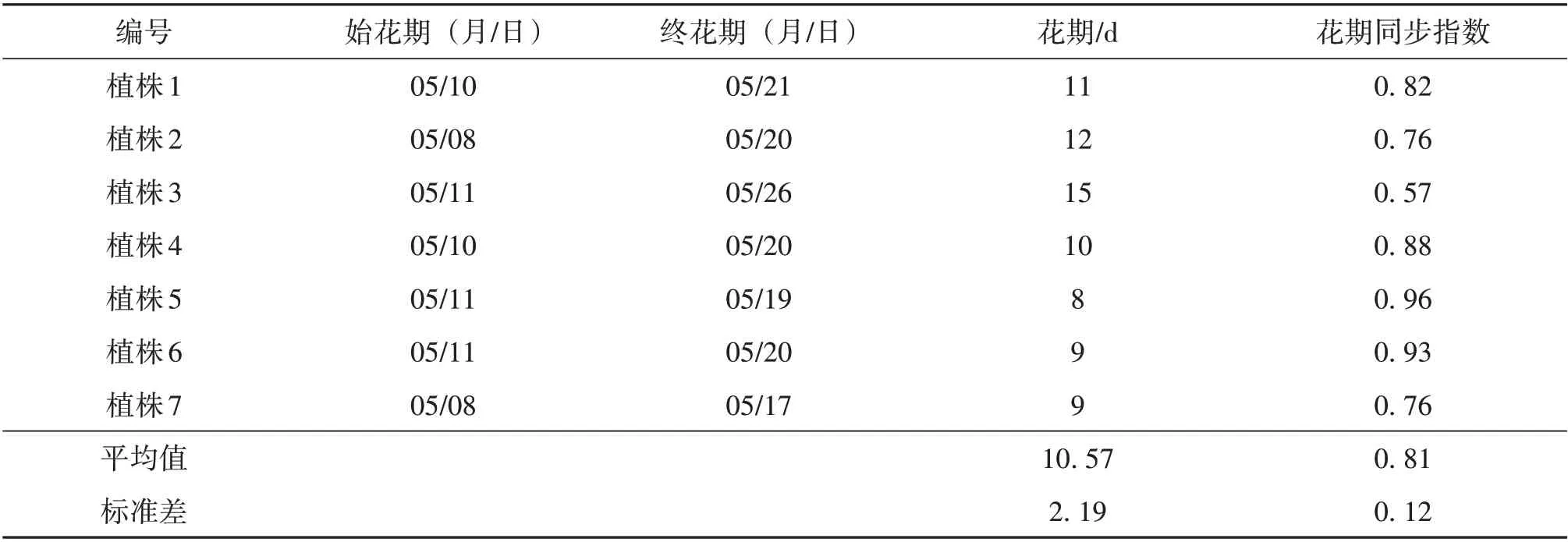
表2 多花黄精单株花期和花期同步指数Table 2 Flowering duration and synchronization index of Polygonatum cyrtonema individual plant
2.1.2 花序水平开花物候多花黄精的花为伞形花序,黄绿色,每个花序上有2~8朵小花,花蕾与花的产生和开放是从基部向上、按顺序的,枝条下部的花先开,位于枝条上部的花随后开放(图3)。多花黄精花序开花持续时间为(5.37 ±2.24) d(平均差±标准差,N=35)。由图4 可知,花序开花物候进程为多峰曲线式样,始花后第6天开花数量达到最高值。根据花序持续时间分布频率的统计结果(图5),多花黄精的花序开放持续时间的频率分布多为2~7 d,约占总体的73%。

图3 多花黄精开花顺序由基部花序向上开放Fig.3 Polygonatum cyrtonema open its flower from the base inflorescence
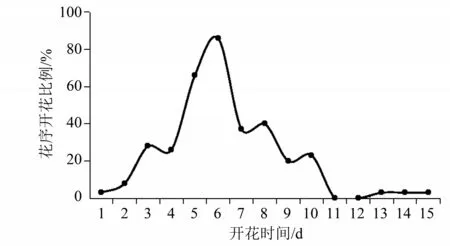
图4 多花黄精花序水平的开花振幅Fig.4 Amplitude of inflorescence in Polygonatum cyrtonema

图5 多花黄精的花序开放时间频率分布Fig.5 Inflorescence flowering duration frequency distribution of Polygonatum cyrtonema
2.1.3 单花开放进程多花黄精单花花期为(2.20 ± 0.82) d(平均差± 标准差,N=35),单花开放的第1天上午10:00,花朵形态饱满正常,花被前端开始张开,花被片前端形成6枚裂片。第2 天上午10:00,花被前端完全张开,花朵形态更加饱满,花被裂片向后卷曲。第3 天上午10:00,单花的花被裂片开始萎蔫,颜色逐渐变为褐色。
2.2 多花黄精花粉萌发条件
2.2.1 蔗糖、H3BO3、CaCl2单因子对多花黄精花粉萌发的影响蔗糖单因素实验结果表明(图6),多花黄精的花粉在50 ~100 g/L 的蔗糖质量浓度范围内,花粉萌发率随蔗糖质量浓度的增加而提高,在100~200 g/L 的蔗糖质量浓度范围内,花粉萌发率随蔗糖质量浓度的减少而降低;当蔗糖质量浓度为100 g/L 时,花粉萌发率达到最高,为69.46%。因此,多花黄精花粉萌发的适宜蔗糖质量浓度为100 g/L。
H3BO3单因素实验结果表明(图6),当H3BO3质量浓度在50~200 mg/L 的范围时,多花黄精的花粉萌发率基本稳定,在H3BO3质量浓度为100 mg/L时,花粉萌发率达到最高,为56.32%,当H3BO3质量浓度超过200 mg/L 后,花粉萌发率急剧下降。因此,多花黄精花粉萌发的适宜H3BO3质量浓度范围为50~200 mg/L。
CaCl2单因素实验结果表明(图6),当CaCl2质量浓度为50~250 mg/L 时,多花黄精的花粉萌发率随CaCl2质量浓度的增加而提高,在CaCl2质量浓度为250 mg/L 时,花粉萌发率达到最高,为43.75% 。当CaCl2质量浓度超过250 mg/L 时,花粉萌发率开始下降。因此,多花黄精花粉萌发的适宜CaCl2质量浓度为250 mg/L。

图6 不同蔗糖、H3BO3、CaCl2质量浓度下多花黄精花粉的萌发率(N=3)不同字母表示显著性差异(P<0.05)。Fig.6 Pollen germination rate of Polygonatum cyrtonema in different sucrose,boric acid,calcium chloride concentrations(N=3)
2.2.2 蔗糖、H3BO3、CaCl2三因子L16(43)正交试验结果正交试验结果表明(表3):用直观分析法分析所得数据,极差分析显示蔗糖、H3BO3、Ca2+这三个因素对多花黄精花粉萌发的影响程度由大到小的顺序为:蔗糖、CaCl2、H3BO3。即蔗糖质量浓度是决定花粉萌发率的最关键因素,其次是CaCl2质量浓度,H3BO3质量浓度的影响效果最小。

表3 多花黄精花粉正交试验的萌发率1)Table 3 Germination rate of Polygonatum cyrtonema pollen in orthogonal test
分析不同因素水平对多花黄精花粉萌发率的影响,每个因素取其平均值的最高水平,组合后得到最适宜培养基配方为A3B3C3,即150 g/L 蔗糖+200 mg/L H3BO3+250 mg/L CaCl2。
在这个最优组合中,CaCl2和H3BO3的适宜质量浓度与单因子试验结果一致,而蔗糖的适宜质量浓度与单因素试验结果有差别。正交试验得出蔗糖适宜浓度为15%,单因子试验得出的适宜浓度是10%,在蔗糖单因子试验中,蔗糖浓度为10%
和15%时的花粉萌发率具有显著差异,二者结果的差别可能是因为不同因素之间对多花黄精花粉萌发的影响具有协同作用,导致各个最优的单因素条件搭配起来并非最适宜多花黄精花粉萌发的配方。
2.3 I2-KI、MTT、TTC化学染色法的比较
3 种化学染色法测定多花黄精花粉活力的结果如表4 所示。I2-KI 染液处理后经过长时间的染色,花粉粒仍难以着色,颜色差异不显著,无法明确区分出是否具有活力,因此I2-KI 染色法不能测定多花黄精的花粉活力。MTT 染色法和TTC 染色法都能法能够在短时间内使花粉明显着色(图7),但MTT 染色法在枯花期测得的结果偏高,原因是染色后花粉的颜色差别很小,大多是较深的蓝紫色,不易分辨,导致测定值偏高,另外该方法与萌发测定不相关[20]。因此TTC 染色法是快速有效测定多花黄精花粉活力的方法。
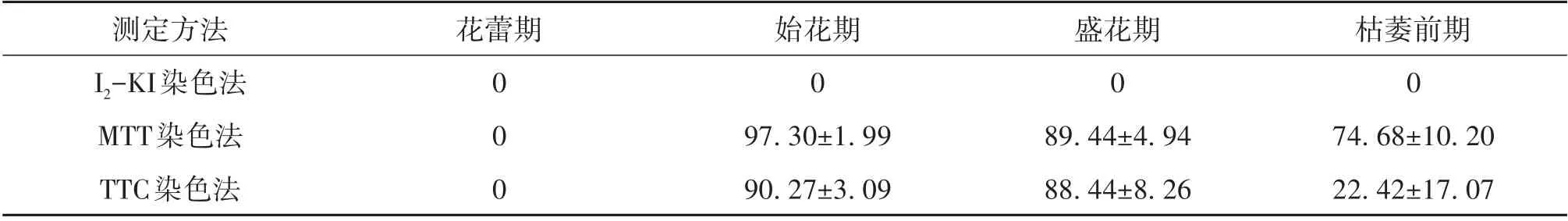
表4 MTT与TTC染色法测定不同时期花粉活力Table 4 Comparison of pollen viability in different stages by MTT and TTC staining%
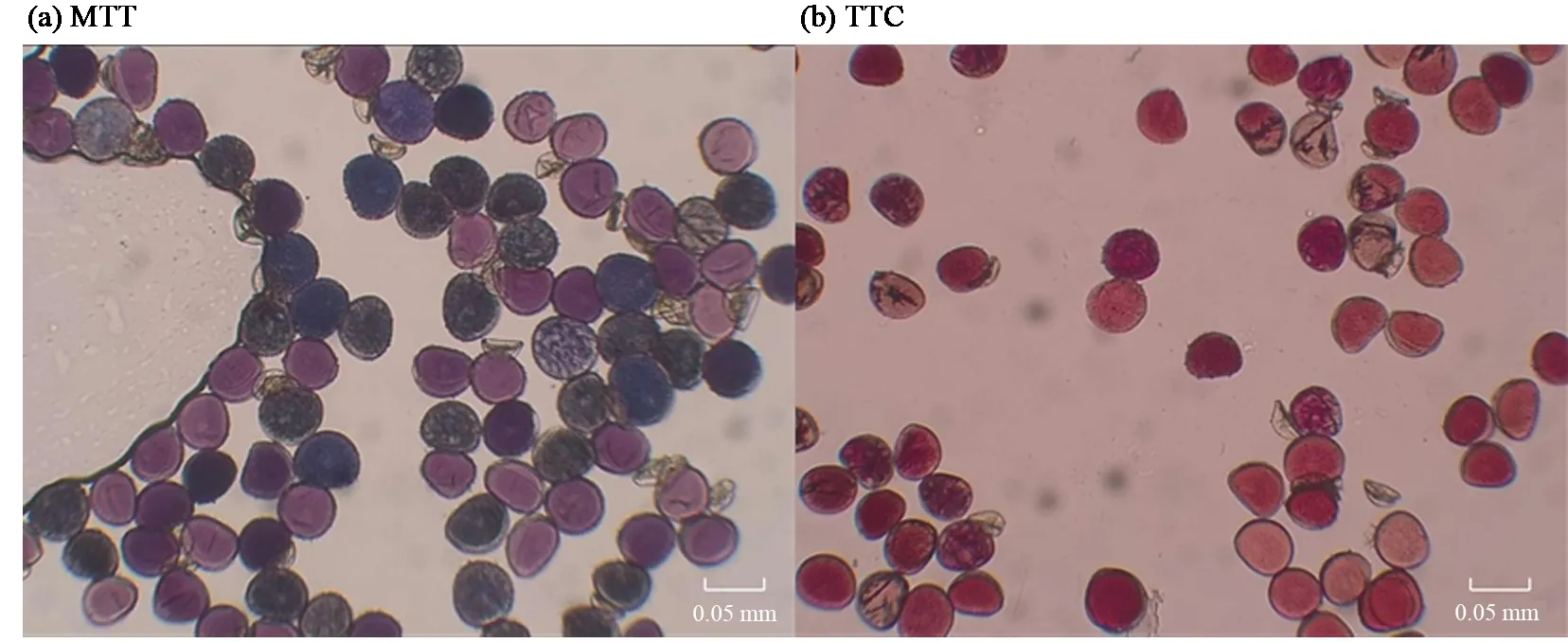
图7 MTT(a)与TTC(b)染色法花粉活力测定效果Fig.7 Effects of MTT(a)and TTC(b)staining methods on pollen vitality determination
2.4 多花黄精花粉活力与柱头可受性
通过悬滴培养法进行花粉萌发实验(表5)发现,多花黄精在含苞期开始出现花粉活力,并随着花药的开裂花粉活力逐渐上升,在盛花期达到最高,花粉活力在始花期到盛花期阶段比较稳定,此后花粉活力随着开花后花粉的散失逐渐下降,至枯萎后期花粉活力几乎丧失。

表5 不同开花时期多花黄精的花粉活力Table 5 The pollen viability of Polygonatum cyrtonema in different flowering periods
通过联苯胺-过氧化氢法检测多花黄精柱头可授性(表6),结果表明:多花黄精在花蕾期柱头颜色无明显变化,周围无气泡产生,表明其不具有可授性,见图8(a);含苞期柱头周围开始产生少量气泡,柱头颜色微微变蓝,表明该时期柱头开始具有可授性,但是可授性较弱,见图8(b);始花期柱头周围产生较多气泡,柱头颜色变蓝,相比含苞期,其柱头可授性明显增强,见图8(c);盛花期柱头颜色变深蓝,柱头周围产生大量气泡,表明该时期多花黄精的柱头可授性最强,见图8(d);枯萎前期部分柱头颜色无明显变化,柱头周围有少量气泡产生,表明该时期柱头可授性开始减弱,见图8(e);枯萎后期柱头颜色无变化,少部分柱头周围有极少量气泡产生,大部分柱头周围无气泡产生,表明该时期的柱头可授性逐渐消失,见图8(f)。

表6 不同开花时期多花黄精的柱头可授性1)Table 6 The stigma receptivity of Polygonatum cyrtonema in different flowering periods

图8 不同时期的多花黄精柱头可授性变化Fig.8 Changes of stigma receptivity of Polygonatum cyrtonema in different flowering periods
2.5 访花昆虫及其访花行为
2.5.1 访花昆虫种类和行为访花昆虫种类(图9)

图9 3种访花昆虫Fig.9 Three species of pollinating insects
主要有中华蜜蜂Apis cerana、黑带食蚜蝇Episyr⁃phus balteatus、熊蜂Bombus latreille等。
访花行为:中华蜜蜂访花前会先在空中盘旋,之后落在某一株植株上开始访花,访问第一朵花后,顺着茎向两侧连续访问其他的花朵,当第一株植株访问完毕后常会跳跃飞行到临近的其他植株上继续访问。访花时直接落到花朵上,用后足抱握花被,中足和前足迅速收集花粉,在采集花粉过程中会转动身体、后足来更换着力点;黑带食蚜蝇访花时直接落到花被上,采集花粉时头部会伸入花腔,直接伸出喙舐食花粉,同时用两前足来回搓动花粉,偶尔用2 前足刷头部或2 前足之间相互刮刷来将头部及前足粘有的花粉送到口器,尾部常有节奏地上下摆动;熊蜂在接近花朵时,前足先接触花瓣并悬空震动翅膀,使成熟花粉释放出来粘在熊蜂的前足、头部及前胸部,之后中足和后足会交叉刮刷,将粘附的花粉收集到花粉篮中,动作幅度一般较大,常会引起相邻近的花朵随之晃动。
2.5.2 传粉昆虫访花习性
1) 传粉昆虫累计访花次数。多花黄精传粉昆虫连续7 d 的累计访花次数如表7 所示。中华蜜蜂的累计访花次数远大于黑带食蚜蝇和熊蜂的累计访花次数,由此可推断,中华蜜蜂是多花黄精主要的传粉昆虫。

表7 传粉昆虫累计访花次数1)Table 7 The cumulative number of pollinating insects
2) 不同时间段传粉昆虫访花次数。5 月11 日至5 月17 日连续7 d 对传粉昆虫访花次数与每日最高温度进行了统计分析(图10),多花黄精传粉昆虫在5 月11 日访花最多,访花次数为79 次,在5月15 日最少,仅22 次,昆虫访花次数与日最高温度变化呈正相关。在一定的温度范围内,温度的升高会促进花香等化学物质的挥发,进而提高昆虫的传粉效率。

图10 传粉昆虫访花次数与日最高温度趋势Fig.10 The trend of pollinating insects and daily maximum temperature
3) 传粉昆虫的每日访花时间。传粉昆虫每日访花时间如表8所示,中华蜜蜂在南区的访花时间为(1.45± 0.55) min(平均值±标准差,N=7),在北区则为(3.02±1.31)min(N=7);熊蜂的访花时间在南区为(7.53 ± 5.57) min(N=3),在北区为1.78 min(N=2);黑带食蚜蝇在南区的访花时间为0.48 min(N=1),在北区为(11.79 ± 9.43) min(N=2)。熊蜂和食蚜蝇由于观测数据较少,数值波动较大。在7 d 的传粉昆虫观测中,均有中华蜜蜂进行访花。中华蜜蜂在日温度较高的5 月11 日、5月17 日的访花时间明显长于日温度较低的5 月14日、5月15日,说明温度对传粉昆虫访花时长有重要影响。
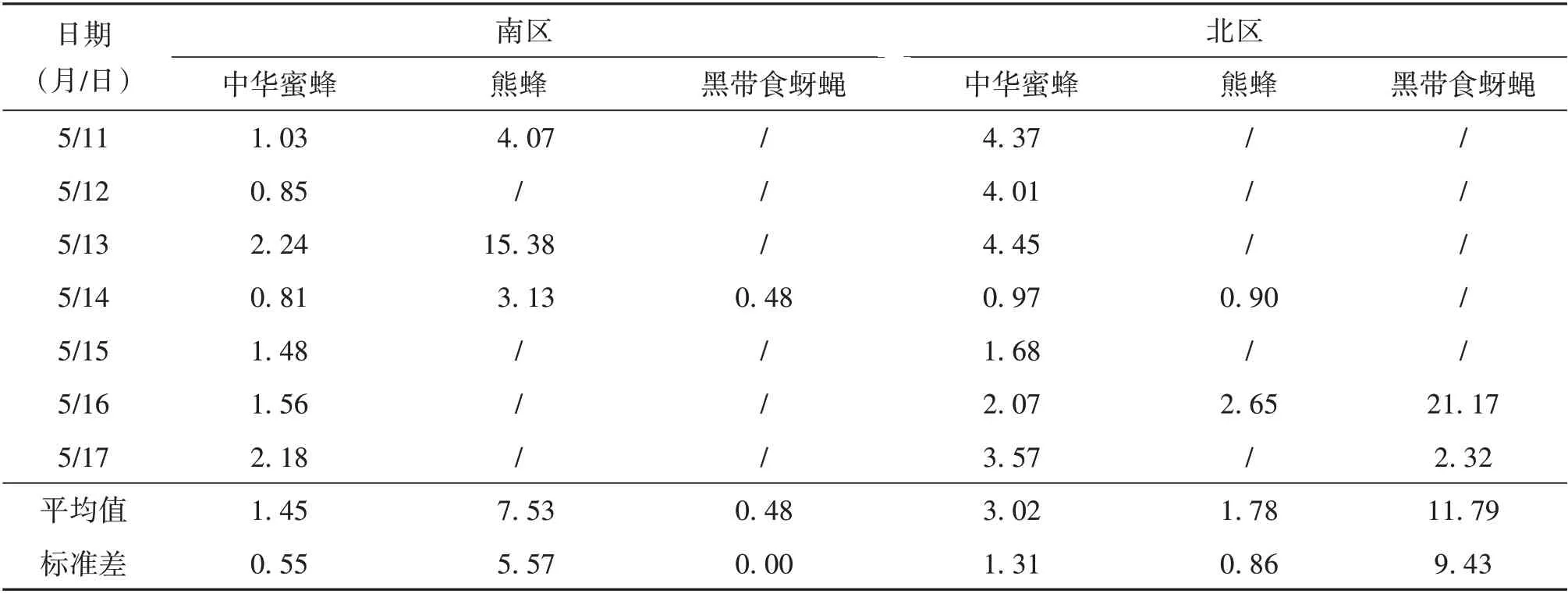
表8 传粉昆虫每日访花时间Table 8 Daily visiting time of pollinating insectsmin
2.6 多花黄精自然结实率统计
通过对多花黄精的开花数和结实率进行观测记录,15 个植株共开花384 朵,结实178 颗,自然结实率为46.35%。部分植株开花和结果时受到天气变化、动物行为等外界环境因素影响,导致落花落果严重。
3 结论与讨论
3.1 多花黄精花粉萌发条件
花粉萌发情况直接反映了花粉活力的高低,对于花粉萌发条件的探究,有助于贮藏花粉,为检测花粉的真实活力提供方法。不同植物之间的花粉的萌发条件不同,存在明显差异性。目前对多花黄精花粉萌发条件的探究实验未见报道。黄精属玉竹Polygonatum odoratum离体花粉萌发的培养液为w为10%蔗糖+ 100 mg/L H3BO3+ 300 mg/L Ca(NO3)2+ 200 mg/L MgSO4+ 100 mg/L KNO3[21]。本试验探究了蔗糖、H3BO3和Ca2+等因素对多花黄精离体花粉萌发的影响。结果表明,适量质量浓度的蔗糖、H3BO3和Ca2+能有效促进离体花粉萌发,萌发的最适蔗糖质量浓度为150 g/L,最适H3BO3质量浓度为200 mg/L,最适CaCl2质量浓度为250 mg/L。除蔗糖、H3BO3和Ca2+等因素外,Mg2+、K+、培养温度和光照条件对离体花粉的萌发也有一定影响,仍需进一步实验探究。
3.2 化学染色法测花粉活力比较
植物花粉活力测定方法有TTC 染色法、I2-KI染色法、MTT 染色法、苯胺蓝染色法、离体培养基法和悬滴培养法等[22-23]。化学染色法具有操作便捷,反应时间短等优点而被广泛应用于花粉活力检测,但由于不同植物花粉体内的酶活力不同,不同化学染色试剂测定花粉活力的效果也存在差异性,本试验对I2-KI、MTT、TTC 三种化学染色法效果进行了比较,发现TTC 染色法是快速、准确地检测多花黄精花粉活力的方法。
3.3 传粉生物学特性
安徽芜湖多花黄精开花从5 月8 日开始,5 月26 日结束,花开放时间为18 d,其单株、花序和单花水平的花期依次为8~13、3~7、1~3 d;单株水平上花期同步指数为0.81±0.12。贵州多花黄精开花从5 月5 日开始,5 月25 日结束,花开放时间为20 d[8];云南金平多花黄精开花从4 月29 日开始,5 月4 日结束,花开放时间平均为13.6 d[13]。不同地区的多花黄精开花物候存在差异,这可能与地理位置所造成的温度、相对湿度和光照强度等外界环境因子有关。多花黄精的花粉活力和柱头可授性总体变化趋势相吻合,均在含苞期出现活力,在盛花期达到最高值,至枯萎后期消失,这保障了多花黄精有性生殖的顺利进行,其与刘艳等[14]对多花黄精花粉活力和柱头可授性的研究结果基本相同。多花黄精在自然状态下主要依靠中华蜜蜂、熊蜂和黑带食蚜蝇等昆虫进行传粉,昆虫种类较少且其访花效率受温度等环境因素影响,提高多花黄精的虫媒传粉效率需对传粉昆虫的生境进行保护。多花黄精自然结实率为46.35% ,明显高于刘艳等[14]17.46% 的结实率,略低于刘佳等[13]报道的60.00%和李立格等[15]报道的65.12%,其存在一定的落花落果现象,对于多花黄精落花落果现象的生物学研究有利于在生产上提高结实率,有待后期研究发现。
3.4 人工授粉建议
基于上述的花粉活力和柱头可授性数据,多花黄精的最佳授粉时期为始花期(开花第1 天)和盛花期(开花第2~3 天)。在九华黄精的育种栽培中,建议采集开花第1 天(花朵刚开放,花药开裂,尚未开始散粉)的花粉对开花第2~3天(花朵完全开放,柱头分泌黏液)的柱头进行人工授粉。

