鸢尾黄酮通过促进自噬抑制结肠癌细胞增殖并诱导其凋亡研究*
洪晓泉 傅锦波 林福生 罗晔哲 林恩德
(厦门大学附属中山医院普通外科 福建厦门361004)
结直肠癌(Colorectal Cancer)是近年来发病率和病死率上升显著的一类癌症,在世界范围内,其发病率位居第三,病死率位居第四,且在发达国家和地区更为多见[1~3]。鸢尾黄酮(Tectorigenin)是鸢尾科植物射干中的一种成分,研究表明其具有抗肿瘤、抗炎、抗氧化等多种作用,并可能对细胞自噬过程存在影响[4~6]。自噬性死亡(Autophagic Cell Death)是指依赖于自噬过程的程序性细胞死亡。对细胞自噬过程的干预可能导致细胞稳态调节机制的失衡,从而导致细胞死亡[7~9]。本研究分析了鸢尾黄酮对结肠癌细胞自噬水平的影响,并通过联合使用抑制剂及下调自噬过程关键蛋白探究鸢尾黄酮对结肠癌细胞增殖活性及凋亡的影响。现报道如下:
1 材料与方法
1.1 细胞株来源和制剂 人结肠癌细胞株SW480和正常人结肠细胞系CCD 841 CoN购自美国模式培养物集存库(American Type Culture Collection,ATCC)。高糖DMEM培养基、胎牛血清、双抗购自美国Hyclone公司。鸢尾黄酮购自Sigma-Aldrich公司。凋亡抑制剂Z-VAD-FMK(S7023)、铁死亡抑制剂Ferrostatin-1(S7243)、坏死性凋亡抑制剂(S8037)购自美国Selleck公司。CCK-8试剂购自博士德公司。兔抗人p62(#8025)、兔抗人LC3(#3868)抗体购自美国CST公司,鼠抗人GAPDH(#AC033)购自武汉爱博泰克公司。Trizol、Lipofectamine 2 000试剂购自美国Thermo Fisher公司。SiATG5及siNC由锐博生物科技有限公司负责构建。
1.2 研究方法
1.2.1 人结肠癌细胞系SW480细胞培养 在加入双抗的含10%胎牛血清的DMEM培养基中,37℃、5%CO2的条件下于培养箱中培养,每1~2天更换新鲜培养基或进行细胞传代。
1.2.2 CCK-8法检测细胞增殖活性及半抑制浓度(IC50)曲线的绘制 取对数生长期的人结肠癌细胞SW480和正常人结肠细胞系CCD 841 CoN,以10^4 CCU/ml的密度种于96孔板中并加入100μl培养基,置于培养箱中培养。待细胞贴壁后吸取上清液,分别加入100μl含不同浓度鸢尾黄酮及相应抑制剂的培养基,以加入二甲基亚砜(DMSO)组作为阴性对照,仅加培养基组作为空白对照,每组设5个复孔。待培养24 h后吸弃上清,每孔加入10μl CCK-8液及100μl培养基,37℃孵育1 h后于酶标仪波长450 nm处读取吸光度(OD)值。根据吸光度值计算细胞增殖的相对速率,以鸢尾黄酮浓度作为横轴,细胞增长抑制率作为纵轴,拟合出IC50曲线,曲线上抑制率为50%的点所对应的浓度即为鸢尾黄酮在SW480细胞系和正常人结肠细胞系CCD 841 CoN中的IC50值。
1.2.3 Western blot法检测自噬相关蛋白表达情况取对数生长期的人结肠癌细胞SW480,分别加入50μmol/L、100μmol/L、200μmol/L鸢尾黄酮,并以加入DMSO作为对照组。作用24 h后以放射免疫沉淀法(Radio-Immunoprecipitation Assay,RIPA)提取蛋白,检测蛋白浓度并根据浓度调整上样量,经电泳、转膜、脱脂奶粉封闭后以LC3、p62及GAPDH一抗4℃孵育过夜、TBST洗膜3次后,二抗室温孵育2 h,TBST洗膜3次后采用增强化学发光法(ECL)曝光。
1.2.4 透射电镜观察结肠癌细胞内自噬体数量取对数生长期的人结肠癌细胞SW480于6 cm培养皿中培养,待细胞贴壁后加入200μmol/L鸢尾黄酮作用24 h,对照组加入等量DMSO。培养24 h后弃去上清,加入2.5%戊二醛,用细胞刮刮下细胞收集入EP管中,离心弃上清后以2.5%戊二醛重悬,并于4℃固定。经锇酸固定、丙酮逐级脱水、环氧树脂包埋后作超薄切片,染色后于透射电镜下观察细胞的超微结构变化。取4个视野下结肠癌细胞SW480内自噬体的平均数量进行对比。
1.2.5 小干扰RNA(siRNA)沉默自噬关键蛋白ATG5转染 取对数生长期的结肠癌细胞SW480种于6孔板中,待细胞密度达到70%左右时,使用Lipofectamine2000将siATG5及对应的阴性对照物(siNC)转染入细胞,24 h后换液,48 h时取部分细胞提取RNA并确认转染效率,剩余细胞重新种板,待贴壁后,取siATG5及siNC组加入200μmol/L鸢尾黄酮,另取siNC组加入DMSO作为对照。分别使用或不使用Z-VAD预处理并作用24 h后用CCK-8法(同1.2.2)检测细胞增殖活性。
1.3 统计学处理 所有实验均设3次重复,实验数据的分析处理采用SPSS23.0软件,柱状图及曲线绘制采用Graphpad Prism7软件。计量资料以(±s)表示,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 鸢尾黄酮在结肠癌细胞系SW480和正常人结肠细胞系CCD 841 CoN中的IC50比较 使用CCK-8法分析不同浓度鸢尾黄酮作用下结肠癌细胞系SW480的生长抑制情况,绘制得出对应的IC50曲线,通过曲线进一步得出SW480细胞系中鸢尾黄酮的IC50为(221.90±35.31)μM,CCD 841CoN细胞系中鸢尾黄酮的IC50为(327.50±7.89)μM。见图1。

图1 鸢尾黄酮作用于SW480和CCD 841 CoN细胞的IC50曲线
2.2 鸢尾黄酮作用于SW480细胞的克隆平板实验结果 根据2.1中的IC50结果,将鸢尾黄酮的作用浓度定为200μM。克隆平板实验表明,鸢尾黄酮对结肠癌细胞的长期增殖能力具有抑制作用。其中,对照组克隆形成个数平均为(219.00±7.94)个,鸢尾黄酮作用组克隆形成个数平均为(133.30±6.33)个,两组比较,差异有统计学意义(t=8.436,P<0.01),说明鸢尾黄酮抑制了结肠癌细胞SW480的长期增殖能力。见图2。
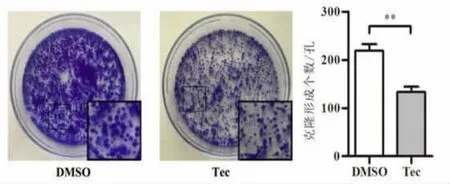
图2 鸢尾黄酮作用于SW480细胞的克隆平板实验结果
2.3 不同抑制剂预处理后鸢尾黄酮作用下SW480细胞活性检测结果 为进一步明确鸢尾黄酮抑制结肠癌细胞系SW480增殖能力的机制,分别使用凋亡抑制剂Z-VAD(50μM)、铁死亡抑制剂Ferrostatin-1(1μM)、坏死性凋亡抑制剂Necrostatin-1(1μM)预处理SW480细胞1 h后,加入200μM鸢尾黄酮继续作用24 h。结果表明凋亡抑制剂Z-VAD显著逆转了鸢尾黄酮对结肠癌细胞的增殖抑制作用,其中鸢尾黄酮单药作用组平均吸光度为(0.82±0.04),Z-VAD预处理组平均吸光度为(1.25±0.04),差异有统计学意义(t=11.12,P<0.01),说明鸢尾黄酮激活了结肠癌细胞系SW480的凋亡。而Ferrostatin-1、Necrostatin-1预处理组与鸢尾黄酮单药作用组无明显差异(P>0.05)。见图3。
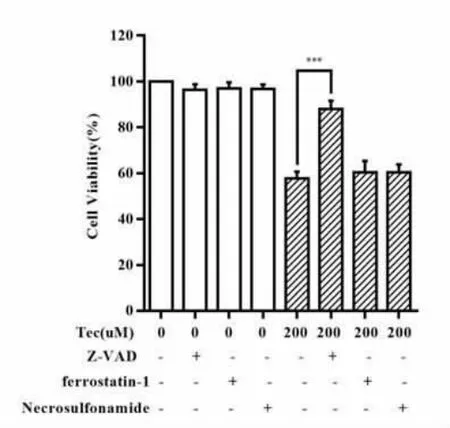
图3 不同抑制剂预处理后鸢尾黄酮作用下SW480细胞活性检测
2.4 Western blot检测不同浓度鸢尾黄酮作用后SW480细胞内自噬相关蛋白变化情况 使用Western blot检测0μM、50μM、100μM、200μM鸢尾黄酮作用24 h后结肠癌细胞系SW480中自噬相关蛋白的变化情况,结果表明,随着鸢尾黄酮作用浓度的升高,SW480细胞内LC3-Ⅱ蛋白水平逐渐增高,p62逐渐降低,提示鸢尾黄酮作用后SW480细胞的自噬被激活。见图4。
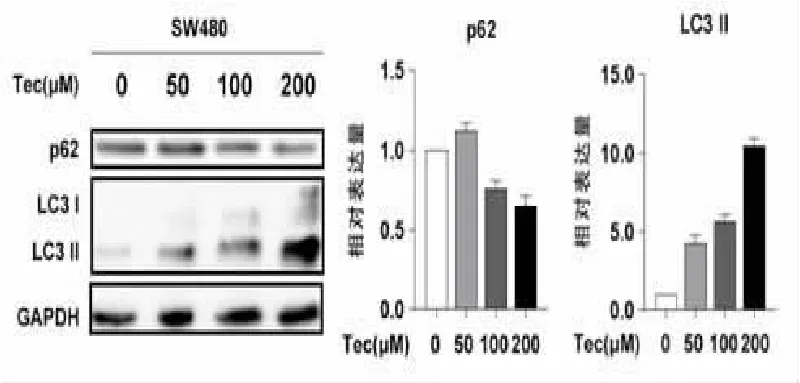
图4 鸢尾黄酮作用于SW480细胞后蛋白免疫印迹法检测自噬相关蛋白含量的变化情况
2.5 SW480细胞内自噬体数量变化情况电镜观察结果 采用透射电镜分别对200μM鸢尾黄酮作用24 h后以及未经处理的SW480细胞进行观察,结果表明,鸢尾黄酮作用后SW480细胞内自噬体数量明显增多。其中,对照组SW480细胞内自噬体数量平均为(5.00±1.16)个,200μM鸢尾黄酮作用24 h后的SW480细胞内自噬体数量平均为(29.67±2.91)个,差异有统计学意义(t=7.888,P<0.01)。见图5。
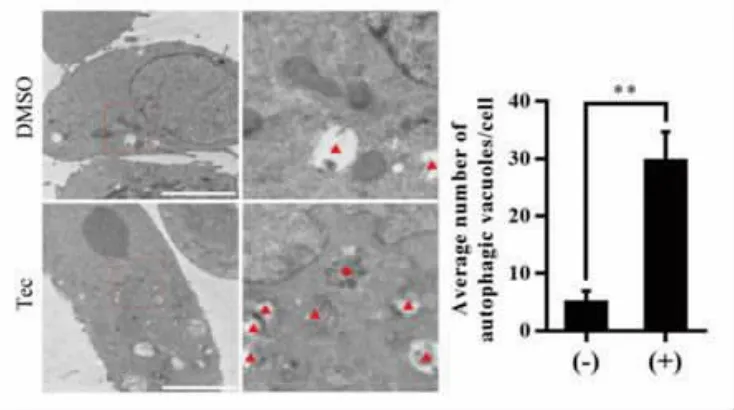
图5 鸢尾黄酮作用于SW480细胞后其细胞内自噬体数量变化情况电镜观察结果
2.6 沉默ATG5联合Z-VAD作用下鸢尾黄酮作用于SW480细胞的细胞活性检测结果 分别使用siATG5和siNC对SW480细胞进行转染,48 h后提取细胞核糖核酸(RNA),用qPCR进行ATG5表达量检测以验证敲低效率,结果显示siATG5组ATG5相对表达量为(0.42±0.03)。使用上述验证过的siATG5和siNC质粒对SW480细胞进行瞬时转染,伴或不伴Z-VAD预处理的情况下加入200μM鸢尾黄酮或等量DMSO,作用24 h后使用CCK-8法检测SW480细胞的增殖活性。结果表明,鸢尾黄酮的杀伤作用在转染了siATG5的SW480细胞中受到了抑制,沉默ATG5抑制了鸢尾黄酮对结肠癌细胞的杀伤作用。其中,鸢尾黄酮作用于siNC对照组平均吸光度为(0.94±0.04),作用于siATG5实验组平均吸光度为(1.42±0.06),差异有统计学意义(t=9.225,P<0.01)。同时,siATG5联合Z-VAD预处理实验组平均吸光度为(1.42±0.04),与仅转染siATG5的实验组相比,未见明显统计学差异(t=0.516,P>0.05)。表明Z-VAD预处理并未在转染了siATG5的结肠癌细胞中进一步抑制鸢尾黄酮的杀伤作用。见图6。
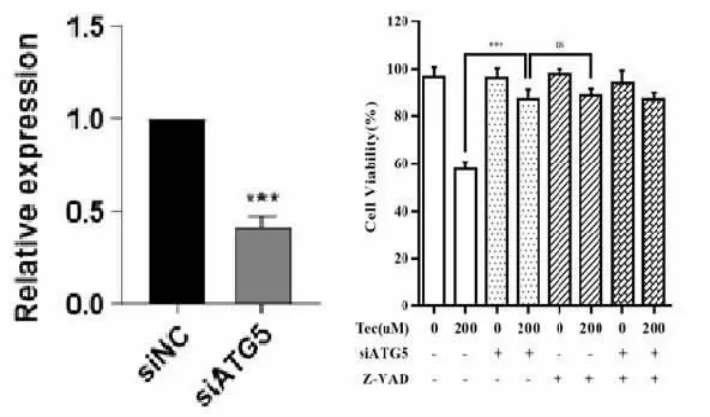
图6 沉默ATG5联合Z-VAD作用下鸢尾黄酮作用于SW480细胞的细胞活性检测结果
3 讨论
随着人们生活水平的提高和饮食结构的改变,我国结肠癌的发病率正逐年上升,且城市地区远高于农村[10~11]。结肠癌早期可无明显症状,多数病人发现时已处于中晚期,其总体发病率在恶性肿瘤中处于前列,尽管医疗工作者在治疗上进行了诸多尝试,但结肠癌仍然是威胁生命安全的主要恶性肿瘤之一,对化疗药物的耐药是结肠癌治疗中面临的主要问题[12~14]。结肠癌的病因学涉及遗传及环境因素,而一些新的有机化合物通过不同的机制调节细胞应答并发挥其抗癌作用,这些机制包括调节凋亡、自噬、抑制血管生成以及上调抑癌基因等[15~17]。有研究表明,鸢尾黄酮可以通过NF-κB和MAPK通路抑制增殖而起到抗肿瘤的作用,此外,其在小鼠巨噬细胞中还能抑制干扰素γ/脂多糖导致的炎症反应。同时,其对细胞自噬过程可能存在影响[18~20]。自噬是细胞调节环境和遗传压力的基本反应机制,两种途径相互联系,并调节肿瘤细胞对环境刺激的反应[21~23]。本研究着重探究了鸢尾黄酮作用后结肠癌细胞增殖及自噬情况的变化,并通过下调自噬过程关键基因ATG5,探究鸢尾黄酮对结肠癌细胞增殖的抑制作用与其对自噬的影响是否有关。
本研究通过CCK-8法对不同浓度鸢尾黄酮作用下结肠癌细胞的增殖能力进行了测定,并绘制出了IC50曲线,结果表明鸢尾黄酮在结肠癌细胞SW480中的IC50约为(221.90±35.31)μM。同时,我们也通过同样的方法绘制了鸢尾黄酮作用于正常人结肠细胞系的IC50曲线,得到鸢尾黄酮在正常人结肠细胞系CCD 841 CoN的半抑制浓度约为(327.50±7.89)μM,表明鸢尾黄酮对结肠癌细胞更敏感,而对正常人结肠细胞具有更小的毒性。随后我们通过克隆平板实验,进一步确认了鸢尾黄酮对结肠癌细胞长期增殖能力的抑制作用。并且,通过使用不同抑制剂的预处理,我们发现凋亡抑制剂Z-VAD显著逆转了结肠癌细胞的死亡,而铁死亡抑制剂Ferrostatin-1(1μM)和坏死性凋亡抑制剂Necrostatin-1(1μM)对其抑制作用无明显效应,表明鸢尾黄酮激活了结肠癌细胞的凋亡通路。Western blot结果表明鸢尾黄酮作用后细胞内自噬标记蛋白LC3-Ⅱ含量上升,而自噬降解底物蛋白p62表达下降;同时,透射电镜观察到鸢尾黄酮作用后结肠癌细胞中自噬体的数量明显增加,表明鸢尾黄酮激活了结肠癌细胞的自噬过程。
ATG5被认为是自噬过程中的关键调节蛋白。其在自噬体的形成过程中起着至关重要的作用,ATG5缺失或突变的细胞将不能有效地形成自噬体[24~26]。本研究通过向结肠癌细胞中转染siATG5使ATG5蛋白表达量下降,从而抑制了细胞的自噬作用,并联合鸢尾黄酮作用后发现其对结肠癌细胞的杀伤作用明显减弱。由此我们认为,鸢尾黄酮对结肠癌细胞的杀伤与其激活自噬过程存在联系。既往研究表明自噬是细胞在外界应激条件下对细胞内组分进行吞噬和清除的过程[27~28]。当细胞内自噬过度激活时,由于胞内成分被过度吞噬和消化,将会引起细胞的自噬性死亡[29~31]。同时,转染siATG5后联合使用凋亡抑制剂Z-VAD并未进一步逆转鸢尾黄酮对结肠癌细胞的杀伤作用,表明鸢尾黄酮很可能通过促进细胞自噬进而激活了结肠癌细胞的凋亡通路,从而引起结肠癌细胞的凋亡。综上所述,鸢尾黄酮通过促进细胞自噬抑制了结肠癌细胞的增殖,并激活其凋亡通路。鸢尾黄酮对自噬过程的影响有望使其成为抗结肠癌治疗的候选药物。

