口蹄疫检测方法研究进展※
●宿 放 信吉阁 董 俊 杨云庆 叶玲玲 罗倩敏 李瑶瑶 董仙兰 王修庚 韩佃刚,※※ 艾 军※※
(1.云南农业大学 云南 昆明 650201;2.昆明海关技术中心 云南 昆明 650200;3.梁山县扶贫开发办公室 山东 济宁 272600)
口蹄疫(Foot and mouth disease,FMD)是由口蹄疫病毒引起的一种急性、热性、高度接触性传染病,主要感染猪、牛、羊、骆驼等偶蹄动物[1]。口蹄疫病毒属于小RNA病毒科口蹄疫病毒属,可通过呼吸道、消化道、生殖道和伤口感染易感动物,通常以直接和间接接触传播,也可通过人、蜱、蝇、鸟等动物传播,在有风的情况下还能远距离传播。感染动物的唾液、泪液、尿液、粪便、乳汁、精液、肉产品及副产品等均可携带病毒[2]。动物感染口蹄疫病毒后几乎100%发病[3],表现为口腔黏膜、蹄部和乳房皮肤发生水疱性疹,溃烂后可引起部位病变,同时伴随发热、厌食、寒战、磨牙、流口水、跛行、跺脚或踢脚、泌乳量减少等症状,死后剖检可见“虎斑心”。世界动物卫生组织(OIE)已将其列为必须报告的动物传染病,我国也将其归为一类动物疫病[4]。
目前已知口蹄疫在世界范围内有7个主要的血清型:O、A、AsiaⅠ、C、SAT-1、SAT-2和SAT-3型[5],且各血清型之间无交叉免疫保护反应,这就意味着在进行免疫防控时相当于面对7种不同的疫病[6]。由于口蹄疫传播途径多、速度快,曾多次在世界范围内暴发流行,造成巨大经济损失和社会影响[7]。我国近年来暴发的口蹄疫主要由O型、A型和AsiaⅠ型病毒引起,严重威胁全国各地区家畜安全和畜产品贸易[8]。
因此,选择合适的口蹄疫检测方法对深入开展我国口蹄疫流行病学调查与防控研究均具有重要意义。本文结合OIE手册和中国国家标准(GB/T 18935-2018)对目前主要的13种口蹄疫检测方法进行归纳,以期为实际检测筛选出最适检测方法提供参考。
1 检测抗原
1.1 病毒分离鉴定
1.1.1 细胞培养与病毒分离鉴定病毒分离鉴定是口蹄疫病毒诊断最可靠的办法,通常使用豚鼠肾、仓鼠肾、猪肾、牛肾、牛舌上皮等原代细胞或传代细胞,使病毒在细胞内增殖,根据细胞病变效应(CPE)来进行分离鉴定。
1.1.2 病毒VP1基因序列分析FMDV蛋白在蛋白酶水解后,裂解为4种结构蛋白(VP1~VP4)和多种非结构蛋白。VP1蛋白是主要的保护性抗原,由于VP1基因变异最频繁,因此其抗原性差异是进行FMDV血清型的划分依据。获得的病毒VP1序列后与已公布的序列进行比对分析,便可确定病毒的血清型及其亚型。
李琪等[11]对广东地区2015~2016年收集的猪病料提取RNA,进行反转录后利用O、A和AsiaⅠ型的通用引物进行扩增,克隆测序后将测序结果利用分析软件进行比对,分析确认了其中有11株O型FMDV属于耿马谱系且发生了变异。石庆伟等[12]同样利用对VP1基因序列分析的方法,确定了从广东采集5份疑似FMDV感染病料中的2份为O型FMDV感染,3份为A型FMDV感染。整个过程比较繁琐,结果可靠性较病毒分离试验差,但只要确保克隆后VP1序列的完整性,也可得到一个较可靠的结果。
1.2 病毒核酸检测
1.2.1 实时荧光定量PCR通过将FMDV各血清型全基因组序列进行比对,可针对不同血清型差异较大的结构蛋白基因设计不同的引物,再根据荧光素的发光原理,利用TaqMan等技术,通过PCR扩增进行血清型鉴别诊断。
实时荧光定量PCR是一种常用的检测病毒样本的方法,结果可直接通过荧光PCR仪进行检测。李世芳等[13]用口蹄疫病毒MYA/98株对3~4日龄的乳鼠进行攻毒,用实时荧光定量PCR检测攻毒后0、5、10、15 h肠道组织中IFN-ε相对表达量的变化,为Ⅰ型干扰素的不同亚型在抗口蹄疫病毒感染过程中的作用提供了实验数据。蔡顺萍等[14]利用实时荧光定量PCR方法用3种口蹄疫试剂盒检测了O型抗原并进行各项指标的比对,为实验室选择试剂盒提供依据。
1.2.2 多重荧光定量PCR多重荧光定量PCR在荧光定量PCR的基础上,通过设计多个探针和引物,可在一次PCR反应中同时对多个模板进行定量检测。
吴绍强等[15]利用多重荧光定量PCR法研发出的口蹄疫病毒试剂盒,可同时检测O、A和AsiaⅠ型的口蹄疫病毒。多重PCR检测方法可同时检测同种病毒的不同血清型,也可以用于不同病毒的同时检测。宋爽等[16]根据牛病毒性腹泻病毒的5′ UTR基因、牛传染性支气管炎病毒的gB基因和口蹄疫病毒的3D基因建立了特异性强、灵敏度高的多重荧光定量PCR的方法,可同时快速鉴别检测这3种病毒。
1.2.3 定型RT-PCR定型RT-PCR同其他PCR方法一样,避免了病毒分离培养的危险性和基因序列分析的繁琐性。与多重PCR方法类似,能同时检测几种不同的血清型,李金海等[17]根据我国主要流行的3种血清型及其主要亚型设计了2对引物(FW1/FW2、FN1/FN2),建立了能够同时特异性检测O型、A型及AsiaⅠ型FMDV VP1全基因的RT-nPCR方法,并结合测序技术,能对检测样本进行准确定型,且灵敏度高,特异性强。
1.2.4 反转录环介导等温扩增技术(RT-LAMP)作为一种新颖的恒温核酸扩增方法,可在65℃恒温条件下完成扩增反应,不需要热变性、电泳和紫外观察等过程,扩增产物可通过荧光定量PCR仪检测荧光强度或通过沉淀反应浊度仪检测焦磷酸镁的沉淀浊度来进行定量分析,也可通过肉眼观察颜色变化进行定性分析,在实验室可用该方法替代PCR方法做初步检测。
袁彩虹[18]根据O、A和AsiaⅠ型3种血清型FMDV全基因组序列建立了一种FMDV通用型RT-LAMP快速检测方法。李健等[19]以FMDV多聚蛋白基因建立了FMDV的RT-LAMP。与PCR方法相比该方法更快速,整个扩增过程大约在1 h内完成,可直接用肉眼观察结果。该检测体系具有极高的特异性,与其他类似病毒如猪细小病毒、猪水泡病病毒、猪瘟病毒等无交叉反应,比普通PCR和荧光PCR的灵敏性高。谢佳芮等[20]根据口蹄疫病毒O型、A型和AsiaⅠ型的3D基因序列,设计17套环介导等温扩增引物,建立了免开盖可视化判定检测结果的FMDV群特异性RT-LAMP技术。免开盖是指避免空气中气溶胶的污染影响肉眼观察到的结果。
发挥地缘优势,大力发展旅游产业。农场有限公司将重点打造“湿地+果蔬采摘+草原旅游”模式,将原生态湿地打造成“观景+野生动植物科教”旅游基地;将湿地边缘的草原打造成“达斡尔族+蒙古族”民俗风情旅游基地;将蔬菜产业园区打造成辐射齐市、内蒙古阿荣旗的瓜、果、菜生产销售基地以及休闲采摘度假于一体的旅游基地。农场有限公司将逐步完善旅游基地的道路、供电、供水、停车场、观景台、游客接待中心等配套设施。力争打造成为以休闲、度假旅游为特色的旅游小城镇,推动哈拉海旅游业从无到有、从接待型向产业经营型转变,让旅游业尽快成为新的经济增长点。
1.2.5 基因芯片技术基因芯片又称DNA微阵列,结合了基因探针和杂交测序技术,通过检测芯片上的杂交信号强度及分布来进行分析,具有高通量、高集成、微型化和自动化的特点。
作为较新的检测技术,近年来基因芯片被广泛应用与优化,更高效、更稳定。魏春霞等[21]根据已知的7种牛易感病原核酸序列,利用多重PCR方法,通过肉眼观察芯片显色程度后,对芯片技术进行优化,建立了具有高通量、高灵敏度、高特异性等特点的基因芯片检测方法。该方法可在3 h内同时检测牛7种病原(Bru、MTB、Anthrax、FMDV、BVDV、BPIV3和IBRV)间无交叉反应,所有芯片可重复使用,且芯片在2~8℃条件下能保存半年以上,可满足一般实验室的样品检测及流行病学监查,同时重复使用也可降低成本。刘志鹏等[22]建立了可鉴定和区分口蹄疫病毒 O、A和AsiaⅠ型3种血清型的分型芯片,灵敏度比常规PCR高10~100倍,特异性也较高,芯片可重复使用,保存3个月以上。
2 检测抗体
2.1 间接ELISA
间接ELISA是实验室最常用的抗体检测方法之一,间接ELISA应用于各种病毒的检测,其原理是通过利用酶标二抗去辨识一抗来测定抗原量。各类ELISA方法均避免了病毒分离试验的危险性,也避免如PCR试验等无菌环境的限约。
前期研究中有对口蹄疫病毒的检测和疫苗的研制的相关实验。宋妮[23]利用原核表达后纯化的SUMO-VP0、SUMO-VP1、SUMO-VP3及VP3蛋白建立了间接ELISA方法,为O型口蹄疫诊断试剂及基因工程亚单位疫苗的研制奠定了基础。王云龙等[24]将O型口蹄疫病毒VP1基因在表达载体pET-41b中表达,最终建立了O型口蹄疫病毒的检测方法。
2.2 竞争ELISA
竞争ELISA也是常用的抗体检测方法之一,其原理是将抗体固定于载体表面,一组加入酶标抗原和待测抗原混合液,另一组只加酶标抗原,通过两组底物降解量之差来测定待测抗原的含量。
杨志元等[25-26]以经原核表达、纯化及组装制备的O型FMDV病毒样颗粒为诊断抗原,HRPIgG为竞争性酶标抗体成功建立用于O型FMDV抗体检测的竞争ELISA方法,可实现大批量样品的快速检测。同时验证了优化后的检测方法,改良了传统的竞争ELISA检测方法,因洗涤次数过多,影响样品的检出速率的缺点[27]。
2.3 病毒中和试验(VNT)
VNT是检测FMD的黄金标准,是最权威、最经典的方法,常作为其他方法的参照。VNT是利用血清中和抗体与病毒的特异性中和作用为原理建立的。
廖德芳等[28]利用VNT来评价建立的口蹄疫固相竞争酶联免疫吸附试验(SPC-ELISA)方法与液相阻断酶联免疫吸附试验(LPB-ELISA)之间的差别,对采集的不同物种共94份血清样品分别进行O型口蹄疫病毒SPC-ELISA、LPB-ELISA和VNT检测,并分别比较了3种方法的符合率和阳性检出率。结果发现,SPC-ELISA比LPBELISA更符合VNT的结果。
2.4 液相阻断酶联免疫吸附试验(LPB-ELISA)
由于其精确性、稳定性高于正向间接血凝试验(PHA),且重复性优于VNT,因此液相阻断ELISA技术成为国际较为认可的一种标准化诊断技术,我国目前也将该技术广泛应用于口蹄疫流行病学调查和免疫[29-30]。王世杰等[31]对该方法进行了改良,利用单一的血清稀释倍数来替代繁复的倍比稀释,使LPB-ELISA的检测通量提高了5倍左右。
2.5 固相竞争酶联免疫吸附试验(SPC-ELISA)
该方法的基本原理是被检血清中的FMD抗体与定量的FMD豚鼠抗体血清竞争,胜者与固相载体表面的抗原结合。被检血清中FMD抗体量越多,结合在固相载体表面的豚鼠抗体越少,显色后颜色就越浅。
在常规检测中,SPC-ELISA可用来替代VNT,通过对该方法不断地优化,使其检测结果更接近于VNT的检测结果。谢庆阁[32]详细介绍了SPC-ELISA的操作步骤;李敏杰等[33]以单抗3D9为捕获抗体,以HRP标记的单抗9A9作为检测抗体,建立了基于单抗的A型口蹄疫抗体SPC-ELISA检测方法;许智强等[34]以单抗3D9为捕获抗体,以HRP标记的单抗8E8作为检测抗体,建立了优化的固相ELISA检测方法,此方法有较高敏感性、重复性、稳定性和特异性。与VNT和LPB-ELISA的相关性和符合率均较高,批内和批间差异性小[35-36]。
2.6 非结构蛋白3ABC抗体酶联免疫吸附试验(3ABC-ELISA)
FMDV的非结构蛋白(NSP)与病毒的复制和装配相关。非结构蛋白抗体试验用于区分人工免疫的动物和感染野毒的动物。其鉴别诊断的依据是:灭活疫苗免疫动物后,动物体内不会有病毒增殖,也就没有病毒特异性NSP表达。而感染野毒的动物体内则有病毒增殖,病毒刺激动物机体产生了相应的NSP抗体。因此,可通过检测动物体内是否产生NSP抗体来区分感染野毒的动物与人工接种疫苗的动物[37]。该方法在最新的国家标准中替代了抗原琼脂凝胶免疫扩散试验(VIAAGID)。
王玉玲等[38]利用150份牛血清对国内外3种口蹄疫非结构蛋白3ABC抗体间接ELISA检测方法和1种口蹄疫非结构蛋白3ABC抗体阻断ELISA检测方法进行比较,结果表明该方法敏感性达到100%,特异性也接近100%,说明该方法具有很高的敏感性和特异性,可用于口蹄疫病毒感染与疫苗免疫抗体的鉴别诊断。
3 FMDV的检测方法的优缺点
文中列举的13种检测FMDV的方法具有不同的优缺点,详见表1。
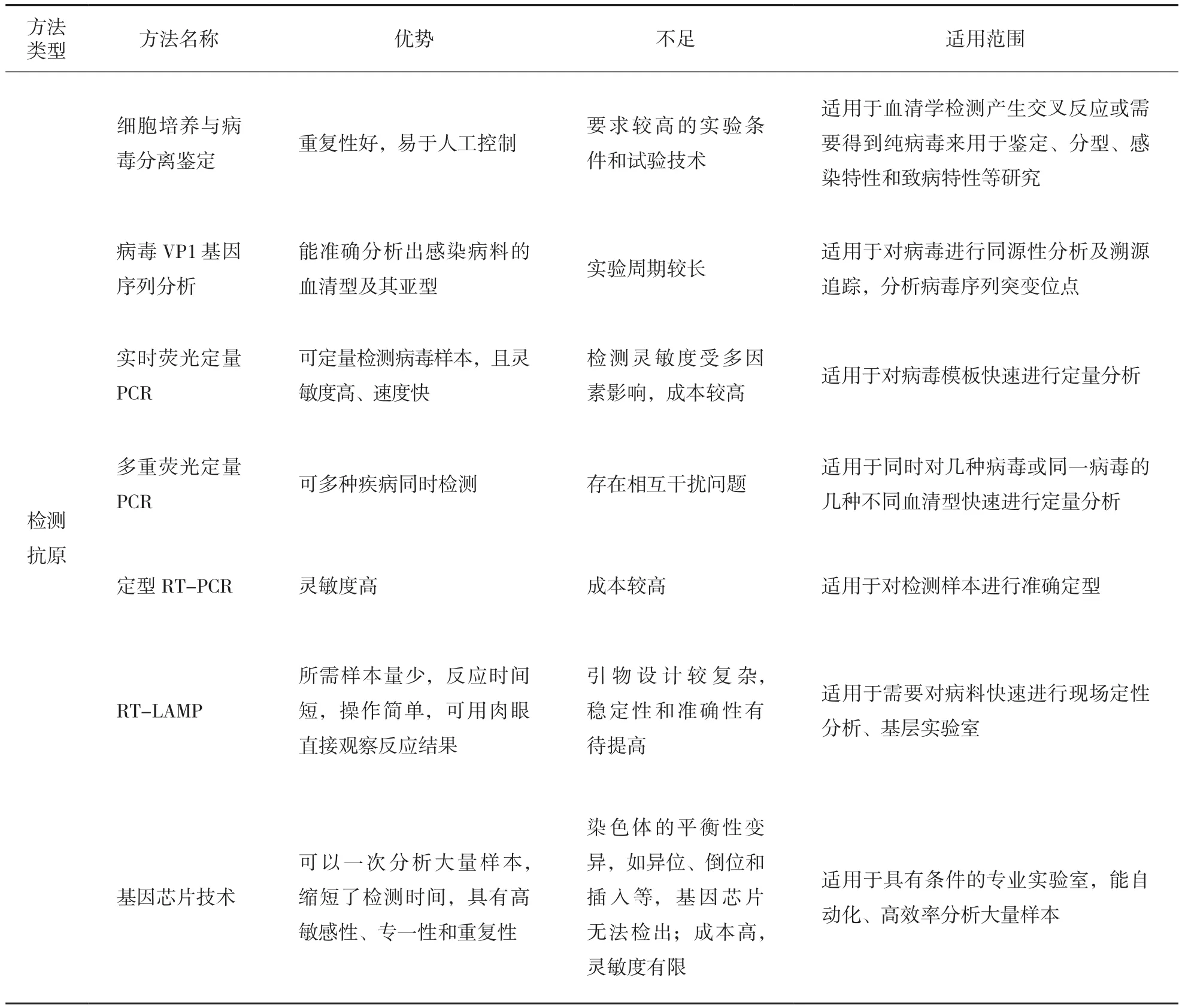
表1 13种FMDV检测方法比较
综上,可以根据具体检测条件和检测要求来选择合适的检测方法,得到更准确的检测结果,方便高效地开展口蹄疫流行病学调查和疫病防控。

