乌梅发酵香料工艺正交优化及其致香成分分析
何 力,罗海涛,刘思奎,邹恩凯,任周营,邵灯寅,陈俊宇,罗建飞
(1.江西中烟工业有限责任公司,南昌330000;2.云南瑞升烟草技术(集团)有限公司,昆明650000)
乌梅,别名酸梅、黑莓,蔷薇科植物梅的果实。乌梅喜温暖湿润、阳光充足的环境,耐寒、耐旱、不耐涝。据相关研究表明乌梅中含有苹果酸、柠檬酸、琥珀酸、谷甾醇、维生素和矿物质等多种成分[1,2]。乌梅被广泛用于食品、药品以及化工行业,是一种极具开发潜力的水果[3,4]。利用乌梅原料制作传统香料的工艺已经很成熟,但是利用微生物进行乌梅原料发酵的研究还鲜有报道。微生物发酵方法不论从香味独特性、成本控制、竞争力以及危废处理上,都展现出了广阔的市场前景[5]。传统提取工艺无法将乌梅原料中纤维素、果胶等物质进行利用,而微生物的代谢活动能充分利用这些物质,并将其转化成其他物质[6-8],本研究利用从松树林土壤中筛选出的一株真菌进行乌梅原料的发酵试验,并对其致香成分进行分析,为微生物发酵香料研究提供数据支撑。
1 材料与方法
1.1 仪器与设备
HP6890/5973 GC/MS分析仪,美国Agilent公司;SHZ-LII予华牌循环水真空泵,巩义市予华仪器有限责任公司;LABOROA 4000旋转蒸发仪,Heido⁃lph;PL3002电子精密天平,梅特勒-托利多仪器(上海)有限公司;SW-CJ-1D单人净化工作台,苏州净化设备有限公司;DW-86L388J医用低温保存箱,青岛海尔生物医疗股份有限公司。
1.2 材料与试剂
乌梅原料(自制);马铃薯葡萄糖琼脂(PDA),广东环凯微生物科技有限公司;马铃薯葡萄糖水,广东环凯微生物科技有限公司;LB培养基,青岛海博生物科技有限公司;TSA培养基,青岛海博生物科技有限公司;丙三醇AR,西陇化工股份有限公司。
1.3 方法
1.3.1 菌株筛选从云南昆明当地松树林中采集离地表10 cm深处的土壤10 g[9],放入已灭菌的蒸馏水中,摇床摇晃1 h±10 min,使土壤中自然存在的菌种充分脱落,然后利用灭菌纱布过滤土壤,之后取其摇晃充分的液体进行稀释涂布平板法接种,接种结束后,PDA平板放于28℃恒温培养箱中培养5~7 d,TSA平板放于37℃恒温培养箱培养24~48 h。培养结束后,观察长有单菌落的平板,将不同菌落形态的单菌落挑入液体培养基中,PDA平板的单菌落挑入马铃薯糖水培养基中培养3~5 d,TSA平板的菌落挑入LB液体培养基中培养24~48 h,无单菌落平板不进行菌种挑选,培养结束后,进行平板划线纯化菌株,之后保种于-80℃低温冰箱中。从土壤中筛选出真菌3株,选用其培养液气息较好的一株真菌进行发酵试验,该真菌在PDA平板上蔓延性生长,能清晰地看见菌丝体,呈青色,表面附着有孢子,在培养3 d后开始出现肉眼可见的菌体,5 d后形成孢子。将其孢子接种进马铃薯糖水进行摇床培养,24 h后培养基可变浑浊,48~72 h后可在培养基中形成菌丝球[10]。
1.3.2 菌株分子生物学鉴定方法将获得的菌液,经过液氮冷冻后,取2 g放入研钵中进行研磨,研成粉末状后加入DNA提取液(0.2 mol/L Tris-HCl、0.5 mol/L NaCl、0.01 mol/L EDTA、1%SDS),添加比例为每0.1 g粉末加入2 mL提取液,然后加入与提取液等体积的酚-氯仿-异戊醇混合液(体积比为25∶24∶1),于涡旋器上剧烈涡旋5 min,然后置于冷冻离心机内以8 000 r/min、4℃离心5 min,将上清液转移到一个新离心管中,向该离心管中加入300 mL的无水乙醇置于-20℃放置30 min。之后取出离心管,以10 000 r/min、4℃离心10 min,弃上清液,在空气中放置10 min使乙醇挥发完全。加入2 mL的TE溶液(10 mmol/L Tris-HCl、1 mmol/L EDTA)溶解沉淀即得到基因组DNA。之后将提取获得的DNA进行PCR扩增,引物对为ITS1,然后将得到的PCR产物进行切胶纯化后进行测序获得其结果。
1.3.3 正交试验设计利用Penicillium polonicum真菌进行乌梅原料发酵的单因素设计试验,以及根据微生物发酵在其他底物上的应用[11,12],以发酵时间、发酵温度和菌液接种量为主要影响因素,感官评吸分数作为考察指标,进行L9(34)正交试验,每项试验重复3次。
1.3.4 菌株发酵试验种子液的制备:取出保存菌株,接种于马铃薯糖水培养基中,接种量为菌种保存液∶培养基=1∶100,接种后于摇床中28℃,180 r/min培养72 h后取出备用。
底物制备:取乌梅去核果肉100 g于锥形瓶中,补水至400 g后放入高压蒸汽灭菌锅中121℃灭菌20 min,结束后拿出冷却到常温备用。
发酵浓缩试验:在无菌环境下,取已制备好的种子液,接种于冷却至常温制备好的底物中,接种后充分摇晃后,放于摇床中培养。培养结束后取出发酵液,装入旋转蒸发仪中进行浓缩,水浴温度为70℃,乌梅发酵浸膏浓缩至密度为(1.390±0.008)g/cm3。
1.3.5 样品致香成分检测方法将制得的发酵乌梅浸膏与未发酵的乌梅原料,利用同时蒸馏萃取-气相色谱质谱联用法检测其致香成分并进行结果分析。
同时蒸馏萃取:取发酵样品与未发酵原料各25 g放入同时蒸馏萃取装置一端的500 mL圆底烧瓶中,加入250 g水,用电热套加热,装置的另一端为盛有25 mL二氯甲烷的100 mL圆底烧瓶,用60℃水浴加热,同时蒸馏萃取2 h。二氯甲烷萃取液用无水硫酸钠干燥,置于4℃保藏柜放置,过滤,滤液倒入浓缩瓶中用Vigreux柱浓缩至约1 mL,浓缩液用于GC/MS分析备用。
GC/MS条件:毛细管柱HP-5MS(30 m×0.25 mm×0.25 μm);进样口温度240℃;载气He,1 mL/min;程序升温50℃(1 min)→8℃/min→160℃(2 min)→8℃/min→260℃(15 min);进样量1 μL,分流比20∶1;传输线温度280℃;电离方式EI,电离能量70 eV;离子源温度230℃;四级杆温度160℃;质量范围35~455 aum,溶剂延迟时间2 min。
2 结果与分析
2.1 菌株鉴定结果
根据碱基对分析得到以下结果,见图1。通过测序结果对比查询可知,该菌株为Penicillium polon⁃icum真菌,有相关研究表明该真菌的代谢产物在各领域中有较多的应用[13-15]。且刘静等[15]在利用其PDB培养基进行培养后,得到了酯类、烯烃类、醛类以及杂环类物质。
2.2 工艺优化
经前期单因素试验验证,将发酵时间、发酵温度以及接种量作为主要影响因素,制作正交因素水平表L9(34)(表1),利用SPSS软件进行正交试验设计对发酵工艺进行优化。

表1 正交试验因素水平表L9(34)
2.2.1 正交试验结果直观分析根据正交设计直观结果(表2)和极差值R的结果(表3)可以得出,各因素对感官评吸分数影响大小的顺序为发酵时间(A)>发酵温度(B)>接种量(C)。

表2 正交试验结果
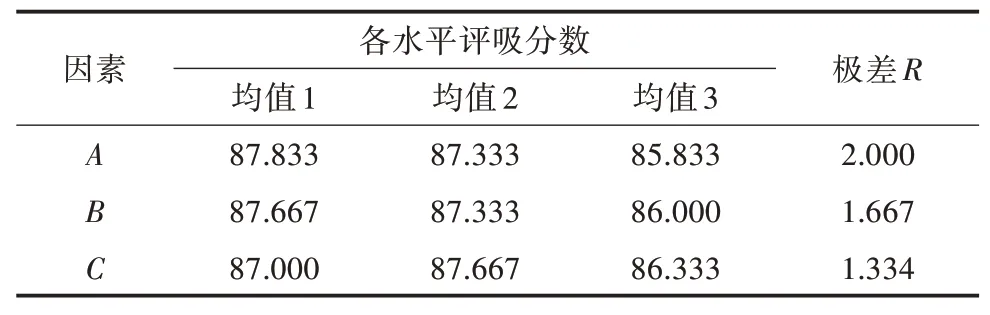
表3 各因素水平均值与极差
根据3因素的平均值以及水平均值(图2)分析可以得出,发酵温度为25℃,感官评吸分数最高;发酵时间为24 h,感官评吸分数最高;接种量为2%,感官评吸分数最高。因此得出其最佳的组合方式为A1B1C2,即发酵乌梅原料的条件为温度25℃、发酵24 h、接种量2%。
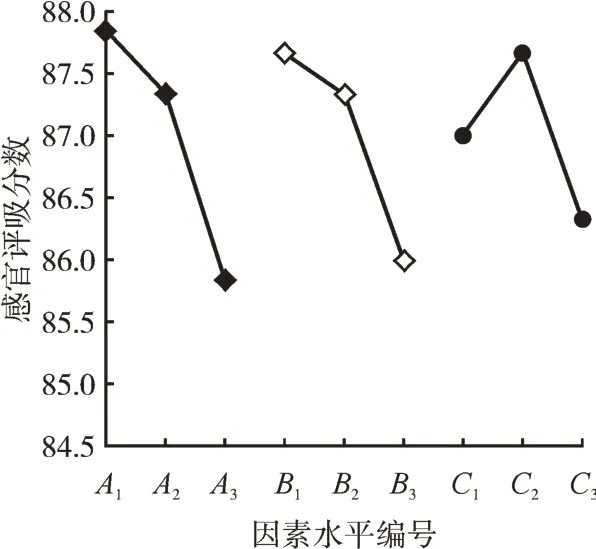
图2 三因素三水平均值
2.2.2 正交试验结果的方差分析和多重比较方差分析结果(表4)表明,各因素对发酵乌梅原料的感官评吸结果的影响为发酵时间影响显著(P<0.05),发酵温度影响显著(P<0.05),接种量影响不显著(P>0.05)。

表4 L9(34)正交试验方差分析
多重因素比较结果(表5至表7)表明,发酵时间中24、48 h水平之间差异不显著(P>0.05),发酵温度中25、30℃之间差异不显著(P>0.05),接种量各水平之间差异不显著(P>0.05),因此,可以确定其最适合发酵条件为A1B1C2,即发酵时间24 h,发酵温度25℃,接种量2%。
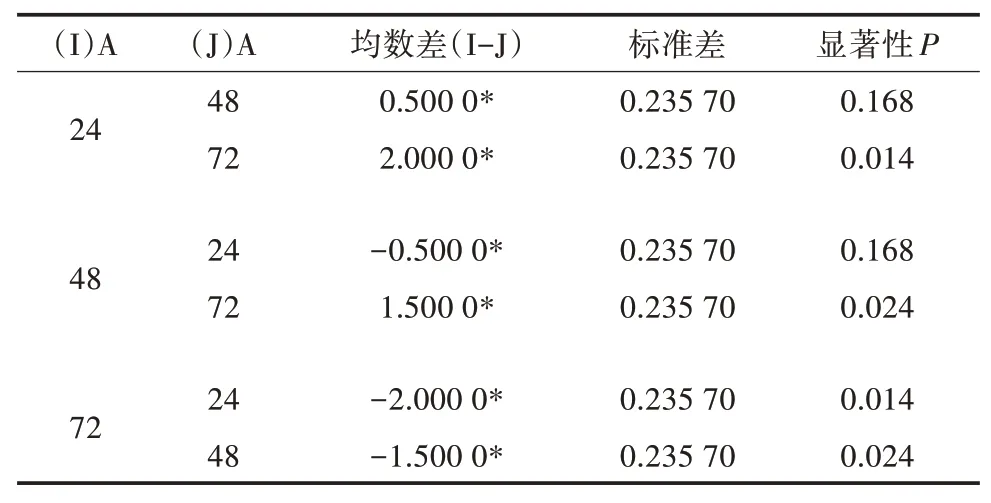
表5 因素A多重比较(LSD法)
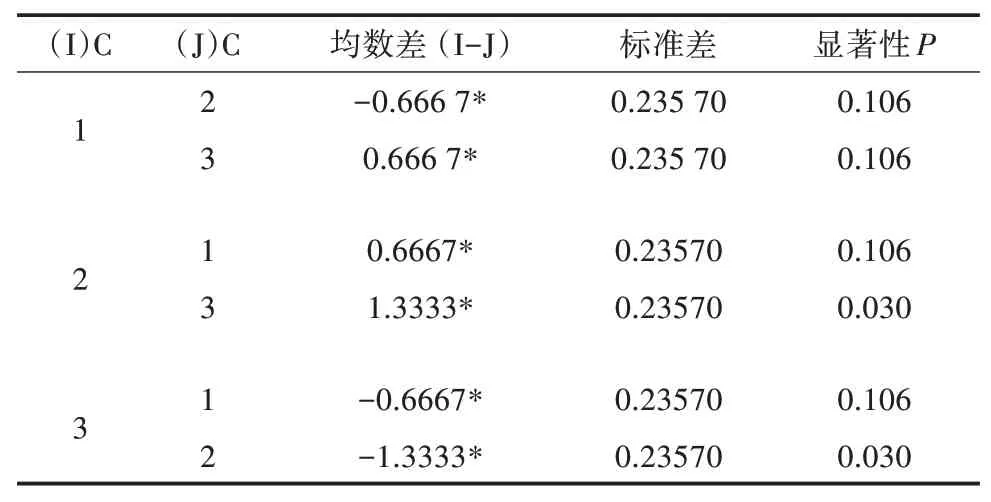
表7 因素C多重比较(LSD法)
2.3 致香成分分析
利用正交试验所得结果进行发酵后乌梅提取物与未发酵乌梅原料的致香成分进行分析,利用同时蒸馏萃取-气相色谱质谱联用法得到以下致香成分,结果见表8。
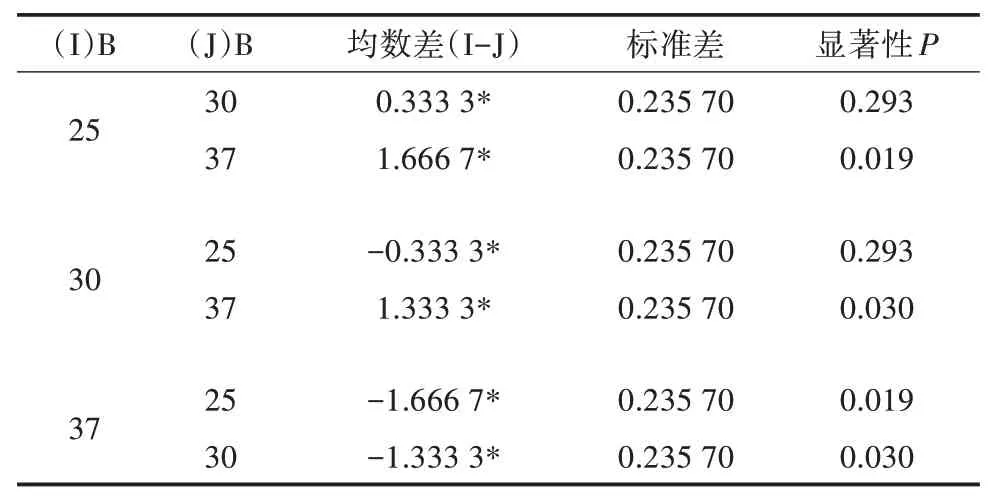
表6 因素B多重比较(LSD法)
发酵乌梅提取物与未发酵乌梅原料致香成分分析可以发现,发酵乌梅浸膏中在应用方面有正面作用的苯甲醇、苯乙醇、苯乙醛[16,17]的含量明显增加,并且产生了新的挥发性物质,其中3-戊烯-2-酮、己醛、乙酸丁酯、2-甲基丁酸、乙酰乙酸乙酯都带有果香味,可以丰富乌梅发酵浸膏果类香味。此外,发酵后的浸膏中具有抑制香气作用的戊酸、己酸、苯甲酸、癸酸乙酯[18]的含量下降。
由表8可知,发酵的乌梅原料中酸类有12种,醛类5种,酯类24种,酮类13种,醇类6种,酚类4种,烯烃类1种,杂环类11种,共76种物质,其主要为糠醛(94.192 μg/g)、苯甲酸(34.948 μg/g)、棕榈酸(155.395 μg/g)、棕榈酸乙酯(69.033 μg/g)、亚油酸(38.596 μg/g)、亚油酸乙酯(54.879 μg/g)、亚麻酸乙酯(35.929 μg/g)。发酵24 h乌梅提取物中酸类有8种,醛类8种,酯类23种,酮类16种,醇类2种,酚类4种,烯烃类1种,杂环类7种,共68种致香物质,有9种新增物质,发酵提取物挥发性成分主要为苯甲醇(34.035 μg/g)、苯甲酸(30.113 μg/g)、棕榈酸(111.236 μg/g)、棕榈酸乙酯(38.695 μg/g)、亚油酸(34.555 μg/g)、亚油酸乙酯(32.446 μg/g)。发酵48 h乌梅提取物中酸类有8种,醛类8种,酯类22种,酮类17种,醇类2种,酚类5种,烯烃类1种,杂环类7种,共70种,有11种新增物质,发酵提取物挥发性成分为苯甲醇(33.397 μg/g)、棕榈酸(76.872 μg/g)、棕榈酸乙酯(31.954 μg/g)。
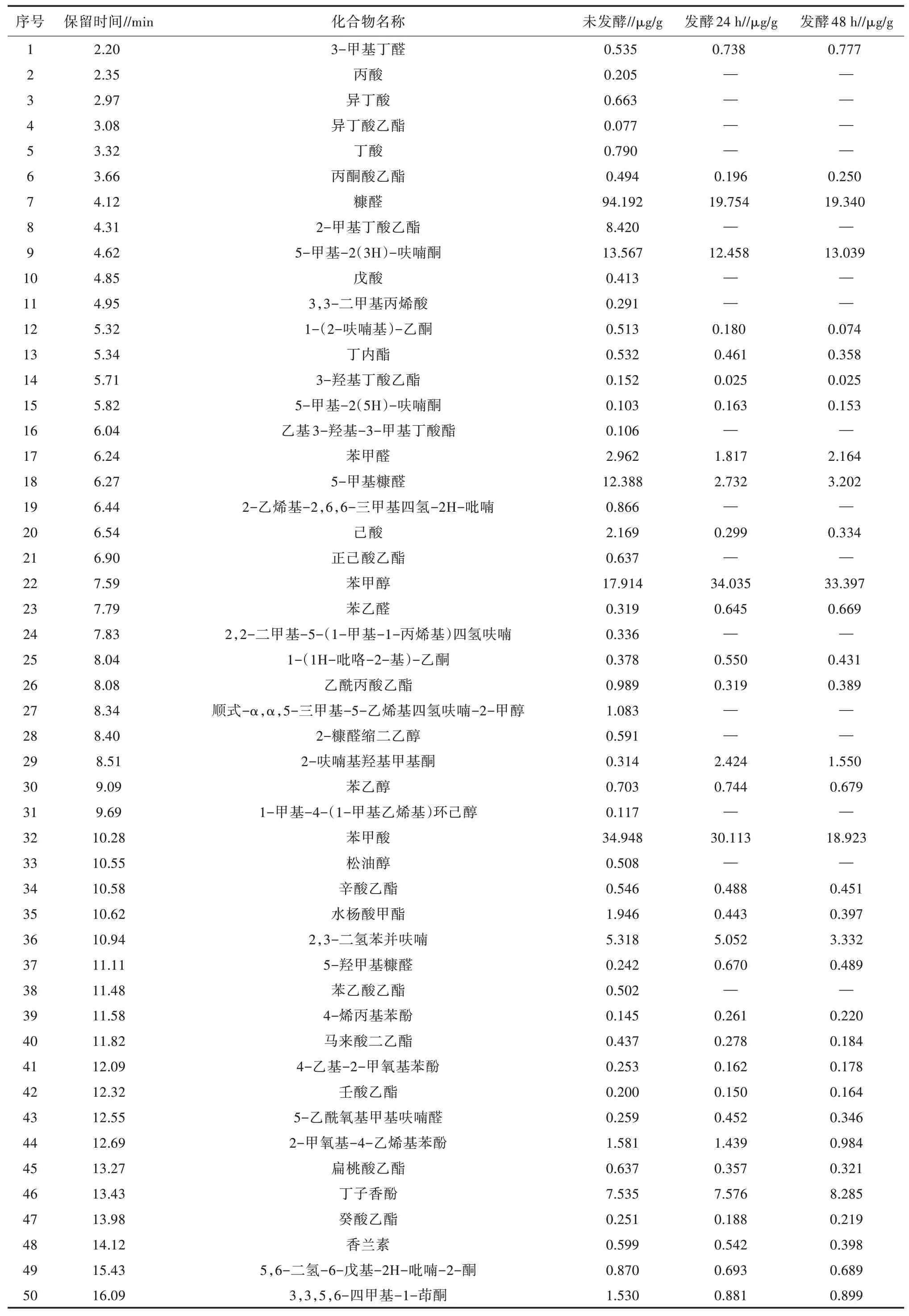
表8 未发酵乌梅浸膏与发酵乌梅浸膏致香成分
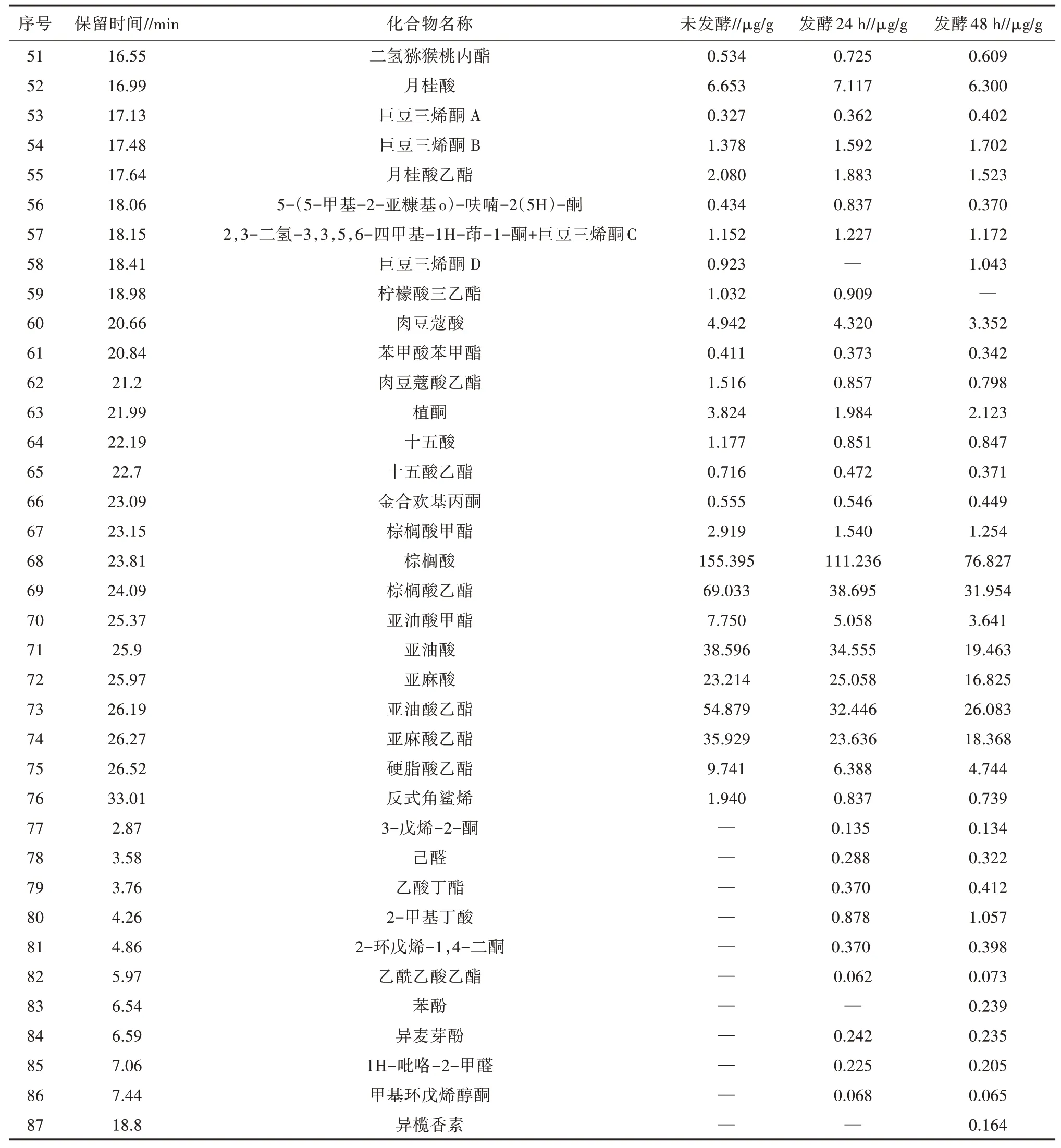
续表
从图3和图4分析可得,发酵24h乌梅提取物与未发酵乌梅原料相比,致香物质中糠醛含量下降79.03%,戊酸下降100%,己酸下降86.21%,正己酸己酯下降100%,苯甲酸下降13.83%,松油醇下降100%,十五酸下降27.70%,棕榈酸乙酯下降43.95%,亚油酸下降10.47%,亚油酸乙酯下降40.88%,亚麻酸乙酯下降34.21%;而也有一些含量明显增加的物质,如3-甲基丁醛上升37.94%,苯甲醇上升89.99%,苯乙醛上升102.19%,4-烯丙基苯酚上升80%,二氢猕猴桃内酯上升35.77%。发酵48 h乌梅提取物与未发酵乌梅原料相比,糠醛含量下降79.47%,戊酸下降100%,己酸下降84.60%,正己酸己酯下降100%,苯甲酸下降45.85%,松油醇下降100%,十五酸下降28.04%,棕榈酸乙酯下降53.71%,亚油酸下降49.57%,亚油酸乙酯下降52.47%,亚麻酸乙酯下降48.88%;而也有一些含量明显增加的物质,如3-甲基丁醛上升45.23%,苯甲醇上升86.43%,苯乙醛上升109.72%,4-烯丙基苯酚上升51.72%,二氢猕猴桃内酯上升14.04%。综上,利用Penicillium polonicum真菌进行乌梅原料发酵,能提高致香物质中果香类物质的含量,降低抑制香气物质的含量。在发酵过程中部分致香物质发酵24 h后含量上升,但发酵48 h后,开始下降,这是因为微生物代谢活动所产生的代谢产物的过多积累会影响菌株的生长,当代谢产物积累到一定量时,菌株代谢活动将被抑制,甚至会利用代谢产物重新合成其他的物质[19]。

图3 致香成分分析
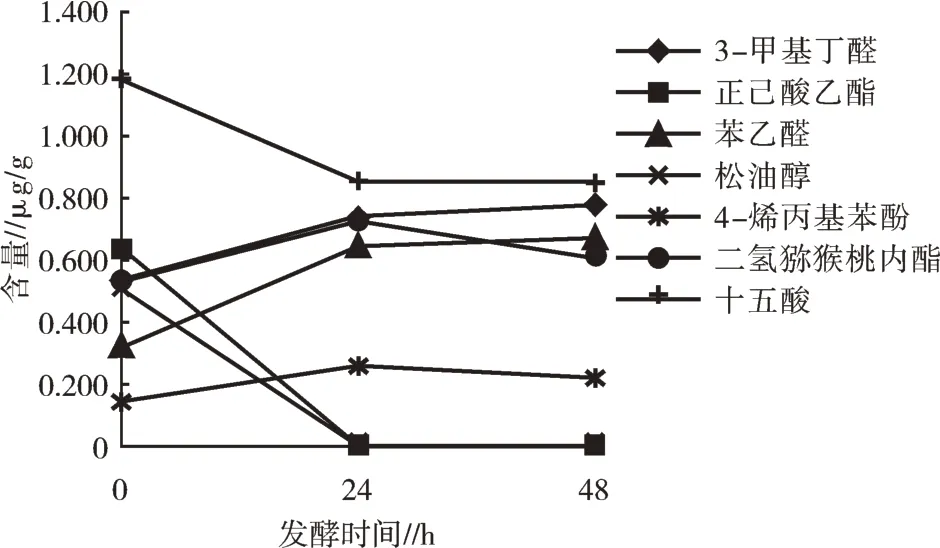
图4 致香成分分析
3 结论
本试验利用从松树林土壤中筛选出来的Peni⁃cillium polonicum真菌菌株,在乌梅原料上进行发酵,发酵后物质含量和数量有明显改变,苯甲醇、苯乙醛和3-甲基丁醛的含量有明显的上升,并且新增了己醛、2-甲基丁酸、异麦芽酚等物质,它们都能为浸膏带来强烈的果香味。从数据上可以推论Peni⁃
cillium polonicum真菌主要是利用浸膏中的糠醛和有机酸类物质进行自身的代谢活动,而产生其他的醇类、酚类、醛类与杂环类物质,由于杂环类物质有不饱和的闭环体系,因此性质稳定,且与苯系物有着相似的性质[20,21],醇、酚、醛以及苯系物大部分具有丰富香气的作用,对发酵的乌梅提取物的致香成分积累有着重要的作用。而且从发酵时间上来看,发酵24 h的提取物积累的致香物质总量相对较多,发酵后的样品能带来更好的清甜香气,说明该菌株以乌梅为原料进行发酵时,发酵24 h时效果达到最佳。

