湖北白猪精原干细胞分离培养及初步鉴定
张立苹,华再东,肖红卫,任红艳,朱 喆,毕延震
(湖北省农业科学院畜牧兽医研究所/动物胚胎工程及分子育种湖北省重点实验室,武汉430064)
精原干细胞(spermatogonial stem cells,SSCs)是一类位于雄性哺乳动物睾丸生精小管基膜上、具有自我更新与定向分化能力并能够产生精母细胞的成体干细胞,也是雄性动物体内惟一能够将自身遗传物质传递给下一代的干细胞,是生成精子的基础细胞[1]。因此,通过SSCs的体外培养和细胞移植,可为繁育优良动物个体、生产基因修饰动物、治疗雄性不育和人类某些遗传疾病提供新思路和新方法[2]。而通过对哺乳动物精原干细胞的诱导分化得到的功能性精子,是解决人类生殖问题的安全、有效的途径,且对精子发生过程、精原干细胞自我更新与分化、生产基因修饰动物等方面的研究具有重要的科学研究意义[3]。
SSCs的体外分离、细胞纯化和鉴定是开展其生物学特性研究、诱导分化及在基因编辑动物制备和种质资源保存上应用的关键和首要步骤,优化精原干细胞分离纯化技术和鉴定方法,建立高效、便捷的精原干细胞体外培养体系,有助于精原干细胞生物学特性和增殖分化机制的进一步研究以及精原干细胞在基因编辑动物制备方面的应用[4]。Kanatsu-Shinohara等[5]首次成功将小鼠精原干细胞诱导为多潜能干细胞。近年来,随着小鼠精原干细胞体外分离培养技术的不断改进,基本能富集到大量细胞,促进了SSCs诱导多能干细胞和体外诱导精子的研究。大动物的SSCs体外分离技术也逐渐兴起,但尚未完全成熟[6,7]。
本试验通过对比不同日龄湖北白猪睾丸精原干细胞的体外分离培养及初步鉴定结果,建立适用于湖北白猪精原干细胞体外分离培养体系,从而为进一步在体外培养条件下研究湖北白猪精原干细胞的分化能力、自我更新能力等提供有力条件,并为后续制备基因编辑猪提供原材料。
1 材料与方法
1.1 材料
1.1.1 试验动物随机选取5日龄、10日龄、15日龄健康湖北白猪,由湖北省瘦肉猪研究中心提供。
1.1.2 主要试剂DMEM-F12培养液、胎牛血清、双抗(1 000 IU/mL)、DPBS等试剂购自于GIBCO公司;Ⅳ型胶原蛋白酶、0.25%胰蛋白酶购自于Sigma公司;DNaseⅠ购自于Invitrogen公司;BCIP/NBT碱性磷酸酶染色试剂盒购自于碧云天生物技术有限公司。
1.1.3 主要仪器Leica DMI3000B倒置显微镜,Ep⁃pendorf AG 22331 Hamburg离心机。
1.2 方法
1.2.1 湖北白猪精原干细胞分离采集5日龄、10日龄、15日龄湖北白猪睾丸,选择75%乙醇溶液擦拭湖北白猪手术部位,活体采集湖北白猪睾丸,75%乙醇溶液洗涤2 min,35℃生理盐水(含双抗100 U/mL)洗涤3次后保温带回实验室;将取回的睾丸放入装有生理盐水(含双抗100 U/mL)的平皿中,用镊子将睾丸提起,用剪刀将睾丸外部组织等剥离,清洗后放在另一个培养皿中,剥去睾丸膜,换入下一个培养皿将睾丸剪碎,分为3份,分别转入2、4、8 mg/mL 3种浓度Ⅳ型胶原蛋白酶中37℃水浴锅消化30 min,600 r/min离心3 min去除大部分的睾丸间质细胞,收集曲细精管于50 mL离心管中并置于37℃水浴锅,加入0.25%胰蛋白酶中消化分离精原干细胞,消化期间镜检观察精原干细胞的分离情况,当消化为单细胞时,加入培养液终止消化,40 μm网筛过滤,分装到2 mL离心管中,1 000 r/min离心5 min洗涤2遍,重悬后接种到6孔板中,每管一孔,补加培养液至2 mL进行培养。在39℃、5% CO2、饱和湿度条件下培养,24 h半量换液。
1.2.2 湖北白猪精原干细胞纯化采用差异贴壁法纯化湖北白猪精原干细胞。将接种在6孔板中细胞放在39℃培养箱培养2 h后,移液器轻轻吹打,吸取上清液,并接种到新的培养皿中继续培养。重复此操作3~4次贴壁,收集未贴壁的细胞置饲养层培养。
1.2.3 湖北白猪精原干细胞体外培养取胎牛血清10 mL加入600 μL双抗,加入DMEM-F12至60 mL,即为精原干细胞体外培养液。将最后一次贴壁板上的细胞消化传代至饲养层细胞上,按2 mL/孔加入六孔板,39℃、5% CO2、饱和湿度培养,24 h半量换液。培养基中添加不同浓度(10、20、30、40和50 ng/mL)LIF,分析LIF对湖北白猪精原干细胞体外培养的影响。
1.2.4 饲养层细胞的处理当2次贴壁的六孔板中贴壁细胞汇合度达到70%~80%时,DPBS洗涤2遍,加入0.5 mL 0.25%胰蛋白酶消化2~3 min,荧光倒置显微镜下观察细胞消化情况,当细胞边缘处于微微皱缩时,加入1 mL培养基终止消化并传代,传代细胞量为400 μL/孔。传代细胞汇合度达到90%时加入20 μg/mL丝裂霉素C处理2 h,即得饲养层细胞。
1.2.5 湖北白猪精原干细胞碱性磷酸酶检测弃去培养在六孔板中干细胞的旧培养基,用提前在37℃保温箱中预热的DPBS洗涤2次,4%多聚甲醛固定10~15 min,DPBS洗涤3次,每孔加入1 mL BCIP/NBT染色工作液,室温避光孵育5~30 min,弃BCIP/NBT染色工作液,DPBS清洗终止显色反应,在荧光倒置显微镜下观察并拍照记录。
2 结果与分析
2.1 湖北白猪精原干细胞的分离纯化
选取5日龄、10日龄、15日龄湖北白猪睾丸(图1A)进行平行试验。结果表明,10日龄小猪睾丸更适合分离精原干细胞,5日龄小猪睾丸小且嫩,试验前为防止出现细胞污染现象,需要75%乙醇溶液对湖北白猪睾丸进行消毒,消毒的同时对睾丸也产生一定的损伤,分离得到的细胞生长缓慢且状态不佳,15日龄猪睾丸分离获取的细胞生长时间长。
在利用Ⅳ型胶原蛋白酶消化时,对比浓度2、4、8 mg/mLⅣ型胶原蛋白酶消化睾丸组织情况。结果表明,4 mg/mLⅣ型胶原蛋白酶水浴消化睾丸组织30 min获取曲细精管(图1B),联合0.25%胰蛋白酶消化获取精原干细胞效果最好(图1C精原干细胞与支持细胞等混合液),组合酶的联合使用既便于镜检细胞的消化程度,又减少了细胞损伤;同时试验对DNaseI的使用进行了对比,研究发现DNaseI对分离干细胞的结果影响不显著,但使用DNaseI时,液体的黏稠度降低,有利于过滤。

图1 湖北白猪精原干细胞体外分离纯化
2.2 湖北白猪精原干细胞的体外培养
采用差异贴壁分选方法纯化湖北白猪精原干细胞。将接种在6孔板中的细胞放在37℃培养箱培养2 h后,轻轻吹打,吸取上清液,接种到新的培养皿中继续培养,重复3~4次贴壁,收集未贴壁的细胞置饲养层培养。湖北白猪精原干细胞分离培养发育进程如图2所示。从图2可以看出,湖北白猪精原干细胞在体外培养过程中,细胞逐渐聚集形成细胞松散的细胞集落,最后形成紧密细胞簇,并且在体外培养过程中,细胞始终呈圆形状态,且附着在支持细胞表面。而睾丸分离出来的支持细胞等贴壁细胞自培养12 h贴壁铺展于培养皿底部,并且开始增殖。试验对比了不同浓度(10、20、30、40和50 ng/mL)LIF对精原干细胞体外培养的影响,结果显示影响不显著。试验同时对比了湖北白猪睾丸支持细胞在湖北白猪精原干细胞培养中的作用,结果发现湖北白猪睾丸支持细胞对湖北白猪精原干细胞的体外培养影响显著,且20 μg/mL丝裂霉素C处理2 h的支持细胞效果更好,但是形态上丝裂霉素C处理前后的支持细胞没有明显区别(图3)。
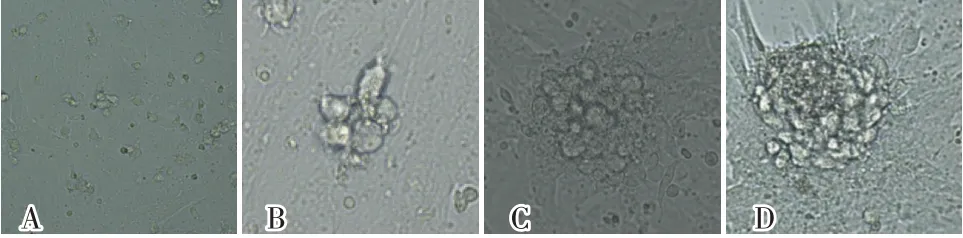
图2 湖北白猪精原干细胞体外培养发育进程
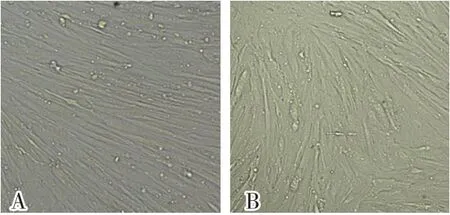
图3 丝裂霉素C处理前后的支持细胞
2.3 湖北白猪精原干细胞碱性磷酸酶鉴定
对培养的干细胞进行了碱性磷酸酶鉴定,结果如图4所示。结果表明,用碱性磷酸酶进行细胞染色后,干细胞表现出较强的碱性磷酸酶活性,且颜色明显,而支持细胞不着色。
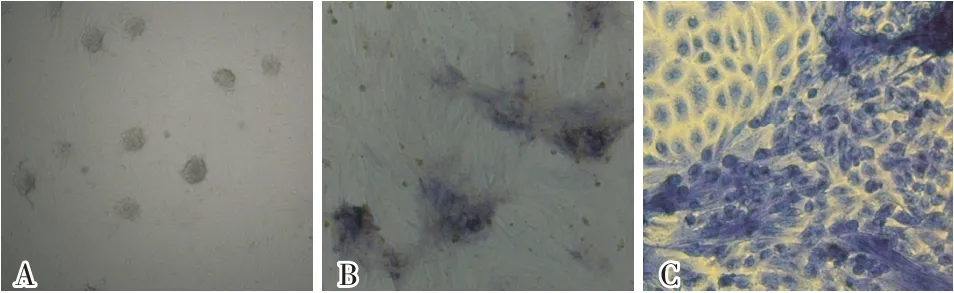
图4 湖北白猪精原干细胞碱性磷酸酶鉴定
3 小结与讨论
3.1 湖北白猪精原干细胞的分离纯化
动物精原干细胞体外分离纯化培养是研究其生物学特性、诱导分化及在基因编辑动物制备和种质资源保存上应用的基础[4],而SSCs的分离是体外培养和细胞系能否成功构建的首要步骤。研究表明,动物精原干细胞具有较强的自我更新和分化能力,理论上可以在各年龄段雄性动物睾丸中分离得到,但获得的干细胞比例随动物年龄增加而明显降低[8]。研究发现,SSCs在新生小鼠睾丸中可达到约1.41%,而在成年小鼠睾丸中则降低至0.02%~0.03%[9],因此,取材动物年龄的选择对SSCs的分离非常重要。研究者分离精原干细胞多选用青春期前的雄性动物睾丸作为原材料。本试验分别对5日龄、10日龄和15日龄湖北白猪精原干细胞进行了体外分离纯化培养,发现10日龄湖北白猪睾丸更适用于精原干细胞的体外分离培养。
目前,获得动物睾丸组织的单细胞悬液一般都采用两步酶消化法,该方法虽然得到不断的改良和优化,但基本的思路是相同的[10-13],即先用消化能力缓和的胶原酶消化间质细胞,暴露内在的曲细精管,再用0.25%胰蛋白酶进一步消化其曲细精管后,用网筛过滤掉细胞壁等杂质,获得单细胞悬液[14-18]。2007年,Goel等[19]在消化猪睾丸组织过程中,首先去掉了间质细胞,最后分离SSCs,从而提高了分离细胞的纯度。Yang等[20]比较了猪精原干细胞分离方法,发现采用酶消化法与机械法结合的方式能获得更高比率的活细胞,约为仅使用机械法获取干细胞的10倍。本研究中采用机械分离法联合酶消化获取精原干细胞,即先用剪刀将已经处理过的睾丸组织剪碎,用Ⅳ型胶原蛋白酶在37℃水浴30 min对组织块进行消化,600 r/min离心3 min除去大部分的睾丸间质细胞,收集曲细精管,0.25%胰蛋白酶中消化分离精原干细胞,最后用40 μm网筛过滤收集得到SSCs细胞,其中对Ⅳ型胶原酶的浓度进行了对比试验,表明4 mg/mL的胶原酶Ⅳ进行消化,消化时间30 min,效果最好,即便于镜检细胞的消化程度,又减少了细胞损伤;离心管处于水浴中进行消化,效果更好;研究发现DNaseI,对分离干细胞的效果影响不显著,但是使用DNaseI时,液体的黏稠度降低,有利于过滤。
3.2 湖北白猪精原干细胞的体外培养
动物精原干细胞分离富集后的体外培养是成功建立SSCs细胞系的关键环节,只有SSCs可以在体外传代并长期培养,才能得到足够的细胞量,从而为后续细胞的生物学研究提供足够的试验原材料,适当的SSCs培养条件可使动物精原干细胞完成自身损伤的修复和增殖,为细胞的遗传修饰及准备受体动物争取时间,提高细胞移植和基因编辑效率[21]。然而,动物精原干细胞的体外培养效果主要取决于最佳培养条件的探索和选择。
饲养层细胞即用物理或化学方法人为处理后不能再次增殖的细胞,但是细胞本身仍然能够分泌诸多生长因子,从而促进精原干细胞增殖[22]或抑制细胞分化[23],因而饲养层有助于干细胞建系[24]。目前,常用的饲养层细胞有睾丸支持细胞、BEF细胞和小鼠胚胎成纤维细胞耐鸟苯苷亚系(STO细胞)等。冉竞超等[25]利用胶原酶和透明质酸酶混合使用来除去间质细胞,从而获得较纯的支持细胞作干细胞培养的饲养层,并在培养基中添加GDNF、LIF和bFGF等生长因子后,精原干细胞克隆明显增加。Zhang等[26]分离新生仔猪的支持细胞作为干细胞的饲养层细胞,并在DMEM-F12添加10%血清替代物(knockout serum replacement,KSR)和4种细胞因子(GDNF、GFRα1、bFGF和IGF1)作为培养基,获得未分化的猪精原细胞,且该细胞可以在体外增殖至少2个月而不丧失细胞干性。本试验用湖北白猪精原干细胞体外分离纯化时2次贴壁的支持细胞经过20 μg/mL丝裂霉素C处理2 h后作为饲养层进行湖北白猪精原干细胞的体外培养得到了较好的效果,湖北白猪睾丸支持细胞跟精原干细胞同种来源,体外培养过程中经过直接分泌或旁分泌产生的生长因子营造的细胞生长微环境更接近于精原干细胞体内生长环境,促进了湖北白猪精原干细胞的体外生长发育。
生长因子是细胞在分化和生长过程中必不可少的一类生物分子。研究表明,白血病抑制因子(Leukemia inhibitory factor,LIF)是胚胎干细胞(Embryo stem cell,ESCs)体外自我更新和促进增殖的关键细胞因子[27,28]。试验表明,LIF对鼠睾丸生殖细胞的体外增殖有促进作用;Dirami等[29]研究表明在培养基中添加EGF、GDNF、LIF、bFGF和SCF 5个生长因子的单个或任意组合时均促进体外SSCs的增殖。在本试验中添加LIF对湖北白猪精原干细胞的生长发育影响不显著。
3.3 湖北白猪精原干细胞鉴定
动物精原干细胞的鉴定方法主要有形态学鉴定法、表面特异性标记鉴定法及功能性鉴定法等。本试验主要通过形态学联合碱性磷酸酶进行了湖北白猪精原干细胞的鉴定,体外培养72 h后干细胞形成集落,培养第6天形成结构紧密的干细胞簇,这与其他研究者的结果一致[11]。研究表明,结构和功能完整的SSCs中有完整的AKP表达,因此,利用AKP细胞化学反应对SSCs进行鉴定,本试验利用AKP对体外培养的PSSCs进行了鉴定,表明细胞是湖北白猪SSCs并具有干细胞的基本特征。

