JAK1/2抑制剂芦可替尼治疗噬血细胞综合征的研究进展
吴梦慧 徐晓军
噬血细胞综合征又称噬血细胞性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis,HLH),是一组机体免疫应答异常导致的淋巴细胞和组织细胞过度增殖、活化,分泌大量细胞因子,引起多器官、多系统高炎性反应的临床综合征,临床以发热、肝脾大及血三系减少等为主要表现[1,2]。HLH病因复杂、起病急、进展快、临床表现多样,不经及时有效治疗,病死率较高,预后极差。近30年来,尤其是HLH发病机制的阐明和HLH-1994及HLH-2004方案的提出,将HLH患儿的生存率从不到5%提高到62%,然而,仍有约30%的患儿对当前治疗反应不佳,迫切需要新的治疗手段[3,4]。
随着对HLH发病机制的深入研究,越来越多的靶向药物如血细胞簇分化抗原52(cluster of differentiation 52,CD52)单抗alemtuzumb、白细胞介素(interleukin,IL)-1受体阻滞剂anakinra及干扰素-γ(interferon-gamma,IFN-γ)单抗emapalumab等得到临床认可[5]。其中JAK1/2激酶抑制剂芦可替尼在治疗HLH、移植物抗宿主病、新型冠状病毒肺炎等各类细胞因子相关的疾病方面得到了广泛的应用,且取得了不错的临床反应。
一、HLH的发病机制
HLH是T细胞或单核-吞噬细胞过度活化引发细胞因子风暴,进而引起多脏器损伤的临床综合征。1991年,Henter等[6]首先发现HLH患儿血清IL-6和IFN-γ水平明显升高。动物模型显示,穿孔素缺陷(Prf-/-)的小鼠在感染淋巴细胞性脉络从脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)后发生HLH,出现HLH典型临床表现并伴有IFN-γ水平显著升高,而利用抗体阻断IFN-γ则可以减轻HLH小鼠的脏器损害,延长其生存期[7]。
笔者所在课题组自2005年开始采用流式微阵列技术检测HLH患儿血清细胞因子水平,发现HLH患儿急性期血清IL-10和IFN-γ显著升高,伴IL-6轻度升高的细胞因子谱对于HLH的诊断有较强的特异性,且HLH缓解后细胞因子迅速降至正常水平。进一步对血液病房发热患者进行队列研究发现,IL-10>75pg/ml,IFN-γ>60pg/ml的细胞因子谱对于HLH诊断的敏感度为93.0%,特异性达到98.9%,具有高度的准确性。同时,该细胞因子谱也有利于HLH的早期诊断[8]。此外,针对IFN-γ的单抗emapalumab对于原发性HLH的临床研究也显示出良好的疗效,明显提高了HLH患儿的总体生存率和需要行造血干细胞移植(hematopoietic stem cell transplantation,HSCT)治疗患儿的生存率[9]。以上研究均表明以IFN-γ为代表的细胞因子在HLH发病中起到关键作用。
随着HLH相关基因的发现,HLH的发病机制也愈加清晰[10]。穿孔素或细胞脱颗粒相关的基因突变,导致T细胞和NK细胞的细胞毒功能缺陷,在机体遭受病毒等各类病原体感染时不能正常杀伤靶细胞。在抗原持续刺激下,T细胞过度增殖、活化,分泌大量IFN-γ,进而激活巨噬细胞。活化的巨噬细胞产生大量细胞因子,如IL-10、IL-12、IL-18及IL-6等,同时黏附分子表达增加,出现噬血现象。细胞因子风暴和组织细胞浸润导致发热、血细胞减少、肝功能损害、凝血功能异常等临床现象。不过目前研究发现,很多继发性HLH并非T细胞驱动,而主要是巨噬细胞驱动,如巨噬细胞活化综合征(macrophage activation syndrome,MAS)、获得性免疫缺陷病(acquired immunodeficiency disease,AID)等[11]。
二、JAK1/2抑制剂芦可替尼治疗HLH的机制
JAK-STAT信号通路是诸多细胞因子信号的重要共同通路,主要由两部分组成:酪氨酸激酶JAK和信号转导及转录活化因子STAT。JAK主要包括JAK1、JAK2、JAK3和酪氨酸激酶2(TYK2),其中,JAK1和JAK2表达于全身细胞,在细胞因子受体介导的信号转导通路中起枢纽作用,而STAT家族是一种转录因子,负责将胞外信号转导到细胞核上,与靶基因相互作用,促进细胞持续活化和增生[12]。IL-6、IL-10和IFN-γ等细胞因子均可激活JAK1、JAK2通路,使与受体偶联的JAK相互靠近并发生磷酸化,激活信号通路,活化的JAK2进一步激活下游的STAT5,进而促进G蛋白偶联受体磷酸化,激活下游的磷脂酰肌醇3-激酶(PI3K),最终致使IL-6、IL-10和IFN-γ的转录增加,引发细胞因子风暴[13,14]。
笔者所在课题组曾报道1例STAT5缺陷的患儿在结核分枝杆菌感染后出现HLH,但并未发生细胞因子风暴,甚至IFN-γ处于正常水平,提示JAK-STAT信号通路对于细胞因子风暴发生的重要性[15]。而JAK1/2抑制剂芦可替尼,可选择性抑制JAK1和JAK2通路信号转导,IL-6和IFN-γ的转录减少,减轻细胞因子风暴(图1)[12]。
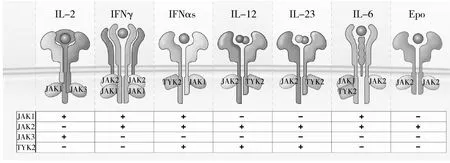
图1 不同JAK抑制剂对细胞因子信号转导通路的调节Epo.erythropoietin,促红细胞生成素
Das等[7]构建了原发性及继发性HLH两种小鼠模型,发现CpG DNA反复感染诱发的继发性HLH小鼠组,在接受芦可替尼治疗后,细胞因子水平下降、血象改善、组织损害减轻;在LCMV感染诱导的原发性HLH小鼠组,芦可替尼除改善临床表现外,还提高了生存率,在不影响细胞脱颗粒能力和细胞毒功能基础上降低T细胞和髓系细胞数量,阻止中性粒细胞活化。Maschalidi等[16]同样利用LCMV来感染细胞毒功能缺陷的小鼠(Prf1-/-和Rab27a-/-),给予芦可替尼治疗后,两组小鼠细胞因子水平,尤其是IL-6和TNF-α显著降低,血象恢复正常,脏器功能改善,生存率显著提高。研究显示,芦可替尼可能是通过IFN-γ依赖和非依赖的机制达到治疗HLH的目的。一方面可以缓解IFN-γ诱发的炎症性贫血;另一方面,芦可替尼治疗后出现的T淋巴细胞和中性粒细胞数量、活化状态和组织浸润减少及细胞因子水平显著下降等现象在IFN-γ单抗治疗中并未发现,表明芦可替尼还能通过非IFN-γ依赖来抑制HLH[17,18]。
三、芦可替尼治疗HLH的临床研究
鉴于芦可替尼可以有效抑制细胞因子产生,改善炎性状态,临床上越来越多地尝试应用芦可替尼治疗HLH。2017年Sin等[19]在国际上首次报道了1例难治性继发EB病毒感染相关HLH患者接受芦可替尼治疗后,血清铁蛋白、纤维蛋白原、乳酸脱氢酶和肝功能等明显改善。同年,Broglie等[20]利用芦可替尼治疗了1例11岁难治性不明原因HLH男性患者,药物应用24h内,患儿体温降至正常,呼吸、肝脏和血流动力学功能迅速改善,且2周内无复发。此后,国内外陆续出现芦可替尼成功治疗HLH的临床报道。
2019年,发现芦可替尼应用24h内,88.2%(30/34)患者体温降至正常,高炎性状态明显改善:铁蛋白、可溶性CD25和细胞因子(IFN-γ和IL-18)水平显著下降,部分缓解率达58.8%,完全缓解者占14.7%[21]。虽然芦可替尼对于改善血三系水平、清除EBV-DNA和治疗原发疾病无显著作用,无法治愈HLH,但使更多的患者得到了接受HSCT的机会,可以作为桥接移植或治疗原发病的手段。
临床研究显示,单用芦可替尼作为一线药物治疗初诊HLH,共入组12例患者,包括8例EBV-HLH,2例自身免疫病相关HLH和2例病因不明者[22]。持续口服芦可替尼28天后,总体反应率高达83.3%,其中完全缓解率占 66.7%,6个月预期无事件生存率为58.3%±10.2%。对于芦可替尼反应不佳或停药后的患儿,HLH-1994方案的治疗仍有良好效果。此外,回顾性分析9例接受芦可替尼治疗的复发难治性HLH患儿资料,包括5例EBV-HLH、2例家族性HLH、1例自身免疫病相关HLH和1例原因未知者[23]。研究发现所有患儿在应用芦可替尼治疗48h内体温均降至正常范围,1周后3例(33.3%)患者达到部分缓解(PR),5例(55.6%)有所改善,但未达到PR,死亡1例(11.1%)。对于复发难治性HLH患儿,芦可替尼是一种耐受性较好的挽救治疗手段,虽然很多患儿不能获得完全缓解,但与化疗相结合可以为这些患儿更进一步的治疗甚至移植赢得时间。
四、芦可替尼的其他临床应用
基于JAK-STAT通路在细胞增殖、分化、凋亡和细胞因子分泌中的重要作用,芦可替尼也被用于骨髓纤维化、移植物抗宿主病(graft-versus-host disease,GVHD)及新型冠状病毒肺炎(coronavirus disease-2019,COVID19)等治疗中。
骨髓纤维化(myelofibrosis,MF)是美国食品药品监督管理局(Food and Drug Administration,FDA)批准的芦可替尼主要临床适应证,是MF治疗领域的里程碑。通过抑制JAK-STAT信号转导通路,抑制细胞因子依赖的恶性血液肿瘤细胞增殖,并且该作用不受JAK2基因突变影响。相关Ⅲ期临床试验结果表明,与对照组比较,芦可替尼治疗组脾脏体积显著缩小、临床症状改善明显、生存质量得到提高、病死率降低,尽管有贫血及血小板减少的不良反应,但通过调整药物剂量或输血等对症处理后,可达到改善,极少因药物不良反应中止治疗[24]。
造血干细胞移植(HSCT)是目前治愈原发性HLH的唯一方法,移植物抗宿主病(GVHD)是异基因HSCT术后的主要并发症,是导致患者移植失败及死亡的主要原因,全身性大剂量糖皮质激素作为一线治疗已达成国际共识,但是,其中一部分激素耐药性(steroid refractory,SR)GVHD仍有极高的病死率,抗胸腺球蛋白、甲氨蝶呤、西罗莫司及英夫利昔单抗等二线治疗方案效果差强人意。由于急性GVHD的发生与淋巴细胞过度活化密切相关,而炎性细胞因子包括IL-1、IL-6和IFN-γ等又是由JAK介导,芦可替尼故而成为首个获得FDA批准的用于治疗成人和12岁及以上儿童急性SR-GVHD的药物[25]。
REACH-2试验是一项Ⅲ期多中心临床试验,将309例Ⅱ~Ⅳ级SR-GVHD患者随机分组,芦可替尼治疗组154例,对照组155例,结果接受芦可替尼治疗患者在第4周、第8周总体反应率明显高于对照组(62% vs 39%、40% vs 22%,P=0.000),中位生存期分别为11.1个月和6.5个月。同时,芦可替尼在不同级别和不同靶器官GVHD的亚组分析中均显示出更好的总体反应率,在6个月时累积无效发生率约为10%,对照组为39%,彰显了该药在SR-GVHD中的良好应用前景[26]。
目前,新型冠状病毒肺炎全球肆虐,患者可出现发热、干咳、乏力等表现,严重者可能进展为急性呼吸窘迫综合征和多脏器衰竭,甚至不乏有发展为HLH者,但目前为止尚无特效治疗方法。不过,越来越多的研究证据表明,新型冠状病毒肺炎患者细胞因子水平升高,是多器官损害的主要原因[27]。芦可替尼因能通过抑制细胞因子产生,阻止肺纤维化、防止多脏器衰竭,改善预后而备受瞩目[28]。Vannucchi等[29]报道了一项芦可替尼用于新型冠状病毒肺炎患者的前瞻性观察性研究,共有34例患有严重肺部疾病的新冠肺炎患者入组,其中85.3%的患者经过中位时间13天治疗后临床症状有所改善,病死率为5%,另有9%患者在第28天获得临床改善,并且芦可替尼的短期治疗(中位时间13天)耐受性良好,几乎没有3级不良事件发生。通过恢复血细胞亚群、抑制炎性细胞活化、降低细胞因子和C反应蛋白水平,证明了芦可替尼的抗炎和免疫调节作用,为新型冠状病毒肺炎免疫调节治疗提供了方向。一项应用芦可替尼治疗重症新型冠状病毒肺炎患者的多中心单盲随机对照研究,结果显示芦可替尼可显著降低IL-6、IL-12等细胞因子水平,更快地改善临床症状,且治疗第2周的胸部CT影像学改善更为明显。对照组病死率为14.3%,芦可替尼组无死亡病例,芦可替尼耐受性较好,毒性较低,充分显示了它在治疗新型冠状病毒肺炎方面的优势[30]。
五、展 望
HLH包括原发性和继发性两大类,尽管两者发病机制不同,但具有共同信号转导通路。近年来,HLH-2004诊断标准的提出和包含地塞米松、依托泊苷的HLH-94临床研究的开展使HLH患者的长期生存获得了显著改善。但与HLH-94方案比较,HLH-2004方案并未显示出更优的临床疗效,反而出现更高的治疗相关死亡,也表明三药联合的HLH治疗遇到了瓶颈,需要研发更多的新药。
芦可替尼通过抑制JAK1/2信号通路、抑制细胞因子分泌,改善炎性状态,无论是在动物模型还是临床研究中都已经显现出对HLH良好的治疗作用,使得更多的患者获得了治疗原发基础疾病和接受HSCT的机会,同时也具有良好的安全性。但是,芦可替尼应用时机、剂量、疗程及安全性等在HLH,尤其是儿童患者中缺乏多中心研究,相信通过大样本量的前瞻性的临床研究,芦可替尼有望为更多的HLH患者带来福音。此外,基于以IFN-γ为核心的细胞因子谱在HLH诊断及治疗中的核心地位,流式细胞因子测定有望成为HLH早期诊断、分层治疗、个体化治疗及监测复发的指标之一。

