BTCABs吸附剂对Ni(Ⅱ)的吸附
邹鹏,黄苗阳,李仲民*,张琳叶,魏光涛,2
(1.广西大学 化学化工学院, 广西 南宁 530004;2.广西生物炼制重点实验室, 广西 南宁 530007)
0 引言
近年来,工业发展迅速,镍元素得到广泛应用的同时对环境也产生了很大的污染。Ni(Ⅱ)污染主要来源于采矿、冶金和电镀[1]。人体内Ni(Ⅱ)浓度过高会导致心脏损伤甚至癌症[2]。因此,从废水中去除Ni(Ⅱ),是一个很现实而又迫切的问题。从废水中去除Ni(Ⅱ)的传统方法有混凝[3]、膜过滤[4]和离子交换等[5]。但大多数方法存在处理成本高、在处理低浓度的重金属离子时效果不佳。相对而言,吸附是一种能有效去除Ni(Ⅱ)的方法。充分利用当地自然资源,制备出性能好且能循环利用的吸附剂,越来越受到研究人员的关注。
单宁是大量存在于植物中的天然生物聚合物,其富含的相邻的酚羟基能与重金属离子结合成稳定的络合物[6]。然而,单宁的水溶性限制了其作为水处理剂的应用。将单宁固化到不溶的基质上,如介孔硅酸盐[7]、纤维素[8]和胶原纤维[9],有利于提高单宁的吸附性能,以及在吸附结束后分离出吸附剂。生物炭具有原料来源广、成本低、制备简单、较高的比表面积,数量较多的吸附官能团、稳定性好等优点[10],因此,生物炭在水处理方面应用广泛。
海藻酸钙作为包埋基质被广泛用于固定壳聚糖[11],碳纳米管[12]。本研究以单宁和生物炭为主要吸附组分,采用海藻酸钙包埋单宁与生物炭,降低单宁的水溶性,使之能进一步提高吸附剂吸附性能。生物炭/单宁/藻酸钙复合吸附剂综合了生物炭的活性吸附官能团与高比表面积、单宁的酚羟基有效官能团的优点。在吸附过程中生物炭与单宁的协同作用,有效地提高了吸附剂的吸附性能。BTCABs的制备原料来自于植物,原料来源广、价格低廉,制备工艺简单、绿色环保。BTCAB在处理重金属废水方面具有较好的应用前景。
1 实验
1.1 试剂与仪器
单宁(上海麦克林生化科技有限公司);海藻酸钠(西陇化工股份有限公司);氢氧化钾、碘、六水合硝酸镍(广东光华科技股份有限公司);柠檬酸铵(上海试四赫维化工有限公司);氯化钙、丁二酮肟、乙二胺四乙酸二钠(国药集团化学试剂有限公司);722分光光度计(上海佑科仪器有限公司);THZ-82水浴恒温振荡器(郑州世纪双科实验仪器有限公司);KQ2200DE超声波仪(北京科玺科技公司)。
1.2 吸附剂的制备
按比例称量单宁、海藻酸钠、生物炭,将单宁溶于10 mL室温的去离子水中,加入生物炭,将混合物搅拌均匀之后超声处理30 min, 随后加入海藻酸钠,搅拌至溶解后,超声处理20 min。将上述混合物缓慢滴入到装有40 mL的5%氯化钙水溶液的烧杯中进行固化,固化2 h后用去离子水洗涤凝胶小球,去除表面过量的氯化钙,再放入干燥箱于60 ℃下干燥12 h后,得到BTCABs吸附剂。
1.3 吸附实验
将100 mL一定浓度(30~500 mg/L)的Ni(Ⅱ)水溶液置于250 mL的碘量瓶中。在pH值对吸附影响的实验中,用0.1 mol的HCl或NaOH溶液调节Ni(Ⅱ)水溶液的pH在3~7。称取0.300 g BCTABs加入至碘量瓶内,将碘量瓶置于设定温度(303 K,313 K,323 K,333 K)及转速为160 r/min的恒温水浴振荡器中,每隔20 min取液样,以滤膜过滤溶液得到滤液。采用722分光光度计在λmax= 530 nm下测定滤液的吸光度,以吸光度计算溶液的Ni(Ⅱ)浓度,当Ni(Ⅱ)浓度不再变化,停止实验。依据公式(1)至式(3)分别计算t时刻的吸附量,平衡吸附量以及吸附率。
(1)
(2)
(3)
式中,C0为镍离子初始浓度,g/L;Ce为镍离子平衡浓度,g/L;V为镍离子溶液体积,L;m为吸附剂的质量,g。
1.4 吸附剂再生
BTCABs吸附Ni(Ⅱ)达到平衡后,对溶液进行过滤,将分离出的BTCABs进行洗涤、干燥后,加入到100 mL 5%CaCl2溶液中进行脱附。用过滤法回收BTCABs,用去离子水对其进行洗涤,随后用烘干箱进行烘干后可用于吸附。如此进行吸附-脱附循环。实验有5次吸附,4次脱附。
2 结果与讨论
2.1 吸附剂的表征
2.1.1 SEM
BTCABs吸附Ni(Ⅱ)前后扫描电镜图如图1所示。由图1(a)可见,吸附前,BTCABs表面呈现出较为平坦的形状,有一小部分凸起,表面有明显的孔洞。由图1(b)可见,吸附后,BTCABs表面出现大量凸起,且表面相对紧实。在海藻酸-活性炭复合材料的研究中也观察到类似的图像[10]。这表明Ni(Ⅱ)吸附在吸附剂表面。

(a) 吸附前
2.1.2 FT-IR
单宁,生物炭,BTCABs吸附Ni(Ⅱ)前后的红外图谱如图2 所示。在图2(a)中,单宁的红外图谱在3 220 cm-1处表示的是O—H基团的伸缩振动峰[13],在单宁与生物炭和海藻酸钙复合之后,BTCABs红外图谱的O—H基团的伸缩振动有所减弱,表明单宁的酚羟基发生了健合作用。生物炭红外图谱在1 000 cm-1和1 500 cm-1处的振动峰在复合之后强度发生变化,这可能是单宁的酚羟基与生物炭的氢氧根结合所导致,说明BTCABs中的单宁与生物炭具有复合作用。
从图2(b)中BTCABs吸附Ni(Ⅱ)前的红外光谱图可见,在3 220 cm-1处为单宁酚羟基的O—H基团的伸缩振动峰;在1 588 cm-1处为海藻酸钠的C—O—O反对称伸缩振动峰[14],在1 021 cm-1处为C—O伸缩振动峰。在图2(b)的BTCABs吸附Ni(Ⅱ)后的红外光谱图中,O—H的伸缩振动峰由3 220 cm-1偏移到了3 212 cm-1;C—O—O反对称伸缩振动峰由1 588 cm-1偏移到1 584 cm-1,C—O伸缩振动峰由1 416 cm-1偏移到1 404 cm-1。并且这几个峰,以及1 021cm-1处的峰强度变弱。由此可知,在吸附过程中,BTCABs的官能团与Ni(Ⅱ)发生了反应。
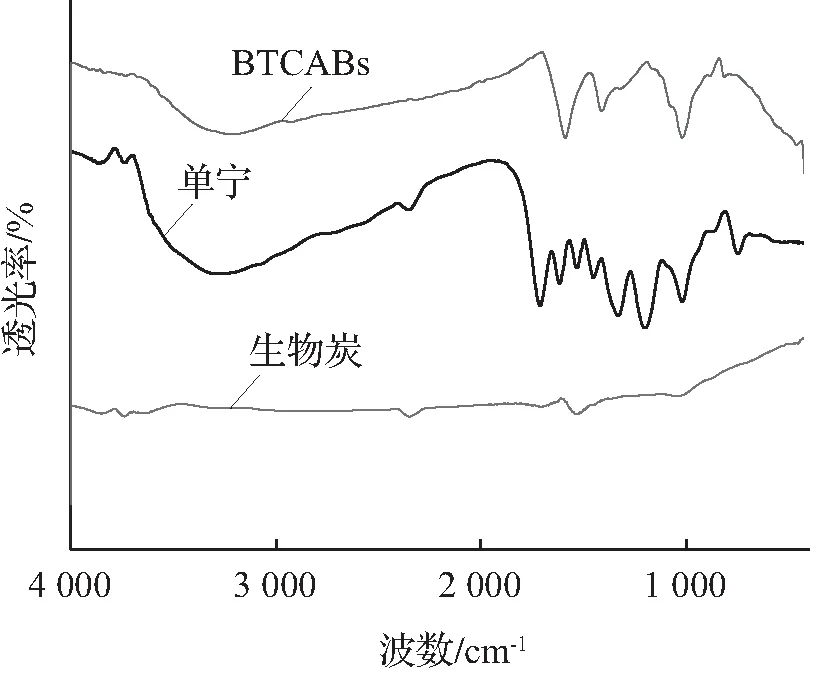
(a) CABs, 单宁, 生物炭的红外图谱
2.1.3 BET
BTCABs在77 K时,氮吸附-脱附等温线和孔径分布曲线如图3所示。根据IUPAC命名法[15],BTCABs的等温线为H3型滞回线的IV型。BTCABs的滞后环形状能反映其属于介孔孔隙结构[16]。BTCABs的结构特性见表1,从表1可见, BTCABs的表面积和累积孔体积分别为233.66 m2/g和0.412 9 cm3/g。由此可知,BTCABs吸附剂具有较大的表面积和良好的介孔结构。这是BTCABs对Ni(Ⅱ)有较好吸附效果的原因之一。
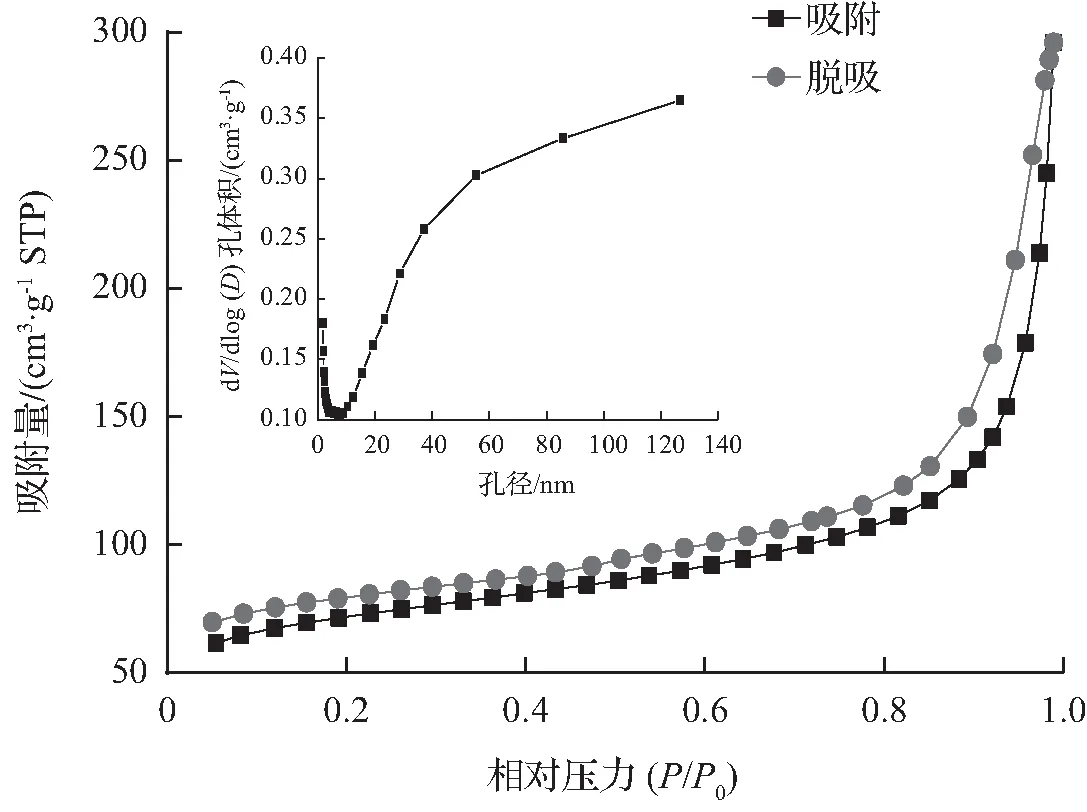
图3 氮吸附-脱吸等温线和孔径分布曲线
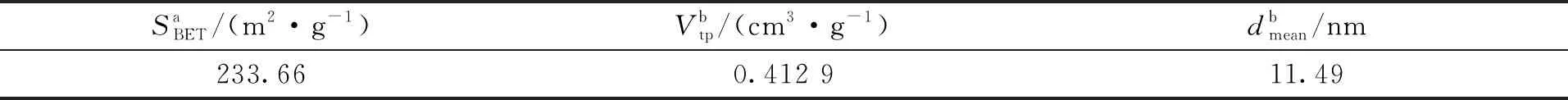
表1 BTCABs的结构特性
2.2 吸附条件对吸附量的影响
2.2.1 Ni(Ⅱ)初始浓度的影响
Ni(Ⅱ)初始浓度对BTCABs吸附量的影响如图4所示。从图4可知,不同Ni(Ⅱ)初始浓度的BTCABs吸附量在吸附时间到达100 min后几乎达到平衡,此时吸附量几乎不再变化。其原因是当吸附时间较短及Ni(Ⅱ)初始浓度较低时,吸附剂表面有大量尚未吸附的活性位点,随着活性点位不断吸附,吸附量随之增大,由于吸附与脱附过程同时发生,当吸附量较大时,脱附量也随之增加,当吸附量与脱附量达到平衡时,吸附量不再增加。图4表明,吸附剂对Ni(Ⅱ)的吸附量随初始浓度Ni(Ⅱ)初始浓度的升高而增大,当Ni(Ⅱ)初始浓度由400 mg /L升高到500 mg /L时,吸附剂对Ni(Ⅱ)的吸附量几乎相等,说明BTCABs对Ni(Ⅱ)的吸附达到最大。其原因是当Ni(Ⅱ)初始浓度较低时,增加Ni(Ⅱ)初始浓度,可增加镍离子与尚未吸附的吸附活性位点的有效碰撞结合,吸附量随之增加[17]。当Ni(Ⅱ)初始浓度较高时,由于此时几乎没有尚未吸附的活性位点,继续增加Ni(Ⅱ)初始浓度,BTCABs对Ni(Ⅱ)的吸附量不再增加。
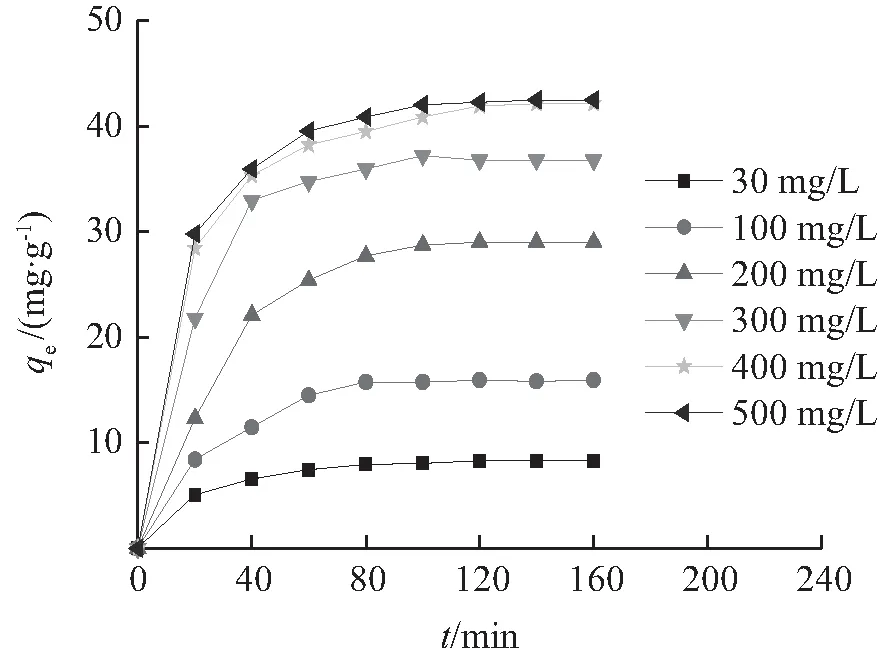
T=303 K,m=0.3 g,pH=6
2.2.2 吸附温度的影响
吸附温度对BTCABs吸附Ni(Ⅱ)的影响如图5所示。随着吸附温度升高,BTCABs对Ni(Ⅱ)的吸附量也随之增大。由此可判断吸附为吸热过程。依据BTCABs吸附Ni(Ⅱ)后的红外图谱可知,BTCABs吸附Ni(Ⅱ)有化学键合作用,升高温度有利于增加镍离子与尚未吸附的吸附活性位点的有效碰撞结合[18],增加BTCABs对Ni(Ⅱ)的吸附量。
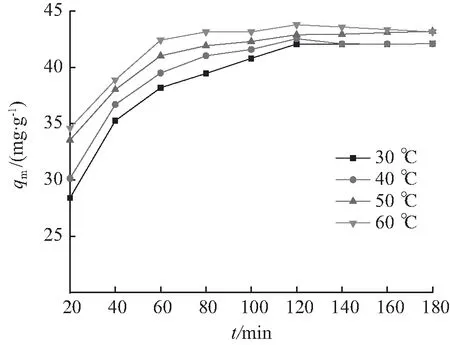
C0=400 mg/L,m=0.3 g,pH=6
2.2.3 pH的影响
pH值对BTCABs吸附量的影响如图6所示。由图6可知,当溶液pH值从3变化到7时,BTCABs对Ni(Ⅱ)的吸附量增加。其原因是吸附剂表面电荷的形式在很大程度上取决于pH的大小,此外,溶液中吸附质所存在的形式也会受到pH的影响[19]。BTCABs的酚羟基能与金属离子形成螯合物[20]。在较低的pH值下,H+会与Ni(Ⅱ)产生竞争吸附,常常会占据吸附剂的活性位点使得与金属离子结合的活性位点减少,使得吸附量有所下降。随着pH值的增加,活性位点释放出H+,有效活性位点的数量增加,吸附剂的吸附量也随之提升。当pH值高于7时,离子交换和金属氢氧化物的形成,可能会成为去除金属离子的重要机制[20]。此时部分镍离子可能形成氢氧化物沉淀而被去除,而不是BTCABs对Ni(Ⅱ)的吸附去除,这对BTCABs吸附Ni(Ⅱ)的效果会产生影响。因此,pH对BTCABs吸附量影响的最高pH值定为7。
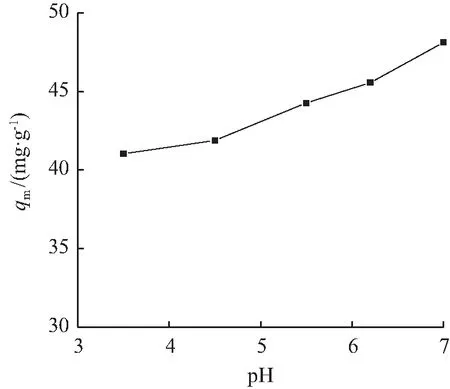
C0=400 mg/L,T=333 K,t=2 h,m=0.3 g
2.3 平衡吸附模型
为了探讨BTCABs对Ni(Ⅱ)的吸附机理,利用Langmuir、Freundlich和Temkin 3种吸附等温线模型对实验数据进行拟合。
Langmuir理论假设吸附剂表面均匀,且吸附质只能在吸附剂上单层吸附[21]。Freundlich可用于处理吸附剂不均匀表面中的多层吸附问题,吸附强度随位点占位增加而降低[22]。Temkin模型的理论基础是吸附质/吸附剂之间存在相互作用,且吸附热与吸附量呈线性关系[23]。上述3种模型的方程分别为式(4)至式(6)。
(4)
(5)
qe=B1lnKT+B1lnCe,
(6)
式中,qe为平衡吸附量,mg/g;qmax为最大吸附量,mg/g;Ce为溶液中Ni(Ⅱ)的平衡浓度,mg/L;b是Langmuir常数;n为吸附强度;Kf为Freundlich常数;B1为与吸附热有关的特征常数;KT为Temkin常数。
BTCABs吸附Ni(Ⅱ)的吸附等温线如图7所示。以Langmuir、Freundlich和Temkin模型拟合图7数据得到3种等温模型的拟合图如图8所示。3种模型的拟合参数见表2。由相关系数R2值可知,BTCABs吸附Ni(Ⅱ)同时符合Langmuir (R2=0.950 4)和Freundlich (R2=0.949 7)模型。其原因是BTCABs为复合材料,吸附过程多种机制共同发生作用。用 Langmuir 模型模拟的最大吸附值qm为50.97 mg/g, 与实验结果qe,exp的42.43 mg/g 比较吻合。1/n值为0.425 5,表明BTCABs对Ni(Ⅱ)的吸附易于进行。Temkin相关系数R2仅为0.883 0,因此,该吸附过程不符合Temkin模型。
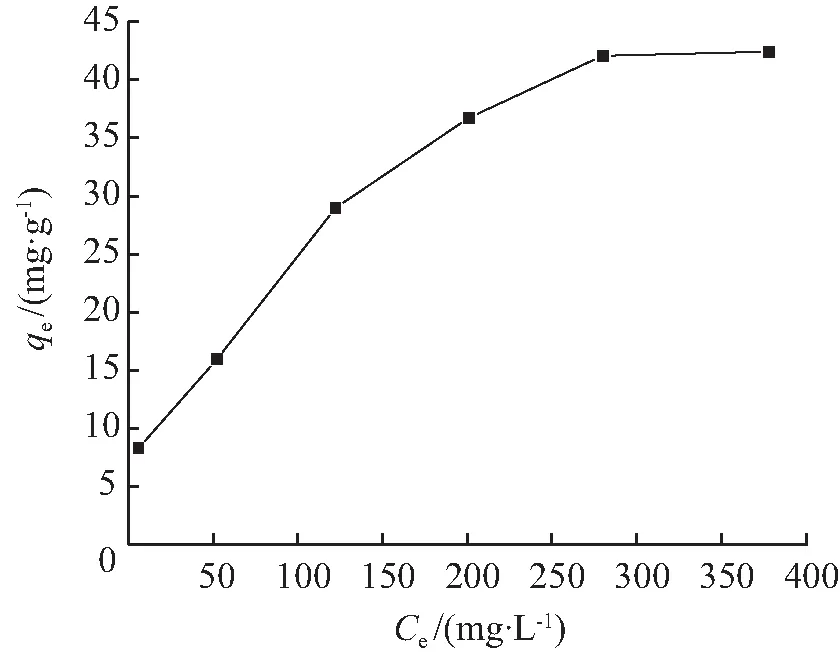
图7 吸附等温线
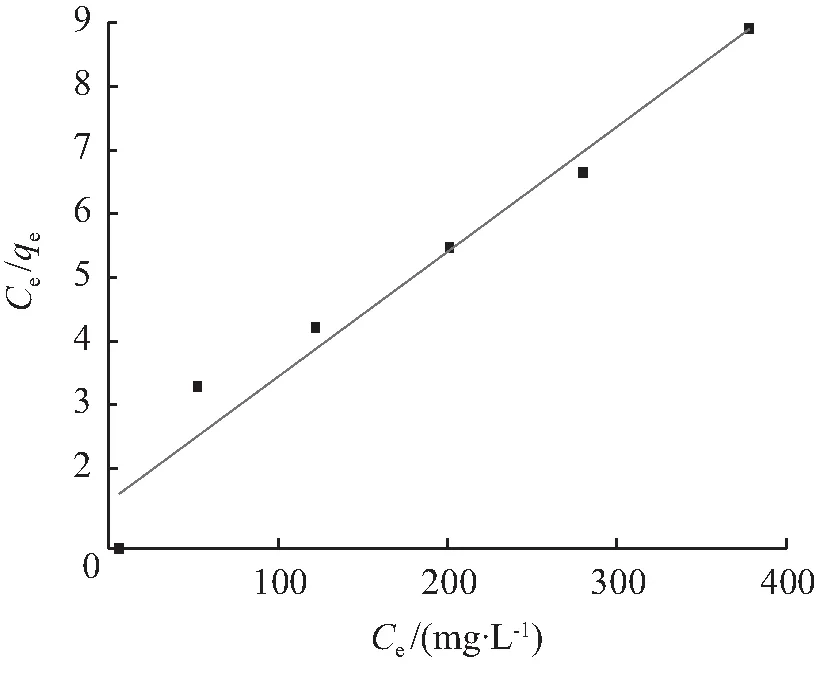
(a) Langmuir

表2 等温模型拟合参数
2.4 吸附动力学
动力学模型可用于解析吸附速率和吸附机理。本文分别采用准一级动力学方程式(7)、准二级动力学方程式(8)和颗粒内扩散方程式(9)对BTCABs吸附Ni(Ⅱ)的实验数据进行拟合。
准一级吸附动力学模型描述了吸附质向吸附位点扩散和传质控制的吸附过程[24]。准二级吸附动力学模型对应的是化学吸附是速率限制步骤[25]。粒子内扩散模型假设粒子内扩散为速率限制步骤[26]。3种模型方程的线性化表达形式如式(7)至式(9)所示。
(7)
(8)
qt=kidt0.5+b,
(9)
式中,qt为t时刻的吸附量,mg/g;qe为平衡时的吸附量,mg/g;k1为准一级动力学常数,1/min;k2为准二级动力学常数,g/(mg·min);kid为颗粒内扩散速率常数,mg/(g·h-0.5);t为吸附时间,min;b为与边界层厚度密切相关的截距值。
3种吸附动力学模型拟合吸附数据如图9所示。拟合参数结果见表3和表4。由表3、表4可知,在不同温度下,颗粒内扩散模型的R2值低于其他两个模型。准二级动力学模型拟合的相关系数R2均大于0.99,而准一级动力学模型的R2在0.925 1~0.967 2。且准二级动力学模型拟合出的平衡吸附量qe分别为45.07、44.35、44.86、44.72 mg/g,与实验所得吸附量et,exp分别为42.09、42.09、43.1、43.38 mg/g接近。因此,准二级动力学模型比准一级动力学模型更适合用于描述BTCABs对Ni(Ⅱ)的吸附,并由模型机理推知该吸附过程吸附速率的限制主要因素为化学吸附。
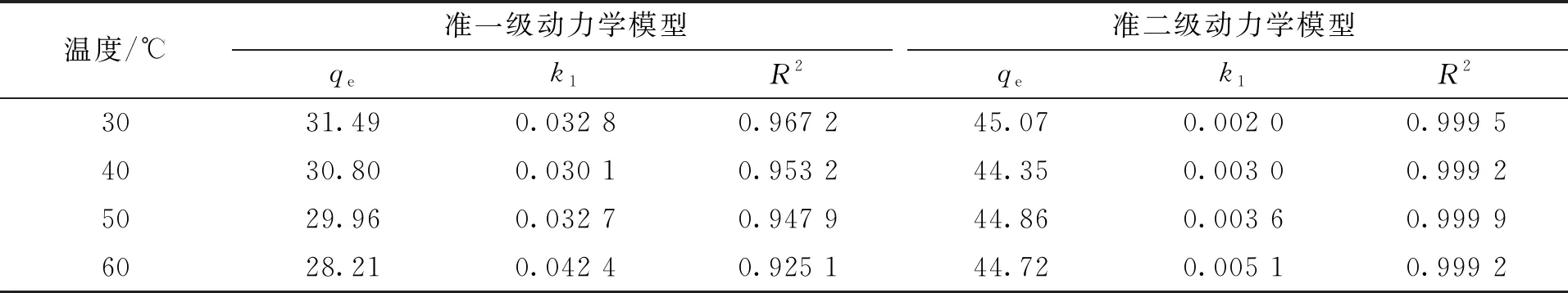
表3 准一级和准二级动力学模型拟合的吸附动力学参数

表4 不同温度下的颗粒内扩散模型拟合吸附动力学常数
由图9(c)可知,颗粒内扩散模型拟合线不经过原点,因此可推知BTCABs吸附Ni(Ⅱ)同时受膜外扩散和膜内扩散控制[27-28]。Ni(Ⅱ)被吸附到BTCABs上可分为两阶段:当Ni(Ⅱ) 到达吸附剂表面的吸附点时,此时吸附剂表面的活性位点较多,溶液中Ni(Ⅱ) 浓度较高,吸附速度较快;随着吸附的进行,慢慢转变为BTCABs颗粒内扩散,此时的吸附速率与边界层厚度有关,随着边界层厚度的增加,吸附逐渐变缓,最终达到吸附平衡。表5列出BTCABs与其他5种吸附剂对Ni(Ⅱ)吸附量的对比。
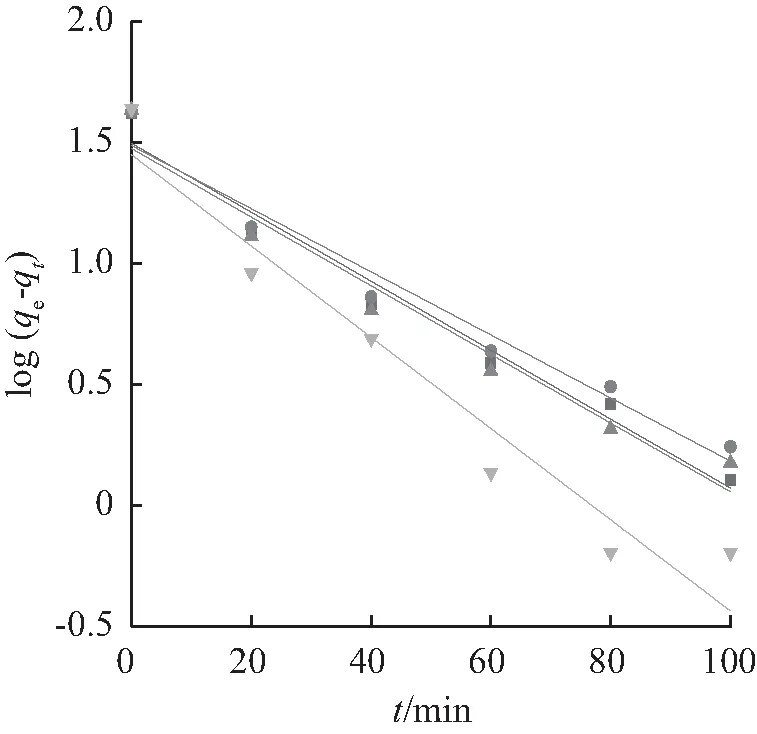
(a) 吸附动力学的准一级模型拟合
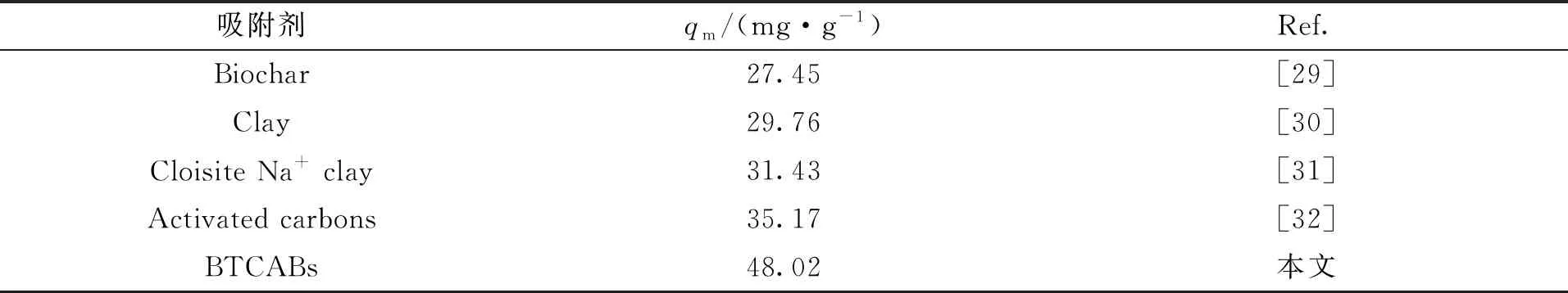
表5 5种吸附剂对Ni(Ⅱ)的最大吸附量的比较
2.5 吸附剂的再生研究
从实用的角度来看,吸附剂重复循环使用可回收重金属离子、减少吸附剂的二次污染与使用成本。吸附剂重复循环使用需要进行再生处理。本实验采用5%CaCl2水溶液作为脱附剂对吸附吸附Ni(Ⅱ)的BTCABs进行脱附处理。重用次数对BTCABs吸附Ni(Ⅱ)影响如图10所示。
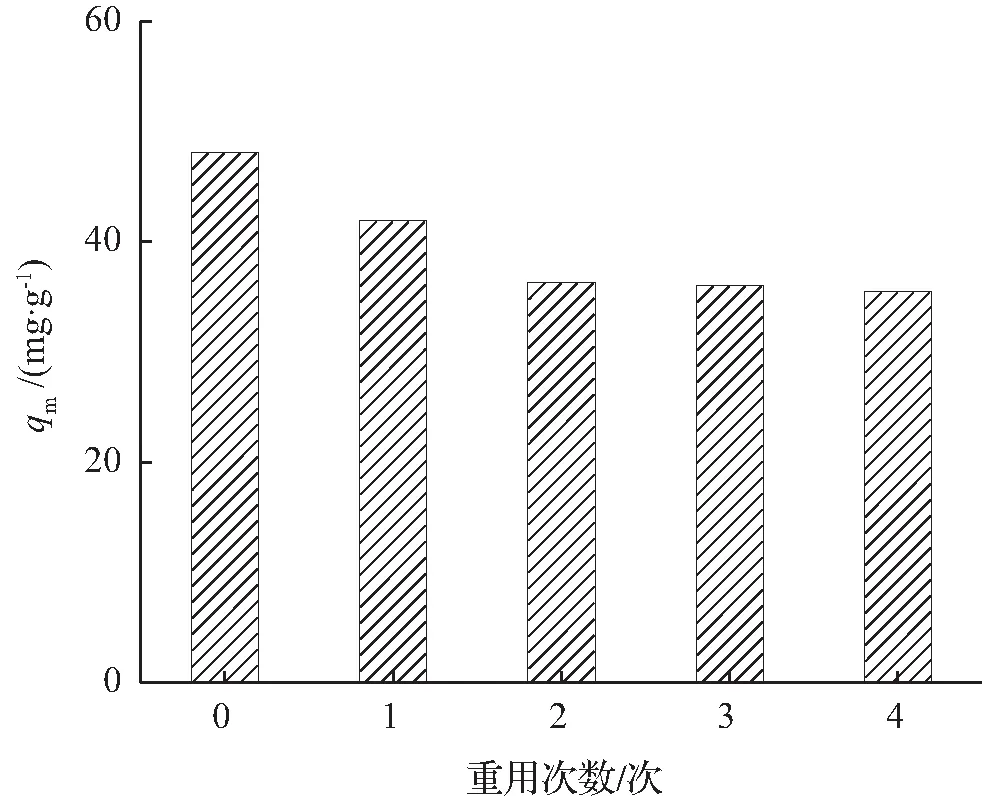
图10 重用次数对BTCABs吸附Ni(Ⅱ)影响
由图10可知,经过4次重复使用后,BTCABs的吸附量为35.50 mg/g,依旧达到最大吸附量48.12 mg/g的73.8%。因此,BTCABs是一种具有较好可再生性能的吸附剂,有望在处理重金属离子废水方面得到应用。
3 结论
本文研制了一种低成本、环保型的BTCABs吸附剂。BTCABs的FT-IR、BET表征结果证实单宁与生物炭之间有复合作用,BTCABs是一种具有高表面积且多活性吸附基团的优良吸附剂。吸附条件对吸附影响的实验结果表明出初始Ni(Ⅱ)浓度、pH和吸附时间对吸附均有显著影响。BTCABs对Ni(Ⅱ)的最大吸附量为48.12 mg/g。吸附符合 Langmuir 与Freundlich模型,证明吸附过程存在多种吸附机制。吸附过程符合准二级吸附动力学模型。BTCABs在重复再生4次后,吸附量仍能达到最大吸附量的73.8%。

