超声波耦合酶解法强化提取蛹虫草多糖
陈静雯,韩 伟
(华东理工大学 药学院 制药工程与过程化学教育部工程研究中心,上海市新药设计重点实验室,上海 200237)
蛹虫草(Cordycepsmilitaris)源于我国,是具有较高药用价值的补益类食用菌[1-2]。由于蛹虫草的药理作用与冬虫夏草类似,故被称为北冬虫夏草[3-4]。随着野生冬虫夏草资源的稀缺,越来越多的研究人员把希望寄托于蛹虫草,侧重于蛹虫草的人工培养和应用创新,以促进蛹虫草的研发,未来蛹虫草产品将具有更加广阔的发展前景[5-6]。
蛹虫草多糖(CMP)是蛹虫草中的重要活性物质,具有抗氧化、抗肿瘤等多种药理活性[7-10],但其含量少、提取难度较大,研究高效、低成本的虫草多糖提取工艺成为当前的研究重点和难点[11]。传统的多糖提取工艺是热水浸提法,但该法所需时间长,提取效果不理想[12-14]。张丽丽等[15]研究了虫草多糖的热水浸提工艺,得到最佳提取时间为4.5 h,但最终多糖得率仅为9.69%。
近年来涌现了一些新型的提取技术,如高温高压水提取、微波辅助提取、超声辅助提取等[16-19]。本文将超声波和酶工程技术进行结合,用于蛹虫草多糖的提取,利用超声波的力学和空化作用使蛹虫草细胞壁破碎[20];同时选用适当的酶将细胞壁进一步分解[21],从而强化对细胞壁的破坏作用,更好地促进蛹虫草多糖的释放,提高提取率。通过对不同超声波强化和酶解强化提取方式组合的筛选,确定超声与酶解工艺,优化工艺参数,以期为蛹虫草多糖后续产品的开发提供参考。
1 实验部分
1.1 主要试剂与仪器
蛹虫草药材购于上海市农业科学院食用菌研究所;葡糖糖标准品、果胶酶(30 000 U/mg)、中性蛋白酶(50 U/mg)购于上海麦克林生化科技有限公司;纤维素酶(50 000 U/mg)购于上海颍汉化工科技有限公司;乙醇、苯酚、硫酸均为分析纯,购于上海泰坦科技股份有限公司。
UV1900 PC型紫外-可见分光光度计,上海亚研电子科技有限公司;YP520N型电子天平,上海菁华科技仪器有限公司;SHZ-DIII型循环真空水泵、RE-2010型旋转蒸发仪,上海予华仪器设备有限公司;SK3310HP型超声波清洗机,上海科导超声仪器有限公司。
1.2 酶的筛选
酶法提取条件温和,有利于提高蛹虫草多糖的提取效果。选用不同种类的水解酶,在适宜的温度和pH条件下进行酶解提取(表1),选取提取效果最佳的酶,为了比较酯法提取效果,采用传统水提醇沉工艺得到对照组实验结果。
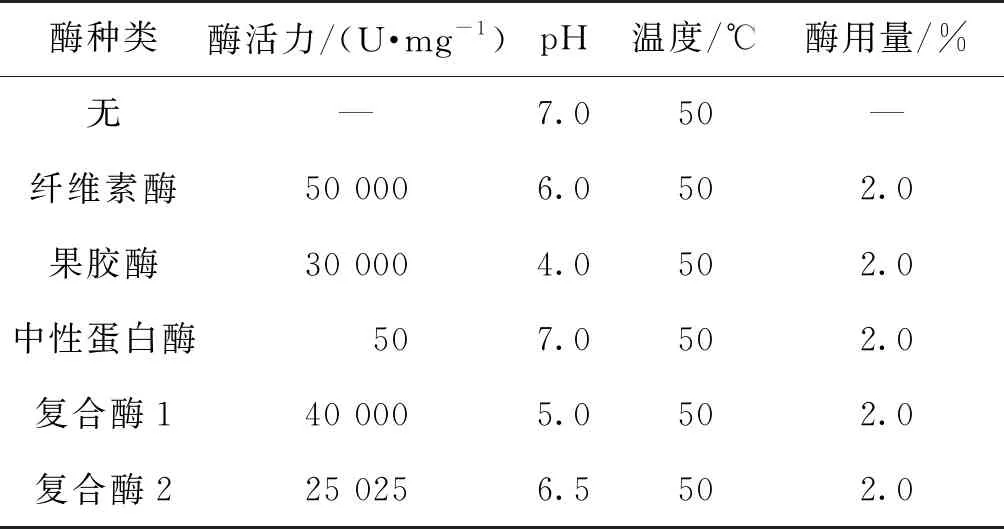
表1 酶的种类与提取条件
1.3 超声与酶解强化提取组合对比实验
提取方案的选择:在预实验中发现单一使用酶解或超声波处理时,蛹虫草多糖的提取效果都不甚理想,因此选用超声与酶解强化提取组合的形式,具体组合方式有先超声后酶解、先酶解后超声以及超声耦合酶解3种。
1)先超声后酶解强化提取:称取3.0 g粒径为100 μm的蛹虫草粉末,根据60 mL/g 的液固比加入去离子水,调节pH=5.0;控制超声功率180 W,于50 ℃超声提取45 min;加入3.0%(质量分数)的酶,于50 ℃继续提取45 min,在100 ℃下灭酶10 min;抽滤,将清液旋蒸后加入4倍量的95%(质量分数)乙醇,在4 ℃条件下静置12 h;抽滤,将滤饼干燥称量。
2)先酶解后超声强化提取:称取3.0 g粒径为100 μm的蛹虫草粉末,根据60 mL/g 的液固比加入去离子水,调节pH=5.0;加入3.0%的酶,于50 ℃提取45 min,在100 ℃下灭酶10 min;控制超声功率180 W,50 ℃下超声提取45 min;抽滤,将清液旋蒸后加入4倍量的95%乙醇,在4 ℃条件下静置12 h;抽滤,将滤饼干燥称量。
3)超声耦合酶解强化提取:称取3.0 g粒径为100 μm的蛹虫草粉末,根据60 mL/g 的液固比加入去离子水,调节pH=5.0;加入3.0%的酶,并且控制超声功率180 W,于50 ℃下超声提取60 min,100 ℃灭酶10 min;抽滤,将清液旋蒸后加入4倍量的95%乙醇,在4 ℃条件下静置12 h;抽滤,将滤饼干燥称量。
1.4 单因素实验设计
在确定了酶的种类以及超声与酶解强化提取组合模式后,再进行单因素实验,分别考察酶用量(质量分数分别为2.0%、2.5%、3.0%、3.5%、4.0%)、pH(4.0、4.5、5.0、5.5、6.0)、提取时间(30、45、60、75、90 min)、提取温度(40、45、50、55、60 ℃)、液固比(20、40、60、80、100 mL/g)等因素对蛹虫草多糖得率的影响。
1.5 响应面实验设计
在单因素实验的基础上,筛选对蛹虫草多糖提取效果影响较大的因素,采用4因素3水平Box-Behnken(BBD)实验设计方法,以提取温度、pH、液固比和酶用量为变量,每个变量分别设计3个水平(-1、0、+1),进行29个实验点的三次回归组合实验,确定最佳提取工艺条件。
2 结果与讨论
2.1 酶的筛选结果
图1为单一水解酶以及复合酶对蛹虫草多糖的提取实验结果。由图1可得:各种水解酶辅助提取得到的多糖得率均高于传统水提醇沉对照组,其中,用纤维素酶得到的多糖得率最高,为17.00%,比水提醇沉对照组(9.33%)提高了7.67%,说明纤维素酶能够较好地作用于子实体细胞壁,使细胞壁结构变得松散,从而提高多糖的得率,因此本文的后续研究均选用纤维素酶。
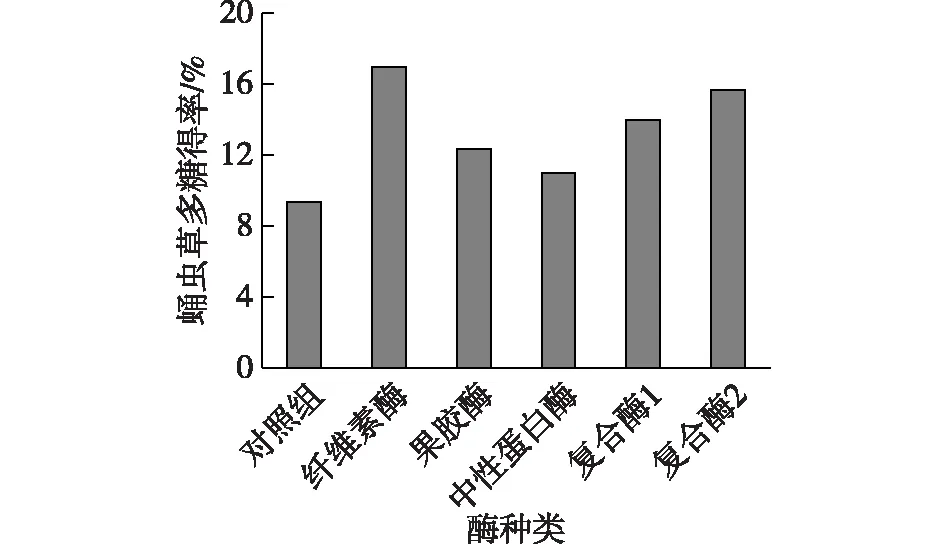
图1 酶种类对蛹虫草多糖得率的影响Fig.1 Effects of enzyme species on the yield of Cordyceps militaris polysaccharide
2.2 超声与酶解强化提取组合对比实验结果
将超声波与纤维素酶结合应用于蛹虫草多糖的提取,能进一步强化对子实体细胞壁的破坏,减少传质阻力,更好地促进多糖的释放和扩散,提高多糖得率。超声与酶解强化提取3种组合方式的实验结果如图2所示。由图2可得:超声耦合酶解强化提取对蛹虫草多糖的提取效果最好。超声波的作用加大了纤维素酶分子的碰撞频率,提高了动能,并且由于动能的提高,活化能减小,反应速率加快[22]。因此,超声耦合酶解强化提取不仅蛹虫草多糖得率高,而且相较于另外两种组合方式,还大大缩短了提取时间(由总提取时间90 min降至60 min),降低了成本。
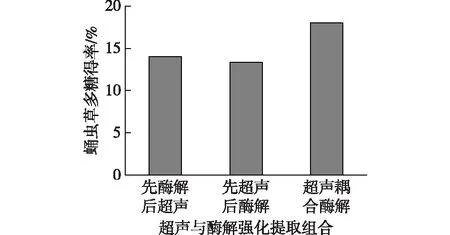
图2 超声与酶解强化提取组合对比实验结果Fig.2 Comparison of ultrasonic and enzymatic hydrolysis enhanced extraction results
2.3 单因素实验结果
2.3.1 酶用量对蛹虫草多糖得率的影响
纤维素是维持细胞壁结构的主要成分,利用纤维素酶酶解细胞壁,可以使存在于细胞壁内的虫草多糖快速溶出,从而提高多糖的得率。因此,总体来说,酶用量越大,蛹虫草多糖的得率越大(图3)。但实验发现,当酶用量超过4.0%时,多糖得率反而降低,分析其原因可能是过量的纤维素酶破坏了多糖的结构,使部分多糖被降解[23]。因此,选择纤维素酶用量为4.0%。
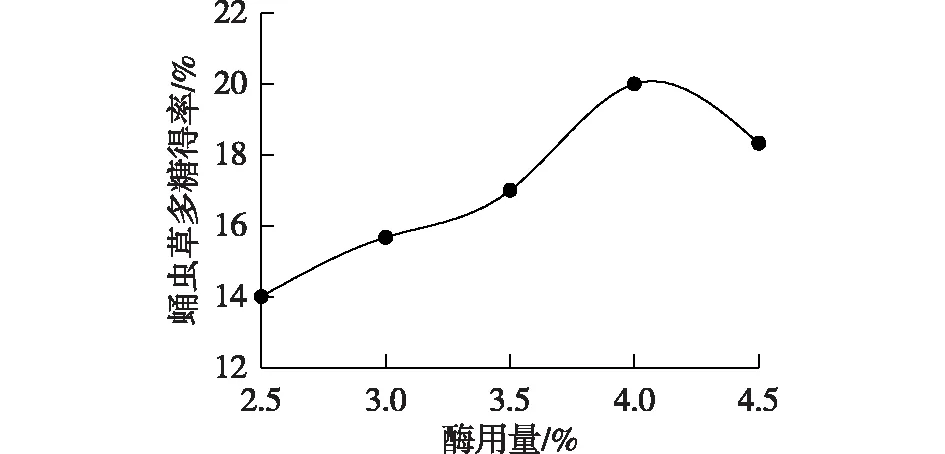
图3 酶用量对蛹虫草多糖得率的影响Fig.3 Effects of enzyme dosage on the yield of Cordyceps militaris polysaccharide
2.3.2 pH对蛹虫草多糖得率的影响
在提取时间60 min、液固比60 mL/g、酶用量4.0%、超声功率180 W、提取温度50 ℃的实验条件下,考察pH对多糖得率的影响,实验结果见图4。由图4可以发现:当提取液pH为5.0时,酶活性达到峰值,此时多糖得率最高,实验结果与李静等[24]得到的纤维素酶活力最适pH一致。当提取液的pH过大或者过小时,都会造成纤维素酶部分失活[25],因此,选择提取液的pH为5.0。
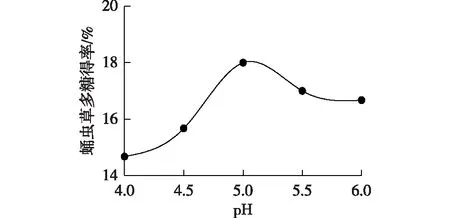
图4 pH值对蛹虫草多糖得率的影响Fig.4 Effects of pH on the yield of Cordyceps militaris polysaccharide
2.3.3 提取时间对蛹虫草多糖得率的影响
图5为提取时间与蛹虫草多糖得率之间的关系曲线。由图5可见:随着提取时间的延长,超声波持续强化细胞内有效成分的穿透能力,会促使蛹虫草多糖向提取液扩散,因此多糖得率也随之提高,在60~75 min时达到峰值。在75 min以后,随着时间的延长,得率反而降低,这是因为超声波长时间的力学剪切作用和热效应,导致多糖的结构遭到破坏[26-27],部分多糖降解,致使得率降低。因此,后续实验的提取时间控制在60 min。
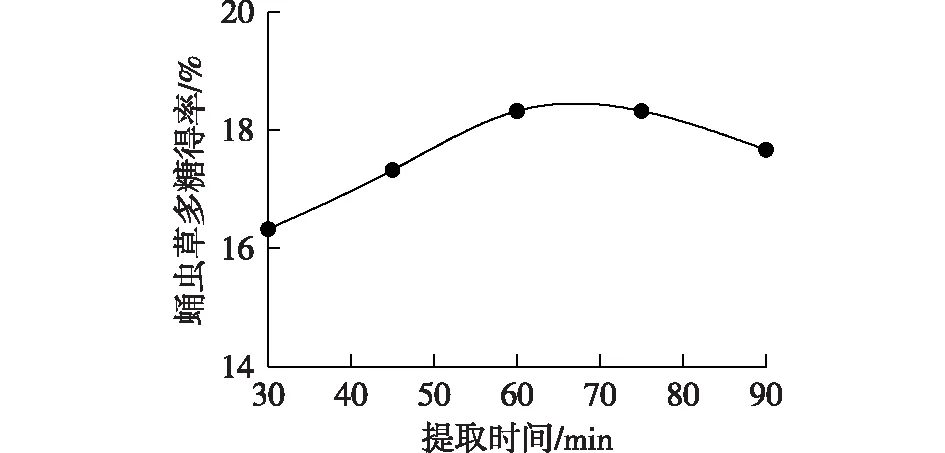
图5 提取时间对蛹虫草多糖得率的影响Fig.5 Effects of extraction time on the yield of Cordyceps militaris polysaccharide
2.3.4 提取温度对蛹虫草多糖得率的影响
图6为提取温度与蛹虫草多糖得率之间的关系曲线。由图6可见:蛹虫草多糖得率随温度的升高而升高,在55 ℃时多糖得率达到最大,较高的提取温度不仅可以加剧分子热运动,增加传质速率,而且还可以提高溶质的溶解度[28]。但当温度高于55 ℃后,多糖得率随温度升高而下降。这是由于当提取温度超过酶的最适温度后,酶开始变性失活,进而多糖得率开始下降[29]。因此,选择提取温度为55 ℃。
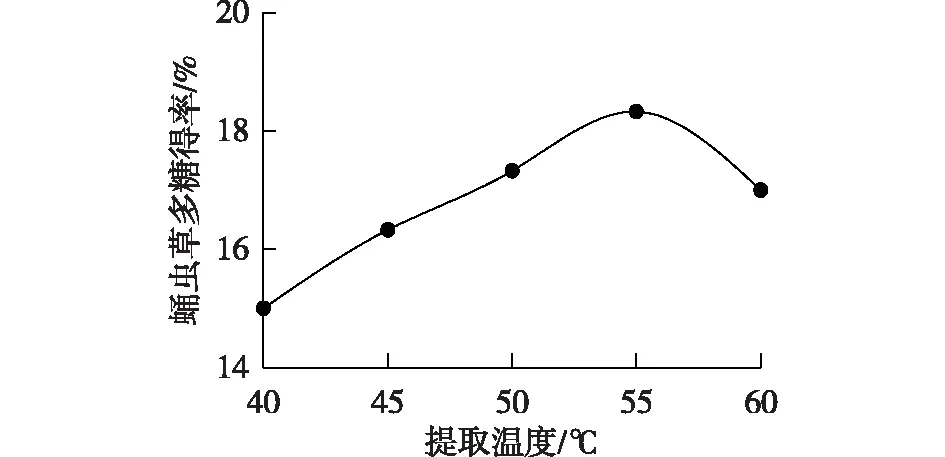
图6 提取温度对蛹虫草多糖得率的影响Fig.6 Effects of extraction temperature on the yield of Cordyceps militaris polysaccharide
2.3.5 液固比对蛹虫草多糖得率的影响
一般情况下,在进行液固提取时,液固比越大,得率会越高,研究液固比对蛹虫草多糖得率的影响,结果见图7。由图7可见:在液固比为20~80 mL/g时,多糖得率随液固比的增大而显著提高,但当液固比超过80 mL/g后,多糖得率的曲线趋于平缓。水量的增加有利于水溶性多糖的溶出,但过大的加水量,会增加后续过滤、浓缩等操作的能耗负担和工作量,同时增大了操作过程中多糖损耗的概率,从而影响多糖得率。因此,综合考虑得率及后续操作等因素,选择液固比为80 mL/g。
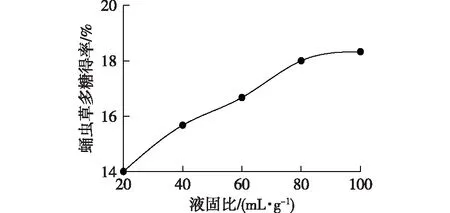
图7 液固比对蛹虫草多糖得率的影响Fig.7 Effects of liquid-solid ratio on the yield of Cordyceps militaris polysaccharide
2.4 响应面优化结果
根据单因素实验的结果,发现各因素对多糖得率均有影响,但每个因素的影响程度略有不同。为了减少BBD优化实验的次数,提高优化效率,对单因素实验的结果进行方差分析,得到各因素对结果影响程度由大到小依次为酶用量、液固比、pH、提取温度、提取时间。故选取影响显著的因素,即酶用量、液固比、pH、提取温度这4个因素为自变量,多糖得率为因变量进行优化,BBD优化设计及结果见表2和3。
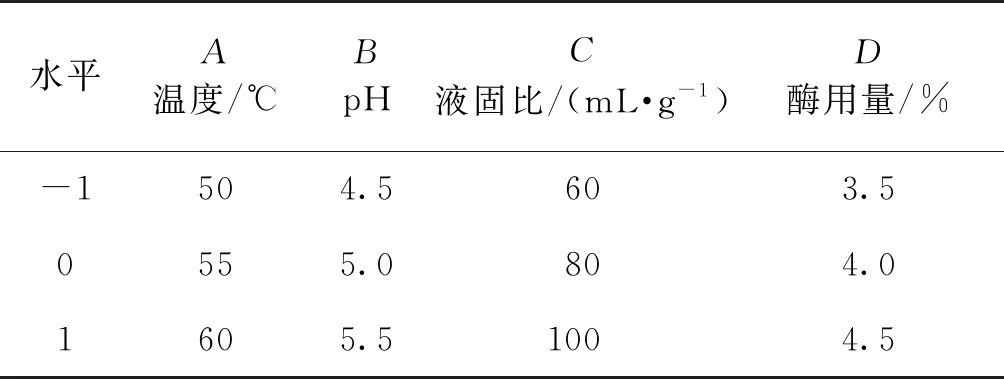
表2 响应面分析因素和水平
通过Box-Behnken设计对表3中的结果进行拟合,得到蛹虫草多糖得率与自变量酶用量、液固比、pH、提取温度的回归方程:Y=20.07-8.333×10-4A+0.083B+0.78C+0.25D+0.25AB+0.082AC-0.50BC+0.34BD-0.082CD+0.038A2+0.16B2+0.12C2-0.59D2。

表3 响应面实验设计结果
对响应值的二次模型方差分析结果见表4,F和P用于检验模型显著性,一般情况下,P<0.05时则模型显著,说明该模型是有效的。由表4可知:回归项的P<0.05,说明本实验拟合得到的二次多项模型具有较高的显著性;且失拟项的P=0.202 0>0.05,说明模型失拟不显著,具有统计学意义,能够很好地分析不同提取条件对虫草多糖得率的影响。
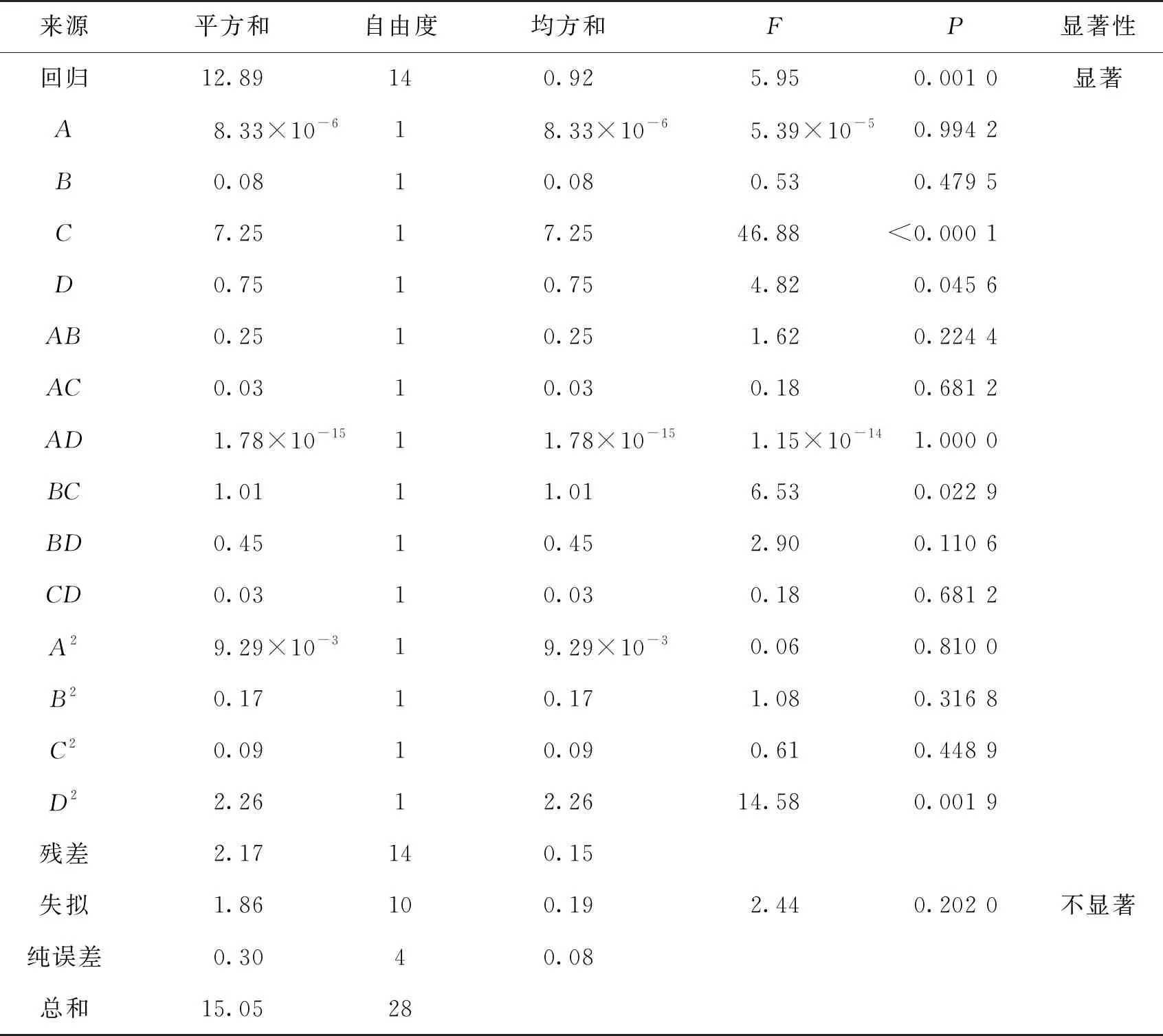
表4 回归方程模型系数评估及其显著性检验
对回归模型进一步分析,确定超声耦合酶解强化提取的最佳工艺条件:提取温度为50.14 ℃,pH为4.52,超声功率为180 W,液固比为99.97 mL/g,酶用量为3.98%,此时蛹虫草多糖得率为21.70%。考虑到实际操作的可行性,将工艺条件稍做调整:提取温度为50 ℃,pH为4.5,超声功率为180 W,液固比为100 mL/g,酶用量为4.0%,提取时间为60 min,在此条件下重复进行3次验证实验,得到的多糖得率平均值为22.00%,略高于预测值,相对标准偏差RSD=0.33%,比文献传统热水浸提法得到的多糖得率(9.31%)提高1倍以上,表明上述模型预测准确,所选工艺有良好的重现性。
3 结论
1)超声耦合酶解强化提取得到的蛹虫草多糖得率最高,明显优于先超声后酶解及先酶解后超声两种提取方法。超声耦合酶解强化提取所需时间短,条件温和,是一种高效绿色的提取方法。
2)通过单因素实验和响应面分析法优化工艺参数,得到蛹虫草多糖的最佳提取工艺:提取温度为50 ℃,pH为4.5,超声功率为180 W,液固比为100 mL/g,酶用量为4.0%,提取时间为60 min,在此条件下多糖得率为22.00%±0.33%,比传统热水浸提法得到的多糖得率(9.31%)提高1倍以上。

