胃蛋白酶原、促胃液素-17在胃癌癌前病变筛查中的应用价值
费丽红,冀子中
(1.蚌埠医学院研究生院,安徽 蚌埠 233030; 2.嘉兴市第一医院消化科,浙江 嘉兴 314000)
胃癌是常见的消化道恶性肿瘤之一。世界癌症分析报告指出,2018年世界胃癌的新发病例近100万,胃癌已成为第五大常见恶性肿瘤,并成为癌症致死的第三大原因[1]。由于早期就诊率低,约50%的胃癌确诊患者处于疾病进展期,治疗效果差、复发率高、死亡率高[2]。胃癌的发生是一个连续性过程,即经历了正常胃黏膜、浅表性胃炎、萎缩性胃炎、肠上皮化生、异型增生的过程,直至发生胃癌[3-4]。研究发现,胃癌患者多数伴有胃黏膜萎缩,因此胃黏膜萎缩的早期诊断和治疗对防止胃癌的发生具有重要意义[5]。目前胃镜结合胃黏膜活检组织学检查是筛查和诊断胃癌的金标准,但胃镜检查成本高,患者依从性差,难以进行大规模普查,而血清胃蛋白酶原(pepsinogen,PG)和促胃液素-17被称为“血清学活检”,在胃黏膜萎缩时通常会发生变化,故可用于筛查胃黏膜萎缩[6-7]。血清学筛查相对于内镜检查更容易被大众接受,且推广度更高,诊断效率高,具有较高的临床价值。本研究通过检测不同病变阶段胃黏膜血清PG-Ⅰ、PG-Ⅱ、PG-Ⅰ/PG-Ⅱ比值(pepsinogen-Ⅰ/pepsinogen-Ⅱ,PGR)和促胃液素-17水平,探讨其在筛查胃癌癌前病变中的应用价值。
1 资料与方法
1.1一般资料 回顾性分析2017年12月至2019年7月在嘉兴市第一医院消化科就诊并行胃镜检查的472例消化道疾病患者的病历资料。所有受试者在胃镜检查前均行血清学检测。纳入标准:①年龄40~79周岁,性别不限。②胃癌高危人群[胃癌高发区人群、既往有幽门螺杆菌感染者、既往有癌前疾病或癌前病变者,特别是有胃癌家族史、慢性萎缩性胃炎(含肠化、瘤变等)、胃溃疡病史,胃癌患者一级亲属(包括父母和兄弟姐妹)及其他危险因素(高盐饮食、喜食烟熏煎炸食品、吸烟、重度饮酒)]。排除标准:①有严重的心、肝、肾功能不全;②严重精神疾患;③胃部手术史(包括外科手术、内镜黏膜下剥离术、内镜黏膜下剥离术)。④正在使用或就诊前2周内使用过质子泵抑制剂等药物。⑤研究人员认为不适合参加本研究者。本研究经嘉兴市第一医院伦理委员会批准,受试者均签署了知情同意书。
1.2胃镜检查与病理诊断 按照1990年悉尼系统标准活检[8],分别于胃窦小弯侧距幽门3 cm处以及胃体小弯侧距贲门8 cm处标准活检,活检组织分别保存并标记取材部位。疑似萎缩、肠化的部位另取活检。病理医师以“慢性胃炎的病理诊断直观模拟评分法”标准判断病理结果[9]。
1.3血清学检测 所有受检者空腹采血5 mL,取离心后血清检测或置于-80 ℃冰箱保存待检。采用酶联免疫法检测血清PG-Ⅰ、PG-Ⅱ、PGR、促胃液素-17(试剂盒购于芬兰必欧瀚集团)。
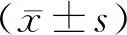
2 结 果
2.1一般情况 472例病检者中,浅表性胃炎347例,其中男164例、女183例,年龄40~78岁,平均(52.8±12.9)岁;萎缩性胃炎108例,其中男60例、女48例,年龄41~77岁,平均(55.8±10.8)岁,其中胃窦萎缩73例,胃体萎缩14例,胃窦、胃体均萎缩21例;异型增生17例,男15例、女2例,年龄48~77岁,平均(60.7±8.7)岁。鉴于异型增生组病例数较少,本研究以萎缩性胃炎组+异型增生组作为胃癌癌前病变检出情况。三组性别、年龄比较差异有统计学意义(χ2=6.175,P=0.002;F=5.403,P=0.006)。
2.2不同病理分型患者PG-Ⅰ、PG-Ⅱ、PGR及促胃液素-17比较 浅表性胃炎组、萎缩性胃炎组和异型增生组患者血清PG-Ⅰ和PGR水平比较差异有统计学意义(P<0.05)。与浅表性胃炎组相比,萎缩性胃炎组和异型增生组患者的血清PG-Ⅰ和PGR水平明显降低(P<0.05);萎缩性胃炎组和异型增生组患者血清PG-Ⅰ、PGR水平差异无统计学意义(P>0.05)。浅表性胃炎组、萎缩性胃炎组和异型增生组患者血清促胃液素-17和PG-Ⅱ水平比较差异无统计学意义(P>0.05)。见表1。
2.3不同萎缩部位萎缩性胃炎患者PG-Ⅰ、PG-Ⅱ、PGR及促胃液素-17比较 各组PG-Ⅱ水平比较差异无统计学意义(P>0.05)。胃体萎缩组、胃窦萎缩组和胃体+胃窦萎缩组患者血清PG-Ⅰ、PGR和促胃液素-17水平比较差异有统计学意义(P<0.05)。与胃体萎缩组相比,胃窦萎缩组、胃窦+胃体萎缩组血清促胃液素-17水平降低,胃窦萎缩组血清PG-Ⅰ、PGR水平升高(P<0.05);胃窦萎缩组和胃窦+胃体萎缩组血清PG-Ⅰ、PGR和促胃液素-17水平比较差异无统计学意义(P>0.05)。见表2。
2.4PG和促胃液素-17对萎缩性胃炎的诊断价值分析 采用ROC曲线分析各项指标对萎缩性胃炎的诊断价值,以PGR≤10.95为临界值,其灵敏度和特异度分别为98.6%、68.7%,以促胃液素-17≥9.95 pmol/L为临界值,其灵敏度和特异度分别为86.1%、64.1%,而两者联合诊断的灵敏度和特异度分别为89.6%、68.5%。见表3、图1。

表1 不同病理分型患者PG-Ⅰ、PG-Ⅱ、PGR及促胃液素-17比较 [M(P25,P75)]
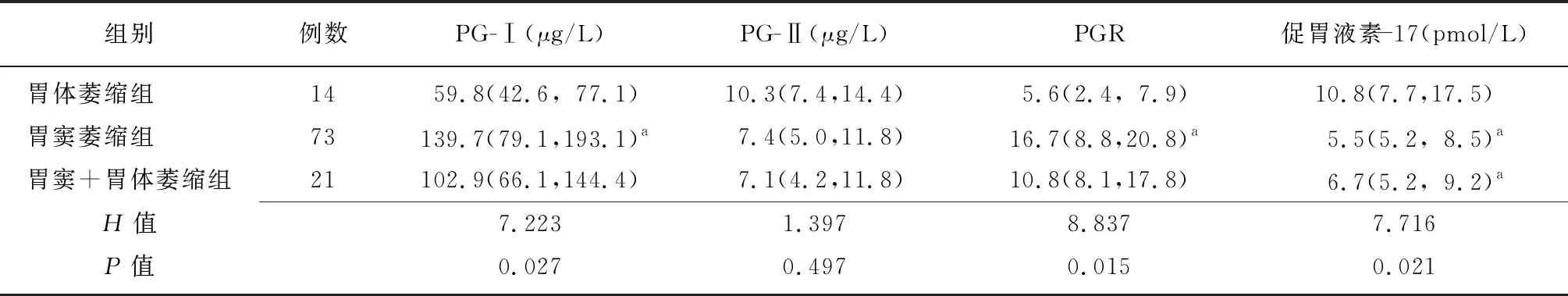
表2 不同萎缩部位萎缩性胃炎患者PG-Ⅰ、PG-Ⅱ、PGR及促胃液素-17比较 [M(P25,P75)]
表3 PG和促胃液素-17诊断萎缩性胃炎的ROC曲线分析

PGR:胃蛋白酶原-Ⅰ/胃蛋白酶原-Ⅱ比值;ROC:受试者工作特征曲线
2.5浅表性胃炎组与胃癌癌前病变组血清学指标异常检出率比较 两组血清PGR≤10.95和促胃液素-17≥9.95 pmol/L的检出率比较差异无统计学意义(P>0.05),胃癌癌前病变组PGR与促胃液素-17联合检测检出率高于浅表性胃炎组(P<0.05)。见表4。
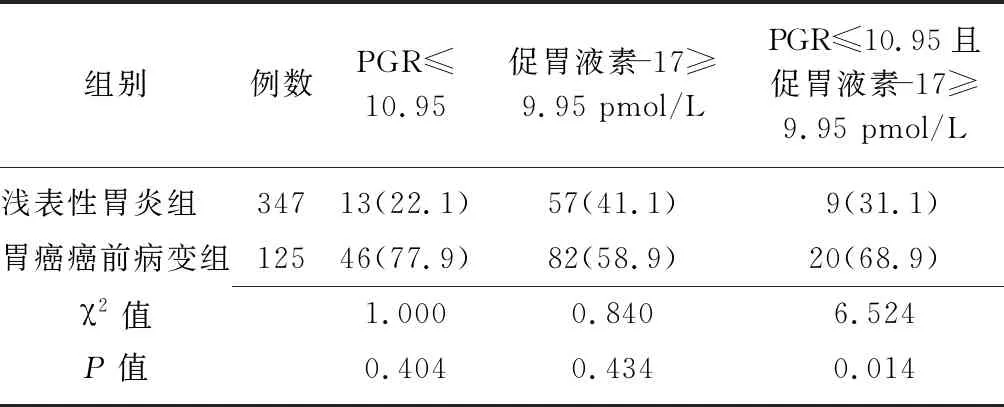
表4 浅表性胃炎组与胃癌癌前病变组血清学指标异常检出率比较 [例(%)]
3 讨 论
据统计,全球近半数新增和死亡的胃癌病例发生在中国,我国作为胃癌的高发国,如何降低胃癌的发病率和死亡率是亟须解决的重大问题[10-11]。萎缩性胃炎、肠上皮化生、异型增生是胃癌发展过程中重要的癌前病变。荷兰的一项大规模回顾性研究发现,萎缩性胃炎患者5年内的胃癌年发生率为0.1%,肠上皮化生发生率为0.25%,轻度至中度不典型增生的发生率为0.6%,重度不典型增生的发生率高达6%[12]。因此,胃癌癌前病变的早期诊断成为目前研究的热点。我国2017年“中国早期胃癌筛查流程专家共识意见”中,将血清PG和促胃液素-17纳入早期胃癌筛查的重要指标[13]。
PG是起源于胃黏膜消化酶的前体酶,在生化和免疫学上分为PG-Ⅰ和PG-Ⅱ两大类。血清PG-Ⅰ水平降低提示胃黏膜腺体萎缩;PG-Ⅱ由胃底腺、胃窦幽门腺和近端十二指肠Brunner腺分泌,PGR可很好地反映胃黏膜的形态和功能状态[14-15]。血清PG在我国胃癌癌前病变的筛查中有一定的应用价值,本研究结果显示,萎缩性胃炎组和异型增生组患者血清PG-Ⅰ、PGR水平明显低于浅表性胃炎患者(P<0.05)。李梦颖等[15]研究发现,与非萎缩性胃炎组相比,胃癌癌前病变组和胃癌组血清PG-Ⅰ、PGR水平明显降低。一项基于时间和胃癌癌前病变进展的纵向研究发现,血清PG水平降低与胃癌癌前病变的进展密切相关[11]。由此可见,在萎缩、肠化、异型增生等胃黏膜改变过程中,腺体细胞萎缩导致腺体分泌功能下降,血清PG水平发生变化,提示胃黏膜的不同病变状态,临床上可通过分析PG表达水平以评估胃癌癌前病变发生的可能性,为深入研究胃癌癌前病变的进展、探索早期临床诊断方法以及易感人群筛查及后续追踪提供一定依据。
促胃液素-17是胃窦和十二指肠G细胞分泌的一种重要的胃肠激素,是反映胃窦内分泌功能的敏感指标之一,可提示胃窦黏膜是否存在异常增殖[16-17]。王冬梅等[18]通过胃癌组织体外研究发现,促胃液素可激活细胞增殖和炎症反应等信号通路,增强胃癌细胞体外增殖能力。血清促胃液素-17可作为判断胃黏膜病变的重要指标。张玲霞等[19]分析不同萎缩部位萎缩性胃炎患者血清学变化的研究发现,胃窦萎缩和全胃萎缩患者血清促胃液素-17水平明显降低。国外一项观察性病例对照研究发现,无论是胃窦萎缩性胃炎患者还是已切除胃窦部位的患者,血清促胃液素-17水平均降低[20]。本研究结果显示,胃窦萎缩和胃窦与胃体均萎缩患者血清促胃液素-17水平明显低于胃体萎缩者,与上述研究一致。血清促胃液素-17主要由胃窦G细胞产生,当胃窦萎缩时,G细胞数量明显减少,进而血清促胃液素-17水平明显降低。不同病变部位促胃液素-17水平变化不同,促胃液素-17可间接反映胃黏膜病变。由于本研究样本量有限、取材部位不一致等,不同病理分型患者的促胃液素-17水平比较差异无统计学意义。
本研究对血清PGR和促胃液素-17进行ROC曲线分析发现,两者联合检测萎缩性胃炎的预测效能高于单独检测。不同研究有关胃癌和萎缩性胃炎等筛查值的差异较大,可能与患者所在地域文化差异、卫生习惯、年龄、性别构成等因素相关。由于本研究样本来源较单一、样本量较少、取材部位有限,仍需进一步分析研究。
综上所述,血清PG、促胃液素-17可用于胃癌癌前病变筛查,促胃液素-17水平下降提示胃窦萎缩有独特优势,两者联合检测对萎缩性胃炎的预测效能高于单独检测;且PGR和促胃液素-17可作为胃癌癌前病变的筛查指标,对异常人群进一步行胃镜检查,有助于更准确地识别胃癌癌前病变,并为研发新的早期干预手段提供依据。

