三元LDH的改性及去除酸性橙II的光谱分析研究
姜双城, 范丹阳, 刘 玥, 王家斌, 吕海霞*
1. 福建省水产研究所,福建 厦门 361013 2. 福州大学材料科学与工程学院,福建 福州 350108 3. 福州大学生物科学与工程学院,福建 福州 350108
引 言
层状氢氧化物(LDH)是一类最具代表性的阴离子型粘土成分,一般由两种金属的氢氧化物构成其主体层板。由于其大的比表面积,层间离子的可交换能力和记忆效应等,已被报道为潜在的废水处理吸附剂材料。鉴于天然或人工合成的无机LDH表面通常是亲水性的,同水分子等极性分子更容易结合,而对一些有机分子的脱色效果却不是很理想。利用芳香酸对LDH进行插层改性,可以大大增强其与水体中染料分子的亲和力[1]。
三元LDH虽然具有相似二元LDH的微观结构,但由于其复杂的元素组成及掺杂离子诱导的协同效应表现出更好的应用潜力[2]。Das等制备了Mg-Al-Fe-LDH并用于污水中孔雀石绿的去除,最大去除率为99.94%[3]。Zhou等通过共沉淀法制备了Fe-Mn-Mg-LDH并用于水中Cu(Ⅱ)的吸附,最大吸附容量为204.07 mg·g-1[4]。此外,煅烧处理也是一种有效改性LDH的方法,不仅可以增强LDH衍生物表面缺陷,利于内部反应[5],而且煅烧产物(LDO)在水溶液中能保持“记忆效应”,其吸附能力高于LDH[6]。Lei等采用水热法合成了Ni-Mg-Al-LDH并对其进行了煅烧,结果发现对刚果红和Cr(Ⅵ)的吸附容量分别从262 mg·g-1增长到466 mg·g-1,32.5 mg·g-1增长到85.1 mg·g-1[7]。目前还没有使用Ca-Mg-Al层状氢氧化物吸附酸性橙Ⅱ的报道。
本研究利用均苯四甲酸(PA)对三元Ca-Mg-Al-LDH进行插层改性,并将改性材料(PA-LDH)及其煅烧产物(PA-LDO)用于阴离子染料酸性橙II的吸附。通过FTIR和BET对制备材料进行了结构表征。以阴离子染料酸性橙Ⅱ为目标污染物,在波长为484 nm的条件下,通过UV-Vis分析检测手段,考察了吸附时间和染料初始浓度等条件对PA-LDH和PA-LDO的吸附性能的影响。另外,对PA-LDH及PA-LDO吸附酸性橙Ⅱ的等温曲线和热力学进行探究。
1 实验部分
1.1 仪器与试剂
Nicolet-5700型傅里叶变换红外光谱(FTIR)仪(美国热电公司); 2450型紫外分光光度计(日本岛津公司); 3Flex全自动气体吸附仪(美国麦克仪器公司)。
盐酸、氢氧化钠(天津市福晨化学试剂厂); 六水合硝酸镁、九水合硝酸铝、四水合硝酸钙、乙醇、尿素(国药集团化学试剂有限公司); 酸性橙Ⅱ、均苯四甲酸(上海阿拉丁试剂有限公司)。无特殊说明,试剂纯度为分析纯。
1.2 制备芳香酸阴离子改性层状氢氧化物
向40 mL去离子水中缓慢加入19.2 g尿素,4.5 g Al(NO3)3·9H2O,4.1 g Mg(NO3)2·6H2O,1.9 g Ca(NO3)2·4H2O和3.0 g PA,搅拌3 h至其充分溶解; 所得溶液于80 mL密封的水热釜中加热至140 ℃,保温36 h,置于80 ℃下结晶8 h,所得产品用水和乙醇交替洗涤数次,离心,于60 ℃真空干燥一夜制得PA-LDH。LDH则是不加入PA在同等条件下制得。将所得产品分别于马弗炉中500 ℃煅烧3 h制得PA-LDO和LDO。
1.3 聚合物的静态吸附
在30 mL样品瓶中分别加入一定质量PA-LDH和PA-LDO,再加入10 mL酸性橙Ⅱ溶液,向体系中滴加适量0.1 mol·L-1HCl和0.1 mol·L-1NaOH溶液以调节pH至目标值,在25 ℃条件下,磁力搅拌,使PA-LDH,PA-LDO与酸性橙Ⅱ充分结合。待吸附平衡,离心,用胶头滴管吸取上层清液,加水定容。采用紫外分光光度法在λ=484 nm处测定吸附前后溶液中酸性橙Ⅱ的浓度。吸附率及吸附容量的计算见式(1)和式(2)
E=100%(c0-ce)/c0
(1)
Q=(c0-ce)V/m
(2)
式中,E为吸附率(%),Q为吸附量(mg·g-1),V为溶液的体积(mL),c0为溶液的初始浓度(mg·g-1),ce为溶液的平衡浓度(mg·g-1),m为吸附剂的用量(g)。
1.4 标准曲线及相关系数
配制1,5,10,15,20 mg·L-1标准酸性橙Ⅱ溶液,用UV-Vis分光光度计在最大吸收波长484 nm处测定吸光度,以酸性橙Ⅱ浓度c作为横坐标,所测吸光度A为纵坐标,绘制标准工作曲线。所得的酸性橙Ⅱ的线性回归方程为:A=0.046 3c-0.001 1,相关系数R2=0.999 6。
2 结果与讨论
2.1 结构表征


图1 红外光谱图Fig.1 FTIR spectra
制备合成吸附材料的N2吸附-脱附测试结果如表1所示。从表中可以看出,与LDH的SBET(13.592 5 m2·g-1)相比,PA-LDH的SBET(15.934 1 m2·g-1)有些许上升,表明均苯四甲酸的插入,增大了吸附剂材料的孔容,比表面积有所提高,这可能与芳香酸的加入使得层状金属氢氧化物的层间距稍有增加有关。此外,与PA-LDH的SBET(15.934 1 m2·g-1)相比,PA-LDO的SBET(119.401 0 m2·g-1)也有较大的提升,说明在煅烧后,其比表面积增大。因此PA-LDO可能具有更好的吸附效果。
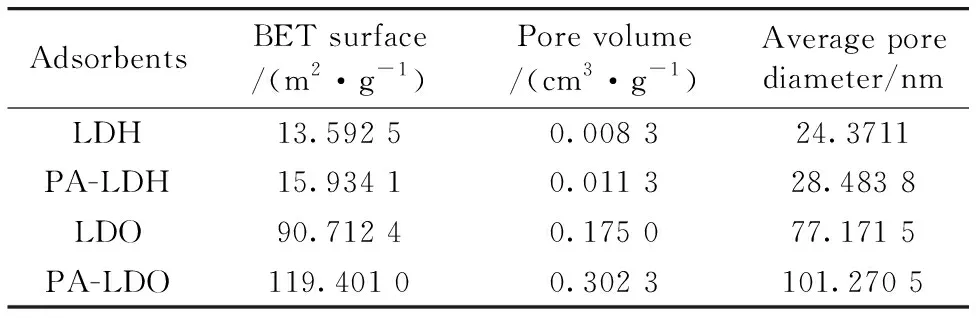
表1 不同材料的结构性质Table 1 Textual properties of different materials
2.2 吸附性能
2.2.1 吸附时间
吸附时间是影响吸附是否达到平衡的重要参数。对PA-LDH和PA-LDO吸附阴离子染料酸性橙Ⅱ的平衡时间进行了探究,实验结果如图2(a,b)所示。可以看出酸性橙Ⅱ的吸光度随吸附时间的延长而降低。从图2(c)中可以看出在180 min前,PA-LDH和PA-LDO对酸性橙Ⅱ的吸附去除率随时间延长急速增长; 在180~720 min时,去除率缓慢上升。当吸附时间达到720 min后,PA-LDH和PA-LDO对酸性橙Ⅱ的去除率变化不大,都在95%以上。因此,酸性橙Ⅱ在720 min内达到吸附平衡,在后续吸附实验中840 min足以使PA-LDH和PA-LDO对酸性橙Ⅱ的吸附达到平衡。
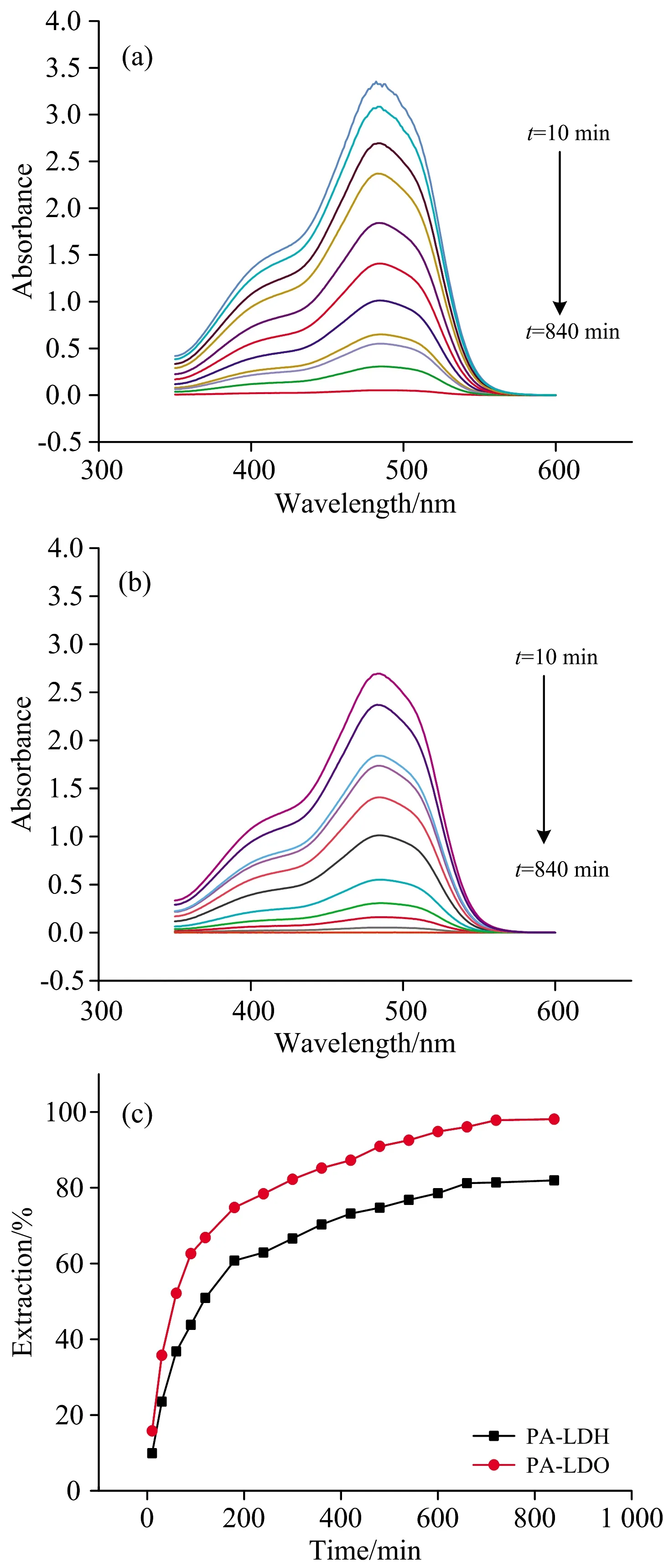
图2 不同吸附时间吸附后的紫外可见光谱(a) PA-LDH; (b) PA-LDO; (c) 吸附时间对吸附率的影响Fig.2 The UV-Vis of (a) PA-LDH and (b) PA-LDO after adsorption under different time; (c) Influence of adsorption time on the extraction
2.2.2 初始染料浓度
对PA-LDH和PA-LDO的改性效果进行探究并计算Qmax。在T=20 ℃,pH 7.0的条件下,分别取5 mg PA-LDH和PA-LDO,加入10 mL酸性橙Ⅱ中,吸附840 min,结果如图3所示。PA-LDH和PA-LDO对酸性橙Ⅱ的平衡吸附量均随着酸性橙Ⅱ初始浓度的增大而升高,并最终趋于饱和,分别为561.322和1 401.639 mg·g-1,相比部分吸附酸性橙Ⅱ的文献报道较高(见表2)。PA-LDO较PA-LDH有更高的吸附容量,这可能是由于煅烧带来更多的吸附位点所致。

图3 初始浓度对吸附容量的影响Fig.3 Influence of initial concentration on adsorption capacity

表2 不同吸附剂吸附酸性橙Ⅱ的QmaxTable 2 Qmax of different adsorbents on Orange Ⅱ
2.3 吸附动力学
在20 ℃,溶液pH 7.0,0.500 g·L-1吸附剂用量和240 mL 200 mg·L-1酸性橙Ⅱ溶液的条件下,考察吸附剂吸附酸性橙Ⅱ的吸附动力学。分别测定吸附时间为10~840 min的废液中含酸性橙Ⅱ的浓度,计算吸附量,通过准一级动力学和准二级动力学模型对实验数据进行拟合分析,拟合结果如图4(a,b)和表3所示。由图表可知,分别比较PA-LDH和PA-LDO的两种模型的相关系数R2,发现二者的准二级动力学模型的R2都在0.998以上,且拟合计算得到的平衡吸附量Qe与实验平衡吸附量Q较接近。因此二者吸附酸性橙Ⅱ的过程可以用准二级动力学方程更好地描述。

图4 PA-LDH和PA-LDO吸附酸性橙Ⅱ的(a) 准一级动力学模型; (b) 准二级动力学模型Fig.4 (a) Pseudo-first-order kinetics; (b) Pseudo-second-order kineticsfor removing Orange Ⅱ by PA-LDH and PA-LDO

表3 吸附酸性橙Ⅱ的动力学参数Table 3 Parameters of kinetic models for orange Ⅱ adsorption
2.4 吸附等温曲线
通过Langmuir和Freundlich吸附等温模型对实验结果进行拟合。
Langmuir吸附等温方程及其分离因子RL,见式(3)和式(4)
ceq/Qeq=ceq/Qmax+1/(bQmax)
(3)
RL=1/(1+bc0)
(4)
Freundlich吸附等温方程,见式(5)
lgQeq=(1/n)lgceq+lgK
(5)
式中,ceq为吸附平衡时溶液中剩余染料的浓度(mg·L-1),Qeq为吸附平衡时的吸附容量(mg·g-1),b为吸附平衡常数,Qmax为饱和吸附容量(mg·g-1),RL为分离因子,c0为染料的初始浓度(mg·L-1),K和1/n分别为Freundlich常数。
在T=20 ℃,pH 7.0的条件下,分别取5 mg PA-LDH和PA-LDO,加入10 mL酸性橙Ⅱ中,吸附840 min,对不同染料浓度对吸附材料吸附染料的影响进行探究,结果如图5所示。Langmuir和Freundlich模型拟合结果如表4所示。结合图表,比较R2值,发现Langmuir模型拟合效果更好,即PA-LDH和PA-LDO对酸性橙Ⅱ的吸附更符合Langmuir模型,单分子层吸附为该吸附过程的主导过程,理论最大吸附容量分别可达588.235和1 428.571 mg·g-1,与实验值(561.322和1 401.639 mg·g-1)相近。
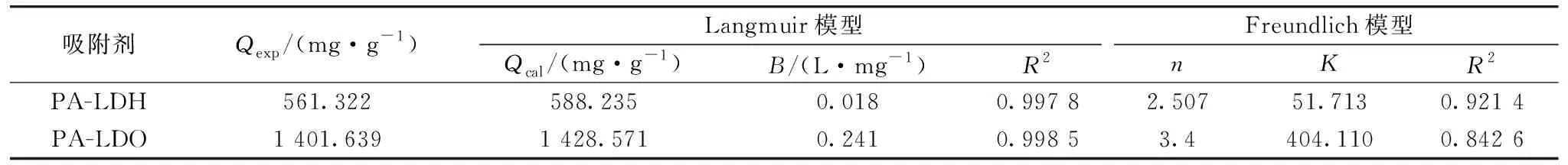
表4 吸附等温参数Table 4 Adsorption isotherm parameters

图5 PA-LDH和PA-LDO吸附酸性橙Ⅱ的吸附等温曲线pH 7.0, 5 mg PA-LDH, 5 mg PA-LDO, 10 mL酸性橙Ⅱ溶液,吸附14 hFig.5 Adsorption isotherm of removing Orange Ⅱ by PA-LDH and PA-LDOpH 7.0, 5 mg of PA-LDH, 5 mg of PA-LDO, 10 mL of Orange Ⅱ solution and 14 h of contact time
2.5 吸附热力学
为探究吸附材料吸附酸性橙Ⅱ的吸附热力学,在T=293,303和313 K,pH 7.0的条件下,分别取5 mg PA-LDH和PA-LDO,加入500 mg·g-1酸性橙Ⅱ中,吸附840 min。结果表明Q随T的升高而增大,可知PA-LDH和PA-LDO对酸性橙Ⅱ的吸附是高温更有利。结合Gibbs方程分析结果,见式(6)。焓变ΔH和熵变ΔS可用式(8)通过lnKd对1/T作图,从拟合曲线的斜率和截距计算得到。式(8)中的Kd是式(7)中在T=293,303和313 K下Qeq和ceq的比值。ΔG通过式(9)计算得到。
ΔG=ΔH-TΔS
(6)
Kd=Qeq/ceq
(7)
lnKd=ΔS/R-ΔH/(RT)
(8)
ΔG=-RTlnKd
(9)
式中: ΔG为吉布斯自由能(kJ·mol-1),ΔS为熵变[J·(mol·K)-1],ΔH为焓变(kJ·mol-1),Kd为吸附平衡常数,R为理想气体常数,取值为8.314 [J·(mol·K)-1],T为绝对温度(K),结果如表5所示。

表5 热力学参数Table 5 Thermodynamic parameters
分析结果表明: ΔH>0,说明该吸附过程是吸热过程,这与样品对酸性橙Ⅱ的吸附能力随温度升高而增加的结果相一致。升高温度,能够使污染物分子在外边界层和吸附剂内部孔隙的扩散速率增大,溶液的粘度降低,并且通过在活性位点的表面附近形成了一些内部键,增加活性位点的数量。ΔG为-1.754~-17.050 kJ·mol-1,说明该吸附过程是自发进行的物理吸附过程(0>ΔG>-20 kJ·mol-1),且随着温度的升高,ΔG变小,PA-LDH,PA-LDO与酸性橙Ⅱ之间越容易结合。ΔS>0,熵增,随着吸附的进行,体系混乱度变大,即吸附剂吸附酸性橙Ⅱ是一个高温有利的,自发的吸热熵增过程。
2.6 再生性能
吸附材料的循环使用能力是评价吸附材料性能的关键指标。将10 mL 100 mg·L-1酸性橙Ⅱ溶液在最佳吸附条件下吸附,用乙醇作为洗脱剂对其进行脱附再生,循环3次。实验结果表明,在重复3次吸附-再生循环后,PA-LDH和PA-LDO对酸性橙Ⅱ的去除率均保持在90%以上,说明PA-LDH和PA-LDO具有良好的可再生能力。
3 结 论
采用均苯四甲酸(PA)对三元层状氢氧化物(Ca-Mg-Al-LDH)进行插层改性,制备了均苯四甲酸改性三元层状金属氢氧化物(PA-LDH)及其煅烧产物(PA-LDO)。通过FTIR和BET对制备材料进行了结构表征。对比LDH与PA-LDH的红外光谱谱图,可以发现PA-LDH在1 717 cm-1处出现了一个新的峰,表明PA可能插层进入了LDH的间层。此外,PA-LDO相比PA-LDH的红外光谱谱图,3 000 cm-1附近的弱峰消失,但在875和723 cm-1处仍存在与M—O和M—OH(M=Ca,Mg和Al)振动相对应的峰,表明煅烧处理后其相似的结构依然得到了保持。以阴离子染料酸性橙Ⅱ为目标污染物,在波长为484 nm的条件下,通过UV-Vis分析检测手段,考察了吸附时间和染料初始浓度等条件对PA-LDH和PA-LDO的吸附性能的影响。结果表明,在最优实验条件下,PA-LDH和PA-LDO对酸性橙Ⅱ的Qmax分别为561.322和1 401.639 mg·g-1,高于目前所报道的Qmax值。吸附过程更符合Langmuir模型。此外,PA-LDH和PA-LDO吸附酸性橙Ⅱ是一个高温有利的,自发的吸热熵增过程。因此,PA-LDH和PA-LDO在染料废水的处理中具有潜在的应用价值。

