β-CD降低AEO-9对紫外光谱检测TDBAC的影响
许慧华,石东坡,吴 浩,尹先清,郑延成,陈 武,李 赓
石油石化污染控制与处理国家重点实验室(长江大学),湖北 荆州 434023
引 言
表面活性剂驱油是三次采油的关键技术之一,能为中老油田的持续稳产提供不竭动力。十四烷基二甲基苄基氯化铵(TDBAC)是三次采油常用的阳离子表面活性剂之一[1],与传统的阴离子表面活性剂相比,TDBAC具有较强的杀菌作用和抗静电作用,在驱油过程中,TDBAC还可被用作黏土/岩石的抑制剂,兼具稳定井壁的作用[2-3]。为了进一步降低表面张力及提高表面活性剂驱油效果,在实际使用过程中,TDBAC通常需要与其他类型表面活性剂进行复配[4-6],因此,准确检测复配体系中TDBAC的含量具有重要的应用前景,对于评价表面活性剂复配体系组分含量和评估表面活性剂驱油效果都具有重要作用。
TDBAC的检测方法主要有光谱法、高效液相色谱法等[7-11],这些检测方法一般能准确检测TDBAC纯溶液的含量,但是对表面活性剂复配体系中TDBAC组分的准确检测仍亟待提高。有研究表明,TDBAC类季铵盐型表面活性剂与阴离子、非离子等其他类型表面活性剂复配后,复配体系中各类型表面活性剂在水溶液中通常会产生较强的相互协同作用[12],并极有可能形成混合胶束,从而对TDBAC的检测产生明显干扰。鉴于此,本文以脂肪醇聚氧乙烯醚(AEO-9)为复配表面活性剂,采用紫外光谱法研究TDBAC/AEO-9复配水溶液中AEO-9对TDBAC检测光谱的干扰。在复配水溶液中添加适量的β-环糊精(β-CD),利用β-CD的自发包结作用[13-15],促使TDBAC与β-CD形成稳定的包结物,从而将TDBAC分子与AEO-9分子“隔离”,切断了TDBAC与AEO-9之间的协同作用,阻止了复配溶液中混合胶束的形成。与其他方法相比,本方法准确度高,复配溶液中TDBAC的回收率达101.9%~103.9%。
1 实验部分
1.1 试剂与仪器
TDBAC,纯度大于98%,上海麦克林生化科技有限公司; AEO-9,纯度大于98%,上海麦克林生化科技有限公司; β-CD,纯度大于98%,天津市光复精细化工研究所; NICOLET 6700型红外光谱仪,Thermo Scientific; UV-2450紫外-可见分光光度计,日本岛津公司; TA Q600热重分析仪,美国TA公司。
1.2 方法
首先采用紫外光谱法研究水溶液中AEO-9对TDBAC的表观临界胶束浓度(cmc)的影响。再加入适量的β-CD以消除AEO-9的干扰,进而研究β-CD对TDBAC紫外光谱的抗干扰作用。然后采用等摩尔连续变化法测定TDBAC/β-CD包结物的包结比,同时配制一系列已知浓度的TDBAC/AEO-9复配水溶液,验证β-CD修正紫外光谱方法的准确性。之后通过红外光谱表征(FTIR)与热重差热分析表征(TG-DSC),分析TDBAC与β-CD包结物的键合作用及包结过程。
2 结果与讨论
2.1 AEO-9对TDBAC表观cmc的影响结果
在浓度为0,0.150和0.300 mmol·L-1的AEO-9水溶液中,分别测定吸收波长为263 nm处TDBAC的吸光度随浓度变化曲线,如图1。

图1 不同浓度AEO-9水溶液中TDBAC的吸光度随浓度变化曲线图Fig.1 Plot of ultraviolet absorbance versus TDBAC concentration in the presence of different AEO-9 concentrations
图1中曲线a表明,在纯水中TDBAC的吸光度随浓度的增加而增大,TDBAC在纯水中的cmc为1.901 mmol·L-1。由图1中曲线b和c可知,当水溶液中AEO-9浓度分别增加至0.150和0.300 mmol·L-1时,TDBAC的表观cmc分别降低至1.739和1.584 mmol·L-1,可见AEO-9能显著降低TDBAC的cmc,这可能是由于TDBAC与AEO-9均为表面活性剂,二者之间的相互协同作用导致AEO-9与TDBAC共同参与了胶束化过程[13],从而降低了TDBAC形成胶束所需的浓度。此外,从图1还可以看出,AEO-9对TDBAC的吸光度有一定的影响,当TDBAC的浓度高于表观cmc时,AEO-9能明显降低TDBAC的吸光度。
2.2 β-CD 对TDBAC吸光度的影响及TDBAC/β-CD包结物的包结比
分别测定纯水及0.800 mmol·L-1β-CD水溶液中,0.800 mmol·L-1TDBAC和0.800 mmol·L-1AEO-9的紫外光谱,结果如图2。
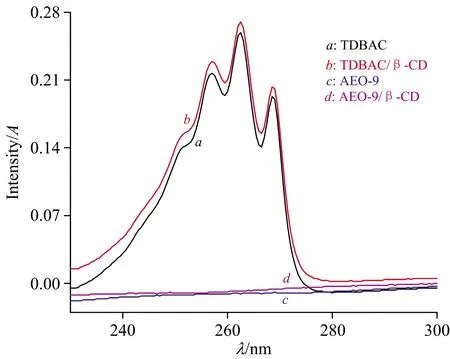
图2 TDBAC, TDBAC/β-CD, AEO-9及AEO-9/β-CD的紫外光谱图Fig.2 UV spectra of TDBAC, TDBAC/β-CD, AEO-9 and AEO-9/β-CD in aqueous solution
从图2可以看出,在230~300 nm波长范围内,0.800 mmol·L-1AEO-9在纯水及在0.800 mmol·L-1β-CD水溶液中的吸光度(曲线c和曲线d)均接近0。对比图2中曲线a和曲线b可知,TDBAC在纯水或β-CD水溶液中的紫外最大吸收波长均为263 nm,当β-CD的浓度从0增加至0.800 mmol·L-1时,0.800 mmol·L-1TDBAC的吸光度由0.259增加至0.270,表明了β-CD对TDBAC的吸光度具有一定的激发作用,这可能是由于带有苯环基团的TDBAC分子优先与β-CD分子自发形成了稳定的包结物[12-13],TDBAC分子受β-CD分子内腔的诱导作用产生了激发的光谱信号,激发的光谱信号一般有利于提高检测的精度。
采用等摩尔连续变化法(Job’s法)研究TDBAC/β-CD包结物的包结比。保持水溶液中TDBAC与β-CD的总浓度为2.000 mmol·L-1,改变TDBAC的摩尔分率,以相同浓度TDBAC溶液(不加β-CD)作为检测背景,扣除检测背景后,水溶液中TDBAC在263 nm处的吸光度变化如图3。在图3中,Job’s曲线在TDBAC的摩尔分率为0.5时出现拐点,表明了在水溶液中TDBAC与β-CD按物质的量之比1∶1进行包结。
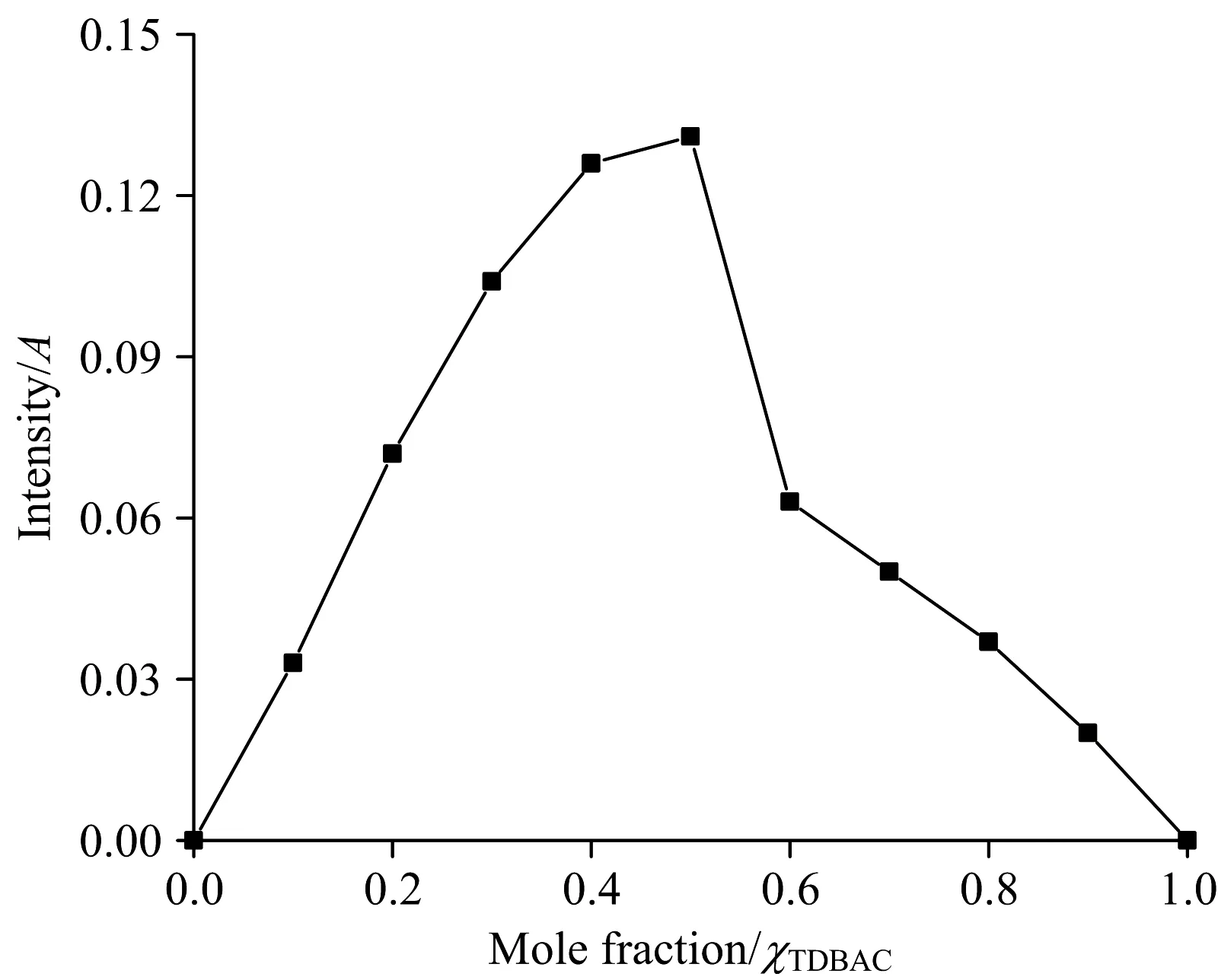
图3 TDBAC/β-CD包结物的Job’s曲线Fig.3 Job’s plot for inclusion of TDBAC/β-CD
2.3 β-CD 降低AEO-9对TDBAC紫外光谱的干扰
在浓度分别为0,0.150和0.300 mmol·L-1的AEO-9水溶液中,按物质的量比1∶1加入TDBAC和β-CD,TDBAC在263 nm处的吸光度如图4。

图4 β-CD降低AEO-9对TDBAC紫外光谱的干扰Fig.4 Interference of AEO-9 on UV spectrum of TDBAC reduced by β-CD
图1表明,当AEO-9 的浓度为0,0.150和0.300 mmol·L-1时,TDBAC的表观cmc分别为1.901,1.739和1.584 mmol·L-1; 对比图4可知,加入β-CD后,在0.600~2.800 mmol·L-1范围内,TDBAC的吸光度随浓度的变化曲线均没有出现拐点(图4中曲线a,b和c),可见TDBAC没有形成胶束,表明了β-CD具有阻止TDBAC在AEO-9水溶液中形成胶束的能力。由图4还可知,当AEO-9的浓度为0,0.150和0.300 mmol·L-1时,TDBAC在β-CD水溶液中的吸光度随浓度变化曲线相近(曲线a,b和c),表明了β-CD 可以显著降低AEO-9对TDBAC紫外光谱的干扰,这可能是由于TDBAC与β-CD形成包结物后,切断了TDBAC与AEO-9之间的协同作用[13-14]。
在一系列不同浓度TDBAC水溶液中按物质的量比1∶1加入β-CD,测定TDBAC在263 nm处的吸光度,绘制出TDBAC在β-CD水溶液中的定量标准曲线(曲线方程为y=0.346 5x+0.112 9),如图5。
2.4 β-CD降低AEO-9对TDBAC紫外光谱的干扰作用验证结果
分别采用图5中的定量标准曲线及TDBAC在纯水中的定量标准曲线(图1中曲线a),测定一系列已知浓度复配水溶液中的TDBAC的含量,验证β-CD的抗干扰效果,测定结果见表1。

图5 TDBAC在β-CD水溶液中的定量标准曲线Fig.5 Quantitative standard curve of TDBAC in β-CD aqueous solution
由表1可知,基于纯水中TDBAC的定量标准曲线难以准确检测复配溶液中TDBAC的含量,TDBAC的回收率为86.3%~107.5%。基于β-CD水溶液中建立的TDBAC的定量标准曲线,能准确检测复配溶液中TDBAC的含量,TDBAC的回收率为101.9%~103.9%。表明了按TDBAC的物质的量比1∶1加入β-CD,确能明显降低AEO-9对TDBAC紫外光谱的干扰作用。
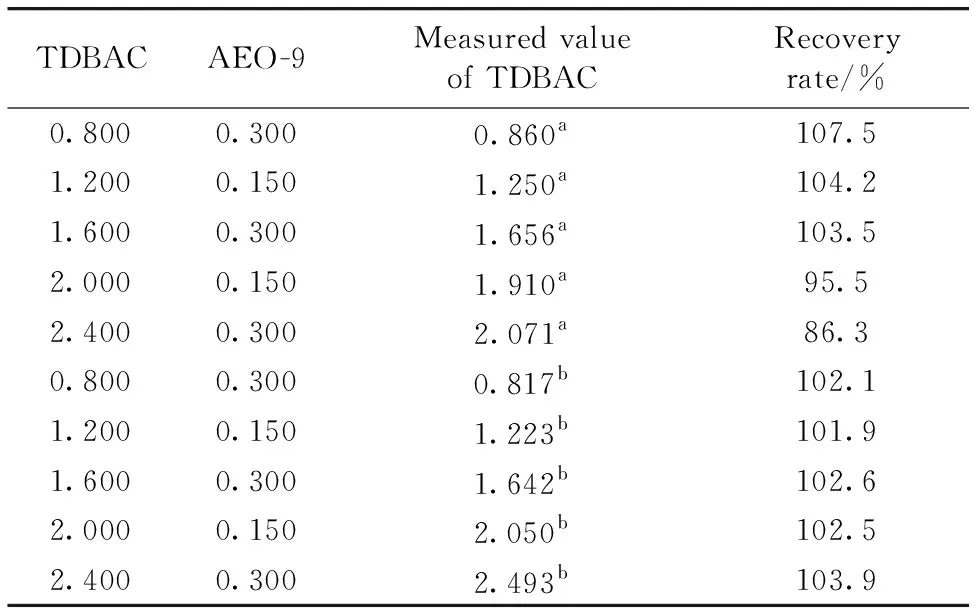
表1 TDBAC/AEO-9水溶液中TDBAC定量验证试验(单位: mmol·L-1)Table 1 Quantitative analysis of TDBAC in TDBAC/AEO-9 aqueous solution (Unit: mmol·L-1)
2.5 β-CD 与TDBAC键合作用分析
按物质的量比1∶1制备TDBAC/β-CD包结物,对其进行FTIR与TG-DSC(采用N2为保护气,升温速率10 ℃·min-1)分析,结果如图6、图7和图8。
对比图6中TDBAC/β-CD包结物(曲线a)和β-CD(曲线b)的红外光谱图可知,包结物的红外光谱图在1 033 cm-1处归属于β-CD分子内腔的C—O—C基团的伸缩振动峰有明显增加,表明了TDBAC分子进入了β-CD分子的空腔。包结物的红外光谱图在1 460 cm-1处归属于β-CD分子宽口径外侧的—OH基团的弯曲振动峰,以及在1 159 cm-1处β-CD分子窄口径外侧的—CH2OH基团的弯曲振动峰,均发生一定变化,表明了TDBAC分子可能从β-CD分子的宽、窄侧两个方向进入β-CD分子内腔。
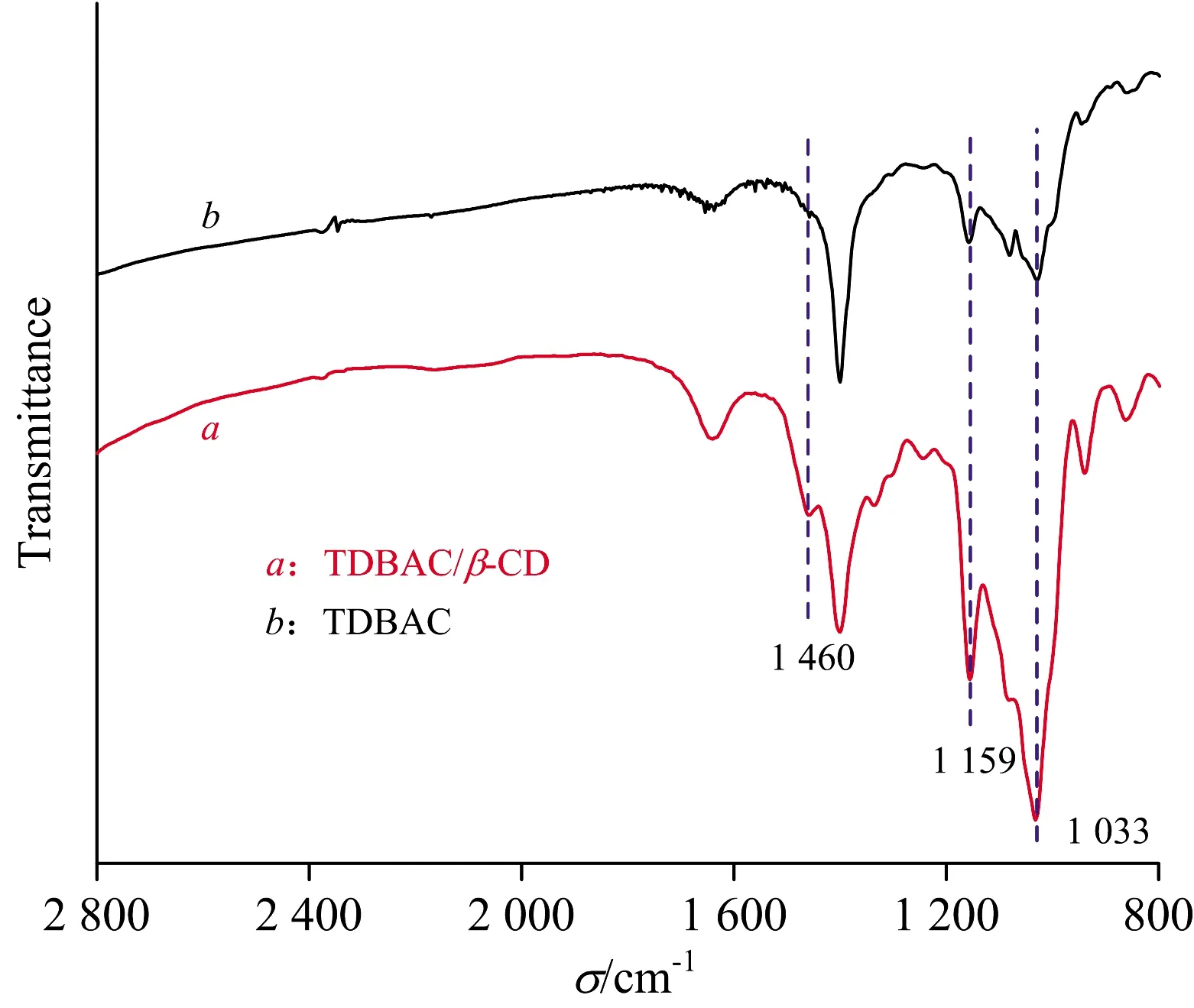
图6 TDBAC/β-CD包结物和β-CD的红外光谱图Fig.6 Infrared spectra of β-CD and TDBAC/β-CD
由图7可知,β-CD(曲线a)和TDBAC(曲线b)在105和61 ℃分别出现吸热峰,相对应的TG图中(图8中曲线a和曲线b)β-CD和TDBAC在105和61 ℃均出现了质量损失,由此可推测出105和61 ℃分别为β-CD和TDBAC失去结晶水的温度。由图7还可知,β-CD和TDBAC在316和202 ℃也分别出现了吸热峰,相对应的TG图中(图8)β-CD和TDBAC在316和202 ℃均出现了明显的质量损失,可见316和202 ℃分别为β-CD和TDBAC的分解温度。图7和图8还表明,TDBAC/β-CD包结物在263 ℃发生分解,包结物在316和202 ℃处既没有出现明显的吸热峰,又没有出现明显的质量损失,表明了包结物结构中的TDBAC和β-CD,与自由态的TDBAC和β-CD的物性已发生了明显变化,可见形成包结物后TDBAC和β-CD之间存在着较强的相互作用。
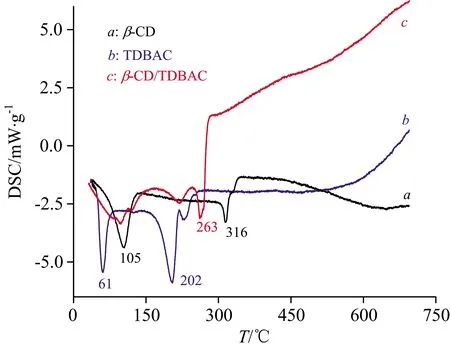
图7 β-CD,TDBAC及二者包结物的DSC图Fig.7 DSC profiles of β-CD, TDBAC and TDBAC/β-CD
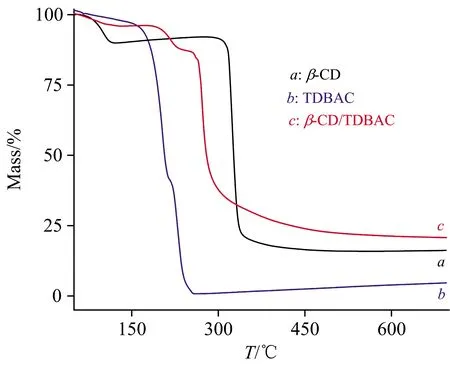
图8 β-CD,TDBAC及二者包结物的TG图Fig.8 TG profiles of β-CD, TDBAC and TDBAC/β-CD
由前文可推测出在 TDBAC/AEO-9复配溶液中,AEO-9能与TDBAC形成混合胶束,加入β-CD后,TDBAC优先选择与β-CD形成包结物,破坏了胶束结构,从而显著降低AEO-9与TDBAC分子之间的协同作用,可能的过程如图9。
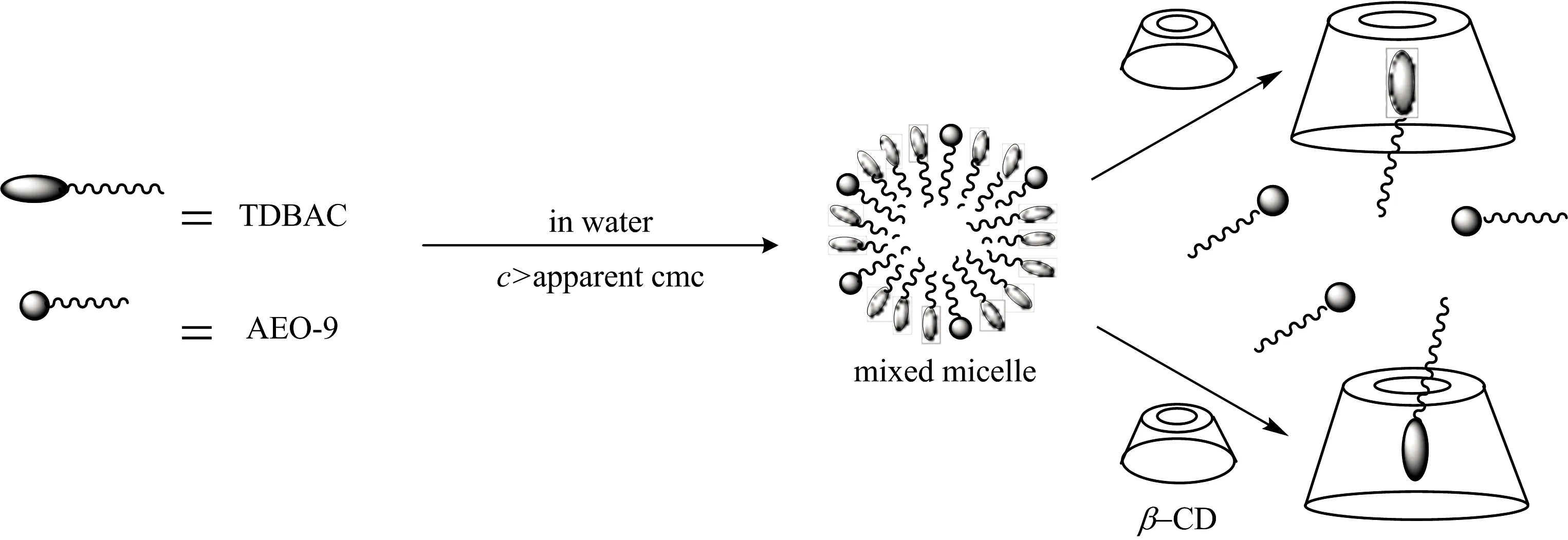
图9 TDBAC/AEO-9复配溶液中TDBAC与β-CD相互作用可能的机理图Fig.9 Possible mechanism of interaction between TDBAC and β-CD in TDBAC/AEO-9 aqueous solution
3 结 论
采用紫外光谱法检测TDBAC时,复配水溶液中的AEO-9不仅能与TDBAC产生较强的相互协同作用,还能与TDBAC共同形成混合胶束,从而对TDBAC的吸光度和cmc均产生了显著影响,致使紫外光谱法检测TDBAC的准确度明显变低。以TDBAC的物质的量计,加入1∶1的β-CD 后,TDBAC可显著降低AEO-9对TDBAC紫外光谱的干扰,方法回收率为101.9%~103.9%。依据FTIR和TG-DSC等分析结果,推测出β-CD 能优先与 TDBAC形成物质的量比为1∶1的包结物,包结物的形成阻止了AEO-9和TDBAC形成混合胶束,也明显降低了AEO-9与TDBAC之间的协同作用。

