荧光成像及手性特异性生物识别
费学宁,郑元杰,谷迎春,李光旻,赵洪宾,张宝莲
天津城建大学理学院,天津 300384
引 言
荧光探针生物识别技术凭借其可视性影像表达及无创伤检测等优点,已成为重大疾病早期识别和组织成像研究的热点问题。近年来荧光成像技术在癌症靶向识别研究方面取得了长足进展。叶酸受体(FR)介导的生物荧光探针识别研究持续受到关注。叶酸受体是癌细胞表面过量表达的标志物,利用叶酸受体与叶酸的特异性结合关系,可介导叶酸及荧光偶联物进入细胞内部且不被放入溶酶体被破坏; 叶酸受体作为靶向标志物在癌症识别研究中具有独特地位。癌症和炎症巨噬细胞表面过量表达的两种叶酸受体亚型FAα和FAβ具有高度同源性,亚型的存在使得荧光探针识别癌症和炎症巨噬细胞存在着结构性缺陷,FAα和FAβ分别由257和255个氨基酸组成,区别在于三个末端未翻译区,用来包结叶酸分子的三角空腔的三种氨基酸不同。如图1所示,FAα和FAβ存在的手性特性区别,两种叶酸受体亚型的三角空腔构成两个不同手性特征的“手性空间”,为设计更加客观识别癌细胞的“荧光-手性”靶向识别探针,实现癌症和炎症巨噬细胞的区分提供了可能性[1]。
1 生物荧光探针研究进展
1.1 有机荧光染料探针
有机荧光染料探针在生物标记过程中,具有荧光量子产率高、稳定性好等优点。文献报道较多的主要有以下四类探针, 如表1所示。

表1 有机荧光探针分子修饰构效关系Table 1 Molecular structure modification of organic dyes probes
含有长波长荧光发色团的荧光分子具有对客体无损成像、生物体内自发荧光且背景干扰低[2]等优点。Koide等[2]将罗丹明B 10位的氧原子用硅原子取代,杂原子的电负性改变了杂环荧光染料分子中电子云密度分布,可使其荧光发射波长红移到650 nm以上,荧光量子产率为0.39; 将罗丹明B的氧原子替换为砜基,产物的荧光发射波长可达700 nm以上,量子产率高于0.4,对细胞具有良好的兼容性。
研究表明, 近红外二区(NIR-Ⅱ, 1 000~1 700 nm)荧光光谱成像可极大减弱生物组织对光的吸收、散射现象, 可显著提升光谱成像效果,在重大疾病诊断与治疗等领域表现出优异的特性, 具有潜在的临床应用价值。由供电子基团(D)和受电子基团(A)构筑的D-A-D荧光分子结构,可大大的提高染料分子量子产率。苯并双噻二唑(BBTD)作为一种强吸电子基团具有高光稳定性和高荧光效率(荧光发射最高峰可达1 000 nm以上)被广泛应用[3]。引入电子屏蔽基团(S)设计的S-D-A-D-S型荧光探针结构,可减少探针与其他分子的相互作用、碰撞猝灭,使分子荧光增强,量子产率可达 0.3以上。研究表明,处于高浓度或聚集状态的荧光分子也能够发射强荧光。四苯基乙烯是典型的具有上述聚集诱导发光(AIE)效应特性的荧光分子。
1.2 无机量子点荧光探针
无机量子点(quantum dots, QDs)是另一类性能优异的生物荧光探针,受光能激发产生荧光的生物标记剂。包括第Ⅲ—Ⅴ或Ⅱ—Ⅵ族元素组成的如CdTe,CdSe和ZnS等无机金属半导体量子点、碳量子点等。尺寸在1~10 nm之间[4], 与有机染料相比,量子点具有荧光量子产率高、激发光谱连续,荧光发射光谱窄,峰型对称等优点[4]。
2 生物荧光探针靶向修饰
荧光探针对癌细胞的特异性作用是实现癌症细胞靶向识别的客观要求。叶酸是维持细胞功能的基本物质之一,叶酸凭借能与叶酸受体特异性结合的特点,在介导荧光探针靶向识别肿瘤研究中具有独到的地位。
2.1 叶酸受体介导的肿瘤识别探针分子改性研究
常见于通过叶酸分子活性位点与荧光探针分子进行偶联, 可赋予荧光分子的靶向性; 叶酸和多糖(壳聚糖、环糊精等)修饰荧光染料分子,可提高荧光靶向探针的生物相容性; 叶酸修饰量子点探针,检测灵敏、量子产率高; 叶酸修饰荧光纳米聚合物点,化学与热力学稳定性及生物相容性好。
癌症和炎症巨噬细胞表面过量表达的两种叶酸受体亚型FAα和FAβ的高度同源性使得荧光染料探针在识别癌症和炎症巨噬细胞的过程中存在着结构性缺陷。科学家重新审视肿瘤细胞的精细结构指出,可依照叶酸受体的三维结构, 研究基于叶酸受体亚型介导的细胞靶向标记物的信息应答关系,设计特异性识别探针,有望提升识别效率。
2.2 叶酸受体的手性特征
叶酸受体有4种不同的亚型(FRα,FRβ,FRγ和FRδ),前两者因在癌细胞和巨噬细胞表面过量表达被密切关注。FRα主要在约90%癌细胞中过量表达,与人类乳腺及口腔表皮样癌细胞(KB)中的蛋白相同,分子量为28 256,由257个氨基酸组成; FRβ主要在类风湿性关节炎炎症部位巨噬细胞表面,胎盘和单核细胞中高表达,分子量为27 401,由255个氨基酸组成。叶酸受体亚型FRα和FRβ约有70%的同源性,主要区别位于三个末端未翻译区,有三种不同种类的氨基酸形成一个用来包结叶酸分子的三角空腔; FRα为丙氨酸(Alanine)、缬氨酸(Valine)、谷氨酸(Glutamate); FRβ为亮氨酸(Leucine)、甘氨酸(Glycine)、苯丙氨酸(Phenylalanine); 如图1所示: 叶酸受体的结构性差异及结合叶酸的口袋作用关系。FRα和FRβ本身的结构对不同的配体表现出立体特异性[5]。叶酸受体亚型存在的“手性空间”差异性为设计新型的基于亚型手性选择性表达识别探针提供结构基础。
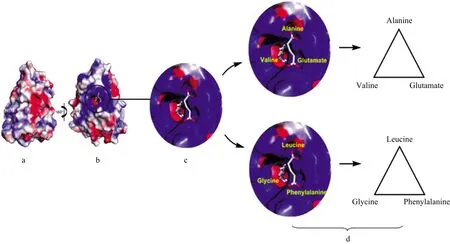
图1 叶酸受体结构性差异及结合叶酸的口袋关系(a),(b): 叶酸受体正反两面示意图; (c): 包结叶酸的三角空腔; (d): 叶酸α,β亚型区别Fig.1 Structural differences of folate receptor and pocket relationship of folate binding(a), (b): The figure show the positive and negative sides of folate receptor;(c): The triangle cavity of folate inclusion; (d): The difference of folate α and β subtypes
2.3 手性荧光探针分子识别氨基酸
2.3.1 手性荧光探针分子识别氨基酸原理
现有氨基酸的识别法主要包括光谱法、电化学发光分析、色谱法和手性识别传感器检测法等。光谱分析法因其利用手性对映体本身不同旋光和圆二特征可快速识别手性化合物得到广泛应用[6]。其中最常用的对手性化合物的表征方法是利用圆二色性(CD),对氨基酸的R、L两种构型发生电子跃迁过程中对圆偏振光吸收程度不同进行区分,可在溶液状态下测定,较接近其生理状态[6]。手性光谱识别法的原理是基于手性对映异构体和外界手性环境(如环糊精和多糖)之间发生氢键、疏水和静电等非共价相互作用,形成非对映异构体,或者手性选择剂对手性对映体吸附效应不同,引起圆二特征峰或荧光强度发生明显变化,进而实现手性识别。
2.3.2 用于识别氨基酸的手性荧光探针分子设计
可用于手性识别氨基酸的分子有以下几类: 基于联萘酚不同位点进行修饰的环状分子,手性大环的特殊结构与氨基酸作用,通过荧光增强能很好的区分α-氨基酸; 方酰胺因其独特的四元环刚性结构、较强的氢键给体属性和两个侧链易于修饰的特点在手性识别领域成为研究热点之一。在其分子上引入碱性的叔胺基团, 可与氨基酸显酸性的羧基中和, 羧基上的质子转移到叔胺上形成盐,两个氢键位点被溶剂占据或与过量的氨基酸结合形成双氢键而引起荧光强度的变化,可实现对氨基酸的手性识别; 在分子中同时引入两个方酰胺片段, 可构建一类具有4个氢键作用位点的口袋式探针分子,通过与氨基酸作用引起荧光强度的改变从而达到识别的效果[7]。
近年来,由于手性量子点同时具有荧光和手性识别特性并能为测试提供手性环境等优点受到广泛关注。
2.4 手性无机量子点
量子点连接L-半胱氨酸等手性配体即成为手性量子点,2007年,Gun’ko课题组合成了左旋/右旋-青霉胺稳定的并具有镜像对称CD信号的CdS量子点被正式提出[8],与未被修饰的量子点相比,量子产率明显提升。手性有机分子与无机纳米粒子的耦合实现了手性从分子尺度向纳米尺度的跨越, 此外,某些蛋白质和药物只对一个对映体有活性,而具手性特性能为其标记、测试提供不可多得的手性环境,也是目前纳米科学在生物医学领域研究的热点之一[9]。
2.4.1 量子点手性产生的本质和发光原理
Takuya Nakashima课题组[10]合成巯基封端的手性CdTe纳米晶体,通过对圆二谱图的分析,推测手性产生的本质。CdSe量子点未在第一激子跃迁带(400 nm以上)范围内出现CD信号,因此观测到的CD信号不能归因于核的第一激子跃迁。他们推测手性来源于包括手性封端分子在内的表面壳层,巯基通过S原子配位Cd原子形成Cd-S配体单层,手性分子中硫醇电子直接跃迁到Cd,改变原子表面电子跃迁引起手性变化。
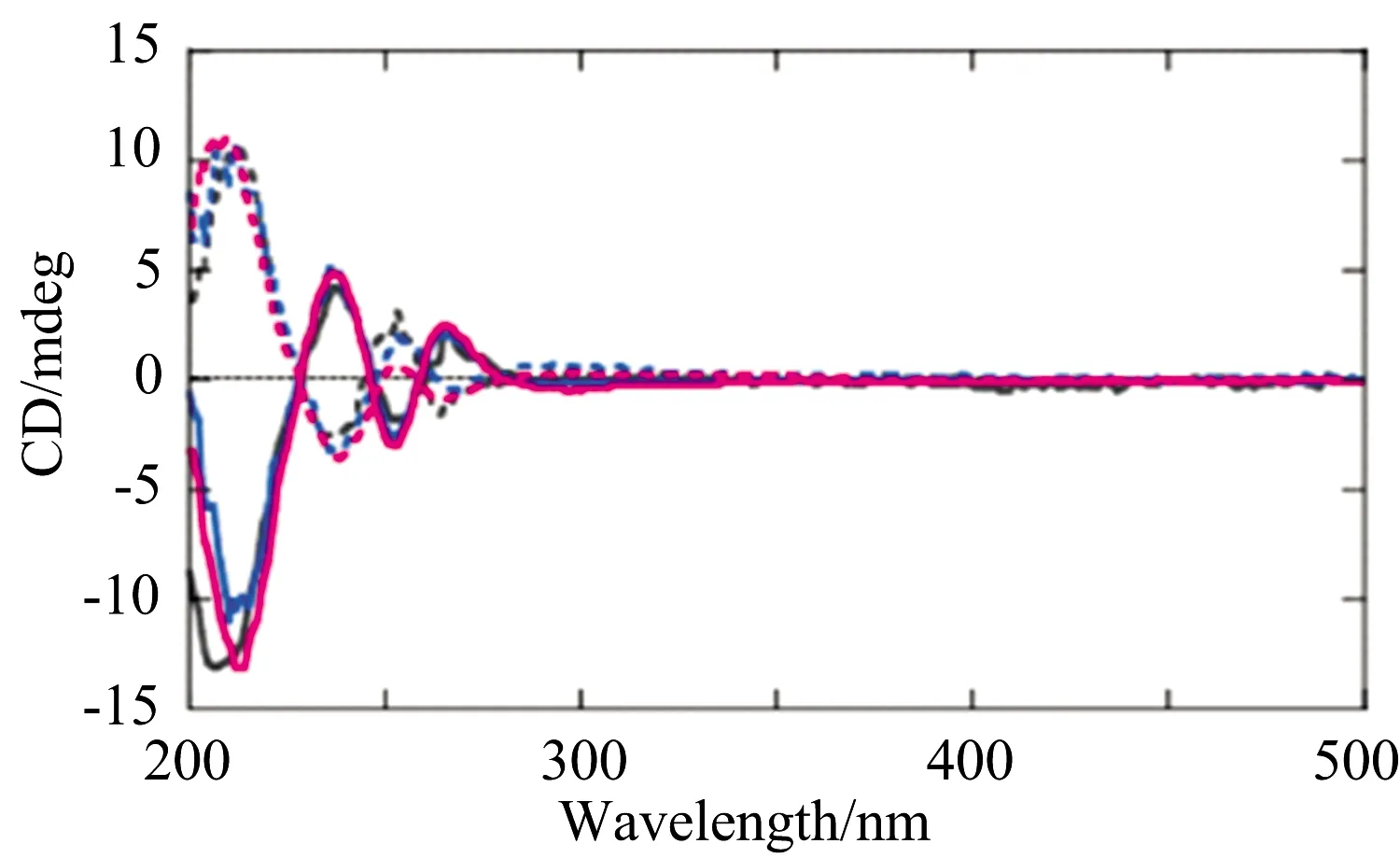
图2 巯基封端CdTe纳米晶圆二谱图Fig.2 Spectrogram of sulfhydryl terminated CdTe nanocrystals
Li等[11]通过研究手性半胱氨酸(Cysteine, Cys)与CdTe量子点作用机制探究手性产生的本质,如图3所示,量子点本身能产生圆二信号,当手性Cys与呈四面体排布的CdTe量子点结合时,Cys的巯基与Cd原子成键产生手性中心,在280~400 nm产生明显的CD信号, 不仅保留了半胱氨酸本身的手性信号, 还显示出手性分子诱导的CdTe核的手性(250~350 nm的宽峰),因此类四面体可能是表现手性行为的主要因素,且手性可能源于更容易被修饰或置换的纳米粒子顶端原子的贡献。
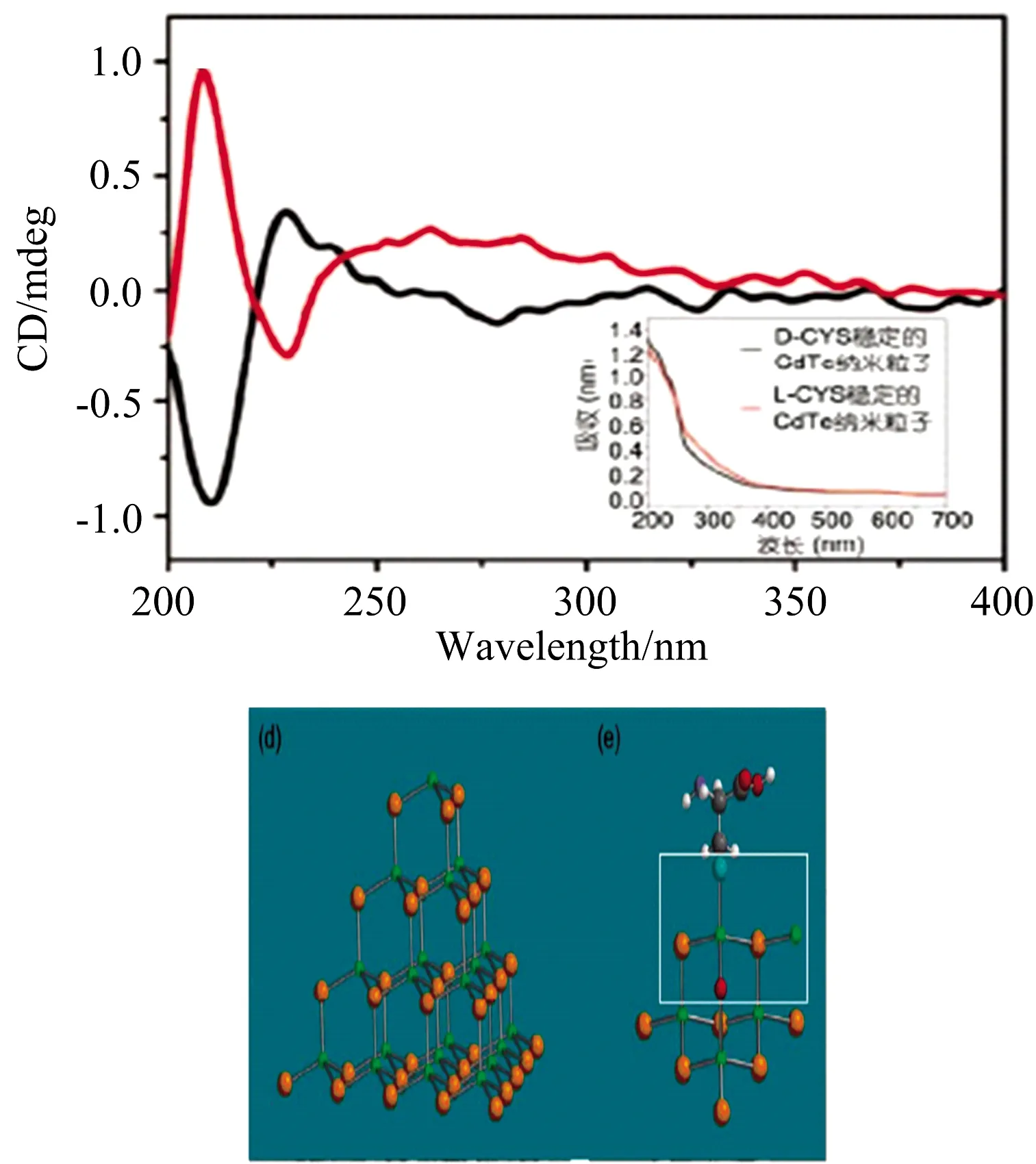
图3 CdTe量子点的圆二特征峰以及结构Fig.3 Circular dichotomous peaks and structures of CdTe quantum dots
有研究发现金纳米粒子也可以被手性配体诱导产生手性。Alvarez等[12]利用谷胱甘肽作为稳定剂制备了手性Au28量子点,在可见光区显示出了配体诱导的手性信号。
本课题组通过研究L/D-cys-CdTe量子点与半胱氨酸、亮氨酸、谷氨酸对映体相互作用时,通过光学活性的变化探究了手性产生的本质,并提出两种主要的观点: 第一,手性是由外壳层的结构手性变形引起,可能是由于表面原子的手性变形或配体壳的手性排列引起。第二,手性配体和半导体量子点间的电子相互作用(而不是物理畸变)反过来会导致圆二发光[11]; QD-CD光谱形状和诱导的CD带的大小取决于许多因素,如材料本身的性质、合成过程中使用的手性配体的浓度等。
理解QD与手性配体之间的关系,可为手性量子点手性的起源提供另一种视角; 手性量子点能为对映体识别提供不可多得的手性环境,在借助光谱生物成像和医学诊疗方面具有潜在的应用价值。
2.4.2 手性量子点识别氨基酸对映体
一些对映体和手性量子点之间的相互作用会改变他们的光物理和光化学特性,使其更具有辨识度。但目前只有少数报道研究手性半导体量子点与其他手性部分(如氨基酸)之间的相互作用。在量子点表面修饰手性配体(半胱氨酸、环糊精、焦谷氨酸),制备的手性量子点可用来手性识别氨基酸对映体。环糊精((Cyclodextrin,CD)是一种具有客体包合能力的手性分子,适合手性化合物的对映体选择性分析,其空腔能够和多种物质如有机分子、无机离子等通过分子间作用力形成包合物,引起荧光强度不同程度的改变; 焦谷氨酸是一种廉价易得的手性原料,相对坚硬的五元内酰胺骨架和羧酸基团可形成双氢键,提供了很强的捕捉目标分子的能力,在氨基酸的识别上提供了一种新的手性对映体识别模块[13]。
Hak Sung Jung课题组[14]用谷胱甘肽稳定CdSe/ZnS量子点,利用双功能偶联剂,将包含罗丹明B的β-环糊精连接到量子点上制备荧光共振能量转移探针成功识别不同构型的苯丙氨酸。量子点作为能量的给与者, 罗丹明B作为能量的接受者,与苯丙氨酸作用后,苯丙氨酸替换罗丹明B,由于不同构型的苯丙氨酸与环糊精缔合常数不同,荧光共振能量转移现象被不同程度的破坏,凭借荧光强度的变化区分对映体。类似的原理还有以β-环糊精为稳定剂, 制备的CdSe/ZnS核壳结构量子点, 成功实现了对酪氨酸对映体的手性识别。Zhou Xu等制得β-环糊精修饰的银量子点并成功区分色氨酸对映体。
Zhu等[13]利用巯基片段修饰焦谷氨酸制备手性配体,连接到CdSe/ZnS量子点表面,如图4所示,焦谷氨酸内酰胺部分具有卓越的氢键和立体控制能力易于捕获目标分子。对映体与手性识别模块可构成的氢键容量不同,结果表明,该手性量子点对D/L-组氨酸(Histidine)、D/L-谷氨酸(Glutamate)对映体具有良好的手性选择性。
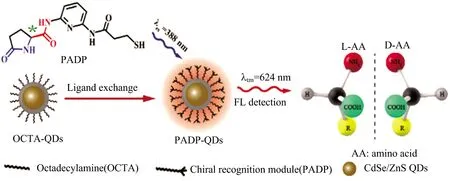
图4 焦谷氨酸修饰的CdSe/ZnS量子点Fig.4 Pyroglutamic acid modified CdSe/ZnS quantum dots
韩翠平等[15]用环糊精修饰制得的手性量子点和巯基乙酸修饰制备的非手性量子点与氨基酸作用,发现非手性量子点无法区分氨基酸对映体,由此他们推测手性量子点的对映选择效应是由于手性配体与氨基酸的相互作用。氨基酸与环糊精作用,原子的嵌入/连接引起核外配体结构变化,限制分子构象,诱导环糊精均匀排列,这种有序取向/增强的构象刚性会抑制猝灭路径,增强了发光强度。
因此手性识别模块的构建是实现特异性识别的关键。通过手性量子点对不同氨基酸的特异性识别,有望区分叶酸的两种不同亚型,进而区分肿瘤细胞和炎症巨噬细胞(如图5所示)。手性纳米结构是一类具有独特性质和潜在应用价值的材料, 将分子的手性传递到纳米尺度并挖掘其生物应用具有非常重要的意义, 但是将手性量子点真正运用于人体肿瘤诊断还需要进行大量的实验,同时也面临着许多挑战,如探针的重金属离子溶出和生物相容性等问题; 值得关注的是,肿瘤细胞与炎症巨噬细胞表面过量表达的叶酸受体,其亚型存在的不同手性特征,为构建实现区分癌症和炎症的生物手性荧光探针提供了结构基础。
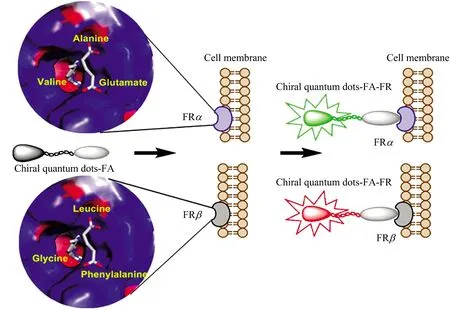
图5 叶酸受体亚型FRα和FRβ的手性空间与手性量子点作用关系Fig.5 Chiral space of folate receptor subtypes FRα and FRβ and their interaction with chiral quantum dots
3 结 论
手性探针的特异性可被用于设计构建叶酸受体亚型水平识别探针,进而探讨对癌细胞进行精准靶向识别的科学性与可行性, 具有潜在的应用前景和不可替代的优势; 值得关注的是,叶酸受体亚型的三角空腔是由三种不同的氨基酸构成的,与单一氨基酸识别的不同之处,三角空腔中三种氨基酸是以一定的空间位置构成的“手性空间”。“手性空间”中如此近的氨基酸质点之间的电子扰动行为和能量作用关系,是否存在“手性能量转移”现象是值得关注的重要问题。随着对手性物质本质规律的进一步理解,对疾病本质的进一步认识, 手性质点之间的作用关系将会对癌细胞精准识别提供新的依据。
相信随着分子生物学的进一步发展, “肿瘤标记物学”这一新兴学科会取得更长足的发展、为早期反映体内肿瘤变化状态提供更充足的依据。

