IL-23/IL-17通路及调节网络在葡萄膜炎发生中的作用
易圣蓝 综述 杨培增 审校
重庆医科大学附属第一医院眼科 眼科学重庆市市级重点实验室 重庆市眼科研究所400016
葡萄膜炎是一类全球性的致盲率较高的眼病,其种类繁多、病程长,具有反复发作、难以根治等特点[1]。葡萄膜炎致盲主要发生于青壮年,且多为不可治盲,给社会及经济带来不容忽视的负担,因此在防盲眼病中占有重要地位[2-3]。葡萄膜炎发病机制复杂,早期研究发现,葡萄膜炎主要可能是辅助性T细胞1/2(T helper 1/2 cells,Th1/Th2)免疫失调所致,即以Th1细胞活化、白细胞介素(interleukin,IL)-12/γ干扰素(interferon-γ,IFN-γ)信号通路激活为特征的免疫机制模式。有研究显示树突状细胞(dendritic cells,DC)在接受刺激后,分泌大量IL-12,通过结合幼稚CD4+T细胞表面的受体,激活CD4+T细胞中特异性转录因子T-bet,促进幼稚CD4+T向Th1细胞转化,合成并释放大量IFN-γ,抑制Th2的合成,从而导致Th1/Th2细胞轴的失调[4-5]。最近研究发现,Th17细胞激活在葡萄膜炎中起着重要作用,补充和完善了葡萄膜炎的免疫学机制。IL-23/IL-17信号通路以Th17细胞活化为主线,作用于靶细胞视网膜色素上皮(retinal pigment epithelium,RPE)细胞,造成炎性因子、趋化因子的大量产生及RPE屏障功能的破坏,进而引起葡萄膜炎的发生[6-8]。研究者还对调节Th17细胞的网络及调节网络中相关因子的基因多态性与葡萄膜炎的相关性进行了深入研究,本文对已获得的这些重要发现进行综述,以期为后期葡萄膜炎的研究提供帮助。
1 IL-23/IL-17通路及其生理功能
IL-23主要由抗原呈递细胞DC及巨噬细胞分泌,其在自身免疫性疾病,如系统性红斑狼疮、类风湿性关节炎等的发生及慢性化中起着重要作用。IL-23属于IL-12家族,与IL-12共享亚单位p40,并由另一个独特的p19亚基共同组成异二聚体细胞因子[9]。从抗原呈递细胞表面Toll样受体(Toll-like receptors,TLR)接触免疫原开始,胞内核苷酸结合寡聚化结构域样受体3(nucleotide-binding oligomerization domain,leucine rich repeat and pyrin domain containing,NLRP3)及Notch等通路受到刺激而被激活,并分泌大量IL-23,后者通过结合受体IL-23R、协同转化生长因子β(transforming growth factor-β,TGF-β)及IL-6,增加CD4+T细胞内转录因子视黄酸相关孤儿受体(transcription factors retinoic acid-related orphan receptor,ROR)γt和RORa的转录,促进CD4+T细胞向Th17细胞亚群分化,产生IL-17[10-12]。Th17是CD4+T细胞亚群中的一种,作为炎症反应和自身免疫反应中重要的效能细胞,其在IL-23/IL-17通路中占据主导地位。Th17细胞除了分泌IL-17A、IL-17F外,还分泌IL-21和IL-22;并且IL-21可以通过正反馈回路刺激RORγt合成,激活信号传导和转录激活因子(signal transducer and activator of transcription,STAT)3及上调IL-23R表达,从而强化IL-23/IL-17通路。而IL-17是多种炎症反应的重要效应分子,作用于靶细胞后,促进肿瘤坏死因子(tumor necrosis factor,TNF)、IL-1、IL-6、IL-8和粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)的分泌,再次形成正向反馈回路,强化和促进免疫反应呈瀑布式进展[13]。
2 IL-23/IL-17通路在葡萄膜炎中的基础研究
2007年,杨培增团队首次报道IL-23/IL17通路在Vogt-小柳-原田(Vogt-Koyanagi-Harada,VKH)综合征发病中起重要作用后数月,又在葡萄炎动物模型中发现了同样的结果[6]。此后,该方向的研究日益增多。
2.1 IL-23/IL-17通路在葡萄膜炎中的作用
Chi等[6]研究发现,VKH综合征活动期患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中IL-23及IL-17 mRNA表达水平显著高于正常对照及VKH综合征静止期患者,ELISA检测发现活动期患者血清中IL-23、IL-17蛋白表达水平也显著高于正常对照组,由此提出二者间可能存在联系,使用重组IL-23蛋白联合CD3、CD28刺激PBMC及CD4+T细胞后发现,重组IL-23蛋白能有效刺激CD4+T细胞向Th17细胞亚群分化,使IL-17的分泌显著升高。这一结果首次确定了IL-23/IL-17通路在葡萄膜炎发病中的重要位置。此后,有研究显示IL-23/IL-17通路在白塞病发病中起着重要作用[14]。Amadi-Obi等[15]研究认为,葡萄膜炎和巩膜炎产生的IL-17可作用于视网膜色素细胞,诱导其分泌TNF-α等炎性因子,使视网膜色素细胞产生炎症反应,并发现使用IL-17抗体可减轻实验性自身免疫性葡萄膜炎模型小鼠眼内炎症。上述研究揭示了IL-23/IL-17通路在葡萄膜炎中的重要性,提示IL-23/IL-17通路是继IL-12/IFN-γ通路葡萄膜炎中另一关键炎症通路,这一新炎症通路的发现进一步解释了葡萄膜炎的复杂性及难治性。
2.2 IL-17靶细胞在葡萄膜炎中的基础研究
IL-17可作用于多种细胞,其受体广泛表达于内皮细胞、上皮细胞及巨噬细胞等,IL-17通过与受体结合,活化TNF受体相关因子(TNF receptor associated factor,TRAF),促进细胞内丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、核转录因子(nuclear transcription factor,NF)-κB及细胞外调节蛋白激酶(extracellular regulated protein kinases,Erk1/2)等磷酸化,引起靶细胞炎症反应。在类风湿性关节炎的研究中,IL-17可诱导体外培养的滑膜成纤维细胞分泌IL-6、IL-8及前列腺素E受体2等炎性因子[16-17]。有研究结果显示,RPE细胞系ARPE-19中可表达IL-17受体,使用重组IL-17蛋白可以刺激RPE细胞分泌IL-1β、IL-6、CXCL8、CCL2及CCL20等炎性介质,并可以破坏ARPE-19单层的屏障功能,扰乱ARPE-19单层中紧密连接蛋白1和Occludin的分布[18]。IL-17对RPE细胞作用的通路研究显示,IL-17可以增强RPE细胞中Erk1/2、MAPK和Akt的磷酸化,且RPE细胞分泌的炎性因子表达水平随MAPK、PI3K-Akt和NF-κB抑制剂浓度的升高而降低[19]。IL-17作用于靶细胞可以引起细胞形态改变,例如RPE细胞色素脱失,还能刺激靶细胞,如巨噬细胞分泌炎性因子,进一步加重和扩大炎症反应。
2.3 葡萄膜炎中IL-23/IL-17通路网络的研究
探讨葡萄膜炎中哪些因素参与IL-23/IL-17通路已成为研究关注的重点问题,近年的研究已揭示出有一庞大网络调节该通路并在葡萄膜炎的发生中起着重要作用(图1)。
2.3.1葡萄膜炎中IL-23/IL-17通路的正性调节因子 白塞病中TLR家族成员TLR2、TLR3、TLR4和TLR8等在PBMC中表达升高,使用TLR特异性刺激剂刺激DC后,可激活NLRP3、Notch及NF-κB信号通路,诱导DC分泌IL-1β、IL-6和IL-23[20-21]。VKH综合征及白塞病中DC同样高表达含核苷酸结合寡聚化域蛋白1(nucleotide-binding oligomerization domain containing protein,NOD)1和NOD2,并且DC分泌的IL-1β及IL-6可受NOD1及NOD2特异性刺激剂刺激而表达增加[22]。IL-6与IL-1β可协同IL-23共同作用于幼稚CD4+T细胞,激活Janus激酶(Janus kinase,JAK)-STAT信号蛋白,诱导JAK、TYK及STAT家族成员磷酸化,促进Th17细胞分化,增加IL-17分泌;并且,IL-6及IL-1β均可由多种免疫细胞及RPE细胞合成,当IL-17作用于这些靶细胞,激活Erk1/2、p38、MAPK、PI3K-Akt和NF-κB等信号通路,使靶细胞再次分泌IL-6及IL-1β等后可形成正向回路,扩大炎症反应[23]。此外,IL-10家族成员IL-26同样可以通过诱导JAK-STAT通路激活,使STAT1和STAT3磷酸化,进而促进Th17细胞分化。活化的Th17细胞除分泌IL-17外,还可分泌IL-21,而CD4+T细胞表面表达的IL-21R可与IL-21形成正反馈回路进一步刺激IL-17表达增加。IL-7在VKH综合征活动期患者PBMC中表达升高,并且使用重组IL-7刺激CD4+T细胞后,Th1和Th17分泌的IL-17及IFN-γ表达明显增加,提示IL-7是IL-23/IL-17通路的协同刺激因子[24]。这些IL-23/IL-17通路上的正向调节因子通过相互作用、共同协作,将信号逐步传送到靶细胞外,促进了IL-23/IL-17信号通路的激活,进而引起炎症的发生。
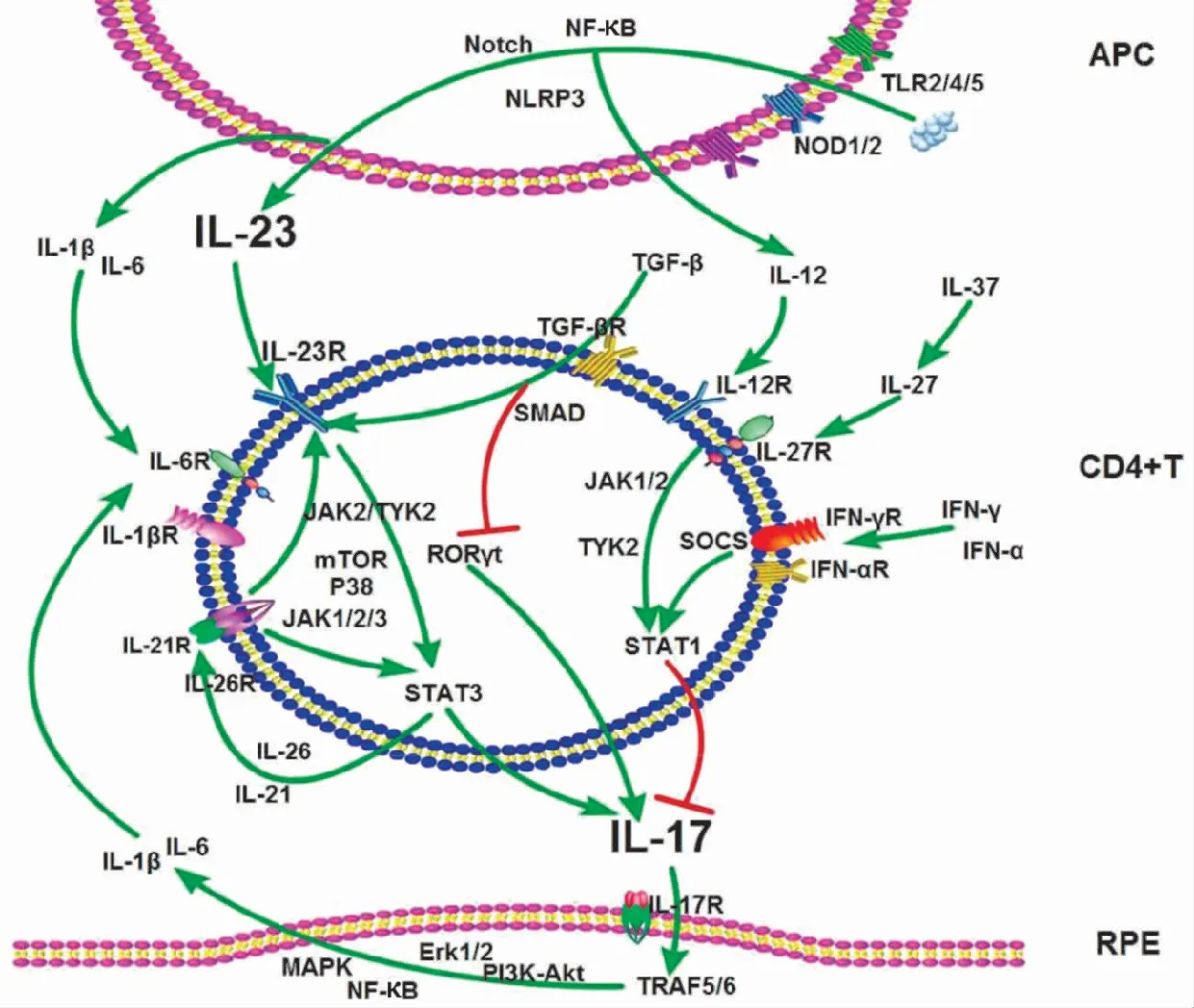
图1 葡萄膜炎中IL-23/IL-17通路及调节网络 NF-κB:核转录因子-κB;IL:白细胞介素;SOCS:细胞信号转录抑制因子;TGF:转化生长因子;ROR:转录因子视黄酸相关孤儿受体;IFN-γR:γ干扰素受体;APC:抗原呈递细胞;RPE:视网膜色素上皮
2.3.2葡萄膜炎中IL-23/IL-17通路的负性调节因子 DC分泌的另一种炎性因子IL-12对IL-23/IL-17通路存在负向调控作用。研究发现,使用重组IL-12蛋白联合CD3、CD28刺激VKH综合征患者PBMC及CD4+T细胞可明显抑制IL-17的合成[6]。VKH综合征患者DC受IL-37刺激后IL-27表达增加,并发现IL-27可抑制Th17细胞分化,继而拮抗葡萄膜炎患者中IL-23诱导的IL-17分泌[25-26]。而重组IL-23刺激PBMC后增加IL-17分泌却抑制IFN-γ分泌,使用IFN-γ蛋白抗体可增加IL-17的表达[14]。此外,细胞因子信号转导抑制因子(suppressor of cytokine signaling,SOCS)是IL-23、IL-6信号传导和Th17细胞分化的重要负性调控因子,IFN-γ通过作用于CD4+T细胞,刺激IL-2表达,抑制胞内SOCS,进一步抑制IL-17的表达,而IFN-γ的这种抑制效应会被JAK激酶抑制剂消除[27]。IFN-α同样可以通过调控STAT抑制IL-17的表达[28]。在葡萄膜炎中,IFN-γ及IFN-α可显著抑制IL-17的产生,但在葡萄膜炎的发病中,IFN-γ与IL-17表达多为同时升高或降低[29]。由此可见,葡萄膜炎中IL-23/IL-17及IL-12/IFN-γ调节网络非常复杂。IFN-γ与IL-17皆为促炎因子,受到上游信号刺激后表达升高,通过不同的炎症通路引起免疫反应,协同扩大炎症信号传递。正负性调节因子的相互影响制约以维持免疫内环境的稳定,一旦平衡被打破可引起免疫失调,进而诱发一系列炎症反应,而葡萄膜炎中负性调控因子的表达降低或相对弱化会打破这一免疫平衡,从而加重免疫反应。
此外,部分调节因子在葡萄膜炎中的功能会随着免疫环境的改变呈现波动性,且同一细胞因子家族成员会表现出完全相反的功能。STAT1和STAT3对Th17细胞的发育至关重要,但STAT1和STAT3对IL-23刺激Th17细胞分化有截然相反的影响,STAT1可与IL-27启动子直接结合,并对IL-23/IL-17信号轴起负向调控作用[22]。而在STAT3基因缺陷鼠中,IL-23刺激Th17细胞IL-17分泌的作用较野生鼠降低,提示STAT3对IL-23/IL-17通路是正向促进作用。TGF-β对IL-23/IL-17通路的调控存在剂量依赖性,低剂量的TGF-β作用于T细胞后,可刺激SMADs活化,增加IL-23R的合成。高剂量的TGF-β可作用于RUNX1及Treg特异性转录因子FOXp3,抑制RORγt,间接抑制IL-17的合成[30-32]。目前发现的葡萄膜炎中作用于IL-23/IL-17通路的正向和负向调节因子均已逾10种,参与IL-23/IL-17及IL-12/IFN-γ通路的调节因子交互影响,逐级联动效应,引起免疫失衡,图1展示研究中被证明与葡萄膜炎有直接联系的重要调控因子及其作用途径。
2.4 IL-23/IL-17通路及调节网络中基因多态性与葡萄膜炎关系的研究
Wang等[33]对不同种族人群中葡萄膜炎相关基因及通路进行了总结,并建立了UVEOGENE平台,可用于鉴定葡萄膜炎与其他自身免疫性疾病之间遗传易感性的异同。本文将IL-23/IL-17信号通路相关的基因多态阳性位点进行总结(表1)。葡萄膜炎中IL-23/IL-17通路基因变异可能影响基因的表达,其碱基改变位点所处的基因片段位置也能引起其功能的改变。目前葡萄膜炎中IL-23/IL-17通路上基因多态性引起的蛋白功能改变仍是研究的重点。
2.4.1IL-23/IL-17通路的基因多态性与葡萄膜炎 IL-23/IL-17信号通路被发现参与葡萄膜炎后,其基因多态性分析同样成为研究重点。一项关于IL-23/IL-17通路遗传易感性的代表性研究使用全基因组关联研究(genome-wide association studies,GWAS)对比分析了1 538例VKH综合征患者和5 603例中国汉族正常人群近十万个单核苷酸多态性(single nucleotide polymorphism,SNP)的基因型数据,发现位于IL-23R/C1orf141基因上的rs117633859位点与VKH综合征的发病密切相关,生物信息学分析提示该位点可能通过单个碱基的改变干扰转录因子的结合,从而影响IL-23R的转录调控;而携带rs117633859位点G等位基因的健康对照者PBMC中>IL-23R mRNA表达明显降低[34]。此外,在非质谱分析方法中,不同种族人群中IL-23R基因rs11209026、rs11465804、rs7517847、rs12561798、rs3762318及rs79755370位点上的碱基改变与葡萄膜炎相关[35-38]。在中国汉族、西班牙、韩国等白塞病患者中,IL23R-IL12RB2的rs11209032、rs1495965、rs7517847等十余个位点的突变与其发病风险相关。IL-23/IL-17通路基因易感性分布与葡萄膜炎的关系存在明显人群差异,在白塞病的GWAS研究和验证中,IL-23R-IL12RB2上rs924080、rs1495965和rs12141431在日本和土耳其人群显示与疾病的发病关系显著[39-41]。而中国、西班牙、韩国人群中相关的基因位点分别是IL-17F基因上的rs763780位点、IL-17A基因的rs8193036位点和IL-17F基因的rs2397084位点[42-43]。此外,有研究结果显示,IL-17F和IL-23A基因拷贝数变异同样与VKH综合征及白塞病发病存在相关性,并且IL-17F蛋白表达水平的升高与其基因高拷贝数呈正相关[44]。
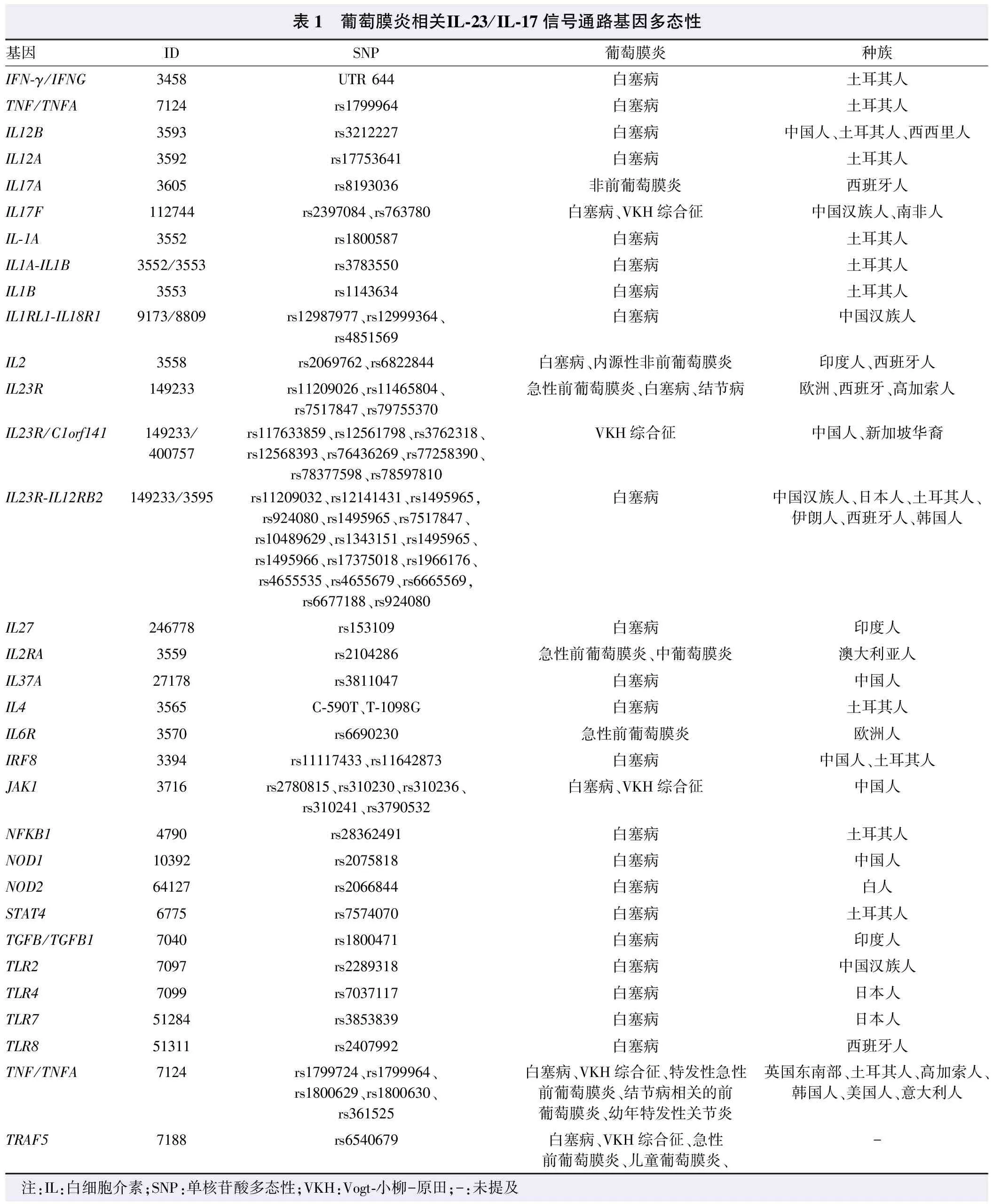
表1 葡萄膜炎相关IL-23/IL-17信号通路基因多态性基因IDSNP葡萄膜炎种族IFN-γ/IFNG3458UTR 644白塞病土耳其人TNF/TNFA7124rs1799964白塞病土耳其人IL12B3593rs3212227白塞病中国人、土耳其人、西西里人IL12A3592rs17753641白塞病土耳其人IL17A3605rs8193036非前葡萄膜炎西班牙人IL17F112744rs2397084、rs763780白塞病、VKH综合征中国汉族人、南非人IL-1A3552rs1800587白塞病土耳其人IL1A-IL1B3552/3553rs3783550白塞病土耳其人IL1B3553rs1143634白塞病土耳其人IL1RL1-IL18R19173/8809rs12987977、rs12999364、rs4851569白塞病中国汉族人IL23558rs2069762、rs6822844白塞病、内源性非前葡萄膜炎印度人、西班牙人IL23R149233rs11209026、rs11465804、rs7517847、rs79755370急性前葡萄膜炎、白塞病、结节病欧洲、西班牙、高加索人IL23R/C1orf141149233/400757rs117633859、rs12561798、rs3762318、rs12568393、rs76436269、rs77258390、rs78377598、rs78597810VKH综合征中国人、新加坡华裔IL23R-IL12RB2149233/3595rs11209032、rs12141431、rs1495965,rs924080、rs1495965、rs7517847、rs10489629、rs1343151、rs1495965、rs1495966、rs17375018、rs1966176、rs4655535、rs4655679、rs6665569,rs6677188、rs924080白塞病中国汉族人、日本人、土耳其人、伊朗人、西班牙人、韩国人IL27246778rs153109白塞病印度人IL2RA3559rs2104286急性前葡萄膜炎、中葡萄膜炎澳大利亚人IL37A27178rs3811047白塞病中国人IL43565C-590T、T-1098G白塞病土耳其人IL6R3570rs6690230急性前葡萄膜炎欧洲人IRF83394rs11117433、rs11642873白塞病中国人、土耳其人JAK13716rs2780815、rs310230、rs310236、rs310241、rs3790532白塞病、VKH综合征中国人NFKB14790rs28362491白塞病土耳其人NOD110392rs2075818白塞病中国人NOD264127rs2066844白塞病白人STAT46775rs7574070白塞病土耳其人TGFB/TGFB17040rs1800471白塞病印度人TLR27097rs2289318白塞病中国汉族人TLR47099rs7037117白塞病日本人TLR751284rs3853839白塞病日本人TLR851311rs2407992白塞病西班牙人TNF/TNFA7124rs1799724、rs1799964、rs1800629、rs1800630、rs361525白塞病、VKH综合征、特发性急性前葡萄膜炎、结节病相关的前葡萄膜炎、幼年特发性关节炎英国东南部、土耳其人、高加索人、韩国人、美国人、意大利人TRAF57188rs6540679白塞病、VKH综合征、急性前葡萄膜炎、儿童葡萄膜炎、- 注:IL:白细胞介素;SNP:单核苷酸多态性;VKH:Vogt-小柳-原田;-:未提及
2.4.2IL-23/IL-17通路调节网络中其他关键基因多态性与葡萄膜炎 IL-23/IL-17信号通路调节网络中其他关键性因子的基因遗传学改变同样会影响对该信号通路的调控。通过对IL-12的基因多态性分析发现,IL-12A基因rs17753641、IL-12B基因rs3212227与白塞病及VKH综合征存在相关性[45-46]。在风湿性关节炎、系统性红斑狼疮及多发性硬化等免疫性疾病中也发现DC及巨噬细胞表面的TLR家族,例如TLR2、TLR4、TLR8、TLR9等基因多态性的存在。而有研究结果显示,TLR2基因rs2289318和rs3804099位点被发现与白塞病相关,在携带rs2289318的CC基因型和rs3804099的TT基因型的健康对照者PBMC中也发现TLR2 mRNA表达增加[47]。然而,日本白塞病人群中并未检测出TLR2基因多态性,而检测出TLR4基因rs7037117和TLR7基因rs3853839与其相关[48]。TLR8基因rs2407992被发现与西班牙白塞病人群有相关性[49]。导致这一结果的可能原因是样本量较小或者人种差异。另一项关于TLR7基因拷贝数的研究提示,中国白塞病人群中TLR7拷贝数增加概率较正常对照高,通过验证发现TLR7拷贝数的增加与其mRNA及蛋白的表达呈正相关[50]。有研究结果显示,IL-17下游基因TRAF5的基因多态性同样与多种类型葡萄膜炎相关,例如VKH综合征、白塞病、前葡萄膜炎及儿童葡萄膜炎[51]。在中国、日本及伊朗等葡萄膜炎患者中发现,受IL-23刺激调节并参与介导Th1和Th17细胞反应的STAT4基因多态性与葡萄膜炎相关。此外,参与IL-23/IL-17信号通路的JAK1、JAK2、STAT3等通路蛋白基因在葡萄膜炎中也存在基因多态性[52-54]。
3 葡萄膜炎中IL-23/IL-17通路生物制剂研究
生物靶向治疗是葡萄膜炎治疗的新方向,IL-23/IL-17通路的研究结果为葡萄膜炎的生物靶向治疗提供了新的思路。多中心研究发现,静脉注射IL-17A单克隆抗体(Secukinumab)后能有效缓解非感染性葡萄膜炎的临床症状[55]。TNF-α单克隆抗体(Infliximab)在白塞病中的研究发现,其降低了白塞病患者因难治性而致盲的风险[56-57],并且对难治性非感染性葡萄膜炎具有提高视力、减少皮质类固醇使用及不良反应等优势[58]。而IL-23单克隆抗体在葡萄膜炎中的应用尚在临床试验阶段[59]。IL-1受体拮抗剂(Anakinra)和IL-1β单克隆抗体(Canakinumab)被证明可以减少白塞病相关葡萄膜炎患者的眼内耀斑数[60-61]。IL-6受体抗体(Tocilizumab)对幼年特发性关节炎相关性葡萄膜炎的中央黄斑增厚、玻璃体混浊及视力下降等症状均有良好的疗效[62]。但免疫反应的发生通常呈网络式,单一的生物抑制剂只能抑制部分通路,使得其临床疗效并不能达到预期。根据图1所示的炎症网路图,JAK、TYK是多个受体接受刺激后的共同细胞内通路,而JAK抑制剂已成为自身免疫性疾病的新治疗靶点。Tofacitinib是JAK1、JAK2和JAK3抑制剂,目前已经被美国食品药品监督管理局批准用于类风湿性关节炎、溃疡性结肠炎和银屑病相关性关节炎等的治疗[63]。通过生物制剂抑制细胞内共同通路蛋白可有效抑制由多种炎性因子引起的炎症反应,找到炎症反应的重要蛋白并使用靶向抑制剂既能有效控制炎症,也能减少因为免疫抑制引起的不良反应,但这些新发现的生物制剂仍需要大样本的人群进行临床试验。此外,生物制剂的眼局部用药研究仍需继续探索,以减少全身性不良反应的发生。
4 IL-23/IL-17通路在葡萄膜炎发病机制中亟待解决的问题和未来基础研究方向
有研究发现葡萄膜炎与肠道菌群失调相关,喂食白塞病患者粪便后的小鼠Th1及Th17细胞分化增加,提示菌群可能通过某种机制影响免疫失调[64]。但肠道菌群对葡萄膜炎免疫作用的机制仍不明确,其是否通过激活IL-23/IL17通路引起葡萄膜炎,是否存在某种特定的菌群与IL-23/IL17通路直接相关仍有待进一步阐明。在多种肿瘤及自身免疫性疾病中,代谢物对疾病发病机制的影响及相关新药的开发将是研究热点。代谢组学目前已在VKH综合征、白塞病、急性前葡萄膜炎中陆续开展,血清中代谢产物在各类型葡萄膜炎中存在差异,这些代谢产物是否能作用于免疫细胞,通过抑制IL-23/IL-17通路发挥治疗作用可能成为葡萄膜炎治疗研究的方向。
目前IL-23/IL-17通路研究已成为葡萄膜炎发病机制研究热点,但详尽的调控通路及相关机制仍需进一步研究阐明。IL-23/IL-17通路的免疫学研究主要集中在有全身炎症反应的VKH综合征及白塞病患者中,单眼受累的葡萄膜炎患者外周血及眼内IL-23/IL-17通路变化情况尚需进一步研究,感染性和非感染性葡萄膜炎中IL-23/IL-17通路的差异目前尚未有明确报道。并且,IL-23/IL-17通路上的基因多态性改变具体引起炎症反应情况、对炎症程度的影响及潜在的基因治疗位点值得进一步挖掘。能否通过基因修饰的方式减轻葡萄膜炎的炎症反应,甚至治愈葡萄膜炎仍需要进行深入研究,且根据葡萄膜炎类型精准靶向IL-23/IL-17通路的药物开发可能成为新的研究方向。
目前中国葡萄膜炎基础研究已达到国际领先水平,但葡萄膜炎发病机制图谱仍有待进一步完善,对葡萄膜炎发病机制更深入的研究及利用已发现的机制指导临床治疗是下一步研究的方向。
利益冲突所有作者均声明不存在利益冲突

