日本眼科学会《早产儿视网膜病变的抗VEGF疗法临床指南》解读
杨小元 蔡瑜婷 李芸
中南大学湘雅二医院眼科 湖南省眼科临床医学研究中心,长沙 410011
2020年12月10日,日本眼科学会等4个委员会联合发布了《早产儿视网膜病变的抗VEGF疗法临床指南》,就早产儿视网膜病变(retinopathy of prematurity,ROP)抗血管内皮生长因子(vascular endothelial growth factor,VEGF)治疗的相关问题进行了详细归纳[1]。该指南是目前已知唯一一个关于ROP抗VEGF治疗的指南,且日本与中国的人种相似度高,该指南对于中国的ROP实践具有重要的参考意义。本文对该指南进行解读,以期为中国眼科医生对ROP的认识和诊疗提供参考。
1 ROP
ROP是发生在早产低体质量儿的一种视网膜血管增生性病变,是全球儿童致盲的首位原因。

表1 ROP临床分类的关键指标关键临床指标分类及描述分区 Ⅰ区 以视盘为中心,视盘至黄斑的2倍长度为半径的圆形区域Ⅱ区以视盘为中心,视盘至鼻侧锯齿缘为半径的环形区域,不包含Ⅰ区后Ⅱ区∗ Ⅰ区外缘外2倍视盘直径宽度的环形区域Ⅲ区 Ⅱ区外颞侧剩余的新月形视网膜区域分期 0期∗ 不完全血管化1期 分界线2期 嵴3期 嵴上视网膜新生血管、纤维增生4期 部分视网膜脱离 4A 视网膜脱离不累及黄斑 4B 视网膜脱离累及黄斑5期 全视网膜脱离 5A∗ 开放漏斗 5B∗ 闭合漏斗 5C∗ 闭合漏斗+前节改变(虹膜粘连、前房变浅、角膜混浊等)附加病变后极部(Ⅰ区)视网膜血管的扩张(静脉)和迂曲(动脉) 注:∗:ICROP3中新增条目 ROP:早产儿视网膜病变
国际ROP分类体系有着重大的意义,它为全球ROP的诊断提供了一个统一、可比较的标准,也为ROP的治疗决策、预后观察及多中心合作奠定了基础。根据最新的国际ROP分类第3版(international classification of retinopathy of prematurity third edition,ICROP3)的描述,ROP的关键临床指标包括分区、分期、附加病变和附加前病变(表1)[2]。
1.1 分区
分区是对视网膜血管化程度和ROP病变进行定位描述的指标。以视盘为圆心、视盘和黄斑距离的2倍为半径划出的圆形区域是Ⅰ区;Ⅰ区外缘至鼻侧锯齿缘为半径的同心环状区域为Ⅱ区;Ⅱ区之外,双眼颞侧剩余的新月形区域为Ⅲ区(图1)。当病变跨多个区域时,以最后部病变所在的区域定义ROP的分区。
在ICROP3中强调了后Ⅱ区的概念,是指Ⅰ区外缘2个视盘直径所组成的同心环区域(图1橙色区域),此区域的ROP病变较其他2个区病变需要更多关注。

图1 ROP分区示意图 改编自ICROP3[2]
1.2 分期
分期是描述ROP病变严重程度的指标。存在无血管区,但在有/无血管的视网膜交界处无特殊病灶的状态被称为不完全血管化,也有研究者称之为0期ROP。1期ROP的标志性改变是已血管化和无血管化视网膜交界处出现平坦、灰白色的分界线。2期ROP则以嵴的形成为特征;嵴由分界线进化而来,是具有宽度和高度的三维结构,有时嵴后可见新生血管芽组成的爆米花样病变。3期ROP嵴上出现视网膜新生血管,嵴色泽发红,轮廓变得粗糙和参差不齐,可伴附近视网膜出血。4期ROP为部分视网膜脱离,不累及黄斑中心凹者为4A期,累及黄斑中心凹者为4B期。5期ROP为全视网膜脱离期,根据视网膜脱离的构型,可分为3个亚型:5A期为全视网膜脱离,视盘可见(开放漏斗);5B期为全视网膜脱离,视盘不可见(闭合漏斗);5C期为全视网膜脱离、视盘不可见,同时合并前节的结构改变,如虹膜粘连、前房变浅、角膜混浊等。
1.3 附加病变和附加前病变
附加病变是指在严重ROP中出现的后极部视网膜血管显著的迂曲和扩张,可以出现在ROP的任何阶段,其是ROP病变更具侵袭性和疾病快速进展的一项标志,通常也是决定开始ROP治疗的一个临床指标。
需要注意的是,从正常视网膜血管到严重的附加病变是一个连续的发展过程,目前,即使很有经验的儿童视网膜疾病专家之间对于附加病变的判读也可能存在差异。附加前病变被用来描述那些表现出上述特征,但并未达到附加病变诊断标准、程度较轻的病变。
2 ROP的治疗
2.1 ROP治疗的适应证
ROP治疗的目标是抑制玻璃体内异常新生血管生成,促进无血管视网膜的正常血管化,支持视网膜的神经和血管发育,改善视觉及系统发育预后。基于这个原则,目前大部分研究和临床实践的初次治疗适应证遵从ETROP试验的标准[3],即有以下任何一种ROP表现时,在72 h内治疗:(1)带有附加病变的Ⅰ区所有ROP;(2)不带有附加病变的Ⅰ区3期ROP;(3)带有附加病变的Ⅱ区3期ROP;(4)急进性后部型ROP(aggressive posterior ROP,AP-ROP)。其中在ICROP3中AP-ROP更名为急进性ROP(aggressive ROP,A-ROP),应尽可能迅速地治疗。

表2 ROP治疗模式的比较治疗模式优点缺点冷凝1.疗效确切,复发率较低2.在屈光间质混浊病例或资源受限地区有应用价值1.组织反应重,增生明显2.远期并发症多,视力预后差3.视网膜后极部病变治疗困难激光光凝1.疗效确切,复发率较低2.较冷凝组织反应更轻,视觉预后更好3.临床应用经验较多,仍是目前ROP治疗金标准1.对操作者技术和设备要求较高2.需患者屈光间质清晰、瞳孔可充分扩大3.操作侵入性较抗VEGF玻璃体内注射高,治疗后患者一般情况可能恶化4.光凝的瘢痕影响周边视野5.治疗后高度近视率升高抗VEGF玻璃体内注射1.组织损伤轻,操作简便快捷2.可较安全地治疗全身情况危重或屈光间质混浊患者3.特定病例具有不低于激光光凝治疗的疗效4.在急进性ROP、Ⅰ区病变的治疗复发率和不良解剖预后较激光光凝低5.可使部分病例的视网膜血管继续发育至原无血管区6.高度近视、弱视发生率较低1.复发率高且更无规律,需更严格、长期的随访2.全球大部分地区为超适应证使用3.可能使视网膜增生和牵拉性视网膜脱离发展加速4.周边视网膜可长期遗留无血管区域5.注射后短期内可能抑制循环血中VEGF水平,眼局部和全身并发症尚待长期观察玻璃体手术治疗充分解除视网膜牵引,对4、5期ROP是必要的治疗手段1.侵入性损伤大,需全身麻醉2.对术者、医疗资源要求最高3.此阶段总体解剖复位率及视功能预后较差 注:ROP:早产儿视网膜病变;VEGF:血管内皮生长因子
2.2 治疗模式选择
目前应用于急性期ROP(1~3期)的治疗方式包括冷凝(已少用)、激光光凝和抗VEGF药物玻璃体内注射;对于4期、5期及出现瘢痕收缩等并发症的ROP,玻璃体视网膜手术是必要的治疗手段。各治疗方法的优缺点比较见表2。
目前尚无选择ROP治疗方法的绝对标准。因此,要综合考虑各治疗方法的优缺点、本医疗机构的条件及随访计划,向家属充分说明后,才能选择个体化的最优疗法。
激光光凝治疗一直是ROP治疗的金标准。近年来研究证明VEGF在ROP的病理过程中起到关键作用,已有多项临床试验证实抗VEGF玻璃体内注射治疗ROP的有效性和安全性[4]。抗VEGF玻璃体内注射逐渐成为ROP的一线治疗方案。
2.3 抗VEGF治疗ROP的重要国际多中心临床试验
已应用于ROP的抗VEGF药物有贝伐单抗、雷珠单抗、阿柏西普、康柏西普,但其适应证、理想剂量、随访方案及长期的眼部及系统安全性等问题尚需在遵循一定共同规范的实践中进行更深入的临床研究和总结。
2.3.1BEAT-ROP[5]贝伐单抗治疗ROP中的新生血管威胁(The Bevacizumab Eliminates The Angiogenic Threat of ROP,BEAT-ROP)[5]研究是为了确定玻璃体内注射贝伐单抗在3期ROP中的疗效。该试验表明,Ⅰ区ROP中,贝伐单抗玻璃体内注射术后复发率低于激光光凝术,且对早产儿的侵袭性较小,治疗时间短。
2.3.2ETROP[3]在2004年,ETROP[3]试验的最终结果确定了激光光凝治疗对ROP早期干预的有效性,激光光凝治疗已被用作全世界治疗ROP的一线治疗。ETROP研究组还定义了需要治疗的Ⅰ型ROP(Ⅰ区伴有附加疾病的任何分期ROP;Ⅰ区3期ROP,有或无附加病变;Ⅱ区2期或3期ROP,伴附加病变)。
2.3.3RAINBOW[6]比较雷珠单抗与激光光凝治疗ROP的国际多中心临床试验Ranibizumab Compared With Laser Therapy for the Treatment of Infants Born Prematurely With Retinopathy of Prematurity(RAINBOW)研究[6]是2015—2017年进行的一项研究,比较了激光光凝和雷珠单抗玻璃体内注射治疗ROP的成功率。该研究纳入26个国家的87个中心,共入组225例病例,将患者随机分为雷珠单抗0.2 mg组、雷珠单抗0.1 mg组和激光光凝组。初次治疗双眼同时进行,初次治疗后如病变复发恶化,距首次治疗28 d以上者双眼可各追加2次同样的治疗;距首次治疗28 d以内者则选用其他补救治疗措施。治疗效果评价的主要标准:治疗开始后24周,双眼均无活动性ROP,也无视网膜的牵引和脱离等不良的解剖预后。各组约有90%的病例完成试验,各组患者的性别、人种、年龄(出生周数、治疗周数)以及ROP的分期无差别。该研究结果显示,雷珠单抗0.2 mg组、雷珠单抗0.1 mg组和激光光凝组治疗成功率分别为80.0%、75.0%和66.2%,总体比较差异无统计学意义。但是,如果加上雷珠单抗0.2 mg组治疗后20周因视网膜脱落出组的1例疗效良好患者,雷珠单抗0.2 mg组的治疗成功率高于激光光凝组,差异有统计学意义,所以推荐使用0.2 mg雷珠单抗。未发现因患者性别、人种、出生周数、治疗周数、ROP分期而产生的差异。
RAINBOW研究在之后的5年继续追踪了眼底的变化、视力及对全身的影响。目前,这些ROP临床试验眼部并发症与成人玻璃体内注射类似,有轻微结膜出血、视网膜出血等;全身并发症主要为早产儿固有的全身问题,如支气管、肺发育不良导致的呼吸窘迫等,未发现治疗本身导致的并发症。虽然有研究者推测玻璃体内注射的雷珠单抗会进入循环血液对全身产生影响,但是在玻璃体内注射雷珠单抗后第14天、第28天测定的血液中VEGF浓度并未见下降[1]。
3 抗VEGF药物选择、用法和用量
截至2020年10月,在欧洲和日本被批准用于治疗ROP的抗VEGF药物仅有雷珠单抗,剂量为单眼0.2 mg/次(0.02 ml)。另外,雷珠单抗有瓶装和预填充2种剂型,被批准用于ROP治疗的仅为瓶装制剂。目前,已有阿柏西普和康柏西普用于ROP治疗的病例系列报道,数据显示其安全性及有效性良好[7-8]。
4 玻璃体内注射方法和注意点
早产儿玻璃体内注射的方法与成人有所不同。在急性期,患儿如在新生儿重症监护室(neonatal intensive care unit,NICU)和新生儿恢复病房(growing care unit,GCU)住院,需要在保育箱中或手术室进行玻璃体内注射。麻醉方法包括助手对患儿进行身体制动结合滴眼液局部麻醉、新生儿科医生使用经静脉麻醉药、麻醉科在手术室进行的全身麻醉及管理等多种方法。注射时,可在NICU和GCU中搬入手术显微镜,根据保育箱内患儿头的位置调整显微镜的镜筒位置,或者使用双目放大镜等;如在手术室中,按照手术进行插管的固定和麻醉器的配置之后,进行头位调整。根据本单位设施的状况选择最合适的麻醉和注射方法。
4.1 玻璃体内注射方法
早产低体质量儿手术视野(面部、眼球)较小,睫状体平坦部未发育成熟,因此应在角膜缘向后1.0~1.5 mm处刺入注射针头。需要特别注意,如果像成人一样在角膜缘后3.0~4.0 mm穿刺注射,很有可能会穿透视网膜。另外,由于新生儿晶状体相对较大,因此应向下(平行视轴、朝向后方)入针。如果像治疗成人患者一样针尖垂直于眼球壁朝向眼球中央,就有穿透晶状体的危险(图2)。

图2 早产儿抗VEGF治疗玻璃体内注射方法与成人的比较[1] A:早产儿玻璃体内注射 自角巩缘后1.0~1.5 mm进针,平行视轴,朝向后方 B:成人玻璃体内注射 角巩缘后3.5~4.0 mm进针,朝向球心
4.2 玻璃体内注射前注意事项
关于术中应用药剂(消毒液、局部麻醉药和扩瞳药等)可能存在变态反应的问题,应事先与儿科和麻醉科等其他科室医生进行讨论。
4.3 玻璃体内注射程序
(1)治疗前扩瞳药、局部麻醉药点眼。(2)手术者及助手佩戴口罩,在滴眼液局部麻醉或经静脉全身麻醉下,助手用双手固定患儿的头部。(3)手术者术前行手部消毒并戴灭菌手套。(4)作为术前的最终检查,进行给药眼别和药剂的确认。(5)对患眼周围皮肤、眼睑缘、睫毛涂抹碘类消毒液,多余的液体用灭菌纱布擦拭,使患眼周围皮肤干燥。(6)于患眼结膜囊内点上稀释的碘类消毒用洗液,放置一段时间。(7)灭菌开睑器开患眼眼睑。(8)准备注射用注射器,进行给药量(0.02 ml)的确认以免过量给药。(9)玻璃体内注射时使用30 G的注射针。用灭菌镊子夹持固定结膜组织后,在角膜缘后1.0~1.5 mm处刺入,平行视轴、朝向后方入针以避免损伤晶状体。(10)小心拔出注射针头,为了防止药液逆流,最好用镊子夹持注射部位的结膜数秒,或者用灭菌棉棒进行压迫,如果眼球的夹持固定困难,则无需勉强进行。玻璃体内注射后,由于眼压上升,会产生角膜水肿。眼压的上升是一过性的,角膜水肿一般也会在短时间内恢复。
5 玻璃体内注射后随访观察的方法
玻璃体内注射后第1天、第3~4天,检查术眼有无眼内炎等不良现象,观察视网膜病变的活动性是否降低。即使术眼视网膜病变静止,也必须定期进行眼底检查。RAINBOW研究[6]中,31%患眼需要再次治疗,再治疗时间为给药后4~16周(中位数为8周)。因此,指南推荐抗VEGF注射治疗后每周进行1次眼底检查,直到给药后16周。A-ROP单独使用抗VEGF治疗,75.0%~87.5%的患儿需要追加治疗。个别患儿在给药后1~3周(早期)复发,需要进行更频繁的眼底检查。由于给药推荐中雷珠单抗的再次给药时间间隔为1个月,早期复发的患眼通常需要追加视网膜激光光凝治疗;即使联用视网膜激光光凝,在给药后3~4个月(后期)也可能会引起视网膜缺血,也有患眼会因视网膜急剧纤维收缩而发生牵拉性视网膜脱离(图3)。多中心回顾性研究显示抗VEGF治疗后的牵拉性视网膜脱离发生在给药后4~335 d,因此如果视网膜血管没有正常发展到眼底周边部,最好在给药后1年内定期进行详细的眼底检查。
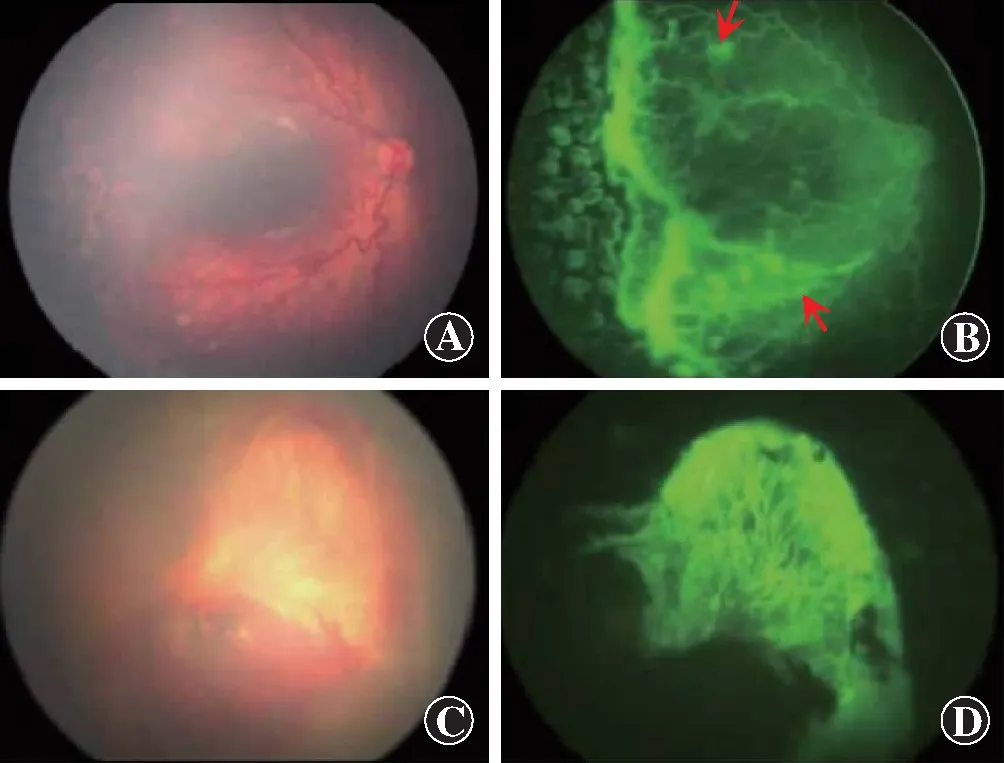
图3 一例贝伐单抗玻璃体内注射后15周复发的ROP患儿眼底情况[1] 患儿出生胎龄22周,出生体质量390 g,矫正胎龄30周时行玻璃体内注射贝伐单抗,之后追加视网膜光凝治疗。玻璃体内注射贝伐单抗后15周,双眼视网膜血管再增生,行玻璃体切割手术 A:患儿右眼彩色眼底照相 颞侧视网膜激光瘢痕上视网膜血管增生复发,血管显著扩张、迂曲 B:患儿右眼眼底荧光造影图 视网膜血管再增生不仅发生在激光瘢痕上,还发生在后部的视网膜血管上(箭头所示) C:患儿左眼彩色眼底照相 发生显著的视网膜血管再增生,包括视盘在内的后极部整体被增生组织覆盖 D:患儿左眼眼底荧光造影图 在增生组织中可以看到明显的新生血管和荧光素钠渗漏,而在后极部的其他有血管区域中血管不显影,提示血流被增生组织阻断而形成缺血(图片引自Miwa Shoten出版的《早产儿视网膜病变》图7-7)
6 ROP复发再治疗标准
对于ROP的复发,应特别关注附加病变(2个象限以上的视网膜血管扩张和迂曲)的再次出现,按照ETROP研究的治疗标准进行追加治疗(图4),眼底荧光造影对明确有无视网膜新生血管及其范围很有帮助。
考虑到对全身的可能影响,RAINBOW研究[6]建议雷珠单抗再次治疗的时间间隔为1个月以上。因此,在A-ROP和Ⅰ区ROP中,出现初次抗VEGF治疗后纤维血管组织增生充血、视网膜血管扩张迂曲、残存异常血管吻合及视网膜血管的活动性不降低的情况,应早期联合激光光凝治疗。对于纤维增生膜广泛且牵拉性视网膜脱离范围较广的患儿,应选择玻璃体切割手术。
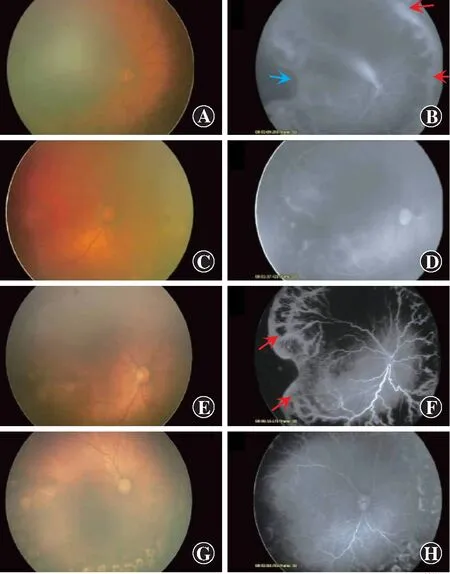
图4 一例玻璃体内注射雷珠单抗后复发进行再次用药的ROP患儿眼底情况[1] 患儿出生胎龄23周,体质量390 g,右眼矫正胎龄33周时变为Ⅰ区附加病变,行视网膜激光光凝治疗。2周后,视网膜的活动性病变未见降低,因此首次注射了雷珠单抗0.25 mg A:雷珠单抗给药前彩色眼底照相 视网膜血管扩张、弯曲 B:雷珠单抗给药前荧光素眼底血管造影图 新生血管处大量荧光素钠渗漏(箭头),黄斑部颞侧视网膜血管弯曲(箭头) C:雷珠单抗玻璃体内注射后1周彩色眼底照相 视网膜血管的扩张、迂曲改善 D:雷珠单抗玻璃体内注射后1周荧光素眼底血管造影图 新生血管的荧光素钠渗漏减轻 E:雷珠单抗玻璃体内注射后4周彩色眼底照相 视网膜血管的扩张、迂曲加重,确认为ROP的复发 F:雷珠单抗玻璃体内注射后4周荧光素眼底血管造影图 新生血管的荧光素钠渗漏增加(箭头) G:再次雷珠单抗玻璃体内注射后4周彩色眼底照相 视网膜血管的扩张、迂曲改善,无需再治疗 H:再次雷珠单抗玻璃体内注射后4周荧光素眼底血管造影图 新生血管消失,颞侧的视网膜血管也消失(图片引自Miwa Shoten出版的《早产儿视网膜病变》图7-5)
7 相关问题探讨
7.1 不适合玻璃体内注射的ROP病例
血管活动性高且与广泛纤维增生同时存在的情况下,抗VEGF治疗后易发生增生膜收缩,导致牵拉性视网膜脱离发生或加重,此时不宜单独进行抗VEGF药物玻璃体内注射(图5)。

图5 一例贝伐单抗玻璃体内注射后牵拉性视网膜脱离恶化患儿眼底情况[1] A、B:贝伐单抗玻璃体内注射前彩色眼底照相和荧光素眼底血管造影图 患眼上方、颞侧、下方有广泛充血的增生膜和牵拉性视网膜脱离(4A期),颞侧增生膜可见荧光素钠渗漏 C、D:贝伐单抗玻璃体内注射后第8天(玻璃体手术前)彩色眼底照相和和荧光素眼底血管造影图 颞侧增生膜充血减轻,但是纤维化加重(蓝箭头),牵拉性视网膜脱离继续进展,黄斑部视网膜脱离(白箭头)(4B期),颞侧增生膜可见荧光素钠渗漏(图片引自Miwa Shoten出版的《早产儿视网膜病变》图7-3)
7.2 视网膜激光光凝和抗VEGF的联合治疗
(1)在抗VEGF治疗后不满1个月病变复发的情况下,应联合视网膜激光光凝治疗。在A-ROP中,由于明显的晶状体血管膜和瞳孔强直,视网膜激光光凝难以实施;且患儿全身状态不良,难以耐受长时间的视网膜激光光凝治疗;A-ROP患儿需要光凝到Ⅰ区的后极部,因此有可能引起视野狭窄等,因而初次治疗选择抗VEGF疗法的病例很多。然而,单独使用抗VEGF药物不能使病变完全消退而短期复发的病例也很多。因此,抗VEGF治疗后需谨慎辨别视网膜病变的活动性,及时发现复发的征兆,并及时联合视网膜激光光凝治疗。(2)抗VEGF治疗后1个月以上病变复发时,可以联合视网膜激光光凝或再次使用抗VEGF治疗。如再次使用抗VEGF治疗,视网膜血管正常发展到眼底周边部之前,有必要继续进行频繁的眼底检查。(3)在初次治疗选择视网膜激光光凝的情况下,对于没有好转或复发的病例,虽然可追加视网膜激光光凝,但是对于活动性高的重症病例有时会辅助性地使用抗VEGF疗法。如前所述,对于视网膜纤维增生膜的范围较广、产生视网膜脱离的病例,抗VEGF疗法并不适合。
7.3 贝伐单抗和雷珠单抗的功效差异
雷珠单抗的半衰期较贝伐单抗短,在给药第14天时,外周血中VEGF浓度即恢复正常,因此被认为对全身的影响较小;贝伐单抗治疗视网膜病变的复发率为0.0%~10.0%,低于雷珠单抗的20.8%~83.0%;复发时间也较早,贝伐珠单抗玻璃体内注射后复发时间为8.8~16.2周,长于雷珠单抗的5.9~8.3周。因此,雷珠单抗注射后需行更为早期而慎重的病程观察。另外,雷珠单抗和贝伐单抗单药治疗均难以有效治愈A-ROP,所以抗VEGF治疗后要尽早甄别,判断是否需联合行激光光凝或玻璃体切割手术。
7.4 雷珠单抗玻璃体内注射后的病程观察标准
根据ROP的类型和严重程度、患儿的全身状态、本医疗中心的管理方案来综合决定。患儿出院后难以进行频繁随访的情况很多,很难明确应该以怎样的频率进行随诊观察。在给药后的1年内,最好每2周左右进行1次眼底检查,但在追加视网膜激光光凝治疗后,或视网膜血管发展到Ⅲ区的情况下,可以每2~3个月检查1次眼底。
对于A-ROP,给药后2~3周内需要每周进行2次眼底检查。即使联用视网膜激光光凝治疗,也会有后期复发的病例,所以给药后4个月内建议每周进行1次眼底检查,之后也以1~2周进行1次眼底检查的频率进行随访。
8 总结
ROP的抗VEGF治疗由于操作简单有效,近年来其临床应用的适应证症不断扩大。2013年ROP治疗共识认为对于Ⅰ区3期伴附加病变的ROP可以考虑行抗VEGF药物治疗[9]。目前普遍观点为对于Ⅰ区病变建议首次治疗时首选抗VEGF药物治疗;而Ⅲ区病变无需治疗。对于Ⅱ区1期ROP宜采用何种治疗模式,目前尚无统一意见。姜燕荣[10]的前期单中心大样本雷珠单抗玻璃体内注射治疗ROP的疗效观察结果显示,雷珠单抗玻璃体内注射治疗对于阈值病变和阈值前病变的Ⅱ区病变治疗效果优于Ⅰ区病变,且单次治疗有效率高。
Mintz-Hittner[11]研究认为,对于新生血管膜较多的3期病变、视网膜脱离的4期和5期病变,应用抗VEGF药物治疗应更加谨慎,4期和5期病变在玻璃体内注射抗VEGF药物降低血管活动性后,往往需立即行玻璃体切割术,在这些情况下,单独采用抗VEGF药物玻璃体内注射治疗并不适合。初次给药后不满1个月复发患儿的追加给药、眼部及附近组织存在明确感染的患儿抗VEGF药物治疗时也需慎重。此外,目前抗VEGF药物治疗ROP的前瞻性临床研究证据、患儿全身安全性的长期随访评估结果仍较缺乏,尚需谨慎选择适应证,并建议治疗后严密随访,组织开展科学设计的多中心随机对照临床研究,以获得抗VEGF治疗ROP在中国人群中的高等级证据[12]。
利益冲突所有作者均声明不存在利益冲突

