骨髓来源树突状细胞miR-338-3p对实验性自身免疫性葡萄膜炎Th17细胞活化的影响
杨超 韦燕凯 魏瑞华 粘红
天津医科大学眼科医院 天津医科大学眼视光学院 天津医科大学眼科研究所 国家眼耳鼻喉疾病临床医学研究中心天津市分中心 天津市视网膜功能与疾病重点实验室 300384
自身免疫性葡萄膜炎是一类易复发、难治性眼内炎性疾病,控制不当可导致视力损伤,甚至致盲[1]。实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)小鼠是自身免疫性葡萄膜炎的经典动物模型,其与人类葡萄膜炎在临床表现及分子机制上具有很大的相似性,在研究自身免疫性葡萄膜炎的发病机制中扮演重要角色[2]。目前研究认为Th17细胞、白细胞介素(interleukin,IL)-23/IL-17通路是自身免疫性葡萄膜炎发生的重要机制[3-6]。Th17细胞分化依赖于抗原提呈细胞的刺激和微环境中细胞因子的调控,而树突状细胞(dendritic cells,DCs)作为专职抗原提呈细胞,可诱导T细胞活化,同时分泌IL-6、IL-23和IL-1β等细胞因子,促进Th17细胞的增生分化[7-8]。微小RNA(microRNA,miRNA)是一类约22个核苷酸的短链非编码RNA,可以在转录后水平调控基因表达[9]。近年来,研究发现miRNA可以通过调控DCs影响Th17细胞的反应[10-12]。miR-338-3p是一种高度保守的miRNA,具有免疫调控作用[13-15]。然而,miR-338-3p对Th17细胞的调控作用尚未见报道。本课题组前期研究结果显示,miR-338-3p在EAU小鼠脾脏细胞中表达明显升高。进一步分析GSE144081数据集发现,miR-338-3p在DCs中的表达丰度明显高于CD4+T细胞。因此,本研究拟探讨骨髓来源DCs(bone marrow-derived DCs,BMDCs)中miR-338-3p对EAU IRBP1-20特异性Th17细胞活化的影响以及可能的分子机制。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级8~10周龄健康雌性C57BL/6J小鼠,体质量(20.1±1.3)g,购自北京维通利华实验动物技术有限公司。实验前排除眼部疾病及其他异常。实验动物的饲养及操作符合国家科学技术委员会《实验动物管理条例》的规定,并获得天津医科大学动物管理及使用委员会的批准(批文号:TJYY2019110117)。
1.1.2主要试剂及仪器 miR-338-3p拟似物、拟似物阴性对照、miR-338-3p 抑制剂、抑制剂阴性对照(上海吉玛生物科技有限公司);胎牛血清、RPMI-1640培养基(美国HyClone公司);重组小鼠粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、重组小鼠细胞因子IL-4、重组小鼠细胞因子IL-23和小鼠IL-17 ELISA试剂盒(美国R&D公司);IRBP1-20多肽片段、实时荧光定量PCR引物(上海生物工程股份有限公司);结核分枝杆菌H37RA(美国Difco公司);弗氏不完全佐剂(incomplete Freund adjuvant,IFA)、佛波醇12-十四酸酯13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)、布雷菲尔得菌素A(brefeldin A,BFA)、钙离子霉素(美国Sigma公司);固定剂、破膜剂、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的大鼠抗小鼠IL-17流式抗体(FITC-IL-17)、巯基化藻红蛋白(sulfhydryl phycoerythrin,PE)标记的大鼠抗小鼠γ干扰素(interferon-γ,IFN-γ)流式抗体(PE-IFN-γ)(美国Biolegend公司);Lipofectamine 2000、逆转录试剂盒、SYBR Green 2倍Master Mix(美国Thermo公司)。7900HTFAST 实时荧光定量PCR仪(爱普拜斯应用生物系统贸易上海有限公司);FACSCalibur流式细胞仪(美国BD公司)。
1.2 方法
1.2.1BMDCs的制备 断颈法处死小鼠,于无菌操作台分离出股骨和胫骨,置于含RPMI-1640培养基的皿中,用1 ml无菌注射器吸取RPMI-1640培养基反复冲洗骨髓腔,直至骨髓腔发白;将冲洗下来的骨髓细胞悬液经无菌棉花柱过滤,以除去残留的骨碎片及肌肉组织,滤液于4 ℃条件下,离心半径16.8 cm,1 264 r/min,离心8 min,弃去上清液,用含体积分数10%胎牛血清的RPMI-1640完全培养基重悬细胞;将细胞以1×106/ml密度接种于24孔板,加入终浓度10 ng/ml GM-CSF及IL-4诱导骨髓细胞向DCs分化;培养第3天半量换液,补充细胞因子,继续培养至第5天得到未成熟的BMDCs。
1.2.2EAU模型的建立及T细胞的提取 小鼠腹腔内注射350 ng百日咳毒素后2 h,于单后足和躯干部皮下注射100 μl含有150 μg IRBP1-20、0.8 mg结核分枝杆菌H37RA和IFA的乳化剂,建立EAU模型;于造模后第13天,断颈法处死小鼠,取脾脏及腘窝淋巴结研磨,将研磨液经棉花柱过滤得到脾脏及淋巴结单细胞悬液;将细胞悬液加入尼龙柱密封,于37 ℃培养箱中培养1 h后,用完全培养基冲洗尼龙柱,收集冲洗下的细胞悬液得到T细胞。
1.2.3BMDCs的转染及其与T细胞的共培养 收集诱导培养第5天的BMDCs,分为miR-338-3p拟似物转染组、拟似物阴性对照组、miR-338-3p抑制剂转染组和抑制剂阴性对照组;用RPMI-1640培养基分别将miR-338-3p拟似物、拟似物阴性对照、miR-338-3p抑制剂、抑制剂阴性对照及Lipofectamine 2000稀释,常温下孵育5 min,将miR-338-3p拟似物、拟似物阴性对照、miR-338-3p抑制剂和抑制剂阴性对照稀释液分别与Lipofectamine 2000稀释液混合,常温下静置20 min,分别加入各组BMDCs中,培养6 h后补充完全培养基;转染24 h,加入终质量浓度100 ng/ml的脂多糖刺激各组BMDCs,培养24 h后收集细胞,一部分BMDCs用于提取总RNA,另一部分BMDCs以1×105/孔分别接种于24孔板,在含有10 μg/ml IRBP1-20的完全培养基中与分离的脾脏及淋巴结T细胞共培养,并加入终质量浓度为20 ng/ml的IL-23(Th17细胞极化条件),培养48 h,收集培养上清液及细胞用于后续研究。
1.2.4ELISA法检测培养上清液中IL-17质量浓度 取各组共培养上清液,根据小鼠IL-17 ELISA试剂盒说明书检测IL-17质量浓度。取酶标板孔用IL-17捕获抗体常温包被过夜,封闭液常温封闭1 h;实验孔加入10倍稀释的样本100 μl,标准品孔加入梯度稀释的标准品100 μl,常温孵育2 h,弃去液体,清洗5次;每孔加入稀释的IL-17检测抗体100 μl,常温孵育2 h,弃去液体,清洗5次;每孔加入100 μl稀释的辣根过氧化物酶,常温孵育30 min,弃去液体,清洗5次;每孔加入100 μl四甲基联苯胺(tetramethylbenzidine,TMB)显色液,室温孵育10~20 min;每孔加50 μl终止液,测定450 nm处吸光度(A)值,用540 nm处A值进行校正;根据标准品浓度和A值绘制标准曲线,得出标准曲线直线回归方程,计算样本IL-17质量浓度。
1.2.5实时荧光定量PCR法检测BMDCs中miR-338-3p、IL-23、IL-1β、IL-6 mRNA和共培养细胞中IL-17、RORγt mRNA相对表达量 采用Trizol法提取miR-338-3p 拟似物转染组和拟似物阴性对照组BMDCs以及共培养细胞总RNA,按照逆转录试剂盒说明书逆转为cDNA,以cDNA为模板,各基因引物序列见表1,进行实时荧光定量PCR。PCR反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火及延伸1 min,40个循环。以GAPDH为内参照,用2-ΔΔCt法计算BMDCs中IL-23、IL-1β、IL-6 mRNA以及共培养细胞中IL-17、RORγt mRNA相对表达量。另取miR-338-3p拟似物转染组和拟似物阴性对照组BMDCs检测miR-338-3p相对表达量,反应条件为:95 ℃预变性3 min;95 ℃变性15 s,62 ℃退火及延伸40 s,40个循环。以U6为内参照,采用2-ΔΔCt法计算2个组BMDCs中miR-338-3p相对表达量。

表1 各基因PCR引物序列Table 1 Primer sequences for PCR基因引物序列(5’-3’)扩增长度(bp)IL-17F:CCTGGCGGCTACAGTGAAG57R:TTTGGACACGCTGAGCTTTGRORγtF:CCTCAGCGCCCTGTGTTTT58R:GCATGCAGCTTTTGCCTGTTIL-23F:CATAGCTGCCCGGGTCTTT57R:GGCACTAAGGGCTCAGTCAGAIL-1βF:AGTTGACGGACCCCAAAAGA57R:GGACAGCCCAGGTCAAAGGIL-6F:CCACGGCCTTCCCTACTTC61R:TTGGGAGTGGTATCCTCTGTGAGAPDHF:CATGGCCTTCCGTGTTCCTA55R:GCGGCACGTCAGATCCA 注:PCR:聚合酶链式反应;IL:白细胞介素;RORγt:维甲酸相关核孤儿受体γt;GAPDH:磷酸甘油醛脱氢酶;F:正向引物;R:反向引物 Note:PCR:polymerase chain reaction;IL:interleukin;RORγt:retinoic acid receptor-related orphan nuclear receptor γt;GAPDH:glyceraldehyde phosphated dehydrogenase;F:forward primer;R:reverse primer
1.2.6流式细胞仪检测共培养细胞中Th17细胞百分比 取收集的miR-338-3p拟似物转染组和拟似物阴性对照组细胞,用含有50 ng/ml PMA、1 μg/ml BFA和1 μg/ml钙离子霉素的RPMI-1640完全培养基于37 ℃、体积分数5% CO2培养箱中刺激4 h;更换为破膜固定液,于4 ℃条件下避光过夜;用2.4G2封闭细胞表面Fc受体;加入FITC-IL-17、PE-IFN-γ抗体,于4 ℃避光条件下孵育2 h;洗涤细胞,流式细胞仪检测IL-17+细胞百分比。
1.3统计学方法
采用GraphPad Prism 8.0.1统计学软件进行统计分析。测量指标的数据资料经Shapiro-Wilk检验证实呈正态分布,以mean±SD表示。各组间测量指标差异比较采用独立样本t检验。采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 拟似物阴性对照组与miR-338-3p拟似物转染组BMDCs中miR-338-3p相对表达量比较
实时荧光定量PCR结果显示,与拟似物阴性对照组相比,miR-338-3p拟似物转染组BMDCs中miR-338-3p相对表达量明显升高,差异有统计学意义(t=6.861,P=0.002)(表2)。

表2 2个组BMDCs中miR-338-3p相对表达量比较(mean±SD)Table 2 Comparison of relative expression level of miR-338-3pin BMDCs between the two groups (mean±SD)组别样本量miR-338-3p相对表达量拟似物阴性对照组31.00±0.03miR-338-3p拟似物转染组31 750.00±254.90t值6.861P值0.002 注:(独立样本t检验) BMDCs:骨髓来源树突状细胞;miR:微小RNA Note:(Independent samples t-test) BMDCs:bone marrow-derived dendritic cells;miR:microRNA
2.2 拟似物阴性对照组与miR-338-3p拟似物转染组共培养细胞中RORγt、IL-17 mRNA相对表达量比较
miR-338-3p拟似物转染组共培养细胞中RORγt、IL-17 mRNA相对表达量分别为1.34±0.16和1.33±0.16,明显高于拟似物阴性对照组的1.00±0.01和1.00±0.01,差异均有统计学意义(t=3.632,P=0.022;t=3.681,P=0.021)(图1)。
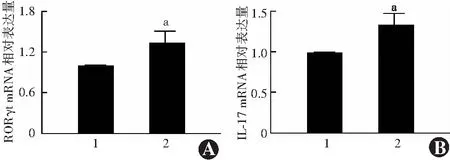
图1 拟似物阴性对照组与miR-338-3p拟似物转染组共培养细胞中RORγt、IL-17 mRNA相对表达量比较 A:各组RORγt mRNA相对表达量比较 B:各组IL-17 mRNA相对表达量比较 与拟似物阴性对照组相比,aP<0.05(独立样本t检验,n=3) 1:拟似物阴性对照组;2:miR-338-3p拟似物转染组 RORγt:维甲酸相关核孤儿受体γt;IL:白细胞介素Figure 1 Comparison of the relative expression levels of RORγt and IL-17 mRNA in co-cultured cells between the two groups A:RORγt B:IL-17 Compared with the mimics negative control group,aP<0.05 (Independent samples t-test,n=3) 1:mimics negative control group;2:miR-338-3p mimics transfection group RORγt:retinoic acid receptor-related orphan receptor-γt;IL:interleukin
2.3 各组细胞共培养上清液中IL-17质量浓度比较
miR-338-3p拟似物转染组共培养上清液中IL-17质量浓度为(5 941.00±452.40)pg/ml,明显高于拟似物阴性对照组的(4 299.00±348.30)pg/ml,差异有统计学意义(t=4.979,P=0.008)(图2);miR-338-3p抑制剂转染组共培养上清液中IL-17质量浓度为(3 092.00±200.90)pg/ml,明显低于抑制剂阴性对照组的(4 063.00±131.50)pg/ml,差异有统计学意义(t=7.005,P=0.002)(图3)。

图4 拟似物阴性对照组与miR-338-3p拟似物转染组共培养细胞中IL-17+细胞百分比比较 A:各组共培养细胞流式散点图 B:各组共培养细胞中IL-17+细胞百分比比较 与拟似物阴性对照组相比,aP<0.05(独立样本t检验,n=3) 1:拟似物阴性对照组;2:miR-338-3p拟似物转染组 IFN-γ:γ-干扰素;IL:白细胞介素Figure 4 Comparison of IL-17+cells percentage in the co-cultured cells between the two groups A:Flow cytometry scatter plots of the co-cultured cells in the two groups B:Comparison of IL-17+ cells percentage in the co-cultured cells between the two groups Compared with the mimics negative control group, aP<0.05 (Independent samples t-test,n=3) 1:mimics negative control group;2:miR-338-3p mimics transfection group IFN-γ:interferon-γ;IL:interleukin

图5 拟似物阴性对照组与miR-338-3p拟似物转染组BMDCs中IL-6、IL-23、IL-1β mRNA相对表达量比较 A:各组IL-6 mRNA相对表达量比较 B:各组IL-23 mRNA相对表达量比较 C:各组IL-1β mRNA相对表达量比较 与拟似物阴性对照组相比,aP<0.05(独立样本t检验,n=3) 1:拟似物阴性对照组 2:miR-338-3p拟似物转染组 IL:白细胞介素Figure 5 Comparison of the relative expression levels of IL-6,IL-23,IL-1β mRNA in BMDCs between the two groups A:IL-6 B:IL-23 C:IL-1β Compared with the mimics negative control group, aP<0.05 (Independent samples t-test,n=3) 1:mimics negative control group;2:miR-338-3p mimics transfection group IL:interleukin
2.4 拟似物阴性对照组和miR-338-3p拟似物转染组共培养细胞中IL-17+细胞百分比比较
miR-338-3p拟似物转染组共培养细胞中IL-17+细胞百分比为(8.03±1.35)%,明显高于拟似物阴性对照组的(4.52±0.73)%,差异有统计学意义(t=3.968,P=0.017)(图4)。
2.5 拟似物阴性对照组与miR-338-3p拟似物转染组BMDCs中IL-6、IL-23、IL-1β mRNA相对表达量比较
miR-338-3p拟似物转染组BMDCs中IL-6、IL-23、IL-1β mRNA相对表达量分别为2.23±0.21、2.21±0.56和2.32±0.43,明显高于拟似物阴性对照组的1.00±0.06、1.00±0.07和1.01±0.15,差异均有统计学意义(t=10.290,P=0.001;t=3.747,P=0.020;t=5.280,P=0.006)(图5)。
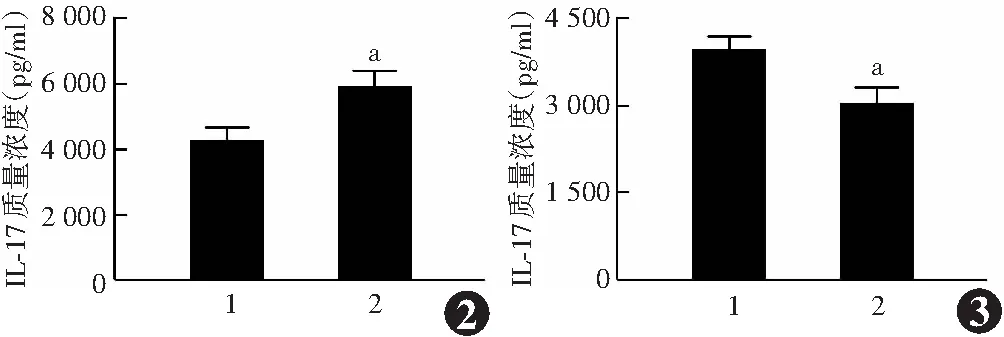
图2 拟似物阴性对照组和miR-338-3p拟似物转染组细胞共培养上清液中IL-17质量浓度比较 与拟似物阴性对照组相比,aP<0.01(独立样本t检验,n=3) 1:拟似物阴性对照组;2:miR-338-3p拟似物转染组 IL:白细胞介素 图3 抑制剂阴性对照组和miR-338-3p抑制剂转染组细胞共培养上清液中IL-17质量浓度的比较 与抑制剂阴性对照组相比,aP<0.01(独立样本t检验,n=3) 1:抑制剂阴性对照组;2:miR-338-3p抑制剂转染组 IL:白细胞介素Figure 2 Comparison of IL-17 concentration in co-cultured supernatant between the two groups Compared with the mimics negative control group, aP<0.01(Independent samples t-test,n=3) 1:mimics negative control group;2:miR-338-3p mimics transfection group IL:interleukin Figure 3 Comparison of IL-17 concentration in co-cultured supernatant between the two groups Compared with the inhibitor negative control group,aP<0.01 (Independent samples t-test,n=3) 1:inhibitor negative control group;2:miR-338-3p inhibitor transfection group IL:interleukin
3 讨论
Th17细胞是一类CD4+T细胞亚群,特异性表达转录因子RORγt,通过分泌IL-17等炎性细胞因子促进自身免疫性疾病的发生和发展[16-17]。研究表明,自身免疫性葡萄膜炎患者体内Th17细胞活性增强,血清中IL-17水平上升,靶向抑制Th17细胞可以缓解患者眼部炎症[18-20]。因此,深入研究Th17细胞的相关调控机制对自身免疫性葡萄膜炎的防治具有重要意义。目前多个研究团队揭示T细胞内源性通路影响Th17细胞反应[21-23],而来自固有免疫细胞的外源信号对Th17细胞活性的影响及机制尚不清楚。Ifergan等[10]研究表明,敲除miR-223的DCs中IL-6、IL-23和IL-1β分泌减少,导致CD4+T细胞向Th17细胞方向分化减少,从而缓解了实验性自身免疫性脑脊髓炎的症状,提示miRNA可以调控DCs介导的Th17细胞反应,参与自身免疫性疾病的发生和发展。本研究中观察了miR-338-3p对EAU中IRBP1-20特异性Th17细胞活化以及BMDCs促炎性细胞因子表达的影响,结果表明miR-338-3p可能通过促进BMDCs中IL-6、IL-1β和IL-23等基因的表达来增强IRBP1-20特异性Th17细胞中RORγt的表达及IL-17的产生。
编码miR-338-3p的基因位于凋亡相关酪氨酸激酶的第7个内含子中,最初发现其在中枢神经系统发育中发挥作用[24]。近年来,大量研究表明miR-338-3p在肿瘤的发生中扮演重要角色。miR-338-3p被证实在胃癌、骨肉瘤、卵巢癌等多种肿瘤组织中表达下调,且可以通过影响MAPK、PI3K/AKT等细胞内信号通路抑制肿瘤细胞的生长[25-27]。最近,miR-338-3p被证实在寻常型天疱疮、重症肌无力和肌萎缩侧索硬化症等多种自身免疫性疾病外周血单个核细胞中表达升高,并且与疾病严重程度相关[28-30]。此外,Xu等[15]的最新研究表明在寻常型天疱疮中,miR-338-3p可以通过靶向RUNX1来抑制FOXP3的表达,从而减少CD4+T细胞向调节性T细胞分化。然而,miR-338-3p在EAU中对Th17细胞的作用尚未见报道。本研究结果表明,miR-338-3p过表达的BMDCs能够促进Th17细胞中RORγt以及IL-17 mRNA表达,提示DCs中miR-338-3p可以促进IRBP1-20特异性Th17细胞反应。流式细胞术分析结果显示,miR-338-3p拟似物转染组细胞共培养中Th17细胞比例明显高于拟似物阴性对照组,进一步表明miR-338-3p过表达的BMDCs能够促进IRBP1-20特异性Th17细胞分化。此外,miR-338-3p拟似物转染组细胞共培养上清液中IL-17质量浓度明显高于拟似物阴性对照组,而miR-338-3p抑制剂转染组细胞共培养上清液中IL-17质量浓度较抑制剂阴性对照组明显降低,表明BMDCs中miR-338-3p能够正向调控IL-17蛋白水平的表达。以上结果均提示miR-338-3p可能参与EAU的发病。
Th17细胞的分化依赖于局部细胞因子环境。研究表明,IL-6可以抑制T细胞中Foxp3的表达,解除RORγt抑制,从而促进Th17细胞分化;IL-1β促进Th17细胞的早期分化;而IL-23维持Th17细胞的稳定,是产生致病性Th17细胞的关键细胞因子[31]。DCs是专职抗原提呈细胞,活化的DCs能够分泌IL-6、IL-23和IL-1β等多种细胞因子,指导CD4+T细胞亚群分化,调控抗原特异性免疫反应[32-33]。有研究表明,miRNA能够通过调控DCs促炎性或抑炎性细胞因子的分泌从而影响Th17细胞的活性[34]。例如,克罗恩病患者DCs中miR-29的减少导致IL-23水平升高,促进了Th17细胞中RORγt和IL-17 mRNA的表达[35]。此外,Kurowska-Stolarska等[12]研究表明miR-34a-/-DCs分泌IL-6、IL-1β、IL-23减少,导致抗原特异性Th17细胞产生减少,从而缓解了抗原诱导的关节炎。而miR-155过表达能够抑制DCs中IL-6、IL-1β的分泌,促进IL-10的表达,抑制白塞病患者CD4+T细胞中IL-17的产生[36]。本研究结果显示,与拟似物阴性对照组相比,转染miR-338-3p拟似物的BMDCs中IL-6、IL-1β和IL-23 mRNA的表达水平明显升高,表明miR-338-3p可能通过DCs创造了有利于Th17细胞活化的微环境。
综上所述,本研究结果表明miR-338-3p可能通过促进BMDCs分泌Th17细胞极化相关细胞因子来增强IRBP1-20特异性Th17细胞的活性,进而影响EAU的发生和发展。然而,本研究仅在体外探讨了BMDCs中miR-338-3p对Th17细胞的调控作用及部分机制,而在体环境复杂,DCs中miR-338-3p如何影响EAU中致病性Th17细胞的活化以及miR-338-3p是通过何种胞内通路影响Th17细胞的活性仍需进一步研究。
利益冲突所有作者均声明不存在利益冲突

