瑞德西韦对感染肠道病毒71 型的人横纹肌瘤细胞和ICR 乳鼠的抗病毒活性
任晓风, 闫赟政, 李 微, 李月香, 肖军海, 曹瑞源, 李永刚
(1.锦州医科大学基础医学院病原生物学教研室,辽宁 锦州 121000;2.军事科学院军事医学研究院毒物药物研究所,北京 100850)
肠道病毒71 型(enterovirus 71,EV71)属于小RNA 病毒科肠道病毒属,是一种无包膜的单股正链病毒[1]。EV71 是手足口病的主要病原体之一,也被认为是继脊髓灰质炎病毒后最强的嗜神经性肠道病毒[2-3]。婴幼儿感染后,可导致脑干脑炎、无菌性脑膜炎、急性弛缓性麻痹和神经源性肺水肿等多种神经系统疾病,严重者甚至死亡[4-5]。然而,目前针对所有的肠道病毒感染,临床尚无可用的抗病毒药物,亟需研发新型抗肠道病毒药物。核苷类似物类药物能够靶向病毒编码的聚合酶,是抗病毒药物研发的重要方向之一。瑞德西韦(remdesivir,RDV,GS-5734)是腺苷类似物的前药,2016年有研究[6]显示:RDV 能保护埃博拉病毒感染的恒河猴免于死亡,改善其症状,降低其病理损伤。在2014年西非埃博拉病毒疫情爆发期间,研究者[7]采用单克隆抗体和RDV 对1例感染者进行治疗的结果显示:患者迅速康复,且未观察到与药物相关的不良反应。RDV 能有效抑制多种冠状病毒[8-12]、副黏病毒[13-14]和黄病毒[15]等多种RNA病毒的复制,有望成为一种新型的广谱抗病毒药物。然而,RDV 对肠道病毒的药效学研究尚未得到充分开展,尤其是其在动物水平的有效性尚未见报道。本研究首先构建基于人横纹肌瘤(rhabdomyosarcoma,RD)细胞的抗病毒活性评价模型,对RDV 的广谱抗肠道病毒活性进行评价,并探讨其在RNA 和蛋白水平对EV71 的抑制效果,初步阐明其抗病毒作用的机制;其次,通过构建基于ICR 乳鼠的感染模型,探讨RDV 对小鼠生存保护和组织病毒载量变化的影响,为RDV 用于治疗EV71 感染提供依据。
1 材料与方法
1.1 细胞、病毒和实验动物 人RD 细胞购自美国模式培养物研究所( American Type Culture Collection ,ATCC)。EV71(H株)、肠道病毒D68 型(EVD68)株、柯萨奇病毒6型(CA6)(TW-2007-00141 株)和柯萨奇病毒16 型(CA16)(119 株)由军事科学院军事医学研究院毒物药物研究所保存。35只无特定病原体(SPF)1d龄ICR乳鼠购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006。
1.2 主要试剂和仪器RDV 购自上海科胜药物研发有限公司,NITD008(广谱的黄病毒[16]RdRp 抑制剂)购自美国MedChemExpress 公司,β-巯基乙醇(β -mercaptoethanol)和二甲基亚砜(dimethyl sulfoxide,DMSO)购自北京伊诺凯科技有限公司,胎牛血清(fetal bovine serum,FBS)、DMEM培养基、胰酶、磷酸盐缓冲液(phosphate buffered saline,PBS)和青霉素-链霉素购自美国Gibco 公司,TRIzol和羊抗鼠IgG(H+L)Alexa FluorTMPlus二抗购自美国Invitrogen 公司,RNeasy®Mini 试剂盒购自德国Qiagen 公司,One Step PrimeScriptTM实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)试剂盒购自日本TaKaRa 公司,BCA 蛋白定量试剂盒购自北京普利莱基因技术有限公司,EV71 VP1 一抗为厦门大学程通教授惠赠,Alpha Tubulin 单克隆抗体购自美国Abcam 公司,辣根酶标记山羊抗小鼠IgG 购自北京中杉金桥生物技术有限公司,CellTiter-Glo®Luminescent 细胞活力检测试剂购自北京Promega生物技术有限公司。多功能酶标仪购自美国Molecular Devices 公司,RT-qPCR仪购自美国Applied biosystems 公司,凝胶电泳仪购自美国Bio-Rad公司,转盘共聚焦活细胞成像系统购自美国PerkinElmer 公司,ADMET Predictor 8.5软件购自上海凡默谷信息技术有限公司。
1.3 细胞培养和动物饲养RD 细胞采用含有10%FBS 的DMEM 培养基培养于细胞培养箱(37℃、5%CO2)中,每3d传代1次。1d龄ICR乳鼠饲养于生物安全性小鼠饲养设施中。
1.4 RDV 细胞水平抗肠道病毒效率检测RD 细胞以1×105mL-1的密度接种于96孔板,每 孔100 μL,贴壁培养过夜;将其分为细胞对照组、病毒对照组和给药组。将含有不同浓度(0.005、0.015、0.046、0.137、0.410、1.230、3.700、11.110、33.330 和100.000 μmol·L-1)RDV的培养基加入给药组( 即0.005、0.015、0.046、0.137、0.410、1.230、3.700、11.110、33.330和100.000 μmol·L-1RDV组);给药组与病毒对照组RD 细胞中加入100 半数组织培养感染剂量(median tissue culture infective dose,TCID50)的EV71病毒液,72 h后采用CellTiter-Glo®Luminescent 检测试剂盒检测各组RD 细胞活性。药物细胞毒性实验:细胞接种密度同上,将其分为细胞对照组和给药组(不同浓度RDV组)。将上述含相同浓度RDV 的培养基加入给药组,培养30 和72h后,检测各组细胞活性。RDV 抗EVD68、CA6 和CA16 活性评价方法同上。RDV 抗病毒活性实验:给药组细胞存活率=(给药组活细胞数-病毒对照组活细胞数)/(细胞对照组活细胞数-病毒对照组活细胞数)×100%;药物毒性实验:给药组细胞存活率=给药组活细胞数/细胞对照组活细胞数×100%。以存活率代表细胞活性。采用Origin 9.0 软件拟合半数毒性浓度(50% cytotoxic concentration,CC50)和半数有效浓度(50%effective concentration,EC50),计算选择指数(selection index,SI)。SI=CC50/EC50。
1.5 RT-qPCR 法检测药物处理后细胞中病毒RNA 的表达水平RD 细胞以4×105mL-1的密度接种于12 孔板,每孔1 mL,贴壁培养过夜,感染复数(multiplicity of infection,MOI)=0.1,EV71病毒液感染细胞,给药组RD 细胞中加入不同浓度(0.03、0.10、0.30、0.80 和2.50 μmol·L-1)RDV,病毒对照组RD 细胞中加入含2% FBS 的DMEM培养基,在37℃共孵育,30 h时采用RNeasy®Mini 试剂盒收集细胞中RNA,RT-qPCR法检测各组RD 细胞中EV71 RNA 拷贝数。相关引物和探针序列:EV71-Forward primer,5′-CCAATCTCAGCGGCTTGGAG-3′,EV71-Reverse primer,5′ -CACTCAAGCTCTACCGG-CAC-3′,EV71-probe,5′6FAM-TCCAATCGAT-GGCTGCTCACCTGCGT-3′BHQ1。反应条件: 42℃、25min,1个循环;95℃、3 min,1个循环;95℃、20 s,59℃、1 min,PCR 扩增,共40个循环。以EV71 RNA 拷贝数代表EV71 RNA 表达水平。
1.6 Western blotting 法检测药物处理后各组细胞中EV71 结构蛋白VP1表达量RD细胞以4×105mL-1的密度接种于12 孔板,每孔1 mL,贴壁培养过夜;MOI=0.1,EV71 病毒液感染细胞,给药组RD 细胞中加入不同浓度(0.03、0.10、0.30、0.80 和2.50 μmol·L-1)RDV,病毒对照组RD 细胞加入2%FBS 的DMEM,24h后收集细胞并加入适量裂解液,充分裂解细胞,离心,收取上清。将上清与上样缓冲液混合均匀,80℃加热10 min。将处理好的样品进行SDS-PAGE 凝胶电泳,采用湿转转膜法将蛋白转移至PVDF 膜上,5%BSA 在室温封闭1 h,加入相应稀释度的一抗,4℃过夜,TBST 洗涤3次,加入相应HRP 标记的二抗,室温孵育1.5 h,TBST 洗 涤3次,加 入Super ECL Plus 超敏发光液进行化学发光显色。定性观察目的蛋白表达量。
1.7 免疫荧光法检测药物处理后各组细胞中EV71 结构蛋白VP1表达RD 细胞以1×105mL-1的密度接种于96 孔板,每孔100 μL,贴壁培养过夜;MOI=0.1,EV71 病毒液感染细胞,给药组加入不同浓度(0.03、0.10、0.30、0.80 和2.50 μmol·L-1)RDV,病毒对照组加入含2%FBS 的DMEM培养基,在37℃孵 育30h后,采用4%甲醛固定30 min,PBS洗涤;加入Hoechst 33342 细胞核染料,37℃孵育0.5 h;采用0.1%Triton X-100 透化,PBS洗涤;采 用5%BSA 于37℃孵育0.5 h;加入相应稀释度的一抗,室温避光孵育2 h,加入5% BSA 洗涤。加入相应稀释度的Alexa FluorTMPlus 二抗,室温避光孵育1 h,弃液,PBS洗涤,荧光显微镜观察下EV71 结构蛋白VP1 的表达。
1.8 加药时序实验检测病毒感染不同阶段RD 细胞中EV71 RNA 表达水平RD 细胞以4×105mL-1的密度接种于12 孔板,每孔1 mL,贴壁培养过夜;按照加药时序实验策略进行加药,分为病毒对照组、0.08 μmol·L-1RDV组和3.00 μmol·L-1阳性对照药物NITD008组。30h时,采 用RNeasy®Mini Kit 收集细胞中RNA,RT-qPCR 法检测细胞中EV71 RNA拷贝数。以EV71 RNA 拷贝数代表EV71 RNA 表达水平。
1.9 RT-qPCR 法检测各组乳鼠各种组织中病毒载量将购买的35只SPF级1 d 龄ICR 子母鼠随机分为3组,分别为安慰剂组(给予2% Tween 80 ,n=12)、3.0 mg·kg-1RDV组(n=12)和1.5 mg·kg-1RDV组(n=11)。每组乳鼠经腹腔攻毒,每只5×103PFU,并于攻毒后4 h,分别给予安慰剂和相应药物处理,之后每天给药1次,连续给药2周,观察21 d,记录各组乳鼠的生存情况,绘制生存曲线。组织中病毒载量检测:于感染后3 d 处死乳鼠,取乳鼠脑、肺和肌肉组织匀浆,采用TRIzol 法提取总RNA,RT-qPCR 法检测各组织中EV71 RNA 拷贝数,以EV71 RNA 拷贝数代表相应组织中病毒载量。
1.10 RDV 血脑屏障渗透性检测将RDV 化学结构信息录入ADMET Predictor 8.5软件。选择pH=7的参数,运行生物药剂学性质模块,从定性和定量两方面预测该药血脑屏障渗透性。BBB-Filter 是定性预测化合物血脑屏障渗透性的参数,Log BB是定量预测化合物血脑屏障渗透性的参数。当BBB-Filter 预测结果为High,表示化合物容易透过血脑屏障;Low 表示化合物不易透过血脑屏障。当Log BB 预测结果大于-1 时,表示化合物的血脑屏障渗透性较高;反之,表示化合物的血脑屏障渗透性较低。
1.11 统计学分析采用GraphPad Prism 8.0.2 统计软件绘制RDV 对EV71、EVD68、CA6 和CA16的抗病毒作用和细胞毒性作用的曲线模式图。采用GraphPad Prism 8.0.2 统计软件进行统计学分析。各组细胞中EV71 RNA 拷贝数符合正态分布,以±s 表示,组间样本均数比较采用单因素方差分析。各组乳鼠生存率以百分率表示,组间生存率比较采用Log-rank 检验。各组小鼠脑、肺、肌肉组织中病毒载量均符合正分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 在安全浓度范围RDV 对EV71、CA6、EVD68和 CA16 的 EC50、CC50及SICellTiter-Glo®Luminescent 细胞活性检测试剂检测结果显示:RDV 在无毒浓度范围内,能有效抑制EV71、CA6、EVD68 和CA16的复制。RDV对EV71 的EC50为(0.05±0.01)μmol·L-1、CC50为(2.54±0.06)μmol·L-1、SI 为50.80;RDV 对CA6 的EC50为(0.14±0.06)μmol·L-1、CC50为(1.78±0.30)μmol·L-1、SI 为12.71;RDV 对EVD68 的EC50为(0.02±0.01)μmol·L-1、CC50为(1.12±0.02)μmol·L-1、SI 为56.00;RDV 对CA16 的EC50为(0.10±0.03)μmol·L-1、CC50为(1.89±0.48)μmol·L-1、SI 为18.90。见图1。

图1 CellTiter-Glo®Luminescent 细胞活性检测法检测RDV 抗多种肠道病毒的抑制效果和毒性Fig.1 Anti-enteroviruses inhibitions and cytotoxicities of RDV detected by CellTiter-Glo®Luminescent cell viability assay
2.2 各组RD 细胞毒性和RD 细胞中EV71 RNA 表达水平在实验浓度范围内,各浓度RDV 处理细胞后细胞活性比较差异无统计学意义(P>0.05),即各组细胞毒性比较差异无统计学意义(P>0.05)。将RDV 作用于EV71 感染的RD 细胞,30 h时收集样品,采用RT-qPCR 法检测细胞中EV71 RNA 表达水平结果显示:与病毒对照组比较,加药组(0.10、0.30、0.80 和2.50 μmol·L-1RDV组)RD 细胞中EV71 RNA 表达水平降低(P<0.05 或P<0.01),且呈浓度依赖关系,0.03 μmol·L-1RDV组RD 细胞中EV71 RNA 表达水平差异无统计学意义(P>0.05)。见图2。

图2 各组RD 细胞活性(A)和RD 细胞中EV71 RNA 表达水平(B)Fig.2 Viabilities of RD cells(A) and expression levels of EV71 RNA in RD cells(B) in various groups
2.3 各组RD 细胞中EV71 结构蛋白VP1 表达量与病毒对照组比较,给药组(0.10、0.30、0.80 和2.50 μmol·L-1RDV组)RD细胞 中EV71结构蛋白VP1 表达水平降低。见图3。免疫荧光检测结果显示: 与病毒对照组比较,0.80 和2.50 μmol·L-1RDV组RD细胞中EV71结构蛋白VP1表达量降低。见图4。
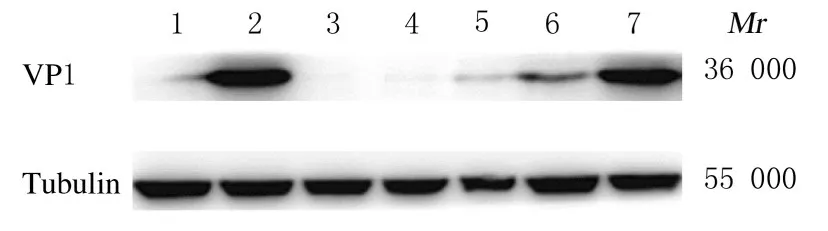
图3 Western blotting 法检测各组RD 细胞中EV71 结构蛋白VP1 表达电泳图Fig.3 Electrophoregram of expressions of EV71 structural protein VP1 in RD cells in various groups detected by Western blotting method
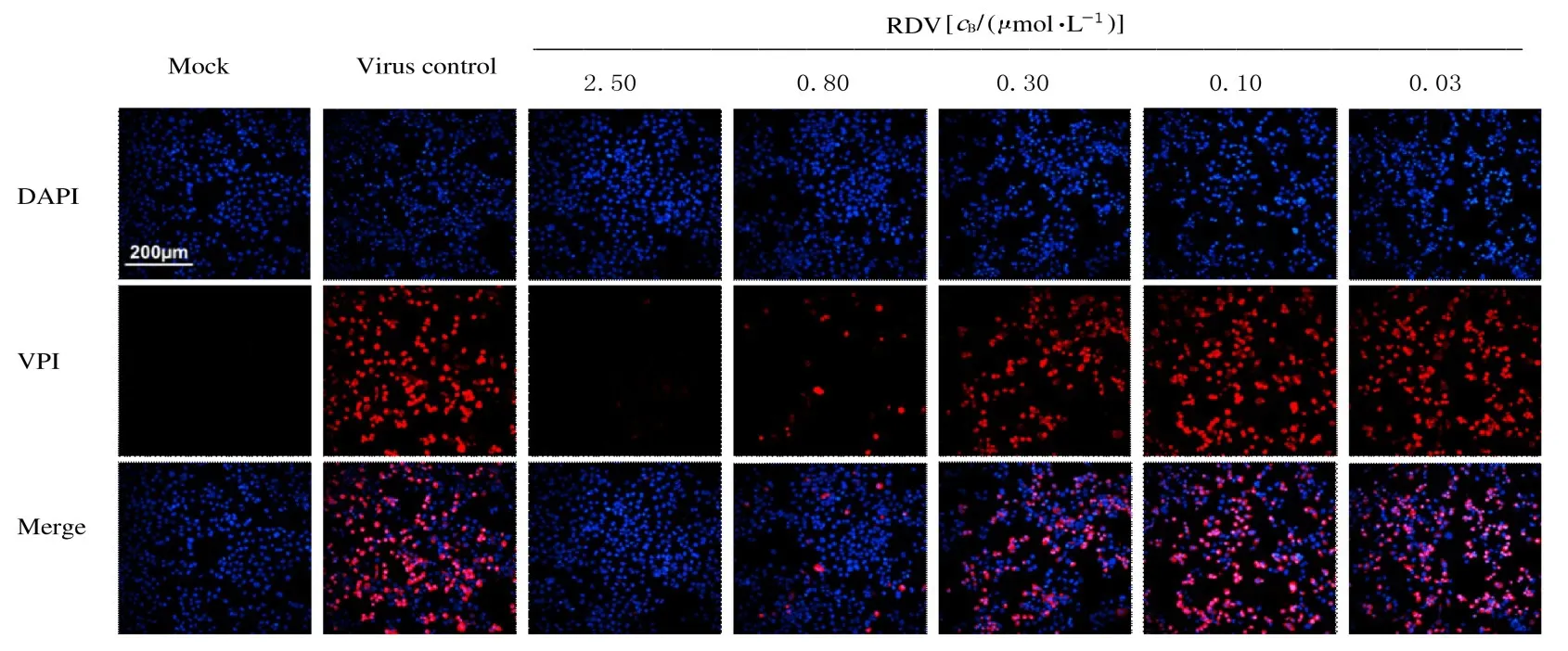
图4 各组EV71 感染RD 细胞中VP1 表达(免疫荧光,×10)Fig.4 Expressions of VP1 in RD cells infected with EV71 in various groups(Immunofluorescence,×10)
2.4 各组EV71 病毒RNA 拷贝数采用加药时序实验在病毒感染的不同阶段加入药物。加药时序实验的检测结果显示: 与病毒对照组比较,0.80 μmol·L-1RDV组在Ⅲ和Ⅳ阶段(病毒复制阶段)RD 细胞中EV71 RNA 拷贝数明显降低(P<0.05)。与病毒对照组比较,3.00 μmol·L-1阳性对照药物NITD008组在Ⅲ和Ⅳ阶段RD 细胞中EV71 RNA 拷贝数明显降低(P<0.05)。与病毒对照组比较,RDV 和阳性对照药物NITD008组在Ⅰ和Ⅱ阶段RD 细胞中EV71 RNA 拷贝数差异无统计学意义(P>0.05)。见图5。
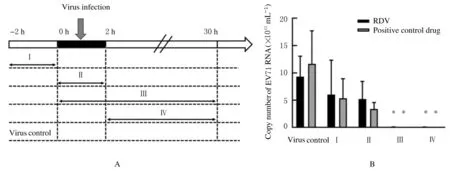
图5 加药时序实验策略(A)和RT-qPCR 法检测不同阶段各组RD 细胞中EV71 RNA 拷贝数(B)Fig.5 Strategy of time of drug addition assay(A) and copy numbers of EV71 RNA in RD cells in various groups at different stages detected by RT-qPCR method(B)
2.5 各组乳鼠生存率和不同组织中病毒载量采用每日给药1次的方式,连续给药14 d,观察21 d。与安慰剂组比较,1.5 和3.0 mg·kg-1RDV组乳鼠生存率有一定程度升高,但各组乳鼠生存率比较差异无统计学意义(P>0.05)。安慰剂组、1.5 和3.0 mg·kg-1RDV组乳鼠生存率分别为33%、55%及75%;与安慰剂组比较,1.5 和3.0 mg·kg-1RDV组乳鼠生存率分别提高了22% 及42% ;与1.5 mg·kg-1RDV组比较,3.0 mg·kg-1RDV组小鼠生存率增加了20%。见图6。

图6 各组乳鼠生存率Fig.6 Survival rates of sucking mice in various groups
为了进一步探讨生存保护不理想的原因,对不同组织中病毒载量进行分析。于病毒感染后第3天处死小鼠,采集新鲜组织样本,并检测脑、肺和肌肉组织中病毒载量。与安慰剂组比较,3.0 mg·kg-1RDV组乳鼠肺和肌肉组织中EV71 RNA拷贝数降低,即病毒载量明显降低(P<0.05或P<0.01),而脑组织中病毒载量差异无统计学意义(P>0.05)。见图7。
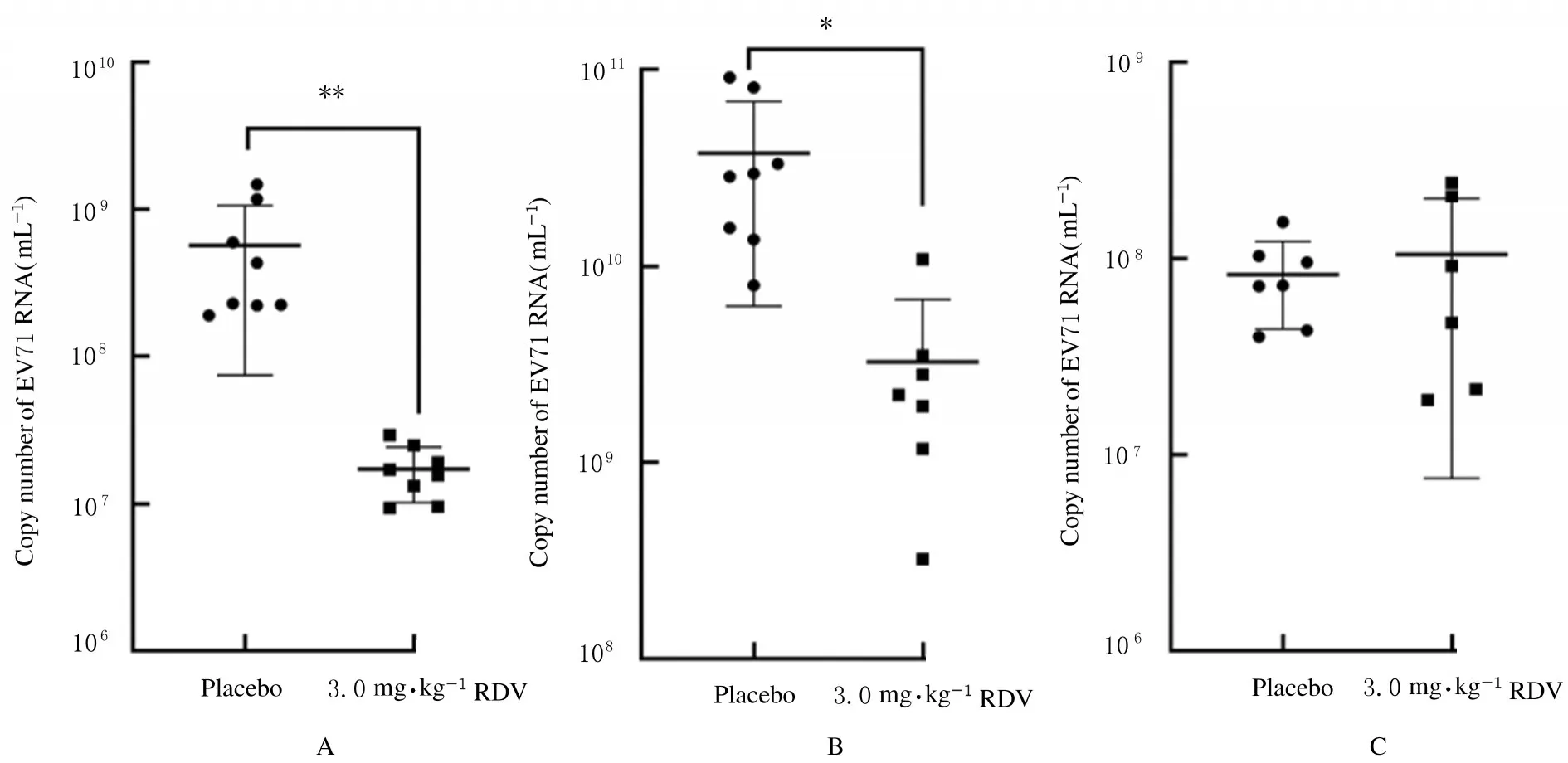
图7 RT-qPCR 法检测各组乳鼠不同组织中病毒载量Fig.7 Viral loads in different tissues of suckling mice in various groups detected by RT-qPCR assay
2.6 RDV 血脑屏障渗透性ADMET Predictor 8.5 软件预测结果显示: 定性预测结果为Low(43%),即RDV 不易透过血脑屏障;定量预测结果为Log BB=-1.637,Log BB 小于-0.1,说明RDV 的血脑屏障渗透性较低。
3 讨 论
自20 世纪70年代以来,EV71 在亚太地区呈周期性传播[17]。EV71 感染引起的神经系统疾病并发症成为亚太地区婴幼儿健康的重要公共卫生问题[18]。尽管EV71 的病原学特征、传播途径和流行病学特征已经明确,但目前尚无特异抗病毒药物可用。相关研究[8-11]显示:RDV 对多种冠状病毒具有良好的抗病毒活性。目前,该药已相继在多个国家和地区被有条件地批准用于治疗新冠肺炎患者[12]。作为一种广谱抗病毒药物,RDV 在此次新冠肺炎疫情中受到极大关注。本研究构建基于细胞水平抗肠道病毒药物评价模型,发现在RD 细胞中,RDV 在低微摩尔水平对EV71、CA6、EVD68和CA16 等多种肠道病毒具有良好的抗病毒活性。本研究采用RT-qPCR、Western blotting 和免疫荧光等多种检测方法,从EV71 RNA 水平和蛋白水平证实了RDV 的细胞水平抗肠道病毒活性。本研究结果表明:RDV 以浓度依赖性的方式抑制细胞中病毒RNA 的复制和病毒结构蛋白VP1 的表达。
为探讨RDV 抗肠道病毒的具体作用阶段,采用加药时序实验进行抗病毒机制的确证。初步分析结果表明:提前加入(Ⅰ阶段)RDV 处理并不能阻止病毒感染RD 细胞;EV71 感染后2h内(Ⅱ阶段),加入RDV 处理也无法抑制EV71 病毒基因组复制;而EV71 感染后2 h(Ⅲ和Ⅳ阶段),加入RDV能明显抑制病毒RNA表达,表 明RDV 在EV71 进入细胞后的复制阶段发挥抗病毒作用。在加药时序实验中,本研究采用另一种公认的广谱抗病毒核苷类似物NITD008 作为阳性对照药物,进一步确保了研究结果的可靠性。RDV 作为一种腺苷类小分子药物,在细胞中被代谢为活性的三磷酸形式,研究[19-22]显示:RDV 通过靶向多种病毒基因组编码的RNA 依赖的RNA 聚合酶(RNAdependent RNA polymerase,RdRp)发挥抗病毒作用。
在抗EV71 动物药效学研究方面,本研究以1 d龄ICR 乳鼠为研究对象,于感染EV71 后4 h,给予不同剂量的RDV,之后每天给药1次,连续给药14 d,观察21 d,记录小鼠的生存率,结果显示:与病毒对照组比较,每天给药1次,不同剂量RDV组小鼠生存率均有一定改善,3.0 mg·kg-1RDV组小鼠生存率最高。
在动物实验中,从生存率角度,未能观察到RDV 有明显疗效。为进一步探讨生存保护不理想的原因,本研究对不同组织的病毒载量水平进行了分析,结果显示:3.0 mg·kg-1RDV组小鼠肺和肌肉组织中病毒载量明显降低,而脑组织中病毒载量未见明显降低。在1 d 龄ICR 乳鼠感染模型中,乳鼠在发病死亡的过程中表现出瘫痪、震颤和萎靡等神经症状,提示病毒性脑炎是感染小鼠发病和死亡的关键。本研究结果显示:小鼠脑组织中病毒载量在给药后未降低,提示药物的血脑屏障通透性可能限制了其药效学活性。为了对此假说进行验证,本研究采用ADMET 预测软件对RDV 的血脑屏障通透性进行了预测,定性和定量结果均显示:RDV的血脑屏障通透性低。结合脑组织病毒载量未降低的现象提示RDV 的血脑屏障通透性限制了其药效学活性。
综上所述,RDV 是一种有潜力的广谱抗肠道病毒药物,能有效抑制EV71 RNA 复制和病毒蛋白的表达,其作用于病毒进入细胞后的复制阶段。抗EV71 药效学研究提示:各剂量RDV组小鼠的存活率均有一定提高;进一步研究显示:RDV 能够有效降低小鼠除脑部组织之外的其他组织中病毒载量,提示制约RDV 抗肠道病毒效果的因素可能与其低血脑屏障通透性相关,本研究结果为未来基于RDV 的抗肠道病毒药物研发提供了依据。

