绿僵菌mad2敲除株构建及其生物学和诱导植物响应的功能分析
蔡霓,闫多子,农向群,王广君,涂雄兵,张泽华
绿僵菌2敲除株构建及其生物学和诱导植物响应的功能分析
蔡霓,闫多子,农向群,王广君,涂雄兵,张泽华
中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193
【目的】昆虫病原真菌绿僵菌兼具植物内生性。已知黏附素MAD2是绿僵菌两种黏附蛋白之一,在实现绿僵菌与植物的黏附、定殖中起重要作用,但其作用机理知之甚少。本研究通过构建金龟子绿僵菌()2敲除突变株(Δ2),探究MAD2蛋白对绿僵菌生物学功能的影响。【方法】从NCBI中获取2前后基因组DNA序列,设计扩增2前后同源臂特异性引物,以绿僵菌基因组DNA为模板,扩增得到前后同源臂基因S1、S2;设计特异性引物Hyg-F/R,以pKH-KO载体为模板,扩增得到带有启动子序列的潮霉素基因;再通过overlap PCR构建2的同源敲除盒S1H、S2H;最后利用PEG介导的原生质体转化,获得稳定遗传的2敲除株。通过对比敲除株与野生株(WT)的生长特性、黏附作用、杀虫毒力以及诱导花生共生基因转录水平的变化,分析MAD2蛋白的生物学功能。【结果】原生质体转化获得了敲除2的同源重组转化子;敲除株与野生株对比分析表明,敲除株的孢子萌发率显著低于野生株,萌发中时间比野生株延长5.47 h;培养12 h和14 h时,敲除株的菌丝长度显著均小于野生株,分别为野生株的77.8%和76.3%;培养12 d的产孢量也比野生株减少33.3%。敲除株对洋葱内表皮的黏附力明显降低,但对蝗虫后翅的黏附性无显著影响。敲除2并不影响绿僵菌对家蚕的毒力。敲除株处理花生12 h后,与野生株处理相比,花生共生受体、钙信号解码相关基因(、和)、脂质氮素转运相关基因(1、24、2)的转录水平出现显著下调;而与空白对照相比2缺失后转录水平仍有一定的上调和的转录水平产生显著抑制对2124的转录无明显影响。【结论】金龟子绿僵菌黏附素MAD2影响菌株的孢子萌发、早期菌丝生长、产孢及对植物的黏附力,但对昆虫的黏附和杀虫毒力无影响;在菌株与花生互作早期,MAD2触发了花生共生基因的转录。
金龟子绿僵菌;黏附素MAD2;基因敲除;黏附性;杀虫毒力;生长特性
0 引言
【研究意义】金龟子绿僵菌()是一种重要的昆虫病原真菌,在自然界中广泛分布,兼具昆虫寄生、土壤腐生和植物内生的生活方式[1-2]。近年的研究证明绿僵菌能与植物建立内共生关系[3],并参与调节植物的生长抗逆和病害持续防控[4-6],但共生建立过程并不清楚。黏附素2(MAD2)被报道与绿僵菌黏附植物有关[7],研究MAD2对绿僵菌生物学的影响以及在调控绿僵菌与植物互作中发挥的作用具有重要意义。【前人研究进展】真菌与植物共生的建立是二者相互作用的过程,黏附是互作的早期阶段。黏附包括表面附着和分泌黏附物质固着等进程,微生物的黏附物质对特定宿主物种的识别和结合有高度特异性[8]。目前已发现绿僵菌有两种黏附蛋白,黏附素1(MAD1)和黏附素2(MAD2)。比较两种黏附素基因在不同种类和株系的绿僵菌中核苷酸序列保守性,发现2相对于1有较大的进化差异[7],MAD2由306个氨基酸组成,有3个主要结构域,结构类似于白色念珠菌(s)的细胞壁ALS(agglutinin-like sequence)蛋白[9]。相对于MAD1对昆虫表皮的黏附作用,MAD2是支持绿僵菌黏附植物的重要物质,并且在植物提取物处理绿僵菌后,2在4 h和12 h表达显著上调[10],说明2的进化更有可能是绿僵菌适应植物的重要因素。近期研究发现MAD1蛋白处理的花生()根6 h时已激活膜受体基因和,并抑制花生免疫级联基因、、及防御相关基因、的表达,推测MAD1抑制免疫有助于绿僵菌在花生根组织上定殖[11]。有关绿僵菌施用后调节植物对微量元素的吸收、促进植物生长和增强植物抗性的报道很多,例如,将棕色绿僵菌()应用于土壤,可以改善高粱()对铁的吸收并促进其生长[4];在马铃薯()植株上施用棕色绿僵菌后,马铃薯生物量和植株磷含量显著增加[12]。对同位素15N的追踪发现,罗伯茨绿僵菌()通过菜豆()和柳枝稷()内共生将昆虫体内的氮转移到植物中,而绿僵菌定殖后,植物也将光合作用产物提供给绿僵菌[13-15]。与未施用绿僵菌的植物相比,绿僵菌定殖后的菜豆侧根和根毛形成数量显著增加,但缺失2的绿僵菌处理植物后,根毛增殖的时间较野生株处理显著延长[16]。在大豆()中应用金龟子绿僵菌LHL07后,植株的大豆异黄酮含量显著提高,抗非生物胁迫的能力显著增强[5],而用不同种的绿僵菌处理玉米()后,发现绿僵菌影响玉米早期的营养生长,使植株能够较早地建立对生物和非生物胁迫的抗性优势,增加生长量,而这种促进作用在施用绿僵菌2敲除株时消失[17]。很多学者还通过不同方法证实绿僵菌能定殖植物根部。从菜豆植株的不同部位进行真菌分离,发现绿僵菌在植物根部被分离出来[18]。利用乳酚棉兰染色,显示罗伯茨绿僵菌以菌丝聚集的形式存在于柳枝稷根皮层细胞内和细胞间隙之间[16],另外利用以增强型绿色荧光蛋白(enhanced green fluorescent protein,eGFP)标记的金龟子绿僵菌处理玉米,14 d后发现,根内有沿细胞延伸的菌丝[19]。这些都证实绿僵菌的植物内生性,但有关绿僵菌定殖植物的过程和机理极少阐述,MAD2在绿僵菌定殖植物过程中发挥的作用并不清楚。【本研究切入点】前期对绿僵菌处理花生根的转录组进行了分析,发现共生建立相关的基因有差异响应[20]。本文在绿僵菌影响花生共生基因表达的基础上,对2缺失后绿僵菌菌株的生长特性、毒力,以及对花生根共生相关基因的影响进行研究。【拟解决的关键问题】利用同源重组的方法构建2缺失突变株,探究2在绿僵菌生长以及植物定殖中的作用,为研究与利用2以及绿僵菌的改良提供生物材料和相关功能数据。
1 材料与方法
试验于2019—2020年在中国农业科学院植物保
护研究所植物病虫害生物学国家重点实验室完成。
1.1 供试生物材料
金龟子绿僵菌Ma9菌株为本实验室保存的潮霉素敏感菌株,添加1%酵母浸出粉的PDA为适用培养基。基因敲除载体pKH-KO含带有启动子序列的潮霉素抗性基因,由中国农业科学院植物保护研究所李梅研究员惠赠。家蚕()4龄幼虫由山东青州广通蚕农场室内饲养,用于菌株生物测定。东亚飞蝗()为本实验室饲养,取后翅用于菌株对昆虫黏附能力测定。洋葱从超市购买,取内表皮用于菌株对植物黏附能力测定。花生‘鲁花11’品系,从农资商店采购种子,室内种植,14日龄幼苗用于2敲除株(Δ2)与野生株(wild-type,WT)对花生根处理,检测共生相关基因差异响应。
1.2 mad2敲除盒的构建
1.2.1 菌丝体培养和总DNA提取 将新培养的孢子用0.05%的无菌Tween-80配制成孢子悬浮液,通过血球计数板计数后吸取适量接种于200 mL产菌丝培养基(1 L ddH2O中含MgSO42 g,蔗糖20 g,酵母粉10 g,K2HPO45 g),至终浓度1×106孢子/mL,28℃培养3 d。菌丝通过真空泵抽滤,并用100 mL无菌水淋洗两次,抽干后收集菌丝体,放入液氮中速冻。利用Plant Genomic DNA purification Kit试剂盒(Genemark生物技术有限公司)提取绿僵菌的基因组DNA。
1.2.2和2前后同源臂的克隆 设计的5对特异性引物见表1。以引物对mad2 S1-F/R、mad2 S2-F/R分别对Ma9基因组DNA进行PCR扩增;以引物对Hyg-F/R对载体pKH-KO进行PCR扩增。依照Takara公司PCR高保真扩增酶说明书配制反应体系,反应温度为95℃ 5 min,95℃ 30 s,55℃ 30 s,72℃ 1.5 min,4℃保温,循环35次。PCR产物经1%琼脂糖凝胶电泳检测后,用PCR产物纯化回收试剂盒(Biomed公司)回收,获得同源前臂S1、同源后臂S2和带启动子Ptrpc序列的。参考徐芳等[21]使用overlap PCR进行序列拼接,最终获得同源前臂与潮霉素连接片段S1H,同源后臂与潮霉素连接片段S2H(图1)。

表1 载体构建及目标片段特异性引物
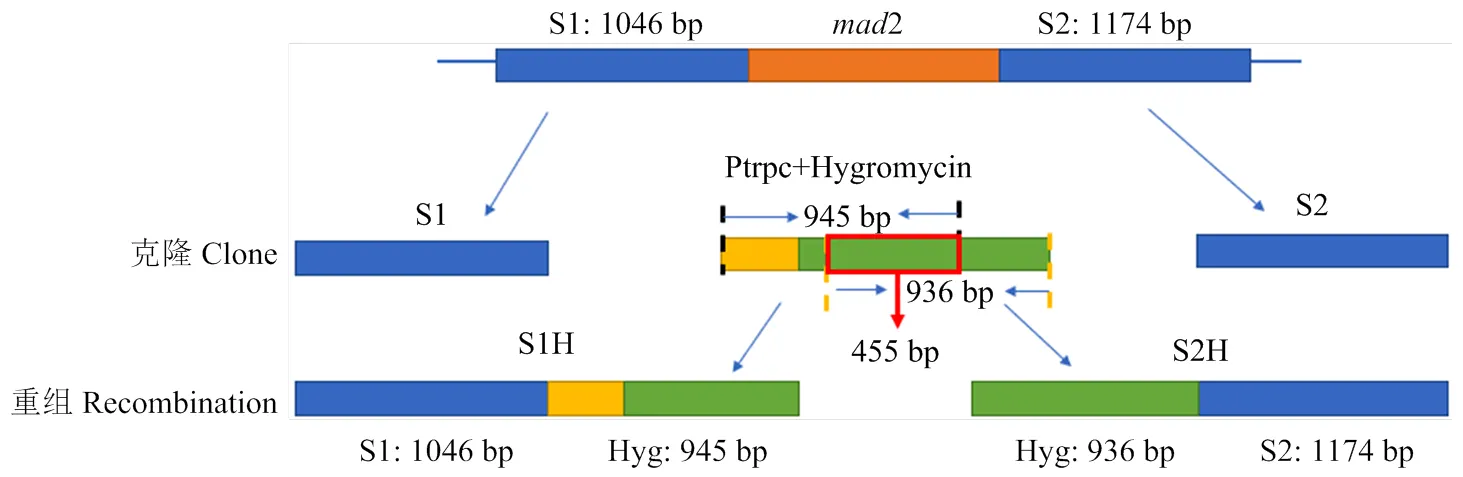
图1 敲除盒构建步骤
1.3 敲除盒转化绿僵菌原生质体
1.3.1 原生质体制备 菌丝体培养:接种金龟子绿僵菌Ma9孢子悬浮液3×108孢子于100 mL产菌丝培养基,27℃、180 r/min 振荡培养20 h,得幼嫩菌丝体。用Miracloth滤布(22—25 µm,北京诺博莱德科技有限公司)过滤,用10 mL 0.7 mol·L-1的NaCl溶液冲洗3次,收集菌丝。
菌丝的酶解:取0.1 g湿菌丝置于50 mL的离心管中,加入20 mL用0.7 mol·L-1NaCl配制的0.1%蜗牛酶液(北京博奥拓达科技有限公司),于30℃、80 r/min解离3 h。用Miracloth过滤除去残余菌丝,得到原生质体,并用20—30 mL 0.7 mol·L-1的NaCl溶液清洗两次。用STC缓冲液(蔗糖200 g,1 mol·L-1Tris-HCl(pH 8.0)50 mL,CaCl25.55 g,加ddH2O定容至1 L)重悬,离心清洗两次,将原生质体悬于600 µL STC buffer中,显微镜下计数,调终浓度至(2—5)×107个/mL。
1.3.2 原生质体转化及转化子检验 参照王晓玲等[22]CaC12-PEG介导原生质体转化法,将敲除盒S1H、S2H加入绿僵菌Ma9原生质体,与40% PEG 8000混合后在28℃孵育20 min。然后涂布在含低熔点琼脂糖的TB3(酵母提取物3 g,酶水解酪素3 g,蔗糖200 g,蒸馏水定容至1 L)固体培养基(含Amp浓度100 µg·mL-1,潮霉素浓度300 µg·mL-1)上,28℃恒温培养3 d,获得菌落为假定转化子。
参照上述1.2方法提取转化子基因组DNA,以潮霉素引物Hyg-F/R,及2敲除验证引物OUT-mad2- F/R进行PCR检验,判断确定转化成功的同源重组子,即2敲除株。
1.4 mad2敲除株黏附性验证
将金龟子绿僵菌Ma9野生株和敲除株接种于PDAY平板上,28℃培养14 d获得新鲜孢子粉,以0.05% Tween-20制备孢子悬浮液,经过血球计数板计数,将孢子浓度调整至1×107孢子/mL。参考刘艳微[23]的方法稍加改进,取蝗虫后翅和洋葱内表皮各3片,分别用37% H2O2杀菌5 min,置于直径5 cm含有10 mL孢子悬浮液的培养皿中,30 r/min振荡1 min,用无菌镊子夹取材料平铺于水琼脂培养基上,28℃培养8 h后,用0.05%的Tween-20 30 r/min振荡30 s以去除多余的分生孢子。处理的材料在光学显微镜下观察,每片计数5个视野的分生孢子数量,统计分析孢子的黏附性。
1.5 mad2敲除株的生物学测定
孢子萌发率测定:同前1.2.1配制野生株与敲除株分生孢子悬浮液,将浓度调整至1×106孢子/mL,分别吸取10 µL悬浮液,均匀涂布于直径5 cm、含有5 mL 1%的水琼脂培养基的培养皿中,28℃培养。分别在6、10、14、18、24、36 h观察孢子的萌发率。每次计数100个孢子,以出芽长度大于孢子长度1/2视为孢子已萌发,记录萌发数和未萌发数,每皿记录2组,记录3皿。计算分生孢子萌发率,萌发率(%)=(孢子萌发总数/镜检孢子总数)×100。
采用Excel 2010进行回归分析,得出绿僵菌孢子萌发率与萌发时间的回归直线方程和相关性,计算孢子萌发率达到50%所需时间,即萌发中时。
生长速率测定:在记录萌发率的同时,在10、12、14、18 h测定敲除株与野生株菌丝长度。在显微镜(重庆澳浦光电技术有限公司)下,将显微镜电脑显示器分辨率参数设置为5 440×3 648(27×18 cm显示框),将显微镜放大倍数调整至10×40,将视野调整清晰后进行视野捕获,使用软件中的测量工具对视野内孢子的长度(L)进行测量,随机选取5个视野,每个视野中孢子数不少于20个,对5个视野中的孢子长度分别取平均数。根据分辨率计算菌丝长度:菌丝长度(µm)=(27/5440)×L/400×102。
产孢量测定:参照蔡守平等[24]的方法并加以改进。同前1.2.1配置野生株与敲除株分生孢子悬浮液,并调整浓度至1×106孢子/mL,用微量移液器分别点滴接种10 µL于PSAY平板中央,各重复5皿。待培养12 d后菌落表面完全覆盖分生孢子,用直径5 mm的打孔器在菌落半径上距离菌落中心1/2处打取菌饼,每菌落按十字对称取4个菌饼,置于定量的0.1%的Tween-80无菌水中,振荡使孢子充分分散。用血球计数板测定孢子浓度并换算成单位面积(cm2)的产孢量,每皿血球计数板计数3次。
1.6 mad2敲除株的毒力测定
将4龄初的家蚕随机分配至无菌的生测筐中(长×宽×高=30 cm×12 cm×9 cm),每框30头,每个处理5个重复。分别收集同一时间培养的野生株与敲除株孢子粉,悬浮于无菌的0.05%的Tween-80水中,显微计数后将孢子浓度调整至5×108孢子/mL。将喷雾塔(Burkard Potter Precision Laboratory)气压调整至80 kpa,用0.05%的吐温水清洗3次,每次5 mL。每框试虫喷菌4 mL,空白对照(Control-0.05% Tween)喷4 mL无菌的0.05%的Tween-80。30 min后,每框加入桑叶20 g。每天记录家蚕死亡数,并补充足量桑叶,连续记录11 d,计算每天死亡率,并绘制死亡率柱状图。
1.7 mad2敲除株诱导花生共生基因响应分析
花生种子表面消毒参照Mayo等[25]的方法,于70%乙醇中浸泡1 min,无菌水冲洗3次,再用1%次氯酸钠溶液浸泡15 min,无菌水冲洗3次,完成消毒。将消毒后的种子置于含有50 mL ddH2O的直径为15 cm的培养皿中,并置于28℃黑暗培养箱中催芽24 h,挑选健康且萌芽一致的种子播种于装满灭菌蛭石的直径15 cm的花盆中,于培养室(L﹕D=14 h﹕10 h,28℃)培养,相对湿度为40%—60%。于花生生长第14天,分别向花生苗根部滴灌野生株与敲除株的分生孢子悬浮液(浓度为1.0×108孢子/mL),每株滴灌20 mL,对照(Control-0.1% Tween)为向植株根部滴灌0.1% Tween-80水溶液20 mL,每个处理重复3株。处理12 h后小心将根取出,将根部蛭石用蒸馏水冲洗去除干净蛭石基质,用吸水纸吸干表面,快速将根剪成5—8 mm小段,立即置于液氮中。同一处理不同的重复进行混样并分成3份,保存于-80℃备用。
取花生根样品,置于液氮中研磨,然后用TRIzol®分离试剂盒(Invitrogen)提取总RNA。用Prime ScriptTM1st strand cDNA synthesis kit反转录试剂盒(TaKaRa公司)进行RNA反转录,得到cDNA。并用NanoPhotometer微量分光光度计(IMPLEN,德国)检测浓度。
基于之前的转录组分析确定候选基因,设计的引物序列见表2,内参基因选用60S ribosomal protein L7()。用SYBR Green荧光定量试剂盒(TaKaRa公司)在7500型(ABI公司)实时荧光定量PCR系统进行反应。反应体系为2×SYBR Green Master Mix 10 µL,正反向引物各1 µL,cDNA 0.8 µL,补足ddH2O至20 µL。PCR扩增程序为95℃预变性2 min;95℃变性5 s,60℃复性30 s,40个循环。每样品3次技术重复,基因相对表达量采用2-ΔΔCt的方法进行分析。
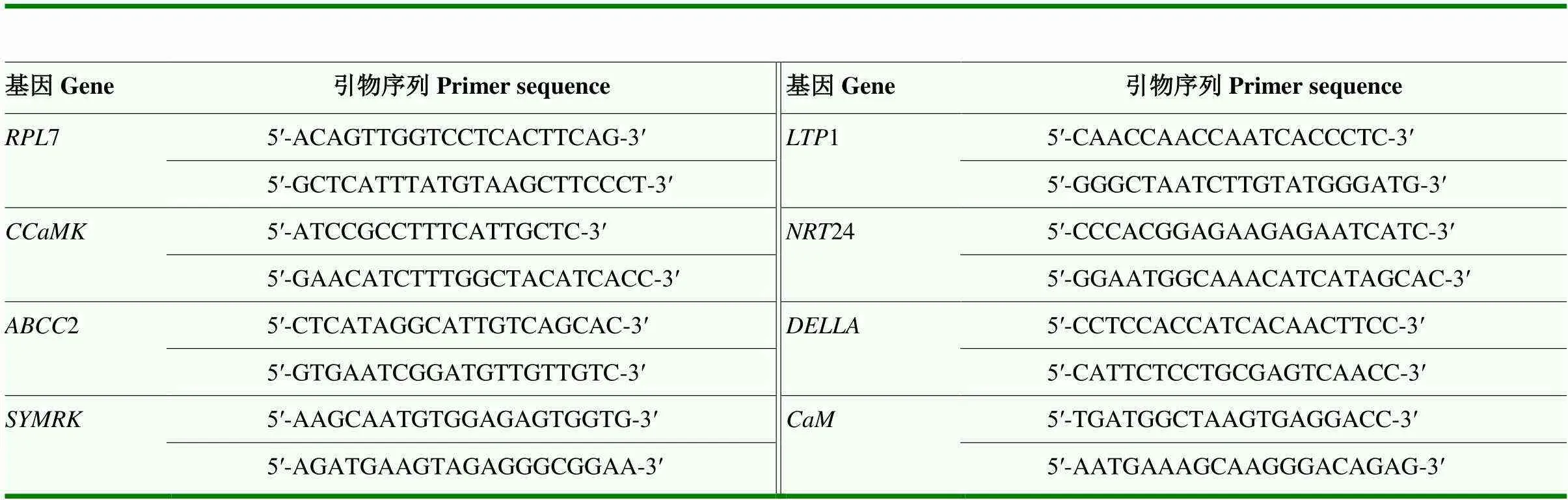
表2 候选基因及其特异性引物
1.8 数据处理
萌发率、生长速率以及产孢量的试验数据利用SPSS 20.0进行分析,数据差异采用单因素-test进行比较。
家蚕死亡率(%)=家蚕死亡数/家蚕总数×100,死亡率统计结果采用SPSS 20.0软件进行分析,用Duncan test进行多重比较。分析结果采用Graph Pad Prism 6软件进行图表制作。
花生中各基因表达试验数据利用SPSS 20.0进行分析,用Duncan test进行多重比较。分析结果采用GraphPad Prism 6软件进行图表绘制。
2 结果
2.1 绿僵菌黏附素基因mad2敲除株的构建
2.1.12前后同源臂克隆 利用特异性引物mad2 S1-F/R扩增得到了1 046 bp的2同源前臂基因序列S1,利用引物mad2 S2-F/R扩增得到了1 174 bp的同源后臂基因序列S2,利用潮霉素引物Hyg-F/R扩增得到了含有Ptrpc启动子的hygromycin潮霉素基因片段,共1 426 bp(图2)。
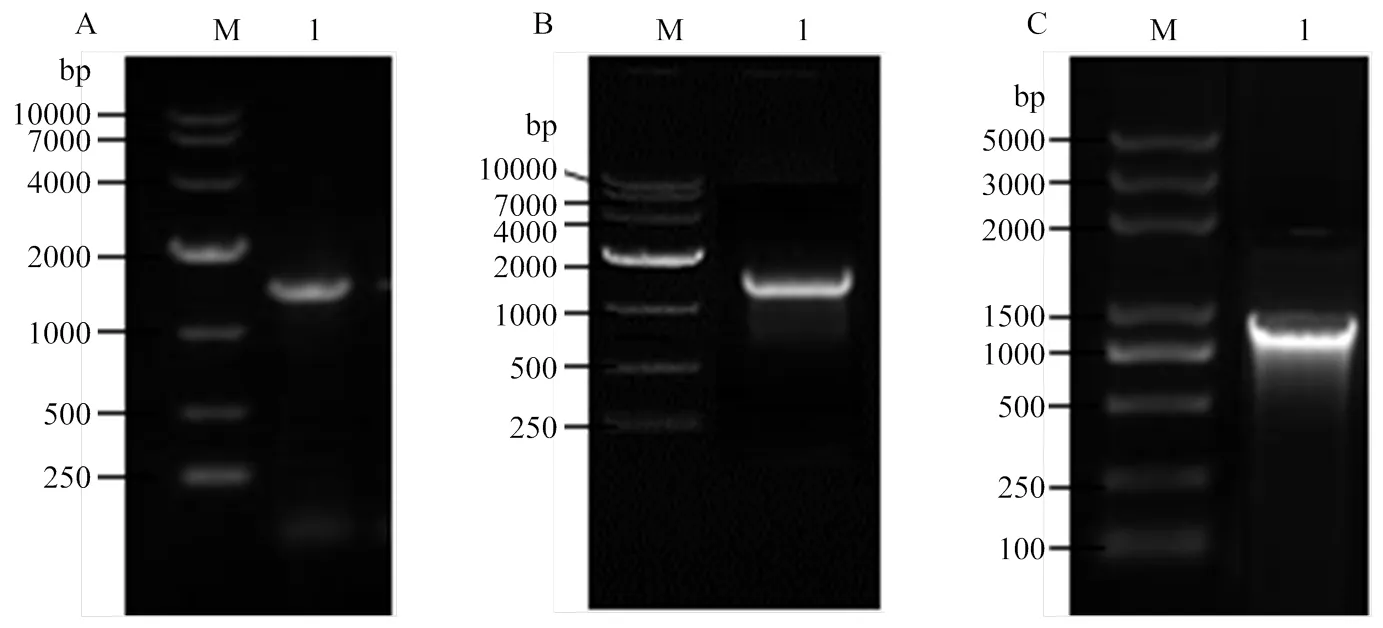
M: DNA marker; A-1: Hyg; B-1: S1; C-1: S2
通过overlap PCR,利用mad2 S1-F与Hyg S1-R引物将1 046 bp S1基因与945 bp潮霉素前端序列相连,获得S1H;利用Hyg S2-F与mad2 S2-R 1 174 bp S2与潮霉素后936 bp序列相连,获得S2H序列(图3)。S1H 片段与S2H片段中间重叠部分的长度为455 bp(图1)。
2.1.2 同源臂转化绿僵菌及转化子筛选 通过CaC12-PEG介导,将扩增得到的2基因同源臂敲除盒S1H、S2H片段转化绿僵菌原生质体,原生质体再生后获得了转化子。转化子在潮霉素平板上转接3代,最终获得10个稳定的转化子。通过特异性引物Out-mad2-F/R和潮霉素Hyg-F/R分别对转化子进行PCR检测,显示有5个转化子的2基因片段扩增为阴性(图4中2—5、9泳道),且同时潮霉素片段扩增为阳性(图4中对应12—15、19泳道),说明这些转化子已经成功敲除2,并在该基因位置处插入了潮霉素片段。选用第9号泳道转化子进行后续研究。
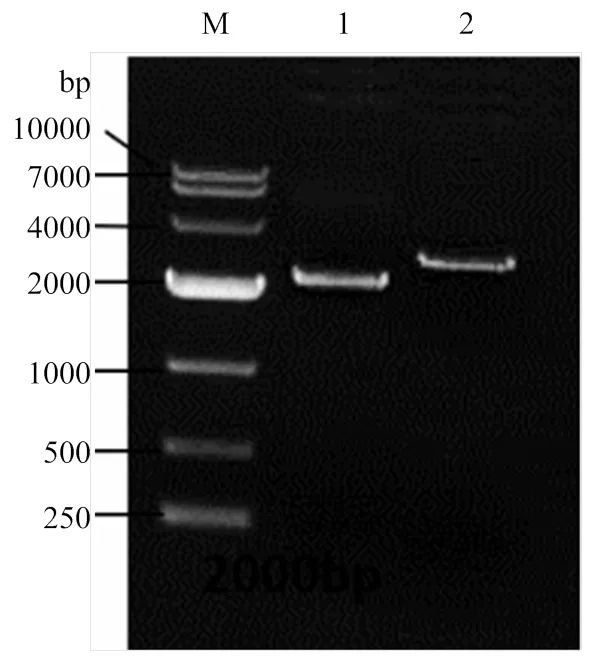
M: DL10000 DNA marker; 1: S1H; 2: S2H
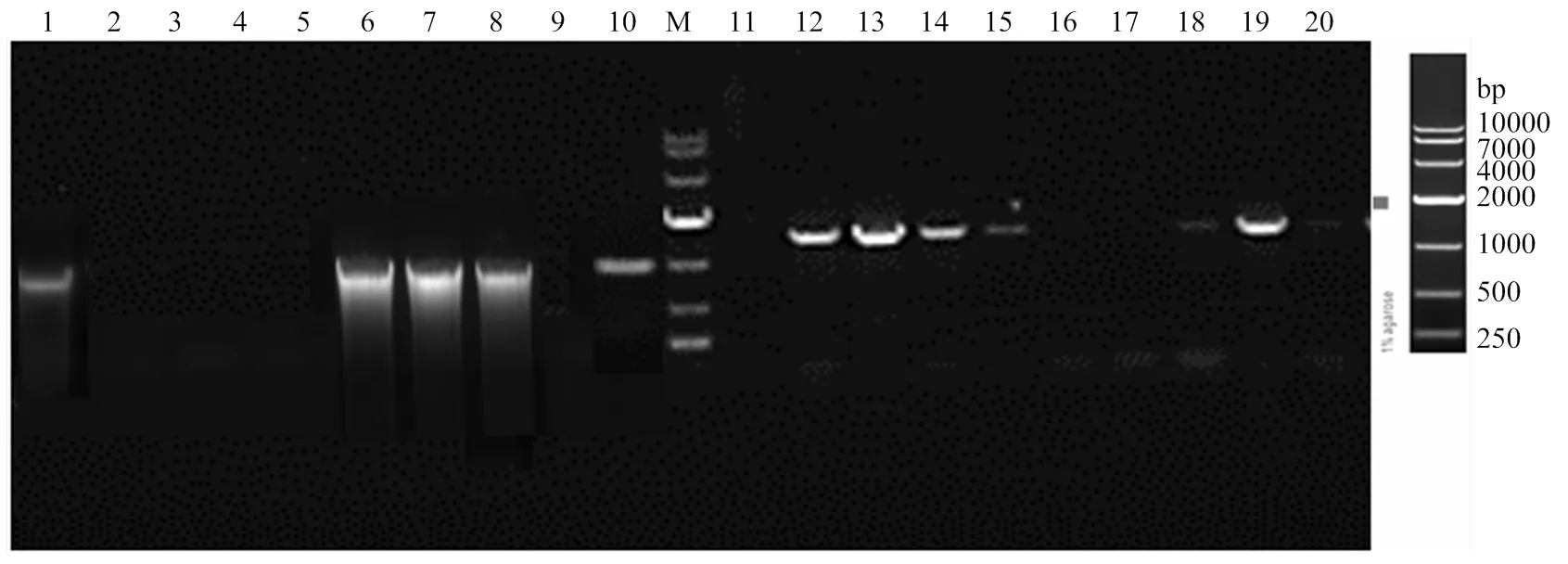
1—10:10个转化子OUT-mad2-F/R引物扩增结果 PCR amplification from 10 transformants by primer OUT-mad2-F/R;11—20为10个转化子Hyg-F/R引物扩增结果 PCR amplification from 10 transformants by primer Hyg-F/R primer
2.2 敲除mad2对菌株黏附力的影响
显微镜下观察了绿僵菌野生株和敲除株孢子在洋葱内表皮和蝗虫后翅上的附着情况(图5-A),显示在处理后8 h,敲除株的分生孢子对洋葱内表皮的吸附量显著低于野生株,但二者对于蝗虫后翅表皮的吸附量并无明显差异(图5-B),说明绿僵菌2敲除之后,降低了孢子对植物的黏附力,即黏附素MAD2有利于绿僵菌在植物上的黏附,但不影响对昆虫的附着。
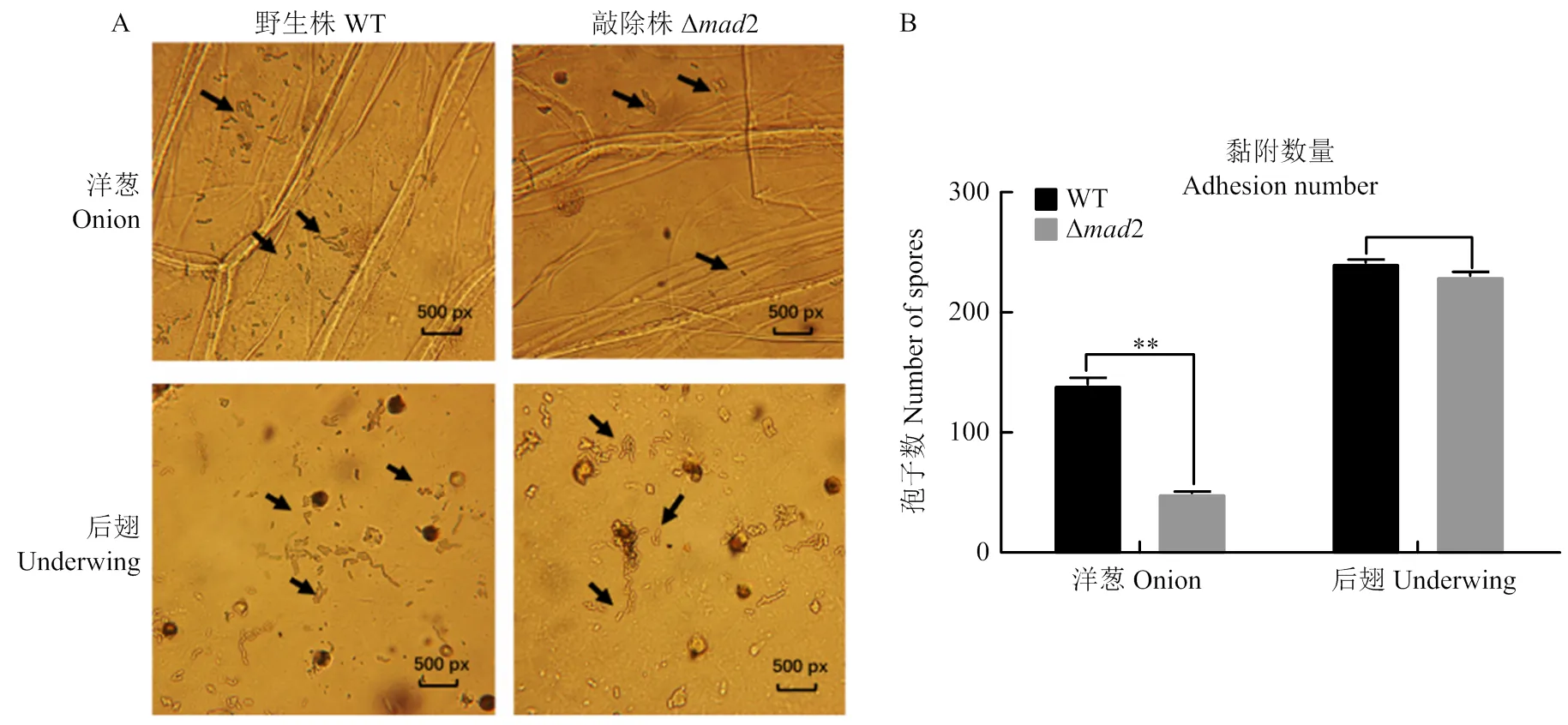
A:光学显微镜10×20倍,箭头所指为孢子adherent spores (pointed by arrows) by 10×20 light microscopy;B:**:相对于野生株有极显著差异there is an extremely significant difference compared with WT (P<0.01)
2.3 敲除mad2对菌株生长的影响
敲除株的萌发率在6、10、14、18、24 h均显著低于野生株,在培养36 h时,萌发率无显著差异(图6-A)。野生株的萌发中时为7.98 h,而敲除株的萌发中时为13.45 h,显著长于野生株,表明2的缺失抑制孢子的萌发。在12、14 h时,敲除株的菌丝长度显著短于野生株,分别短22.2%、23.7%(图6-B),说明2有利于绿僵菌孢子的萌发和生长。对于产孢量,在培养第12天,野生株产孢量为(5.22±1.01)×108孢子/cm2,而敲除株产孢量为(3.48±0.17)×108孢子/cm2,比野生株显著下降了33.3%,表明2的缺失影响了绿僵菌的产孢(图6-C)。

**:相对于野生株有极显著差异there is an extremely significant difference compared with WT (P<0.01);*:相对于野生株有显著差异there is a significant difference compared with WT (P<0.05)
2.4 敲除mad2对菌株毒力的影响
敲除株、野生株对家蚕均有较高毒力,与空白对照相比,在第6天的死亡率分别为9.34%和7.32%,均达到差异显著水平,之后两者处理的死亡率逐日上升,但一直无显著差异,最终死亡率均达到80%以上(图7),表明2的敲除并不影响绿僵菌的毒力。
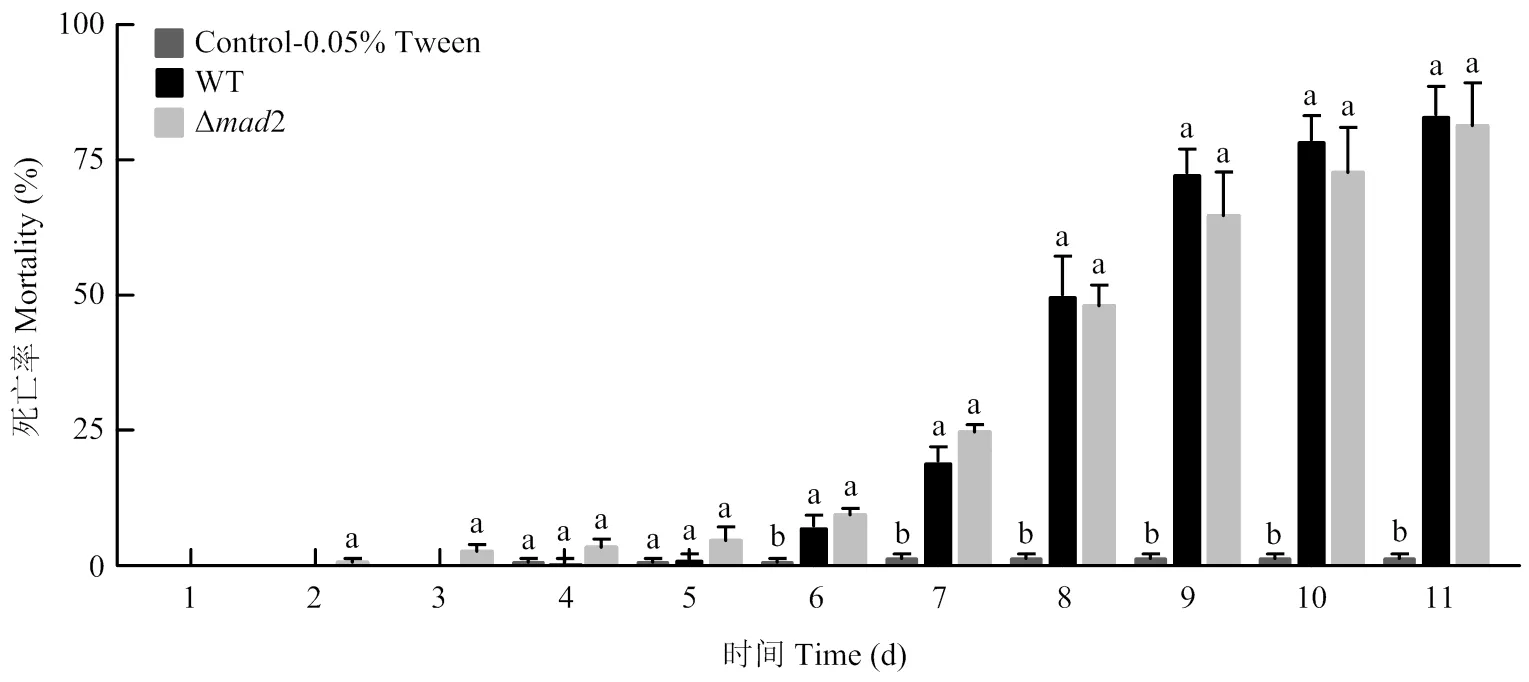
柱上不同字母代表不同处理间在0.05水平差异显著Different letters on the column represent significant differences among different treatments at P<0.05 level。图8同The same as Fig. 8
2.5 敲除株与野生株诱导下花生共生基因差异响应
检测了绿僵菌野生株、敲除株处理花生根的7个共生相关基因转录水平,发现在处理12 h后,敲除株处理下花生根共生受体的转录水平显著下降至野生株处理下的68.4%;同时,钙调素蛋白基因、钙-钙调素依赖蛋白激酶基因、信号解码的蛋白基因、ABC家族转运蛋白基因2、脂质转移蛋白基因1以及硝酸根转运蛋白基因24的转录水平相较于野生株处理均显著下降,其中和1分别下降至野生株的15.6%和10.8%,且降低到空白对照的16.5%。但相较于空白对照,2的敲除只对、和的转录水平产生显著抑制,而对有一定的上调作用,对2、1、24的转录无明显影响(图8)。由此可见,2敲除后绿僵菌对共生相关基因的诱导表达减弱,说明绿僵菌的MAD2蛋白参与了触发共生相关基因的转录,而不同基因受到的调控方式和调控程度不同。
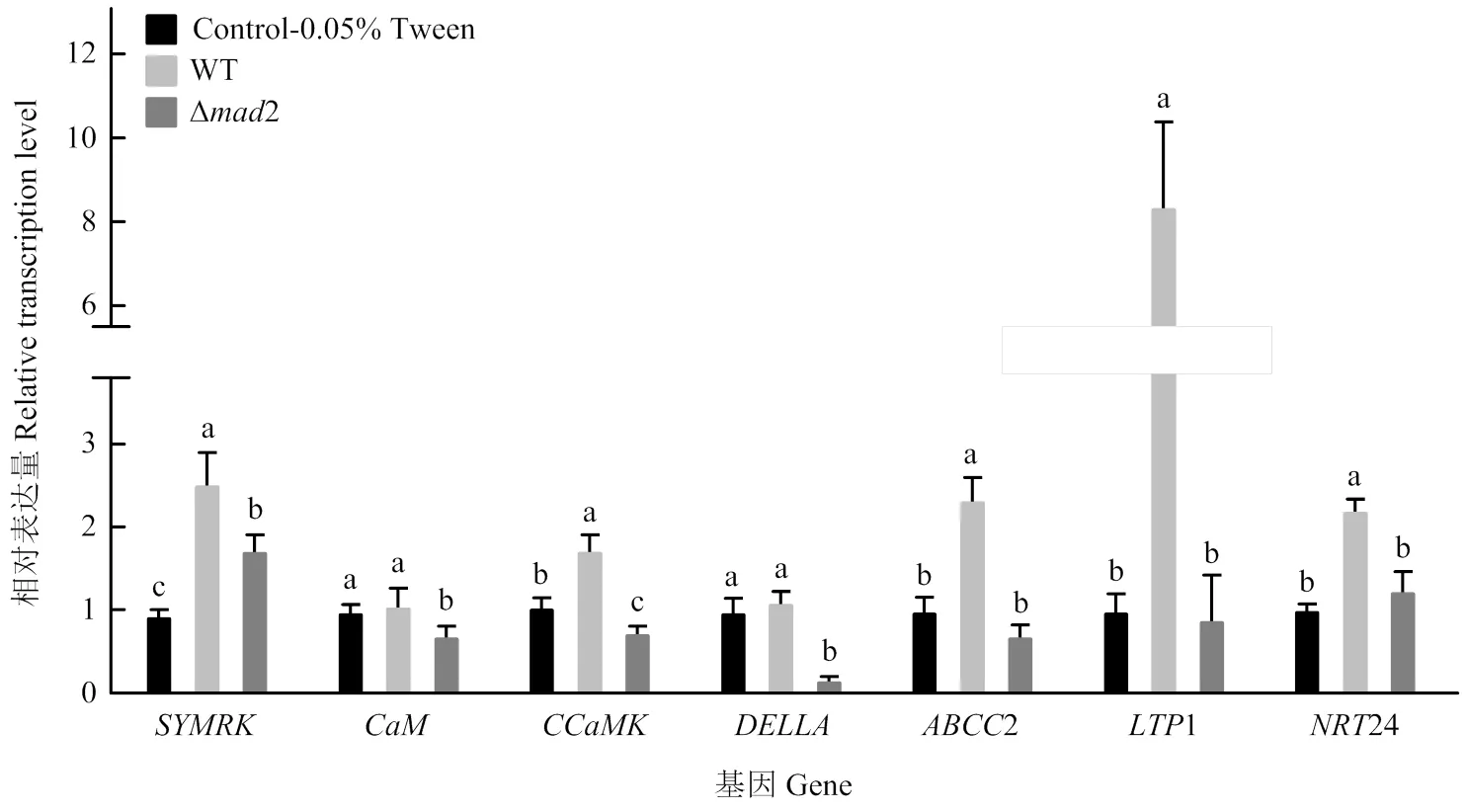
图8 绿僵菌野生株与敲除株处理下花生根共生基因实时荧光定量PCR检测
3 讨论
3.1 黏附素MAD2影响绿僵菌生长和对植物的识别与附着
已报道黏附素MAD2与绿僵菌黏附植物有关,但其作用机理尚不明确。黏附是微生物侵入宿主过程中的第一步,黏附素分子是微生物与宿主识别、信息交流的关键因子。目前,白色念珠菌黏附素的特性和作用研究较清楚,该黏附素多肽由类凝集素序列(ALS)、菌丝胞壁蛋白1(hyphal wall protein 1,Hwp1)以及整合素基因(Int 1p)等基因编码。这些基因与细胞间的识别、菌丝的形成以及毒力相关[26]。类凝集素ALS参与白色念珠菌黏附功能,尤其是ALS3蛋白对黏附作用至关重要,缺失会使真菌黏附于上皮细胞的能力明显降低[27]。AlS3通过促进与宿主内生菌交联形成混合生物膜,诱导宿主细胞内吞而产生黏附作用和介导入侵。例如,ALS3能与口腔格氏链球菌()的单链DNA结合蛋白(single strand DNA-binding protein,Ssb)交互作用,通过菌丝与体内链球菌相连接形成混合生物膜,促进白色念珠菌在体内稳定定殖[28]。在与宿主细胞表面E-钙黏蛋白和N-钙黏蛋白绑定后,ALS3能够诱导上皮细胞内吞作用而促进白色念珠菌入侵[29]。而白色念珠菌Hwpl蛋白具有颊上皮细胞谷氨酰胺转胺酶(transglutaminase,TGase)活性,与颊上皮细胞的蛋白质交联,当敲除后就会降低对底物TGase的作用活性,因而降低与人颊黏膜上皮细胞的共价结合水平[30]。在敲除后,白色念珠菌毒力降低,对上皮细胞的附着减少40%,并且造成菌丝在奶粉-吐温培养基和蜘蛛(spider)培养基上生长有缺陷[31]。绿僵菌黏附素MAD2与白色念珠菌胞壁凝集素分子AlS的结构十分相似,也由3个主要结构域组成,在其N-端有疏水信号肽,C-端具有预测的糖基磷脂酰肌醇细胞壁锚点,中间区域含有富含Thr的串联重复序列,可通过快速形成稳定的H键与宿主蛋白和肽相结合[7]。Fu等[32]发现白色念珠菌Als 1p除了是侵染小鼠的毒力因子,还是菌株表皮生长因子1(efg1)的效应子,调节菌丝形成途径。本研究发现绿僵菌黏附素MAD2也具有影响菌体生长和附着能力的作用。当缺失2后,孢子萌发率降低,菌丝生长率变慢,产孢量减少,对洋葱表皮的黏附力下降,但对蝗虫后翅的黏附性和对家蚕的毒力没有影响,说明黏附素MAD2参与了对植物的附着,并涉及孢子萌发、菌丝生长和产孢,从而影响绿僵菌与植物之间共生关系的建立。
3.2 MAD2与绿僵菌非适条件的适应有关
自然界中,绿僵菌通过侵染各种昆虫寄主获得大量繁殖以扩增种群,昆虫及其栖境提供了绿僵菌的适宜营养和生存条件。有研究表明,在昆虫表皮培养基上,绿僵菌孢子快速萌发和生长,但此过程2的转录并无显著变化,而在大豆根分泌液或水培上,绿僵菌缓慢生长,2转录从处理后2 h即开始积累,并伴随菌丝生长逐渐增加,但在培养20 d的绿僵菌孢子粉中,2的拷贝数极低,说明MAD2参与绿僵菌与植物的早期互作[7]。相对的,2在非适环境条件下(如营养缺乏、甲壳素处理、番茄茎秆上)显示上调表达,是一种抗逆进化的表现[33]。本研究中也发现,在水琼脂(营养缺失)培养中,2敲除株在培养6、10、14、18、24 h各时间段的萌发率均显著低于野生株,说明MAD2涉及绿僵菌在非适条件下的生长。
3.3 绿僵菌MAD2参与诱导植物SYMRK响应以调节植物生长和促进共生
植物体内钙离子信号途径涉及多种生理机能,包括与环境微生物共生的调控。在与丛枝菌根真菌的典型共生中,植物(共生受体激酶)接收外界信号因子,引起Ca2+的内流,胞内Ca2+激增,Ca2+作为二级信号向胞内传递,(钙调素蛋白)具有保守的Ca2+结合结构域,在共生过程中具有信号转导的功能[34-35]。(钙-钙调素依赖蛋白激酶)在钙存在的情况下,Ca2+-与结合,促进构象变化,诱导底物蛋白磷酸化。磷酸化的与形成复合物,与GRAS转录因子(如DELLA蛋白)协同作用,启动下游基因的表达[36]。前期研究表明,绿僵菌可以促进植物共生基因的转录[37]。本研究中,缺失2后,在野生株处理显著上调的转录水平出现一定程度下降,而2缺失使钙信号解码的基因、、转录水平较野生株或空白对照均显著下调,说明感应了MAD2及其他信号因子,被诱导上调表达,通过Ca2+信号转导,引起响应,并使的转录受到显著抑制。不仅是赤霉素信号通路的阻遏因子,还能通过与(依赖钙离子蛋白激酶IMD3的底物)结合形成蛋白复合体,促进豆科植物原生质体中结核诱导相关基因的表达,进而促进根瘤菌共生[38]。2缺失对转录的强烈抑制说明MAD2在绿僵菌诱导植物生长调节、促进共生建立中具有重要作用。
3.4 绿僵菌MAD2可调动植物脂质和氮素转运功能以参与共生建立
共生的后期阶段涉及多种物质的合成与转运,许多基因参与共生建立。2属于ABC(ATP-binding cassette)转运蛋白家族,参与植物体内激素、脂质、金属离子、次生代谢物和外源物质的运输[39],1(脂质转移蛋白)被认为在胞间发生作用,负责脂质结合和转运,参与植物脂质动员,角质层合成[40],24(硝酸根转运蛋白)参与硝态氮的吸收,并且在大豆中发现,过表达或后大豆根瘤数目显著增加[41]。在本研究中,野生株处理时对2124的转录上调至空白对照的2.34、8.32、2.17倍,而2缺失后相较于空白对照无明显差异,说明MAD2是诱导2124上调的关键因子,并可能通过独立途径实现。可见,MAD2可调动宿主的转运脂质和氮素功能,参与绿僵菌与植物共生的建立。
4 结论
成功构建了绿僵菌敲除2的稳定突变株。敲除株生物学分析表明,黏附素MAD2可正向调控绿僵菌的萌发、菌丝生长、产孢以及对植物的附着能力,但不影响绿僵菌的杀虫毒力。MAD2被植物受体识别后,调节植物中共生基因(、、、)的转录,诱导植物脂质和氮素合成和转运基因(2124)的转录上升。综合显示,黏附素MAD2与绿僵菌的生长、黏附和环境适应性有关,并且诱导与植物共生信号的交流,启动对植物的附着和共生关系的建立。
[1] MENG Y, ZHANG X, GUO N, FANG W. Mrst12 implicated in the regulation of transcription factor aftf1 by fus3-mapk during cuticle penetration by the entomopathogenic fungus. Fungal Genetics and Biology, 2019, 131: 103244. DOI: 10.1016/j.fgb.2019.103244.
[2] PARSA S, ORTIZ V, GÓMEZ-JIMÉNEZ M I, KRAMER M, VEGA F E. Root environment is a key determinant of fungal entomopathogen
endophytism following seed treatment in the common bean,. Biological Control, 2018, 116: 74-81. DOI:10.1016/j.biocontrol.2016.09.001.
[3] STEINWENDER B M, ENKERLI J, WIDMER F, EILENBERG J, KRISTENSEN H L, BIDOCHKA M J, MEYLING N V. Root isolations ofspp. from crops reflect diversity in the soil and indicate no plant specificity. Journal of Invertebrate Pathology, 2015, 132: 142-148. DOI: 10.1016/j.jip.2015.09.007.
[4] RAYA-DÍAZ S, SÁNCHEZ-RODRÍGUEZ A R, SEGURA-FERNÁNDEZ J M, DEL CARMEN DEL CAMPILLO M, QUESADA-MORAGA E. Entomopathogenic fungi-based mechanisms for improved Fe nutrition in sorghum plants grown on calcareous substrates. Plos One, 2017, 12(10): e0185903. DOI: 10.1371/journal.pone.0185903.
[5] KHAN A L, HAMAYUN M, KANG S M, KIM Y H, JUNG H Y, LEE J H, LEE I J. Endophytic fungal association via gibberellins and indole acetic acid can improve plant growth under abiotic stress: an example oflhl10. BMC Microbiology, 2012, 12: 3. DOI: 10.1186/1471-2180-12-3.
[6] AKELLO J, SIKORA R. Systemic acropedal influence of endophyte seed treatment onandoffspring development and reproductive fitness. Biological Control, 2012, 61(3): 215-221. DOI:10.1016/j.biocontrol.2012.02.007.
[7] WANG C, ST LEGER R J. The MAD1 adhesin oflinks adhesion with blastospore production and virulence to insects, and the MAD2 adhesin enables attachment to plants. Eukaryotic Cell, 2007, 6(5): 808-816. DOI: 10.1128/EC.00409-06.
[8] NICHOLSON R L, EPSTEIN L. Adhesion of fungi to the plant surface//COLE G T. The Fungal Spore and Disease Initiation in Plants and Animals. Springer US, 1991: 3-23. DOI: https://doi.org/ 10.1007/978-1-4899-2635-7_1.
[9] SHEPPARD D C, YEAMAN M R, WELCH W H, PHAN Q T, FU Y, IBRAHIM A S, FILLER S G, ZHANG M, WARING A J, JR EDWARDS J E. Functional and structural diversity in the Als protein family of. The Journal of Biological Chemistry, 2004, 279(29): 30480-30489. DOI: 10.1074/jbc.M401929200.
[10] PAVA-RIPOLL M, ANGELINI C, FANG W, WANG S, POSADA F J, ST LEGER R. The rhizosphere-competent entomopathogenexpresses a specific subset of genes in plant root exudate. Microbiology, 2011, 157(1): 47-55. DOI: 10.1099/mic. 0.042200-0.
[11] 闫多子, 蔡霓, 王峰, 农向群, 王广君, 涂雄兵, 张泽华. 绿僵菌黏附素MAD1体外表达及诱导花生响应的作用. 中国农业科学, 2021, 54(4): 744-753. DOI: 10.3864/j.issn.0578-1752.2021.04.007.
YAN D Z, CAI N, WANG F, NONG X Q, WANG G J, TU X B, ZHANG Z H. Expression in vitro ofadhesin MAD1 and its effect on inducing response in peanut. Scientia Agricultura Sinica, 2021, 54(4): 744-753. DOI: 10.3864/j.issn.0578- 1752.2021.04.007. (in Chinese)
[12] KRELL V, UNGER S, JAKOBS-SCHÖNWANDT D, PATEL A V. Endophyticmitigates nutrient deficits in potato and improves plant productivity and vitality. Fungal Ecology, 2018, 34: 43-49. DOI: 10.1016/j.funeco.2018.04.002.
[13] BEHIE S W, BIDOCHKA M J. Ubiquity of insect-derived nitrogen transfer to plants by endophytic insect-pathogenic fungi: an additional branch of the soil nitrogen cycle. Applied and Environmental Microbiology, 2014, 80(5): 1553-1560. DOI: 10.1128/AEM. 03338-13.
[14] BEHIE S W, MOREIRA C C, SEMENTCHOUKOVA I, BARELLI L, ZELISKO P M, BIDOCHKA M J. Carbon translocation from a plant to an insect-pathogenic endophytic fungus. Nature Communications, 2017, 8: 14245. DOI: 10.1038/ncomms14245.
[15] BEHIE S W, ZELISKO P M, BIDOCHKA M J. Endophytic insect-parasitic fungi translocate nitrogen directly from insects to plants. Science, 2012, 336(6088): 1576-1577. DOI: 10.1126/science. 1222289.
[16] SASAN R K, BIDOCHKA M J. The insect-pathogenic fungus(clavicipitaceae) is also an endophyte that stimulates plant root development. American Journal of Botany, 2012, 99(1): 101-107. DOI: 10.3732/ajb.1100136.
[17] LIAO X, O’BRIEN T R, FANG W, ST LEGER R J. The plant beneficial effects ofspecies correlate with their association with roots. Applied Microbiology and Biotechnology, 2014, 98(16): 7089-7096. DOI: 10.1007/s00253-014-5788-2.
[18] BEHIE S W, JONES S J, BIDOCHKA M J. Plant tissue localization of the endophytic insect pathogenic fungiand. Fungal Ecology, 2015, 13: 112-119. DOI: 10.1016/j.funeco.2014. 08.001.
[19] CAI N, WANG F, NONG X Q, WANG G J, McNeill M, Cao G C, Hao K, Liu S F,ZHANG Z H. Visualising confirmation of the endophytic relationship ofwith maize roots using molecular tools and fluorescent labelling. Biocontrol Science and Technology, 2019, 29(11): 1023-1036. DOI: 10.1080/09583157. 2019.1641792.
[20] HAO K, WANG F, NONG X Q, MCNEILL M R, LIU S F, WANG G J, CAO G C, ZHANG Z H. Response of peanutroots to the presence of beneficial and pathogenic fungi by transcriptome analysis. Scientific Reports, 2017, 7(1): 964. DOI: 10.1038/s41598-017-01029-3.
[21] 徐芳, 姚泉洪, 熊爱生, 彭日荷, 侯喜林, 曹兵. 重叠延伸pcr技术及其在基因工程上的应用. 分子植物育种, 2006, 4(5): 747-750. DOI: 10.3969/j.issn.1672-416X.2006.05.025.
XU F, YAO Q H, XIONG A S, PENG R H, HOU X L, CAO B. SOE PCR and its application in genetic engineering. Molecular Plant Breeding, 2006, 4(5): 747-750. DOI: 10.3969/j.issn.1672-416X.2006. 05.025. (in Chinese)
[22] 王晓玲, 蒋伶活, 张泽华. 以G418抗性为选择标记的金龟子绿僵菌原生质体转化的研究. 安徽农业科学, 2007, 35(28): 8865-8866, 8868. DOI: 10.3969/j.issn.0517-6611.2007.28.020.
WANG X L, JIANG L H, ZHANG Z H. Protoplast transformation ofwith G418 resistance as selective marker. Journal of Anhui Agricultural Sciences, 2007, 35(28): 8865-8866, 8868. DOI: 10.3969/j.issn.0517-6611.2007.28.020. (in Chinese)
[23] 刘艳微. 转基因球孢白僵菌工程菌株的构建及鉴定[D]. 哈尔滨: 哈尔滨师范大学, 2015. DOI: 10.7666/d.D678481.
LIU Y W. Construction and identification oftransgenicstrains[D]. harbin: harbin Normal University, 2015. DOI: 10.7666/d.D678481. (in Chinese)
[24] 蔡守平, 何学友, 曾丽琼, 黄金水, 钟景辉, 嵇保中. 感染星天牛幼虫高致病力金龟子绿僵菌菌株的筛选. 中国生物防治学报, 2012, 28(2): 293-297. DOI: 10.3969/j.issn.2095-039X.2012.02.023.
CAI S P, HE X Y, ZENG L Q, HUANG J S, ZHONG J H, JI B Z. Susceptibility oflarvae to the entomopathogenic fungus,Chinese Journal of Biological Control, 2012, 28(2): 293-297. DOI: 10.3969/j.issn.2095-039X.2012.02.023. (in Chinese)
[25] MAYO S, COMINELLI E, SPARVOLI F, GONZÁLEZ-LÓPEZ O, RODRÍGUEZ-GONZÁLEZ A, GUTIÉRREZ S, CASQUERO P A. Development of a qPCR strategy to select bean genes involved in plant defense response and regulated by theinteraction.Frontiers in Plant Science, 2016, 7: 1109. DOI: 10.3389/fpls.2016.01109.
[26] 廉翠红, 刘维达. 与白念珠菌黏附和侵入相关的毒力因子研究进展. 国际皮肤性病学杂志, 2004, 30(5): 323-325. DOI: 10.3760/cma.j.issn.1673-4173.2004.05.018.
LIAN C H, LIU W D. Research progress on virulence factors related to adhesion and invasion ofInternational Journal of Dermatology and Venereology, 2004, 30(5): 323-325. DOI: 10.3760/cma.j.issn.1673-4173.2004.05.018. (in Chinese)
[27] WÄCHTLER B, CITIULO F, JABLONOWSKI N, FÖRSTER S, DALLE F, SCHALLER M, WILSON D, HUBE B.-epithelial interactions: dissecting the roles of active penetration, induced endocytosis and host factors on the infection process. PLoS ONE, 2012, 7(5): e36952. DOI: 10.1371/journal.pone. 0036952.
[28] SILVERMAN R J, NOBBS A H, VICKERMAN M M, BARBOUR M E, JENKINSON H F. Interaction ofcell wall als3 protein withSspb adhesin promotes development of mixed-species communities. Infection and Immunity, 2010, 78(11): 4644-4652. DOI: 10.1128/IAI.00685-10.
[29] MURCIANO C A, MOYES D L, RUNGLALL M, TOBOUTI P, ISLAM A, HOYER L L, NAGLIK J R. Evaluation of the role ofagglutinin-like sequence (Als) proteins in human oral epithelial cell interactions.PLoS ONE, 2012, 7(3): e33362. DOI: 10.1371/journal.pone.0033362.
[30] STAAB J F,Bradway S D, Fidel P L, Sundstrom P. Adhesive and mammalian transglutaminase substrate properties ofhwp1. Science, 1999, 283(5407): 1535-1538. DOI: 10.1126/science.283.5407.1535.
[31] GALE C A, BENDEL C M, MCCLELLAN M, HAUSER M, BECKER J M, BERMAN J, HOSTETTER M K. Linkage of adhesion, filamentous growth, and virulence into a single gene,. Science, 1998, 279(5355): 1355-1358. DOI:10.1126/ science.279.5355.1355.
[32] FU Y, IBRAHIM A S, SHEPPARD D C, CHEN Y C, FRENCH S W, CUTLER J E, FILLER S G, EDWARDS J E.ALS1p: an adhesin that is a downstream effector of thefilamentation pathway. Molecular Microbiology, 2002, 44(1): 61-72. DOI: 10.1046/j.1365-2958.2002.02873.x.
[33] BARELLI L, PADILLA-GUERRERO I E, BIDOCHKA M J. Differential expression of insect and plant specific adhesin genes,and, in. Fungal Biology, 2011, 115(11): 1174-1185. DOI: 10.1016/j.funbio.2011.08.003.
[34] BATISTI O, KUDLA J. Analysis of calcium signaling pathways in plants. Biochimica et biophysica acta, 2012, 1820(8): 1283-1293. DOI: 10.1016/j.bbagen.2011.10.012.
[35] 熊珊珊, 赵斌.丛枝菌根真菌的钙调素基因在共生过程中的作用. 湖北农业科学, 2014, 53(13): 3177-3182. DOI: 10.3969/j.issn.0439- 8114.2014.13.052.
XIONG S S, ZHAO B. The roles of calmodulin gene ofin symbiosis process. Hubei Agricultural Sciences, 2014, 53(13): 3177-3182. DOI: 10.3969/j.issn.0439-8114.2014.13.052. (in Chinese)
[36] MACLEAN A M, BRAVO A, HARRISON M J. Plant signaling and metabolic pathways enabling arbuscular mycorrhizal symbiosis. The Plant Cell, 2017, 29(10): 2319-2335. DOI: 10.1105/tpc.17.00555.
[37] WANG F, NONG X Q, HAO K, CAI N, WANG G J, LIU S F, ULLAH H, ZHANG Z H. Identification of the key genes involved in the regulation of symbiotic pathways induced byin peanut () roots. 3 Biotech, 2020, 10(3): 124. DOI: 10.1007/s13205-020-2105-x.
[38] JIN Y, LIU H, LUO D, YU N, DONG W, WANG C, ZHANG X, DAI H, YANG J, WANG E. Della proteins are common components of symbiotic rhizobial and mycorrhizal signalling pathways. Nature Communications, 2016, 7: 12433. DOI: 10.1038/ncomms12433.
[39] 邵若玄, 沈忆珂, 周文彬, 方佳, 郑炳松. 植物ATP结合盒(abc)转运蛋白研究进展. 浙江农林大学学报, 2013, 30(5): 761-768. DOI: 10.11833/j.issn.2095-0756.2013.05.020.
SHAO R X, SHEN Y K, ZHOU W B, FANG J, ZHENG B S. Recent advances for plant ATP-binding cassette transporters.Journal of Zhejiang A&F University, 2013, 30(5): 761-768. DOI: 10.11833/j.issn. 2095-0756.2013.05.020. (in Chinese)
[40] CARVALHO A O, GOMES V M. Role of plant lipid transfer proteins in plant cell physiology: a concise review. Peptides, 2007, 28: 1144-1153. DOI: 10.1016/j.peptides.2007.03.004.
[41] 李国纪, 朱林, 曹金山, 王幼宁. 大豆和基因的克隆及功能探究. 作物学报, 2020, 46(7): 1025-1032. DOI: 10.3724/SP.J.1006.2020.94152.
LI G J, ZHU L, CAO J S, WANG Y N. Cloning and functional analysis ofandin soybean. Acta Agronomica Sinica, 2020, 46(7): 1025-1032. DOI: 10.3724/SP.J.1006.2020.94152. (in Chinese)
Adhesin gene2 knockout and functional effects on Biological characteristics and inducing plant responses in
CAI Ni, YAN DuoZi, NONG XiangQun, WANG GuangJun, TU XiongBing, ZHANG ZeHua
State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193
【Objective】, an entomopathogenic fungus, is found also an endophyte. MAD2 is known to be one of the two adhesin proteins of, which plays a vital role in adhesion and colonization in plants, but its functional mechanism is poorly understood. The objective of this study is to explore the functional effect of MAD2 protein on thecharacteristics of growth, virulence, adhesion and inducing plant responses inby construction of the2 mutant strain (Δ2) ofstrain Ma9. 【Method】The genomic DNA sequences of2 anteroposterior were obtained from NCBI, and specific primers were designed to amplify2 homologous arm genes S1 and S2 by PCR based on genomic DNA template ofstrain Ma9. Meanwhile, Hyg-F/R primer pair was designed to amplify hygromycin gene with promoter sequence based on pKH-KO vector DNA template. Then, homologous knockout boxes S1H and S2H of2 were constructed by overlap PCR. Finally,2-knockout strains with stable inheritance were obtained by PEG-mediated protoplast transformation of the homologous knockout boxes. By comparing the biological characteristics of the knockout strains (Δ2) to the wild-type strains (WT), the effects of MAD2 protein on thecharacteristics ofgrowth, virulence, adhesion and inducing the peanut response of symbiosis genes were analyzed. 【Result】homologous recombination transformants with2 knockout were obtained by protoplast transformation.The spore germination rate of Δ2 was significantly decreased and spore semi-germination time was significantly prolonged 5.47 h compare to WT, as well as the mycelium length of Δ2was significantly shorter than WT in 12 h and 14 h incubation, which occupied 77.8% and 76.3% of WT, respectively. The sporulation in 12-day incubation was reduced by 33.3% compared to WT. The ability of Δ2 strain adhesion in onion was significantly decreased but showed no difference in adhere to the underwings of locust.In addition,2knockout did not affect the virulence ofto silkworm. In the peanut inoculated2-knockout strain for 12 h, the transcription level of symbiosis receptor gene,calcium signal decoding related genes (,,), lipid and nitrogen transfer related genes (1,24,2) was significantly down-regulated compared to the treatment of wt. While compared with blank control, Δ2 still had certainly up-regulatedtranscription level, significantly inhibited the transcription levels of,and, but had no effect on the transcription level of2,1 and24. 【Conclusion】adhesin protein MAD2 affects spore germination, initial growth of mycelium, sporulation quantity and plants adhesion, while has no effect on insect adhesion and virulence of strain, and MAD2 triggers the transcription of peanut symbiotic genes at the initial stage of interaction between the strain and peanut.
; adhesin protein MAD2; gene knockout; adhesion; virulence; growth trait
2021-04-14;
2021-05-12
国家重点研发计划(2017YFD0201205,2018YFD0201002)、国家科技基础资源调查专项(2019FY102002)、国家引才引智示范基地(YZJD202001045)
蔡霓,E-mail:741347573@qq.com。通信作者农向群,E-mail:xqnong@sina.com。通信作者王广君,E-mail:guangjunwang@hotmail.com
(责任编辑 岳梅)

