超声对豌豆分离蛋白结构及乳化性能的调控效应
李朝蕊,韩馨蕊,范鑫,黄峻榕,曹云刚,熊幼翎
超声对豌豆分离蛋白结构及乳化性能的调控效应
李朝蕊1,韩馨蕊1,范鑫1,黄峻榕1,曹云刚1,熊幼翎2
1陕西科技大学食品与生物工程学院,中国西安 710021;2肯塔基大学动物与食品科学系,美国肯塔基州列克星顿 40546
【目的】考察超声波处理对豌豆分离蛋白(pea protein isolate,PPI)结构和理化性质的影响,揭示超声处理对PPI乳化特性的调控机制,为豌豆蛋白作为天然乳剂及其相关产品在食品领域中的应用提供理论依据。【方法】选用频率为20 kHz、功率为600 W的超声波经不同时长(0、20、30、40和60 min)的预处理后制备改性豌豆蛋白(ultrasonic-pea protein isolate,U-PPI),再经高压均质制备U-PPI乳液。通过自由氨基、总巯基、粒径、溶解度及SDS-PAGE探究超声波处理对豌豆蛋白理化性质的影响;借助圆二色谱仪分析U-PPI二级结构的变化;通过内源性色氨酸荧光测定分析U-PPI三级结构的变化;通过乳化活性指数、粒径、乳液界面蛋白分布、Zeta电位和表观黏度表征U-PPI的乳化能力和乳液稳定性;借助激光共聚焦荧光显微镜观察乳状液的微观结构。【结果】超声波处理对PPI结构具有显著修饰作用,30—40 min的短时间超声处理能够显著降低-螺旋并提高-折叠含量,使PPI的结构更加舒展柔韧,更多的疏水基团暴露在界面上,同时超声波的解聚效应还引起PPI的平均粒径减小、溶解度显著增大;因而在此条件下超声处理对PPI结构的修饰有利于其在油/水界面形成致密而稳定的蛋白膜,有效地提高了PPI的乳化活性和乳状液的稳定性,微观结构也显示其乳液粒径更小、分布更加均匀。然而,60 min的长时间超声处理会导致PPI的疏水重聚,溶解度降低,不利于其在油/水界面的吸附重排,降低了其乳化活性和乳液稳定性。【结论】30和40 min超声处理产生的空化效应、机械效应等对PPI具有显著的解聚作用,促使蛋白分子结构舒展,有利于其在油/水界面的吸附重排,从而显著改善了豌豆蛋白的乳化性能。
超声波改性;豌豆分离蛋白;结构修饰;乳液稳定性
0 引言
【研究意义】近些年有研究表明过多食用动物蛋白可能会增加糖尿病和心血管疾病的患病几率,因此,人们更倾向于摄入低脂、低热量的植物源蛋白。豌豆蛋白作为一种新兴的优质蛋白,因其丰富而均衡的营养价值和相对较低的成本,在食品工业中作为潜在的成分被给予更多的考虑[1-2]。但天然的豌豆蛋白溶解性并不理想,功能特性不够突出,应用范围受到一定限制。因此,对豌豆蛋白进行适当改性,扩展其应用范围,具有重要的商业意义。【前人研究进展】植物蛋白乳状液及其相关产品的稳定性在很大程度上取决于其加工或制备方法。通过对天然植物蛋白的结构进行修饰可以改善其加工性能,现有的蛋白改性方法主要包括物理法、化学法和酶法[3]。相对于化学和酶法改性,物理修饰在食品研究与加工中的应用更为广泛,且具有用时短、安全性好以及对产品营养成分影响较小等优点,物理法主要包括热、高压、超声波、微波和挤压处理等[4]。如PENG等[5]通过热处理修饰豌豆蛋白(95℃,30 min),发现经热处理后的豌豆蛋白形成的乳状液具有更高的蛋白质吸附率和乳液稳定性,这主要归因于热处理对豌豆蛋白分子结构的修饰。Yin等[6]在高压(200和400 MPa)处理红芸豆分离蛋白时,发现高压处理导致蛋白结构展开,溶解度显著提高,乳化活性和乳液稳定性增强,表明高压处理对蛋白质的功能特性具有调控作用[7]。SHEN等[8]采用热处理和微射流联合处理来改善大豆蛋白的表面性质,发现微射流处理能以预热温度依赖的方式促使蛋白质的结构重排,进而提高大豆蛋白的溶解性和乳化性。李燕燕[9]研究发现微波能够通过使蛋白分子高速震动,降低二硫键含量,调节二级结构,提高大米蛋白溶解度。超声波处理是一项具有成本效益的新兴技术,在食品工业中得到了广泛的应用。超声波修饰的潜在机制很大程度上归因于蛋白质分子的构象变化[4]:超声波产生的高频振荡,作用于液体对蛋白质大分子产生空化作用,能在瞬间产生较强的湍流和高能量剪切波,使蛋白质的空间结构发生变化,进而影响蛋白质的性质与功能[10]。超声处理对蛋白结构及性能的影响取决于超声强度(超声时间、温度、功率等)。如O′SULLIVAN等[11]发现,采用一定强度的超声预处理(20 kHz,~34 W·cm-2,2 min)小麦蛋白和大豆分离蛋白,会改善二者的溶解度和乳化性能,且较低强度声能不足以破坏蛋白肽链内的共价相互作用。李笑笑[12]对比200—800 W的高场强超声波处理商用大豆分离蛋白时发现,200 W和400 W的功率促使蛋白分子聚合体被打散,平均粒径变小;而600 W和800 W的功率使蛋白分子部分聚合,疏水相互作用增强,溶解度降低。CHANDRAPALA等[13]在处理10%葵花籽油水体系时,20 kHz频率超声处理形成的乳液效果最好,当频率升高为211 kHz 时,乳液无法形成。谢为峰等[14]采用不同的超声功率对杏仁粕蛋白进行处理,结果表明当蛋白浓度为 4 g∙mL-1时,在超声功率 500 W、超声时间15 min的条件下,杏仁蛋白的溶解度最优,达160 mg∙g-1。因此,推测不同强度的超声波处理,会对豌豆蛋白结构产生不同程度的修饰,进而可以调控其乳化特性。【本研究切入点】虽然超声对植物蛋白结构及功能特性的调控已有一些研究,但超声波处理对豌豆蛋白结构及乳化性能的影响尚缺乏系统研究,其内在调控机制也尚待明晰。【拟解决的关键问题】本研究系统探究不同时间超声处理对豌豆蛋白结构、粒径、溶解度、乳化活性、乳化稳定性等的影响,分析超声诱导的蛋白结构变化与其乳化性能改变之间的内在关系,揭示超声处理对豌豆蛋白结构和乳化活性的调控机制,为改善豌豆蛋白的加工性能提供理论依据。
1 材料与方法
试验于2020年5月至2021年3月在陕西科技大学食品与生物工程学院实验楼进行。
1.1 主要材料与试剂
中豌八号青豌豆购置于沭阳唱亮园林绿化有限公司,真空包装后保存。金龙鱼大豆油购置于西安市未央区润家超市。
DTNB(二硫代双(2-硝基苯甲酸))购于麦克林公司,水溶性维生素E(Trolox)购于Sigma-Aldrich公司,TNBS购于美国Ark Pharm公司,其他化学试剂均为分析纯。
1.2 主要仪器与设备
HR/T20MM立式高速冷冻离心机,湖南赫西仪器装备有限公司;高速多功能粉碎机,武义海纳电器有限公司;超声波细胞破碎仪,宁波新芝生物科技股份有限公司;UV2900紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;高剪切分散乳化机,上海FLUKO公司;AH-BASIC I高压均质机,ATS纳米技术(苏州)有限公司;Mini-PROTEAN 3 Cell电泳仪,美国 Bio-Rad 公司;Haake-Mars 60流变仪,德国Thermo Fisher Scientific公司;安东帕Litesizer™ 500纳米粒度及Zeta电位分析仪,奥地利Anton Paar公司;荧光光谱仪Fs5,英国Edingburgh Instruments公司;圆二色谱仪,英国Applied Photophysics公司;Mastersizer 2000激光粒度分析仪,英国Malvern Instruments有限公司;LSM800激光共聚焦荧光显微镜,德国Carl Zeiss公司。
1.3 试验方法
1.3.1 豌豆分离蛋白(PPI)的制备 参考JIANG等[15]的方法,称取5 kg豌豆种子,于40℃烘箱烘干后用高速多功能粉碎机破碎去皮(2 s左右),去皮后粉碎成30—200目的粗粉,用气流磨粉机处理20 min得到豌豆细粉。用正己烷-乙醇混合溶剂(10﹕1,v/v)在抽滤装置中对豌豆粉脱脂处理。将脱脂豆粉按一定比例与超纯水混合,调节pH到8.0并搅拌2小时,在4℃下以10 000×离心30 min。调节上清液的pH至4.5,在4℃下以3 300×离心20 min。用超纯水洗涤两次,6 000×离心10 min。最终将沉淀分散在5倍的超纯水中,调节pH至7.0。样品经过冷冻干燥后于4℃保存,取少量PPI测定其主要成分(水分、蛋白质、灰分、脂肪含量)。
1.3.2 超声改性处理 称取样品,配制成质量浓度为30 mg∙mL-1的豌豆分离蛋白溶液,pH调至7.0后搅拌2 h至充分溶解,取80 mL上述溶液于烧杯中冰浴超声(温度不高于20℃)。通过预试验对比了3组不同超声功率(200、400和600 W)以及不同超声时间(0—60 min)处理后PPI的溶解特性变化,根据预试验结果及前人研究报道[16],设定超声细胞破碎机工作参数:工作4 s、间歇2 s,超声频率为20 kHz,超声功率为600 W,超声时间为0、20、30、40和60 min。超声处理结束后,取部分豌豆蛋白溶液使用蒸馏水稀释至4 mg∙mL-1测定其溶解度;另一部分豌豆蛋白溶液经冷冻干燥用于结构等的测定。
1.3.3 自由氨基含量测定 参考LERTITTIKUL等[17]的方法并做修改,取200 μL 4 mg∙mL-1的蛋白溶液于10 mL棕色离心管,加入2.0 mL 1% SDS(0.2 mol∙L-1磷酸缓冲液(pH 8.2))、1.0 mL 0.01%的TNBS充分混合后,置于50℃水浴中避光反应30 min,用2.0 mL 0.1 mol∙L-1Na2SO3终止反应后,室温下放置 15 min。空白是在相同条件下用蒸馏水代替反应液。在420 nm波长处测定吸光值,每组样品测定3次。自由氨基含量根据L-亮氨酸含量的标准曲线来确定。
1.3.4 总巯基含量测定 使用0.1 mol∙L-1磷酸缓冲液(pH 7.4)将处理后的样品稀释为蛋白浓度2 mg∙mL-1;以0.5 mL磷酸钠缓冲液(0.1 mol∙L-1、pH 7.4)代替蛋白液作为试剂空白,用于紫外分光调零。取0.5 mL于玻璃试管中,加入2.0 mL尿素-SDS溶液、50 μL DTNB(10 mmol∙L-1)。涡旋混匀后,室温下避光反应15 min,于412 nm处测定吸光度值[18]。总巯基含量通过下式计算:
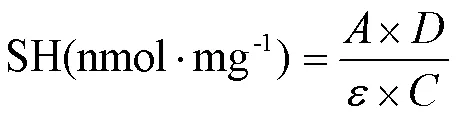
式中,:吸光度;ε =13 600 M-1∙cm-1;D:稀释倍数6;:蛋白浓度(mg∙mL-1)。
1.3.5 圆二色谱测定 使用10 mmol∙L-1磷酸盐缓冲液(pH 7.0)将U-PPI样品稀释至0.2 mg∙mL-1,采用圆二色谱仪分析超声改性豌豆蛋白二级结构的变化。试验温度:25℃,样品池光程:2 mm,灵敏度:100 mdeg∙cm-1,在180—260 nm扫描蛋白样品的圆二色谱,累计扫描3次取其平均值并扣除缓冲液背景,使用CDNN软件计算蛋白二级结构含量。
1.3.6 内源性色氨酸荧光测定 使用10 mmol∙L-1磷酸盐缓冲液(pH 7.0)将U-PPI样品稀释为0.4 mg∙mL-1,设置激发波长为290 nm,利用荧光光谱仪扫描样品在300—400 nm的发射光谱。激发狭缝和发射狭缝宽均为5 nm,扫描3次。相同条件下记录样品缓冲液发射光谱,并从样品发射光谱中扣除,以排除干扰[5]。
1.3.7 粒度测定 配制4 mg∙mL-1豌豆蛋白溶液,磁力搅拌2 h使蛋白充分溶解,颗粒分散均匀。采用激光纳米粒径分布仪对蛋白颗粒大小进行测定。参数如下:分散剂为10 mmol∙L-1PBS(pH 7.0);分散剂折射率:1.3318;得粒径体积分布图。
1.3.8 SDS-PAGE 在还原(+DTT)和非还原(-DTT)条件下,使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对超声改性豌豆蛋白的分子量分布情况进行分析。参考LIU等[19]、JIANG等[20]的方法并适当修改,浓缩胶浓度为5%,分离胶浓度为12%。将样品稀释为4 mg∙mL-1,与样品缓冲液等体积混合,于沸水浴加热3 min后立即冷却,每孔上样量为15 μL,染色脱色后拍照,对电泳条带进行分析。
1.3.9 溶解度测定将制备的样品稀释为质量浓度为4 mg∙mL-1溶液,9 000 r/min离心20 min,采用双缩脲法测定上清液中可溶性蛋白质含量。溶解度计算公式如下:
。
1.3.10 U-PPI乳状液的制备 使用10 mmol∙L-1磷酸盐缓冲液(pH 7.0)稀释制备质量浓度为10 mg∙mL-1的U-PPI溶液,加入10%(v/v)纯大豆油并混合,13 000 r/min剪切2 min后,30 MPa高压均质循环2次,于4℃贮藏[16]。
1.3.11 乳化活性的测定 将均质得到的乳液快速地转移到100 mL烧杯中,分别在放置0和10 min时,从底部取样5 μL,加入5 mL 0.1% SDS,涡旋振荡10 s,以SDS溶液为空白并测定500 nm处的吸光度[14]。乳化活性(EAI)用下式计算:
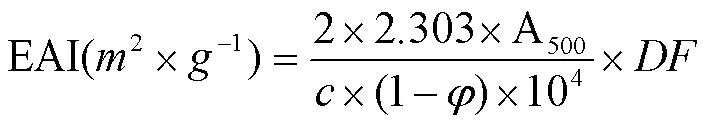
式中,:稀释倍数,:初始蛋白浓度(g∙mL-1),:乳液中油的体积分数(v∙v-1)。
1.3.12 乳液粒径的测定 在25℃下采用Mastersizer 2 000激光粒度分析仪测定乳液的平均粒径大小,分别将各组乳液分散于800 mL蒸馏水中,添加样品使遮光度达到10%—13%,重复测定3次取其平均值。
1.3.13 界面蛋白分布 参考JIANG等[20]的方法,将乳状液在15 000×离心30 min,得到乳化层和乳清层。取下部乳清层在15 000×再次离心30 min,小心吸取下层清液,并通过0.22 µm滤膜。将得到的滤液稀释到一定浓度,用双缩脲法测定蛋白含量。PPI在两相中分配系数(partition coefficient,PC)的计算:
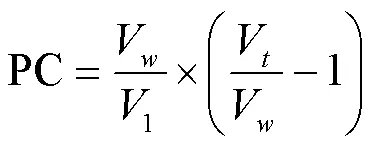
式中,V:水相体积(mL);l:油相体积(mL);W:总蛋白含量(mg∙mL-1);W:水相中蛋白含量(mg∙mL-1)。油的密度按0.922 g∙mL-1计算。水相中PPI占总PPI的比例计算公式为(Ww/Wt)×100%;界面上PPI所占比例通过总PPI和水相中PPI的含量之差计算。
1.3.14 ζ电位的测定 用0.01 mol∙L-1的磷酸盐缓冲液(pH 7.0)将乳状液稀释至质量分数0.5 mg∙mL-1,使用激光纳米粒度仪测定。
1.3.15 剪切黏度的测定 根据文献[21]的方法并稍作修改后,采用Haake-Mars 60流变仪测定乳液的黏度随剪切速率的变化。测定选用直径为35 mm的不锈钢平行板转子,设定间距为1 mm,测定温度25℃,平衡时间3 min,剪切速率从0.1到100 s-1。
1.3.16 乳液微观结构的测定 为了评估油滴的大小和分布,采用激光共聚焦荧光显微镜观察乳液的微观结构。参照LI等[22]的方法并略作修改,取1 mL乳液与40 μL混合染液(0.01%尼罗红和0.01%尼罗蓝)充分混合均匀,取8 μL染色乳液放在显微镜载玻片上,盖上盖玻片后避光反应0.5 h。在显微镜下观察时,使用488 nm(氩激光)和633 nm(氦氖激光)的激发波长观察油滴的分布,用63×油浸物镜采集图像。
1.4 统计分析
使用Statistix 9.0分析软件通用线性模型程序(Analytical Software,Tallahassee,FL,USA)对试验数据进行方差分析。采用LSD全配对多重比较方法进行显著性分析,值设置为0.05。试验数据以平均数±标准差(SD)表示,并使用Origin 8.5软件绘图。
2 结果
2.1 超声波处理对PPI结构的影响
2.1.1 对PPI侧链氨基酸功能基团的修饰 如图1所示,未超声处理的PPI中总巯基含量约为18.68 nmol∙mg-1,随着超声处理时间的延长,总巯基含量总体呈显著下降趋势。当超声时间为60 min时,总巯基含量最低,为12.87 nmol∙mg-1,相比未超声处理下降了31%(<0.05)。未超声处理的PPI中自由氨基含量为85.3 nmol∙mg-1,20 min超声后其自由氨基含量降低了12.9%(<0.05)。超声时间30、40 min时,自由氨基含量又有所提高,在超声处理60 min时,PPI的自由氨基含量最低,为68.4 nmol∙mg-1,相比未超声处理下降了19.81%(<0.05)。
2.1.2 对PPI二级结构的影响 蛋白质分子内多肽链由-螺旋、-折叠、-转角以及无规则卷曲等特定的立体结构构成,这些结构的变化可反映蛋白二级结构的变化。由图2可以看出,超声处理对PPI二级结构的影响比较显著,引起了二级结构之间的相互转化。在超声处理0—40 min时,PPI的-螺旋结构比例随超声时间延长而降低,同时-折叠结构比例随超声时间延长而增加。在超声处理40 min时,-螺旋结构比例最低,为8.80%,而-折叠结构比例达到最高,为38.18%,表明适度超声处理诱导蛋白质分子更加舒展、柔性增强。然而当超声时间继续延长至60 min时,-螺旋比例又有所上升,同时-折叠比例有所下降。
2.1.3 对PPI三级结构的影响 蛋白质色氨酸残基的荧光特性对其微环境非常敏感,其变化可以反映蛋白质三级结构的变化[8]。如图3所示,未经处理的PPI处于折叠状态,色氨酸残基处在蛋白内部的疏水性环境中,具有较大的荧光强度;经超声处理20—40 min后,PPI的内源荧光强度随超声时间延长而显著降低,这是由于适度超声处理导致蛋白质结构展开(图2),色氨酸残基暴露于亲水性溶剂中所致[8];当超声时间继续延长至60 min时,PPI的荧光强度显著增强,再一次说明PPI发生了重聚。
2.2 超声处理对PPI解聚、交联情况及溶解度的影响
2.2.1 对PPI粒径分布和溶解度的影响 图4为不同超声时间处理条件下PPI的平均粒径和溶解度。相对于未处理的PPI,超声波处理的PPI平均粒径显著降低了70%以上(<0.05),在超声时间20—60 min时,PPI粒径随超声处理时间延长而逐渐降低,60 min时最低,为95.47 nm。这可能是由于超声波的空穴效应使溶液形成湍流,产生的机械剪切力将PPI聚集体打散[23]。
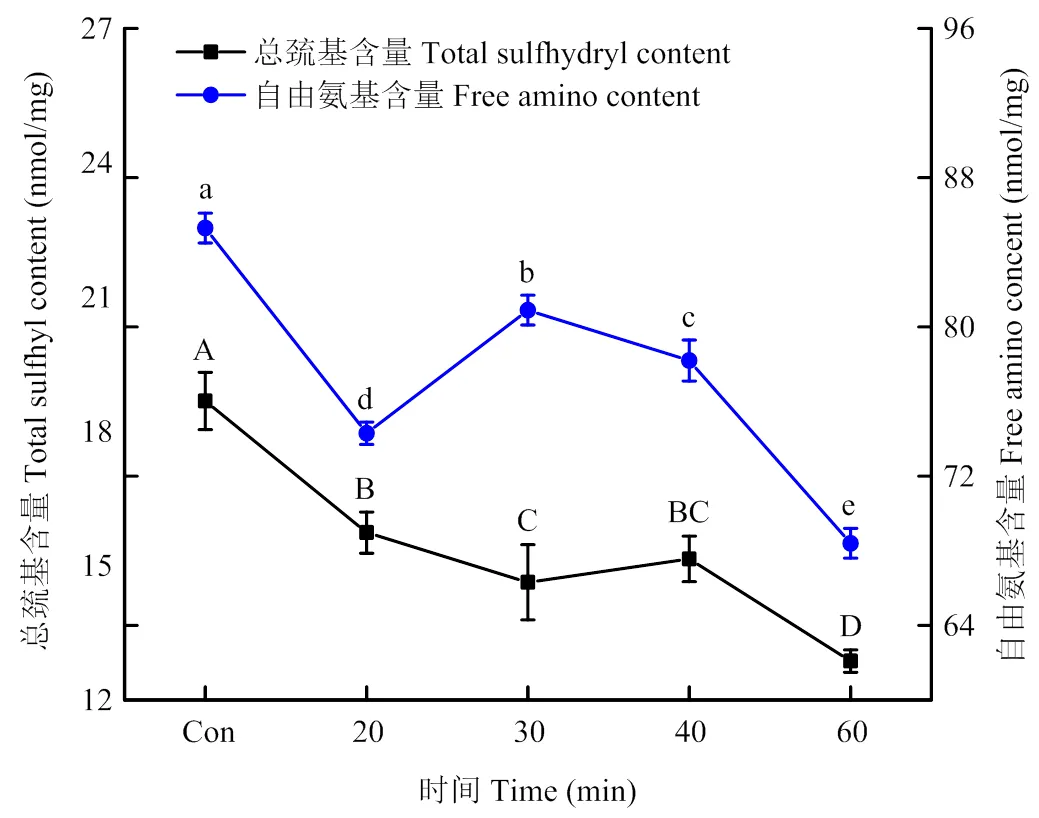
Con:未超声处理。不同小写字母和不同大写字母分别代表同一指标在不同处理间差异显著(P<0.05)。下同
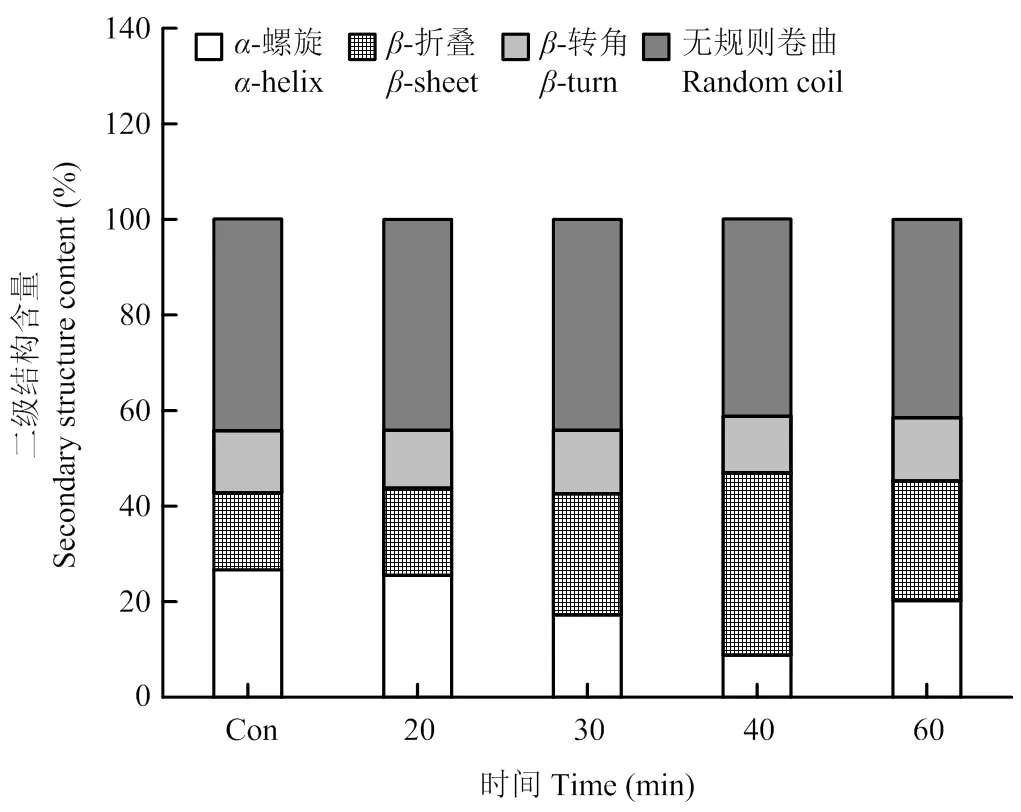
图2 不同超声处理时间对PPI二级结构的影响
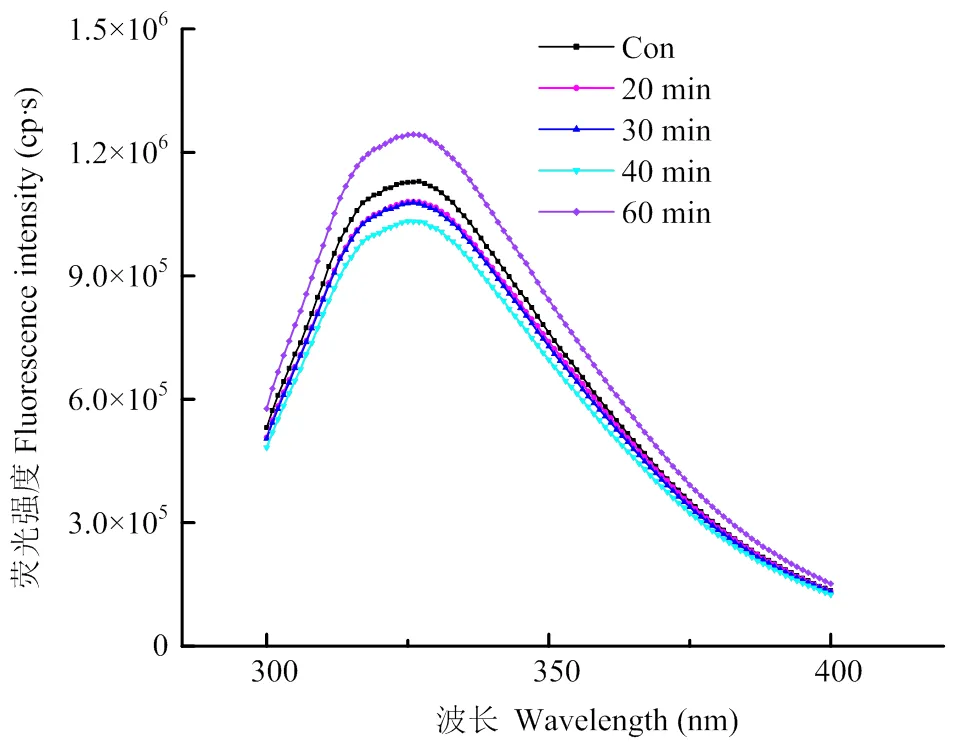
图3 不同超声处理时间对PPI内源性色氨酸荧光的影响
溶解度是蛋白重要的功能特性之一,可以间接反映蛋白分子间以及蛋白与水分子间的相互作用力。超声处理对PPI溶解性的影响如图4所示。在20—40 min时,超声处理能显著提高豌豆分离蛋白的溶解度,在超声条件为40 min时,溶解度达到最大,为85.27%,相比于未处理的PPI,溶解度上升了10.97%,存在显著性差异(<0.05)。谢为峰[14]也研究发现,在一定范围内,超声处理时间越久,杏仁粕蛋白的溶解度越大。然而超声处理60 min使PPI的溶解度降低为75.95%,与未处理PPI的溶解度相当,差异不显著(>0.05)。
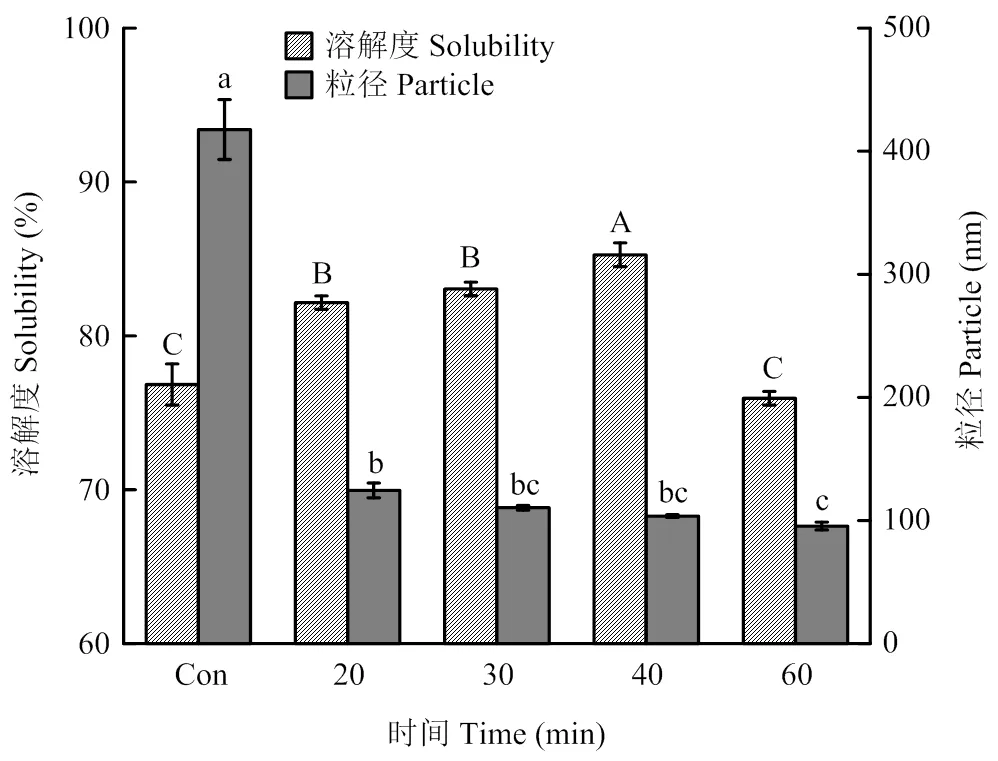
图4 不同超声时间处理对PPI粒径和溶解度的影响
2.2.2 超声处理对PPI亚基的影响 PPI主要包含豆球蛋白(legumin,11S)、豌豆球蛋白(vicilin,7S)以及伴豌豆球蛋白(convicilin)[24]。11S球蛋白由六对非共价亚基组成,每对亚基由一个酸性亚基(leg A)和一个碱性亚基(leg B)通过一个二硫键连接而成。7S球蛋白是三聚体,其亚基通过疏水作用而非二硫键结合在一起。Convicilin相对分子质量为71—75 kD,它含有含硫氨基酸和一个高电荷的N-端延伸。20—40 min超声波处理对PPI的亚基条带无显著影响(图5),但60 min超声波处理时,部分11S、7S球蛋白亚基条带变浅(图5),同时在11—14.4 kD,小分子蛋白质条带加深(图5-A),这说明高强度超声处理导致PPI的部分11S和7S球蛋白亚基断裂形成了小分子物质。这一研究结果与包中宇[25]等利用超声波改性大豆蛋白的研究结果类似。由于11S和7S两种蛋白均以-折叠结构为主,过度超声引起的11S和7S球蛋白亚基减少可能是其导致PPI中-折叠结构降低(图2)的重要原因。还原性条件下,在11—14.4 kD附近的小分子条带基本消失,说明这些小分子之间存在二硫键,高强度超声处理导致PPI巯基含量显著降低(图1)也从侧面印证了这一推测。
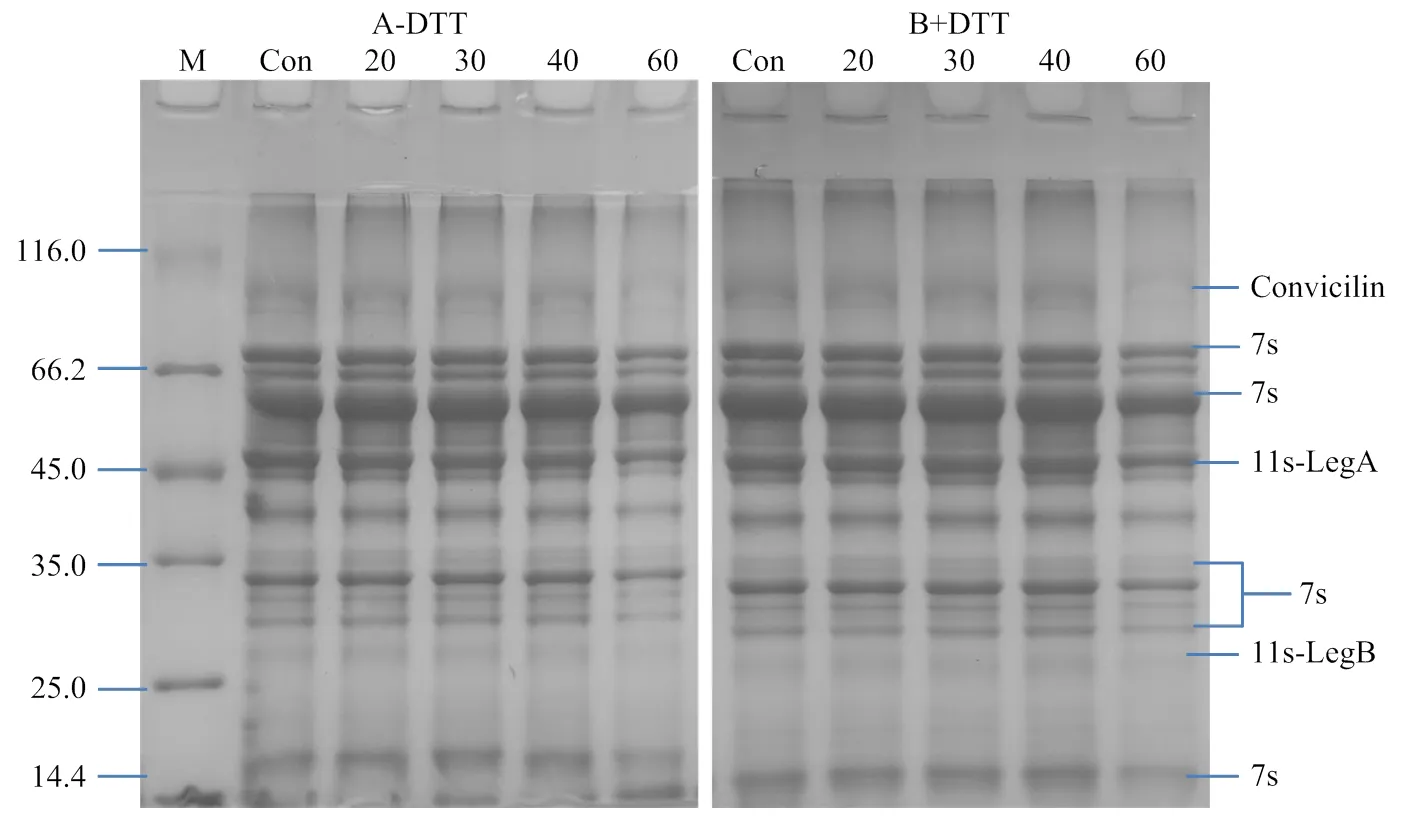
图5 不同超声时间处理对PPI亚基的影响
2.3 超声处理对PPI乳化性能的影响
2.3.1 对PPI乳化活性的影响 如图6所示,PPI的乳化活性随着超声时间(0—30 min)的延长而逐渐增加,当超声时间达到30 min时,蛋白质的乳化性达到最大,为18.45 m2∙g-1;相比未处理的蛋白,乳化活性提高了20.1%(<0.05)。超声处理40 min时,PPI的乳化活性与30 min处理无显著差异(>0.05)。当超声处理时间为60 min时,PPI的乳化活性明显降低,但仍略高于未处理PPI的乳化活性。因此,适度的超声处理对于PPI乳化活性的提高具有积极的影响。
2.3.2 对PPI乳液粒径分布和Zeta电位的影响 液滴直径是评估乳液乳化稳定性的重要参数[26]。由图7-A可以看出,未改性豌豆蛋白乳状液的粒径分布曲线含有3个峰,其平均粒径为15.11 μm。与未改性PPI乳液相比,超声波处理过的PPI(U-PPI)制备的乳状液,其乳液的粒径分布更加集中,平均粒径明显降低(<0.05)。经超声处理20、30和40 min的U-PPI所制备的乳液,其粒径分布曲线含有2个峰;经60 min改性处理过的PPI制备的乳液,其粒径分布曲线为单峰。与此相对应,随着超声处理时间延长,U-PPI所制备的乳液,其粒径大小呈下降趋势。60 min改性处理过的U-PPI制备的乳液,平均粒径为2.78 μm,相比未改性PPI乳液的平均粒径减小了81.6%(<0.05)。
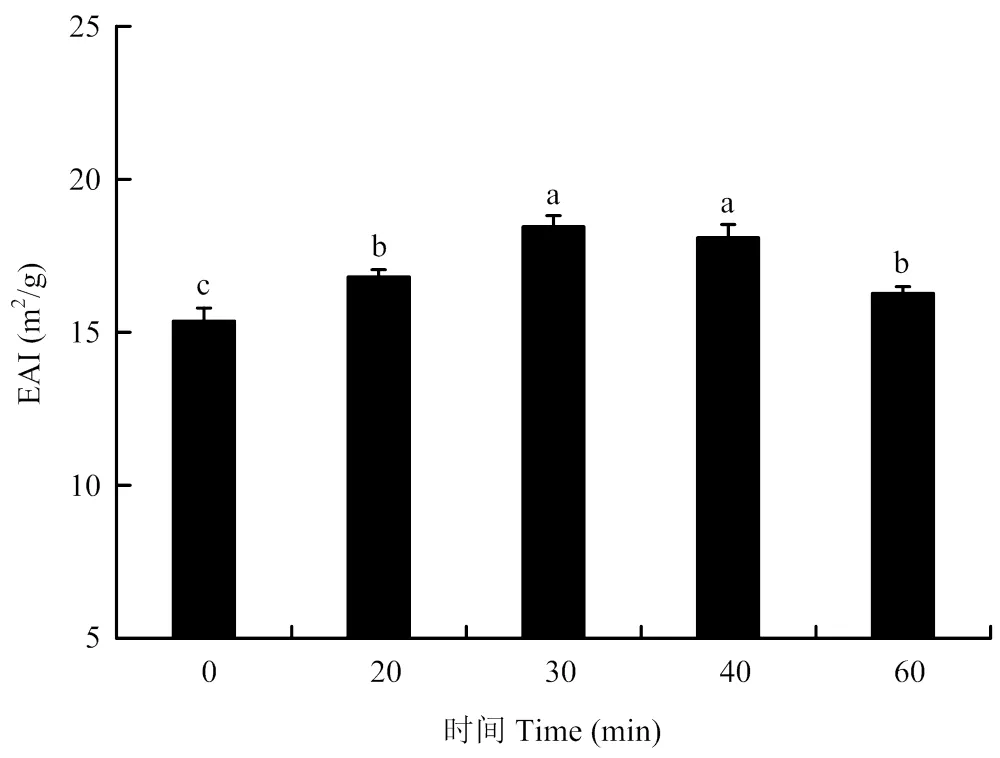
图6 不同超声时间处理对PPI乳化活性的影响
Zeta电位可以反映物质表面电位的变化,是衡量食品乳液中液滴之间静电相互作用水平和乳液体系稳定性的关键参数。如图7-B所示,与未处理的PPI乳液相比,U-PPI制备的乳液,其Zeta电位绝对值明显升高(<0.05)。超声处理20和30 min的U-PPI制备的乳液,其Zeta电位值无显著差异,此后随超声处
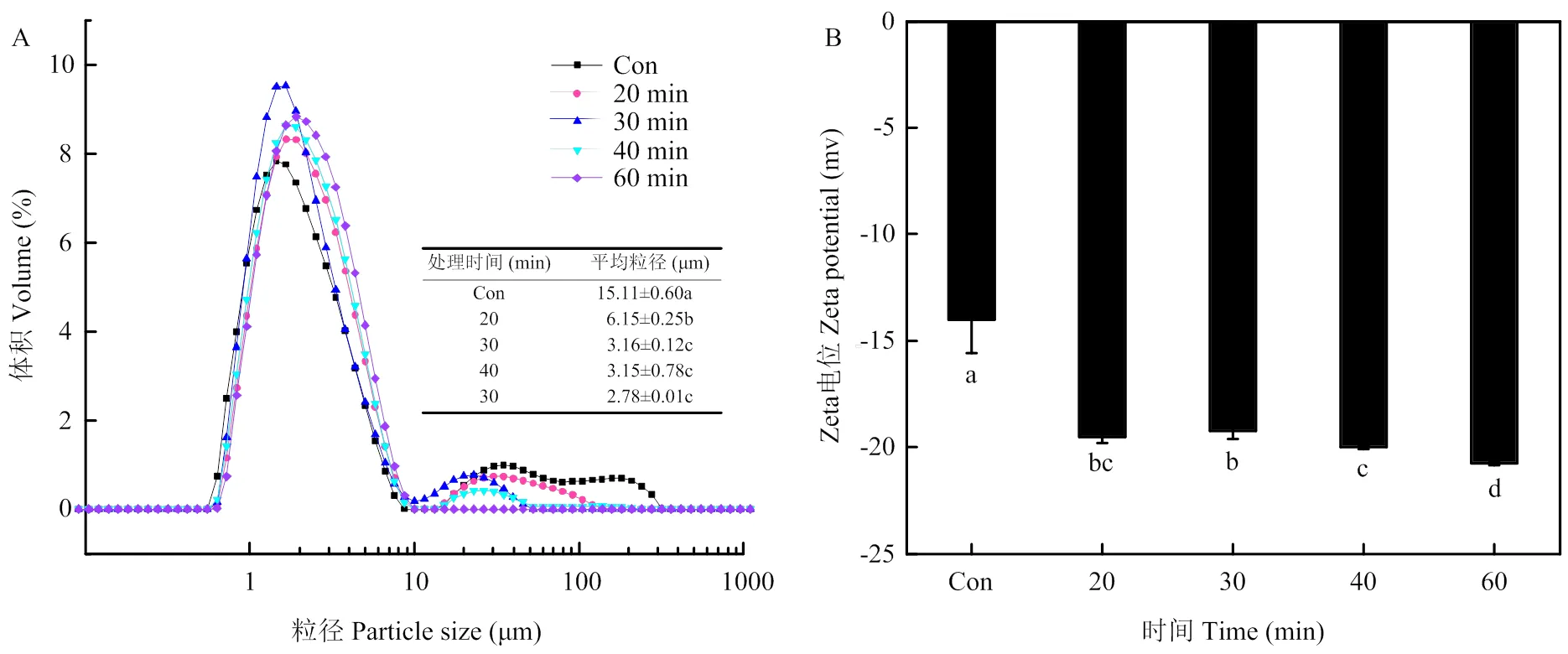
图7 不同超声时间处理对PPI乳液粒径分布和Zeta电位的影响
理时间延长,U-PPI所制备乳液的电位绝对值逐渐升高,在60 min时,Zeta电位的绝对值达到最高,相比于未处理PPI提高了48.2%(<0.05)。这可能是由于超声能够促使一些带电荷的氨基酸残基暴露,覆盖在油滴上提高了界面电荷并改变了界面的电双层。Zeta电位绝对值的增加表明乳液液滴之间的静电斥力增加,预示着乳液体系稳定性的提高。
2.3.3 对PPI乳液界面蛋白分布的影响 未处理的PPI乳液的水相蛋白含量最高,而两相界面蛋白含量最低。超声处理可以显著提高PPI在油水两相界面上的分布:当超声时间为20—30 min时,超声波处理过的U-PPI制备乳液的界面蛋白含量随超声时间延长而增加,且超声处理30 min时,其界面蛋白含量最高,为72.67%,相比未处理组提高了17.2%(<0.05)。但当超声时间为40—60 min时,界面蛋白含量随超声时间延长呈现减少趋势(表1)。
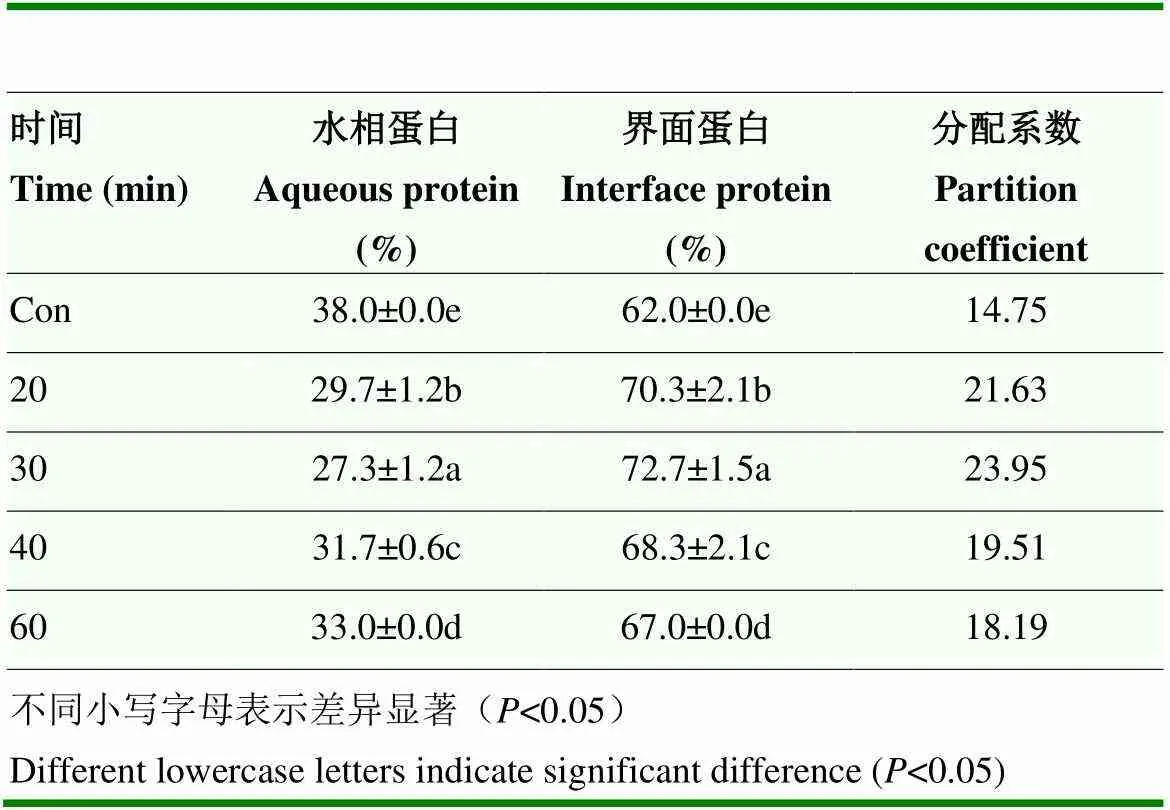
表1 不同超声时间处理对PPI乳液界面蛋白分布的影响
2.4 对PPI乳液剪切黏度的影响
超声处理会影响PPI乳液的表观黏度,不同乳液的表观黏度随着剪切速率的变化曲线如图8所示。未超声处理PPI的乳液初始黏度为0.06 Pa·s,随着剪切速率的增加,乳液的表观黏度呈现下降趋势,表现出剪切变稀的特性。超声处理可以显著提高PPI乳液的表观黏度,但不会改变乳液的剪切变稀特性[27]。其中超声处理40 min时,U-PPI制备乳液的表观黏度值最大,相比未处理的PPI乳液,其初始黏度提高了33.3%。超声处理20、30和60 min时,U-PPI制备的乳液表观黏度相差不大,但均显著高于未改性PPI乳液。超声对乳液表黏度的影响可能与其对蛋白质在界面膜上的吸附重构调控有关[28]。
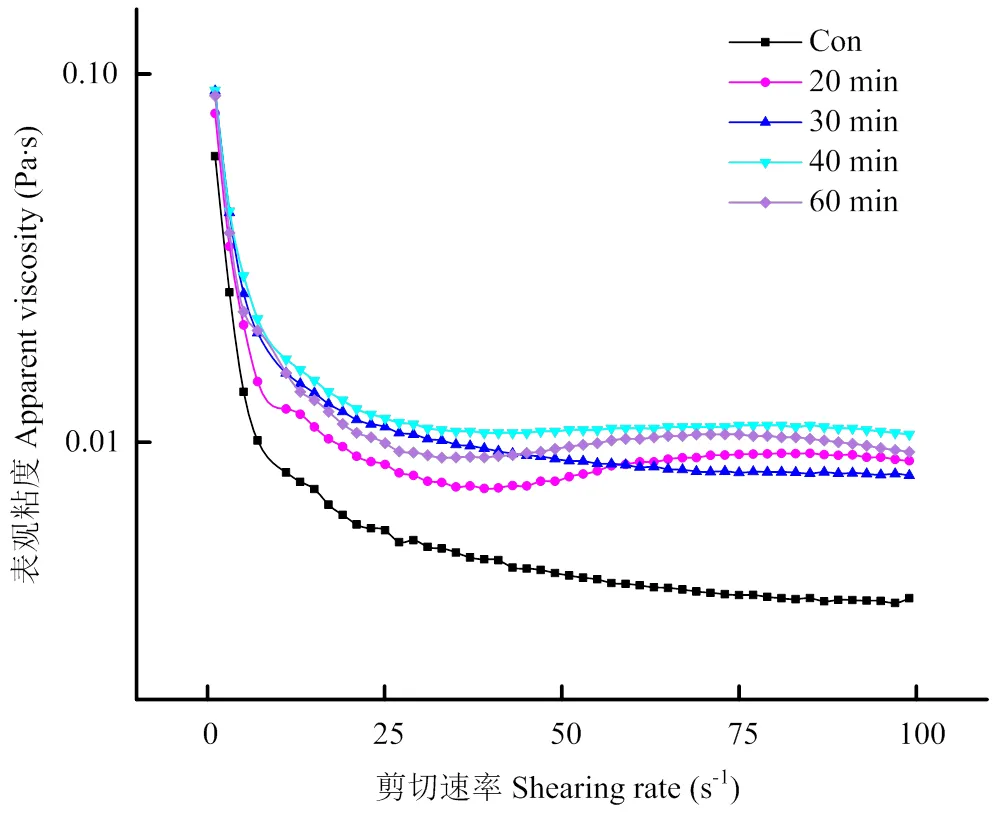
图8 不同超声时间处理对PPI乳液表观粘度的影响
2.5 对PPI乳液微观结构的影响
通过观察PPI乳液的微观结构(图9)可以反映乳液中油滴和蛋白质间相互作用和分布情况,进一步揭示超声处理对PPI乳化性能的影响[22,29]。本研究采用488 nm(氩激光)和633 nm(氦氖激光)的激发波长分别观察油滴(红色)和水相蛋白质(蓝色)的分布情况。未超声处理的PPI乳液,其油滴尺寸较大,分布不均匀,有一些油滴共用蛋白发生了聚集。而20—40 min超声处理U-PPI制备的乳状液,其油滴呈现颗粒分明的球状,分布更加均匀;且随着超声处理时间的延长,乳液粒径变小,分散也更加均匀。而60 min超声处理过的U-PPI制备的乳状液,其乳液颗粒体积增大,呈不规则球状或串珠状,液滴形态多样且分布不均一,说明过长时间的超声作用不利于PPI形成稳定的乳液。
3 讨论
3.1 超声处理改变了PPI的结构
蛋白质的结构与其乳化性等加工性能密切相关,超声诱导的PPI结构改变表现为氨基酸侧链基团修饰、CD图谱及内源性色氨酸荧光光谱的变化。总巯基和自由氨基含量可以反映超声诱导的PPI一级结构的变化。本研究发现随着超声时间的延长,PPI的总巯基含量显著下降,推测是超声波作用产生大量具有高能量和高热量的空穴气泡,促进了体系中自由基的形成,诱发了蛋白的氧化,导致巯基转化为二硫键。与之类似,GÜLSEREN[30]在研究超声处理BSA时,发现随着超声时间的延长,BSA的巯基含量逐渐降低。谢为峰[14]研究发现低强度的超声处理可诱导杏仁粕蛋白分子内巯基含量减少,二硫键含量增加。但HU等[31]发现超声处理(15或30 min)后大豆分离蛋白的游离巯基含量显著升高,作者认为超声导致蛋白中原有的二硫键断裂、巯基含量升高。因此,超声对于蛋白巯基含量的影响可能与不同超声条件、蛋白种类和蛋白分子的原始空间结构等不同有关。同样,超声处理也引起了PPI中自由氨基含量的降低,可能是由于超声波的热效应和空穴效应促使体系产生自由基,攻击PPI中赖氨酸侧链的-NH2基团,经脱氨基反应生成羰基,生成的羰基可以进一步与NH2发生羰氨反应或与组氨酸(His)、赖氨酸(Lys)生成Schiff碱,使自由氨基含量进一步降低(图1)[32-33]。
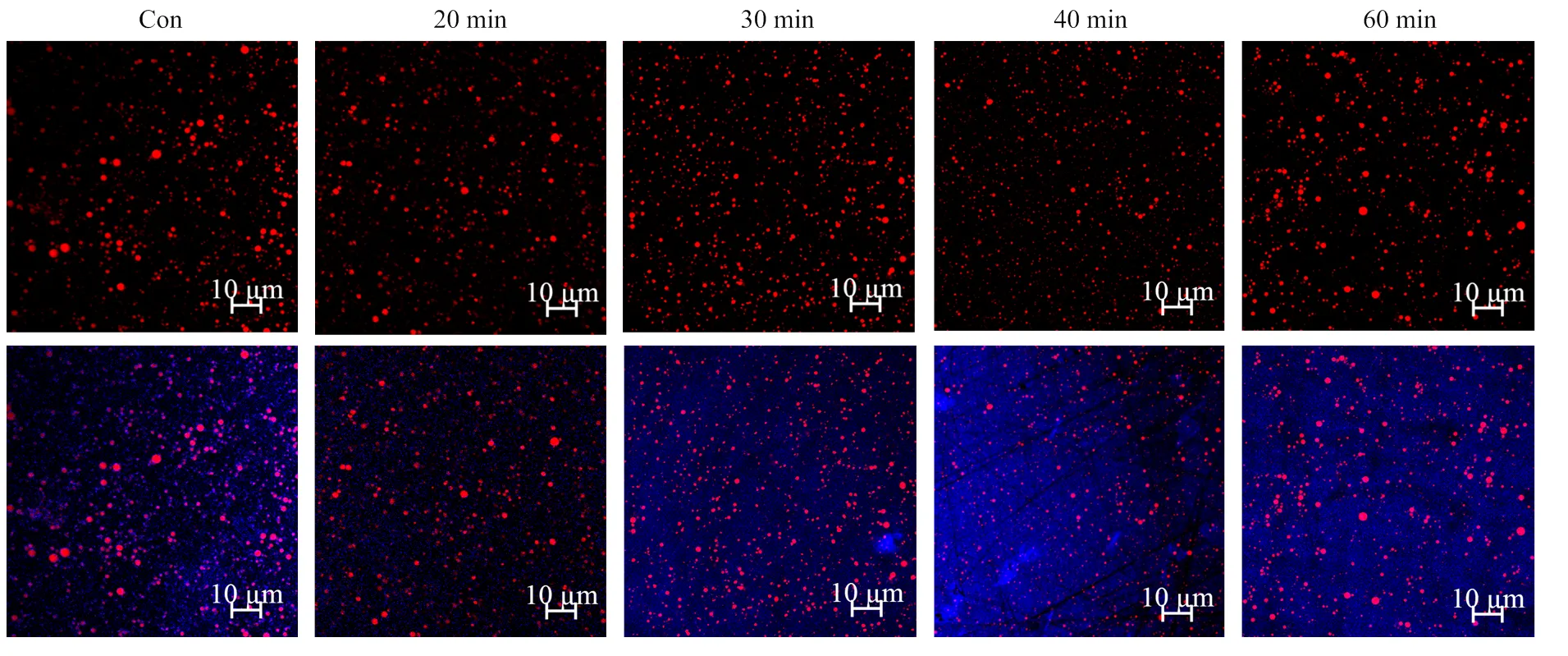
尼罗红和尼罗蓝分别用来染油滴(红色)和水相蛋白质(蓝色),上图为单独油滴分布,下图为油滴在水相中的分布情况
圆二图谱可以提供蛋白质二级结构的信息,反映蛋白质中-螺旋、-折叠、-转角以及无规则卷曲结构的变化。20—40 min超声处理会破坏蛋白质分子的完整性(图2)。推测是超声的空化作用引起PPI肽链氨基酸上羰基和酰胺基团之间的氢键断裂,-超螺旋结构解旋,促使维系蛋白二级结构的刚性部分减弱,使PPI的构象向柔性部分转变,蛋白结构更加舒展。这与报道的超声诱导大豆蛋白[34-35]、米糠蛋白[36]等的二级结构含量变化类似。当超声处理60 min时,PPI的二级结构改变出现相反变化:-螺旋含量上升、-折叠含量下降,这说明过度超声处理会使蛋白质展开的二级结构通过分子间相互作用重新聚集。
超声处理显著地影响了PPI的三级结构(图3),超声波的空穴作用使埋藏于分子内部的疏水基团暴露,被包围在PPI内部疏水性核心的色氨酸残基暴露到溶剂中,表现为PPI的荧光强度降低。与CD结果相对应:在超声时间0—40 min,PPI在最大发射峰处的荧光强度随着超声时间延长而降低,说明超声后PPI的三级结构发生改变,局部蛋白结构展开。在大豆蛋白[25]、牡蛎蛋白[37]和辣木种子蛋白[38]的超声改性研究中,也发现内源性色氨酸荧光强度下降的现象。然而过长时间(60 min)的超声处理导致PPI内源荧光强度显著上升,这可能是由于过度超声导致结构展开的蛋白分子间疏水相互作用及共价相互作用加剧,从而形成了新的聚集物。
3.2 适度超声处理能够降低PPI的粒径,提高其溶解性
PPI结构上的改变可以引起其他理化性质方面的变化。超声处理可能会对PPI分子间氢键和分子间疏水相互作用造成破坏,从整体上降低蛋白分子之间的化学相互作用力[39-40],进而对PPI的平均粒径及溶解度造成影响。本研究中,超声波诱导的蛋白解聚作用使PPI粒径显著变小,且粒径大小随超声处理时间(0–60 min)的延长而逐渐降低(图4)。ARZENI等[26]在研究超声波处理卵清蛋白、大豆蛋白和蛋清蛋白时发现超声处理能够降低团聚体的粒径,推测是由于超声波的空化效应和机械效应等作用,使大颗粒的蛋白聚集体解聚成较小颗粒的蛋白分子。蛋白质的溶解度受到很多因素的影响,如蛋白质的结构、粒度、蛋白分子大小等。试验结果显示(图4),较短时间(0— 40 min)超声后,蛋白质的溶解性随超声时间的延长而显著增加,这个结果和国内外的相关研究一致[8,35]。这是因为:(1)适度超声处理能够修饰PPI结构,促使更多的亲水基团暴露,强化蛋白质-水以及蛋白质-蛋白质之间的相互作用,形成了更多可溶解的蛋白;(2)适度超声处理减小了PPI粒度,使其与水接触的表面积增大,蛋白更容易发生水化作用。但随改性处理的持续进行(60 min),高强度超声作用会导致PPI的溶解度降低。与本研究结果基本一致,SUI等发现[41]短时间(450 W、12 min)超声有利于提高大豆分离蛋白的溶解度,但处理时间的增加(24 min)会导致溶解度的降低。这可能是高强度超声作用会诱发蛋白空间结构的过度修饰,暴露的亲水基团被重新包埋,疏水相互作用及共价作用促使蛋白重新聚集,溶解度降低。
3.3 适度超声处理提高了PPI的乳化活性和乳液稳定性
超声波处理通过影响PPI的氨基酸侧链活性基团和空间构象,进而调控其理化和功能特性。乳化性是蛋白质的一项重要的功能性质,主要包括乳化活性和乳化稳定性两方面。PPI的乳化性受到蛋白的结构柔韧性、表面性质、蛋白粒径和溶解度等重要因素的影响[12,16,42]。在本研究中,适度超声处理(20—40 min)能够显著提高PPI的乳化活性,尤其是40 min超声处理效果最好。这主要是因为超声空化效应可诱导PPI解聚分散为粒径小且均一、可溶性高(图4)、扩散速度快的球蛋白,并促使蛋白质分子链的快速运动和去折叠(图2),暴露出更多的疏水基团(图3),增强了蛋白分子在油水界面吸附及定向重排(使疏水性基团位于油相中,亲水基团处于水相中)的能力,进而在油水界面形成一层结构致密的粘弹性膜(表1)[4,21,43]、提高了PPI的乳化活性(图6)和乳液稳定性(图7—9)。与之类似,TAHA等[44]在超声改性大豆蛋白中也发现蛋白质颗粒越小,更容易快速扩散到油滴表面,通过重新排列成膜降低了界面张力,避免了油滴聚集。O'SULLIVAN等[11,27]发现用超声波处理过的SPI制备的乳剂具有增强的界面层和更大的静电斥力。CHEN等[35]研究发现超声与酶解复合改性可以改善大豆蛋白的分子柔性、提高其溶解度和蛋白质在油水界面的吸附分数,显著提高了其乳化活性和乳化稳定性。
然而过长时间(60 min)的超声处理会加剧PPI的氧化程度(图1),增强蛋白分子之间疏水相互作用,促进蛋白分子之间二硫键和其他共价键的形成,导致PPI重新聚集、溶解度及分子柔性降低,在界面膜上的吸附和重排效率变低,降低了PPI的乳化性能。综上所述,通过合理控制超声改性强度可以有效调控PPI的结构及理化性质,进而改善其乳化性能。
4 结论
不同时间超声处理显著修饰了PPI的结构,进而改变了其乳化性能。其中30—40 min的超声处理能最大程度地增加PPI的-折叠含量,提高蛋白分子柔性,明显降低了PPI的粒径大小,提高了其溶解度,促进PPI在油水界面的吸附和重排,显著提高了PPI的乳化活性和乳液稳定性。因此,适度超声改性是提高豌豆分离蛋白乳化性能的有效方法,对扩大豌豆蛋白作为一种重要功能成分在食品和饮料工业中的应用具有重要的价值。
[1] NESTERENKO A, ALRIC I, SILVESTRE F,DURRIEU V. Influence of soy protein's structural modifications on their microencapsulation properties: α-Tocopherol microparticle preparation. Food Research International, 2012, 48(2): 387-396.
[2] 李慧, 王琪, 付鑫, 王鑫烁, 周泉城. 豌豆蛋白挤出物制备抗氧化肽工艺优化及其分离. 食品工业科技, 2018, 39(6): 165-169.
LI H, WANG Q, FU X, WANG X S, ZHOU Q C. Optimization of preparation technology and separation of antioxidant peptides from pea protein extrudate. Science and Technology of Food Industry, 2018, 39(6): 165-169. (in Chinese)
[3] HAFIZ R S, PETER A. W, MIAN K S, SHABBAR A, HAMID M, KINGSLEY G M, WASEEM S, FANG Z. Current progress in the utilization of native and modified legume proteins as emulsifiers and encapsulants-A review. Food Hydrocolloids, 2018, 76: 2-16.
[4] 孙英杰. 超声波处理对大豆分离蛋白结构和功能性质影响研究[D]. 哈尔滨: 东北农业大学, 2014.
SUN Y J. Study on the effect of ultrasonic treatments on the structure and functional properties of SPI [D]. Harbin: Northeast Agricultural University, 2014. (in Chinese)
[5] PENG W W, KONG X Z, CHEN Y M, ZHANG C M, YANG Y X, HUA Y F. Effects of heat treatment on the emulsifying properties of pea proteins.Food Hydrocolloids, 2016, 52: 301-310.
[6] YIN S W, TANG C H, WEN Q B, YANG X Q, LI L. Functional properties andtrypsin digestibility of red kidney bean (L.) protein isolate: Effect of high-pressure treatment. Food Chemistry, 2008, 110(4): 938-945.
[7] SILVA J L, WEBER G. Pressure stability of proteins. Annual Review of Physical Chemistry, 1993, 44: 89-113.
[8] SHEN L, TANG C H. Microfluidization as a potential technique to modify surface properties of soy protein isolate. Food Research International, 2012, 48(1): 108-118.
[9] 李燕燕. 改性提高大米蛋白体外消化率的研究[D]. 无锡: 江南大学, 2015.
LI Y Y. Study on improving digestibility in vitro of rice protein by modification [D]. Wuxi: Jiangnan University, 2015. (in Chinese)
[10] WANG F, ZHANG Y Z, XU L, MA H L. An efficient ultrasound- assisted extraction method of pea protein and its effect on protein functional properties and biological activities. LWT-Food Science and Technology, 2020, 127: 109348.
[11] O′SULLIVAN J, PARK M, BEEVERS J. The effect of ultrasound upon the physicochemical and emulsifying properties of wheat and soy protein isolates. Journal of Cereal Science, 2016, 69: 77-84.
[12] 李笑笑. 高场强超声波处理对大豆分离蛋白结构及乳化性的影响[D]. 广州: 华南理工大学, 2020.
LI X X. Effect of high intensity ultrasonic treatment on structure and emulsification of soy protein isolate [D]. Guangzhou: South China University of Technology, 2020. (in Chinese)
[13] CHANDRAPALA J, OLIVER C, KENTISH S, ASHOKKUMAR M. Ultrasonics in food processing. Ultrasonics Sonochemistry, 2012, 19(5): 975-983.
[14] 谢为峰, 罗丰收, 解超男, 王胜, 孔令明. 超声波处理对杏仁粕蛋白质理化和功能性质的改性研究. 农产品加工, 2016(9): 1-3, 7.
XIE W F, LUO F S, XIE C N, WANG S, KONG L M. Modification of ultrasonic treatment of almond meal protein physicochemical and functional properties. Farm Products Processing, 2016(9): 1-3, 7.(in Chinese)
[15] JIANG J, CHEN J, XIONG Y L. Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes. Journal of Agricultural and Food Chemistry, 2009, 57(16): 7576-7583.
[16] 丁芳芳, 田少君, 常慧敏, 章绍兵. 超声改性豌豆蛋白乳状液稳定性的研究. 中国油脂, 2020, 45(2): 76-110, 116.
DING F F, TIAN S J, CHANG H M, ZHANG S B. Modification of emulsion stability of pea protein by ultrasonic technology. China Oils and Fats, 2020, 45(2): 76-110, 116. (in Chinese)
[17] LERTITTIKUL W, BENJAKUL S, TANAKA M. Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH. Food Chemistry, 2007, 100(2): 669-677.
[18] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D]. 无锡: 江南大学, 2016.
CAO Y G. Effects of plant-derived polyphenols on oxidative stability and functional properties of meat proteins: mechanism and application [D]. Wuxi: Jiangnan University, 2016. (in Chinese)
[19] LIU G, XIONG Y L. Electrophoretic pattern, thermal denaturation, anddigestibility of oxidized myosin. Journal of Agricultural and Food Chemistry, 2000, 48(3): 624-630.
[20] JIANG J, ZHANG X, TRUE A D, ZHOU L, Xiong Y L. Inhibition of lipid oxidation and rancidity in precooked pork patties by radical-scavenging licorice () extract. Journal of Food Science, 2013, 78(11): C1686-C1694.
[21] WANG Q L, JIANG J, XIONG Y L. High pressure homogenization combined with pH shift treatment: a process to produce physically and oxidatively stable hemp milk. Food Research International, 2018, 106: 487-494.
[22] LI Y Y, LIU H T, LIU Q, KONG B H, DIAO X P. Effects of zein hydrolysates coupled with sage () extract on the emulsifying and oxidative stability of myofibrillar protein prepared oil-in-water emulsions. Food Hydrocolloids, 2019, 87: 149-157.
[23] CARBONARO M, MASELLI P, NUCARA A. Relationship between digestibility and secondary structure of raw and thermally treated legume proteins: a Fourier transform infrared (FT-IR) spectroscopic study. Amino Acids, 2012, 43(2): 911-921.
[24] 夏轩泽, 李言, 钱海峰, 张晖, 齐希光, 王立. 豌豆蛋白乳化性及其改善研究进展. 食品与发酵工业, 2021, 47(2): 279-284.
XIA X Z, LI Y, QIAN H F, ZHANG H, QI X G, WANG L. Research progress on improvement the emulsification property of pea protein. Food and Fermentation Industries, 2021, 47(2): 279-284. (in Chinese)
[25] 包中宇. 超声波技术对大豆分离蛋白功能性质、结构及凝胶特性的影响[D]. 南昌: 南昌大学, 2015.
BAO Z Y. Effects of functional, structural and gelation property of soybean protein isolate treated by ultrasound [D]. Nanchang: Nanchang University, 2015. (in Chinese)
[26] ARZENI C, MARTINEZ K, ZEMA P, ARIAS A, PÉREZ O E, PILOSOF A M R. Comparative study of high intensity ultrasound effects on food proteins functionality. Journal of Food Engineering, 2012, 108(3): 463-472.
[27] O'SULLIVAN J, MurrayB, FLYNNC C, NORTONA I. The effect of ultrasound treatment on the structural, physical and emulsifying properties of animal and vegetable proteins. Food Hydrocolloids, 2016, 53: 141-154.
[28] BEN-HARB S, PANOUILLÉ M, HUC-MATHIS D, MOULIN G, SAINT-EVE A, IRLINGER F, BONNARME P, MICHON C, SOUCHON I. The rheological and microstructural properties of pea, milk, mixed pea/milk gels and gelled emulsions designed by thermal, acid, and enzyme treatments. Food Hydrocolloids, 2018, 77: 75-84.
[29] 卢菊慧. 豌豆蛋白的乳化特性及其影响机制研究[D]. 无锡: 江南大学, 2018.
LU J H. Study on the emulsifying property of pea protein and its influencing mechanism [D]. Wuxi: Jiangnan University, 2018. (in Chinese)
[30] GÜLSEREN I, GÜZEY D, BRUCE B D, WEISS J. Structural and functional changes in ultrasonicated bovine serum albumin solutions. Ultrasonics Sonochemistry, 2007, 14(2): 173-183.
[31] Hu H, Wu J H, EUNICE C Y, ZHU L, ZHANG F, XU X Y, FAN G, WANG L F, HUANG X J, PAN S Y. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions. Food Hydrocolloids, 2013, 30(2): 647-655.
[32] LIANG H N, TANG C H. Emulsifying and interfacial properties of vicilins: Role of conformational flexibility at quaternary and/or tertiary levels. Journal of Agricultural and Food Chemistry, 2013, 61(46): 11140-11150.
[33] LIU G, XIONG Y L, BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolates. Journal of Food Science, 2000, 65(5): 811-818.
[34] CHEN N N, ZHAO Q Z, SUN W Z, ZHAO M M. Effects of malondialdehyde modification on the in vitro digestibility of soy protein isolate. Journal of Agricultural and Food Chemistry, 2013, 61(49): 12139-12145.
[35] CHEN L, CHEN J S, REN J Y, ZHAO M M. Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates. Journal of Agricultural and Food Chemistry, 2011, 59(6): 2600-2609.
[36] 常慧敏, 杨敬东, 田少君. 超声辅助木瓜蛋白酶改性对米糠蛋白溶解性和乳化性的影响. 中国油脂, 2019, 44(4): 35-40.
CHANG H M, YANG J D, TIAN S J. Influence of ultrasound-assisted papain modification on solubility and emulsification of rice bran protein. China Oils and Fats, 2019, 44(4): 35-40.(in Chinese)
[37] 吴凡. 物理加工对牡蛎()蛋白结构和功能性质的影响[D]. 大连: 大连工业大学, 2019.
Wu F. Effects of physical processing on structure and functional properties of oysters protein [D]. Dalian: Dalian University of Technology, 2019. (in Chinese)
[38] TANG S Q, DU Q H, FU Z. Ultrasonic treatment on physicochemical properties of water-soluble protein fromseed. Ultrasonics Sonochemistry, 2021, 71: 105357.
[39] WANG Y S, ZHAO J, ZHANG W W, LIU C Q, JAUREGI P, HUANG M G. Modification of heat-induced whey protein gels by basic amino acids. Food Hydrocolloids, 2020, 100: 105397.
[40] MAITY I, RASALE D B, DAS A K. Sonication induced peptide-appended bolaamphiphile hydrogels forgeneration and catalytic activity of Pt nanoparticles. Soft Matter, 2012, 8(19): 5301-5308.
[41] SUI X N, BI S, QI B K, WANG Z J, ZHANG M, LI Y, JIANG L Z. Impact of ultrasonic treatment on an emulsion system stabilized with soybean protein isolate and lecithin: Its emulsifying property and emulsion stability. Food Hydrocolloids, 2017, 63: 727-734.
[42] 王耀松, 张唯唯, 马天怡, 蔡敏, 张怡帆, 胡荣蓉, 唐长波. 丙二醛氧化对核桃分离蛋白结构及乳化性的影响. 中国农业科学, 2020, 53(16): 3372-3384.
WANG Y S, ZHANG W W, MA T Y, CAI M, ZHANG Y F, HU R R, TANG C B. Influence of oxidative modification by malondialdehyde on structure and emulsifying properties of walnut protein. Scientia Agricultura Sinica, 2020, 53(16): 3372-3384. (in Chinese)
[43] SHA L, KOOSIS A O, WANG Q L, TRUE A D, XIONG Y L. Interfacial dilatational and emulsifying properties of ultrasound- treated pea protein. Food Chemistry, 2021, 350: 129271.
[44] TAHA A, HU T, ZHANG Z, BAKRY A M, KHALIFA I, PAN S Y, HU H. Effect of different oils and ultrasound emulsification conditions on the physicochemical properties of emulsions stabilized by soy protein isolate. Ultrasonics Sonochemistry, 2018, 49: 283-293.
Regulation Effects of Ultrasound on the Structure and Emulsification Properties of Pea Protein Isolate
LI ZhaoRui1, HAN XinRui1, FAN Xin1, HUANG JunRong1, CAO YunGang1, XIONG YouLing2
1School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China;2Department of Animal and Food Sciences, University of Kentucky,Lexington 40546, KY, United States
【Objective】This study was designed to investigate the effects of ultrasonic treatment on the structure and physicochemical properties of pea protein isolate (PPI), and to explore the regulation mechanism of ultrasonic treatment on the emulsifying characteristics of PPI, so as to provide the theoretical basis for the application of PPI as natural emulsions or related products in the food field. 【Method】 The ultrasonic-pea protein isolate (U-PPI) was prepared by ultrasonic wave with frequency of 20 kHz and power of 600 W under different times (0, 20, 30, 40 and 60 min), and then U-PPI emulsions were prepared by high pressure homogenization. The effects of ultrasonic treatment on the physicochemical properties of PPI were investigated by the tests of free amino group, total sulfhydryl group, particle size, solubility and SDS-PAGE. The changes in secondary and tertiary structure of U-PPI were analyzed by circular dichroism and intrinsic tryptophan fluorescence, respectively. The emulsifying ability and emulsion stability of U-PPI were characterized by emulsion activity index, particle size, protein distribution at the interface of emulsion, Zeta potential and apparent viscosity. The microstructure of the emulsions was observed by using laser confocal fluorescence microscopy. 【Result】Ultrasonic treatment significantly modified the structure of PPI, i.e., a short time (30 to 40 min) ultrasonic treatment significantly reduced the-helix content and improved the-sheet content of PPI, which made the structure of the PPI more flexible and more hydrophobic groups exposed to the interface. Simultaneously, the depolymerization effect of ultrasonic also caused the decrease of the average particle size and the significant increase of the solubility of PPI. Therefore, the modification of PPI by a short time ultrasonic treatmentwas conducive to the formation of a dense and stable protein film at the oil/water interface, which effectively improved the emulsifying activity of PPI and the stability of the emulsions, and the microstructure of the emulsions also showed that the particle sizes of emulsions stabilized with U-PPI were smaller, and the droplet distribution was more uniform. However, a long time (60 min) ultrasonic treatment caused the hydrophobic repolymerization and insolubility of PPI, which was not conducive to the adsorption and rearrangement of PPI in the oil/water interface and thus reduced the emulsifying activity and emulsion stability. 【Conclusion】The cavitation effect and mechanical effect produced by a short time (30, 40 min) ultrasonic treatment had significant depolymerization effect on PPI, which promoted the protein structure more flexible and was beneficial to the adsorption and rearrangement of PPI at the oil/water interface, and thus significantly improved the emulsifying properties of PPI.
ultrasonic modification; pea protein isolate; structural modification; emulsion stability
2021-04-11;
2021-07-27
国家自然科学基金青年基金(32001762,31801480)、陕西省重点研发计划一般项目(2021NY-146)、陕西省科技厅自然科学基础研究计划项目(2019JQ-397)
李朝蕊,E-mail:1762903310@qq.com。通信作者曹云刚,E-mail:caoyungang@sust.edu.cn。通信作者熊幼翎,E-mail:ylxiong@uky.edu
(责任编辑 赵伶俐)

