葡萄糖氧化酶对大肠杆菌攻毒肉鸭生长性能、免疫功能及肠道健康的影响
刘娇,陈志敏,郑爱娟,刘国华,蔡辉益,常文环
葡萄糖氧化酶对大肠杆菌攻毒肉鸭生长性能、免疫功能及肠道健康的影响
刘娇,陈志敏,郑爱娟,刘国华,蔡辉益,常文环
中国农业科学院饲料研究所/农业农村部生物饲料重点实验室北京 100081
【目的】探究饲粮中添加葡萄糖氧化酶(GOD)对大肠杆菌攻毒肉鸭生长性能、免疫功能和肠道健康的影响及其作用机制,为寻求预防肉鸭大肠杆菌病的抗生素替代品研究提供思路。【方法】选用144只1日龄健康北京公鸭,随机分为3组,每组6个重复,每重复8只鸭。对照组饲喂基础饲粮,两个试验组分别在基础饲粮中添加30 mg·kg-1维吉尼亚霉素(抗生素组)或200 U·kg-1GOD,于试验第7天分两次对所有鸭口腔灌服0.2 mL大肠杆菌 O88(3×109CFU / mL),两次攻毒间隔8 h。试验期28 d。【结果】(1) 与对照组相比,饲粮中添加抗生素和GOD显著提高攻毒肉鸭1—14日龄平均日增重和平均日采食量(<0.05)。(2)GOD和抗生素显著降低28日龄攻毒肉鸭血液中白细胞数(<0.05),提高血液中淋巴细胞百分比(<0.05)。此外,GOD显著降低血液中红细胞含量(<0.05)。(3)GOD和抗生素显著降低14日龄肉鸭血清MDA和28日龄CAT的含量(<0.05); GOD显著提高28日龄肉鸭血清T-AOC(<0.05),且有降低14日龄CAT的趋势(=0.087)。(4)抗生素和GOD显著降低14、28日龄肉鸭血清内毒素含量(<0.05)。(5)GOD和抗生素显著降低肉鸭14、28日龄空肠IL-1β和IL-6浓度(<0.05),以及28日龄空肠TNF-α浓度(<0.05),两组间无显著差异(>0.05)。(6)抗生素和GOD显著降低大肠杆菌攻毒肉鸭14、28日龄血清DAO活性和-LA含量(<0.05),两组间无显著差异(>0.05)。(7)GOD增加了回肠特有OTUs的数量,降低了大肠杆菌含量,提高了乳酸杆菌和双歧杆菌等益生菌的相对丰度。【结论】饲粮中添加GOD通过平衡大肠杆菌攻毒肉鸭的肠道菌群结构、减少细菌内毒素的产生以及降低氧化应激对细胞的损伤来维持肠黏膜的完整性、避免因内毒素进入血液后激活炎症信号通路而引起炎症反应的发生,从而改善肉鸭肠道健康、促进肉鸭生长。GOD能够作为抗生素替代物用于预防或减轻肉鸭的大肠杆菌病。
葡萄糖氧化酶;肉鸭;大肠杆菌攻毒;生长性能;免疫功能;肠道健康
0 引言
【研究意义】随着我国肉鸭需求量攀升,集约化养殖密度持续增大,导致肉鸭养殖的环保和免疫压力日益增加。大肠杆菌病是肉鸭养殖中的常见疾病,抗生素是当前解决该疾病的最常用且最有效的饲料添加剂。但饲用抗生素在为畜禽集约化养殖提供保障、推动养殖业快速发展的同时,其药物残留、细菌耐药性等负面影响也日益显著。根据2019年农业农村部194号公告,我国已于2020年7月1日在饲料端全面禁用抗生素。因此,寻找绿色、安全、高效、无毒副作用的抗生素替代品对提高动物生产性能、预防畜禽疾病具有重要的现实意义。【前人研究进展】葡萄糖氧化酶(GOD)能够利用分子氧作为电子受体催化b-D-葡萄糖氧化成葡萄糖酸和过氧化氢,主要发挥促消化、保护肠道健康、免疫、抗菌、抗氧化、抗应激等方面的功能[1-3],是理想的抗生素替代物之一。我国对GOD的研究起始较晚,但如今其使用范围已涵盖了包括食品[4]、医药[5]、生物等多个领域,并于1999年被纳入12种允许在饲料中添加的酶制剂列表。汤海鸥等[6]研究表明GOD能显著改善肉鸡的生长性能和肉品质,且能达到与抗生素相同的水平。赵国先等[7]发现在肉鸡饲粮中添加 GOD能显著降低其肠道大肠杆菌含量,同时提高盲肠内乳酸菌和双歧杆菌含量。GOD能够降低仔猪肠道pH,改善仔猪十二指肠形态,在降低肠道内大肠杆菌含量的同时,提高乳酸菌含量,进而促进仔猪的生长[8]。【本研究切入点】GOD在畜禽养殖中的作用效果已取得了部分研究成果,但对于其在肉鸭上的应用效果却鲜有报道。【拟解决的关键问题】本试验通过在肉鸭饲粮中添加GOD,研究其对大肠杆菌攻毒肉鸭生长性能、免疫功能和肠道健康的影响及其作用机制,并探明其替代抗生素预防肉鸭大肠杆菌病的可行性。
1 材料与方法
1.1 试验时间及地点
动物试验于 2019 年4—6月在中国农业科学院饲料研究所南口中试基地完成。其余试验于 2019 年7—12月在中国农业科学院饲料研究所完成。
1.2 试验材料
试验所用葡萄糖氧化酶,酶活为1 000 U·g-1,试验所用抗生素为维吉尼亚霉素,两者均由北京挑战生物技术有限公司提供。大肠杆菌O88购自中国兽医微生物菌种保藏管理中心。
1.3 试验方法
首先确定大肠杆菌攻毒方法。选取66只1日龄健康北京公鸭,随机分为11组,每组6只。7日龄时,2—11组按照不同攻毒方案对肉鸭口腔灌服大肠杆菌O88菌液(菌液浓度为1×109CFU/mL)进行感染试验,1组为健康对照组,口腔灌注1 mL灭菌LB肉汤培养基,各组具体攻毒方式见表1,各组均饲喂相同基础饲粮(表2),观察其攻毒后7d内生长状况并记录,以确定最优大肠杆菌攻毒方案。
各处理组肉鸭在人工感染大肠杆菌后临床表现各不相同,与T1组(对照组)相比,T2、T3组无显著变化,T4到T11组肉鸭表现出精神不振,排灰白或绿色稀便。进一步剖检观察到T9、T11组肉鸭出现大肠杆菌病的典型病理变化:心包内充满黄白色纤维性渗出物,肝脏肿大且被覆淡黄色纤维渗出物。由图1可知,与对照组相比,T8至T11组肉鸭有更低的平均日增重,更高的料重比,这显著影响了肉鸭的生长性能。此外,图中可见T1至T7组无死淘个体,T8至T11组死淘率分别为16.7%、33.3%、50.0%和16.7%。
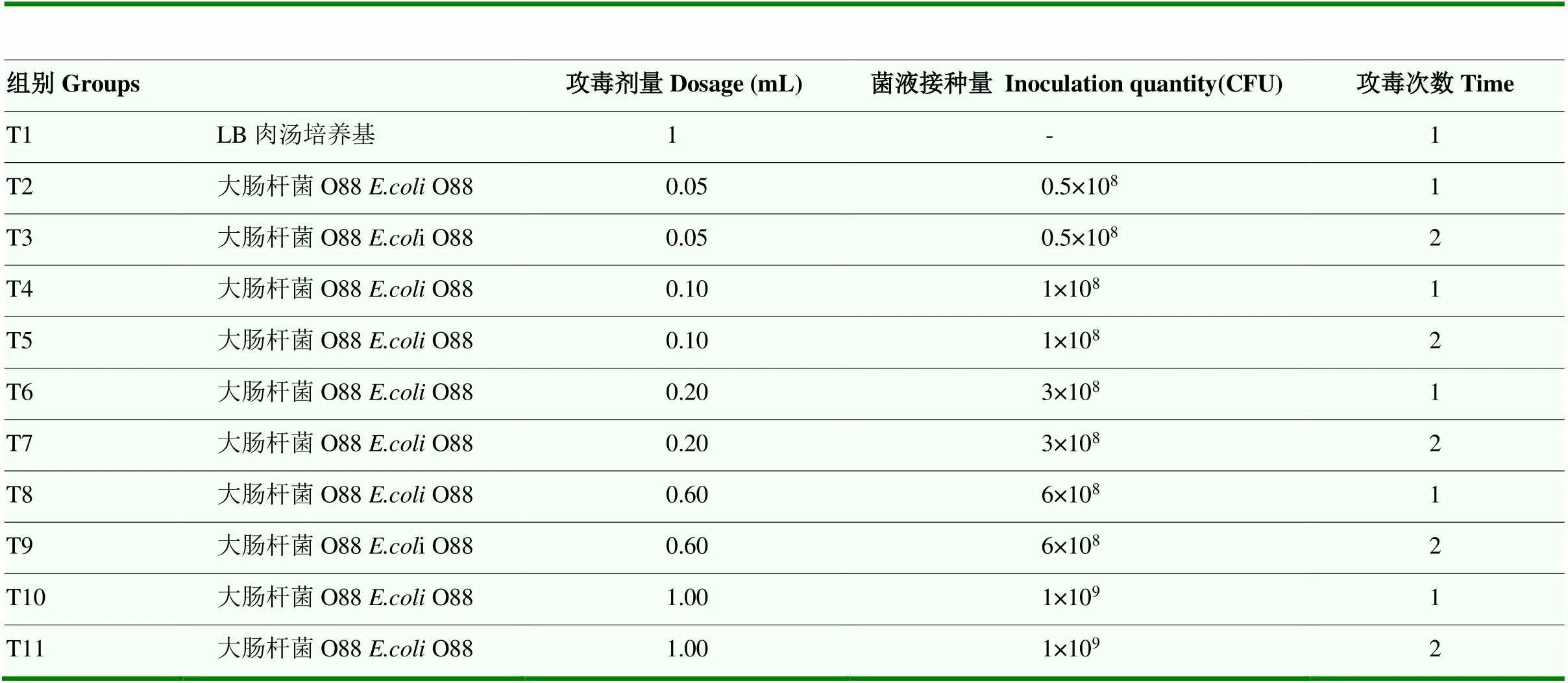
表1 试验分组及攻毒方式
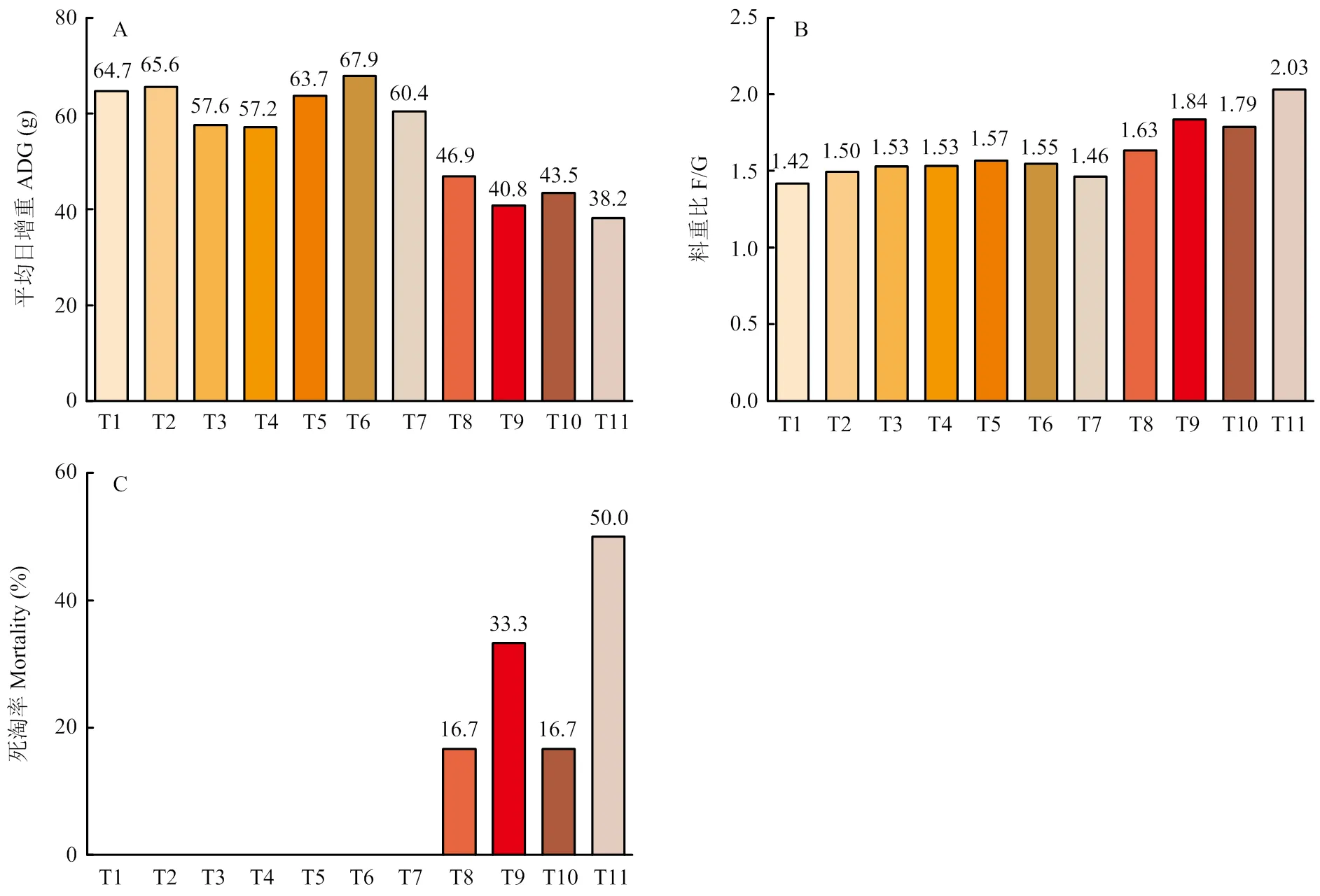
>A:不同攻毒方式对7-14日龄肉鸭平均日增重的影响;B:不同攻毒方式对7-14日龄肉鸭料重比的影响;C:不同攻毒方式对7-14日龄肉鸭死淘率的影响;T:处理组
A: Effects of different infecting methods on average daily gain of 7 to 14 days of age ducks; B: Effects of different infecting methods on feed/gain of 7 to 14 days of age ducks; C: Effects of different infecting methods on mortality of 7 to 14 days of age ducks; T: Treatment
图1 不同攻毒方式对7-14日龄肉鸭生长性能的影响
Fig. 1 Effects of different infecting methods on growth performance of 7 to 14 days of age ducks
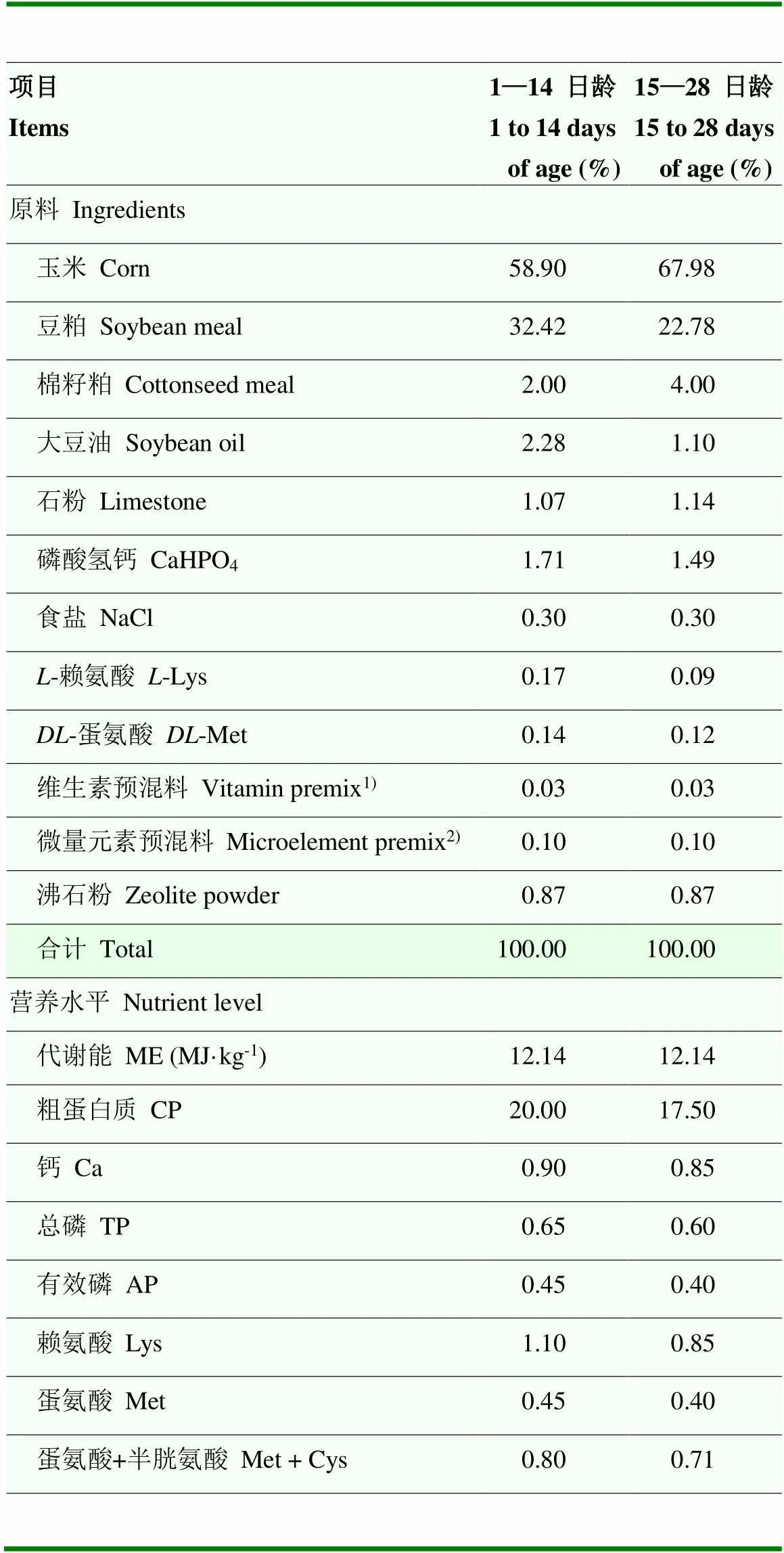
表2 基础饲粮组成及营养水平(风干基础)
1)维生素预混料为每千克饲粮提供The vitamin premix provided the following per kg of diets: VA 10 000 IU, VD32 000 IU, VE 10 IU, VK32.5 mg, VB11 mg, VB26 mg, VB310 mg, VB540 mg, VB63 mg, VB110.3 mg, VB120.01 mg, 生物素 biotin 0.12 mg
2)微量元素预混料为每千克饲粮提供The mineral premix provided the following per kg of diets: Cu (as copper sulfate) 8 mg, Fe (as ferrous sulfate) 80 mg, Mn (as manganese sulfate) 60 mg, Zn (as zinc sulfate) 40 mg, Se (as sodium selenite) 0.15 mg, I (as potassium iodide) 0.35 mg
由生长性能及剖检结果发现,T9、T11组出现了明显大肠杆菌感染的临床症状及病理变化。最终综合考虑病理检查、生长性能及死淘率结果选定最优的攻毒方案为大肠杆菌接种量6×108CFU,攻毒两次,两次间隔8 h。
1.4 试验设计
选择144只健康1日龄北京公鸭(50±2.75)g作为试验动物,随机分为3组,每组6个重复,每重复8只鸭。对照组饲喂基础饲粮,两个试验组分别在基础饲粮中以30 mg·kg-1维吉尼亚霉素(抗生素)或200 U·kg-1GOD等比例替代其中的沸石粉,试验期28 d。根据筛选试验确定的最优大肠杆菌攻毒方案,于试验第7天分两次对所有鸭口腔灌服0.2 mL大肠杆菌 O88(3×109CFU / mL),两次攻毒间隔8 h。试验采用玉米-豆粕-杂粕型基础饲粮,参照《肉鸭饲养标准》(NY/T 2122-2012)配制,其组成及营养水平见表2。
1.5 饲养管理
试验采用立体三层笼养,1—3 d每日24 h光照且鸭舍温度维持在33℃,第3天后每日为23 h光照,以每周降低2℃的速度将鸭舍内温度降至24℃,之后温度不再继续降低,使用乳头式饮水器,自由采食。试验鸭饲养管理和鸭舍卫生管理均按常规饲养规程进行。每天进行健康观察,记录死亡只数、时间以及原因,按时记录损料、余料以及各项生长性能指标。
1.6 测定指标及方法
1.6.1 生长性能 于肉鸭14、28日龄时,断食空腹12 h,之后分别对每个重复鸭进行称重、结料。计算1—14日龄、14—28日龄和1—28日龄肉鸭平均体重(BW)、平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.6.2 血液样品采集与测定 于肉鸭14、28日龄时,分别从每重复中随机选取一只肉鸭。经翅静脉采血,经3 500 r/min离心10 min,收集血清,分装于EP管中,于-20℃冰箱保存备用。28日龄时另取5 mL血液于含乙二胺四乙酸二钾(EDTA-2K)抗凝剂的EP管,30 min之内进行血常规测定。采用南京建成生物工程研究所试剂盒测定总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)、丙二醛(MDA)、过氧化氢酶(CAT)、二胺氧化酶(DAO)以及-乳酸(-LA)的含量;采用酶联免疫吸附(ELISA)(Bethyl Laboratories, Inc. USA)的方法测定血清中内毒素含量;全血稀释后采用全自动动物血液分析仪(TEK-Ⅱ mini)检测红细胞数(RBC)、白细胞数(WBC)、淋巴细胞比例(LYM%)、血小板数(PLT)。
1.6.3 空肠样品采集与测定 于肉鸭14、28日龄时,分别从每重复中随机选取一只肉鸭,迅速屠宰,解剖。在无菌条件下,取空肠肠段(对折后取中段)约3cm,用生理盐水冲洗肠道内食糜后置于无菌冻存管,于-80℃冷冻保存,采用ELISA(Bethyl Laboratories, Inc. USA)的方法检测炎症因子(肿瘤坏死因子α(TNF-α),白介素-1β(IL-1β),白介素-6(IL-6))以及TLR4的含量。
1.6.4 回肠样品采集与测定 于肉鸭14日龄时,分别从每重复中随机选取一只肉鸭,迅速屠宰,解剖。在无菌条件下,取回肠中段处的食糜样品置于无菌冻存管中,于-80℃冷冻保存备用。
提取14日龄肉鸭回肠食糜的微生物基因组DNA,同时采用Nanodrop对其进行定量,并通过1.2%琼脂糖凝胶电泳进行质量检测。使用无菌水稀释部分样品至1 ng·mL-1。以取得的稀释后基因组DNA为模板,根据测序区域,设计并使用含有Barcode序列的特异性引物,并在全式金公司的Pfu高保真DNA聚合酶的作用下进行目标片段的PCR扩增,确保扩增准确性的同时提高扩增效率。本试验采用16s rRNA基因V3-V4区的引物为:F:5′-ACTCCTACGGGAGGCA GCA-3′和R:5′-GGACTACHVGGGTWTCTAAT-3′来扩增细菌DNA。将扩增后的PCR产物进行磁珠纯化回收,随后将PCR扩增回收产物进行荧光定量,荧光试剂为Quant-iT PicoGreen dsDNA Assay Kit。根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合。采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,构建好的文库经过在Agilent Bioanalyzer(Agilent High Sensitivity DNA Kit)上的质检和Promega QuantiFluor荧光定量系统(Quant-iT PicoGreen dsDNA Assay Kit)对文库进行定量,文库合格后,使用Illumina MiSeq PE250进行上机测序,测序分析由上海派森诺生物科技有限公司完成。
采用绝对定量PCR的方法测定食糜中大肠杆菌的含量,具体方法如下:首先使用DNA提取试剂盒从0.2 g肉鸭回肠食糜中提取细菌总DNA(Mag-Bind Soil DNA Kit 200,Omega公司,美国),置于-20℃冷冻存放。PCR引物设计基于16s rDNA,引物序列见表3。使用DNA纯化试剂盒对PCR产物进行回收后,与PCR®2.1质粒载体(TA克隆试剂盒,Invitrogen公司,美国)相连后导入大肠杆菌的感受态细胞DH-5α(Takara公司,日本)制成标准质粒,使用超微量分光光度计(Nano-drop 2000)测定质粒浓度。随后将标准质粒进行梯度稀释,加入96孔板制作标准曲线。最后,使用已提取的回肠食糜DNA为模板,按照AceQ®qPCR SYBR®GreenMaster Mix试剂盒的说明书进行荧光定量PCR。最终食糜中微生物的含量用基因拷贝数/每克食糜来表示。
按照“中国特色、世界水准”的高等职业教育的奋斗目标,高职院校在今后的内涵式发展中势必进一步加强国际交流和合作。辅导员要积极组织中、外学生文化交流,引导学生敢于并善于把中国文化最优秀的一面展示给国外留学生,树立学生的文化自信。同时,要引导学生积极思考,按照“各美其美、美人之美、美美与共、天下大同”的原则,发现他文化之长,并结合实际情况,经过科学的扬弃后使之为我所用。
表3 大肠杆菌16s rDNA PCR引物序列表
1.7 统计分析
采用SPSS 19.0软件对试验数据进行单因素方差分析(one-way ANOVA),对组间差异显著的指标,使用Duncan 氏法进行多重比较。以<0.05作为差异显著性判断标准,<0.01为差异极显著的标准。
2 结果
2.1 葡萄糖氧化酶对大肠杆菌攻毒肉鸭生长性能的影响
由表4可知,与对照组相比,饲粮中添加GOD极显著提高了1—14日龄肉鸭平均日增重和平均日采食量(<0.01),且与抗生素组间无显著差异。添加GOD对攻毒肉鸭其他阶段生长性能影响不显著(>0.05)。
2.2 葡萄糖氧化酶对大肠杆菌攻毒肉鸭血常规的影响
由图2可知,与对照组相比,饲粮中添加GOD和抗生素均显著降低了血液中白细胞数(<0.05),极显著提高了血液中淋巴细胞百分比(<0.01)。此外,GOD极显著降低了血液中红细胞含量(<0.01),抗生素仅有降低红细胞含量的趋势。GOD和抗生素对血液中粒细胞数无显著影响(>0.05)。
2.3 葡萄糖氧化酶对大肠杆菌攻毒肉鸭抗氧化功能的影响
由表5可知,饲粮中添加GOD和抗生素能显著降低14日龄肉鸭血清MDA(<0.05)且极显著降低28日龄CAT的含量(<0.01)。此外,GOD能够显著提高肉鸭28日龄血清T-AOC(<0.05),且有降低14日龄CAT的趋势(=0.087)。抗生素有提高肉鸭28日龄血清T-AOC的趋势(>0.05)。GOD和抗生素对其他抗氧化功能无显著影响(>0.05)。
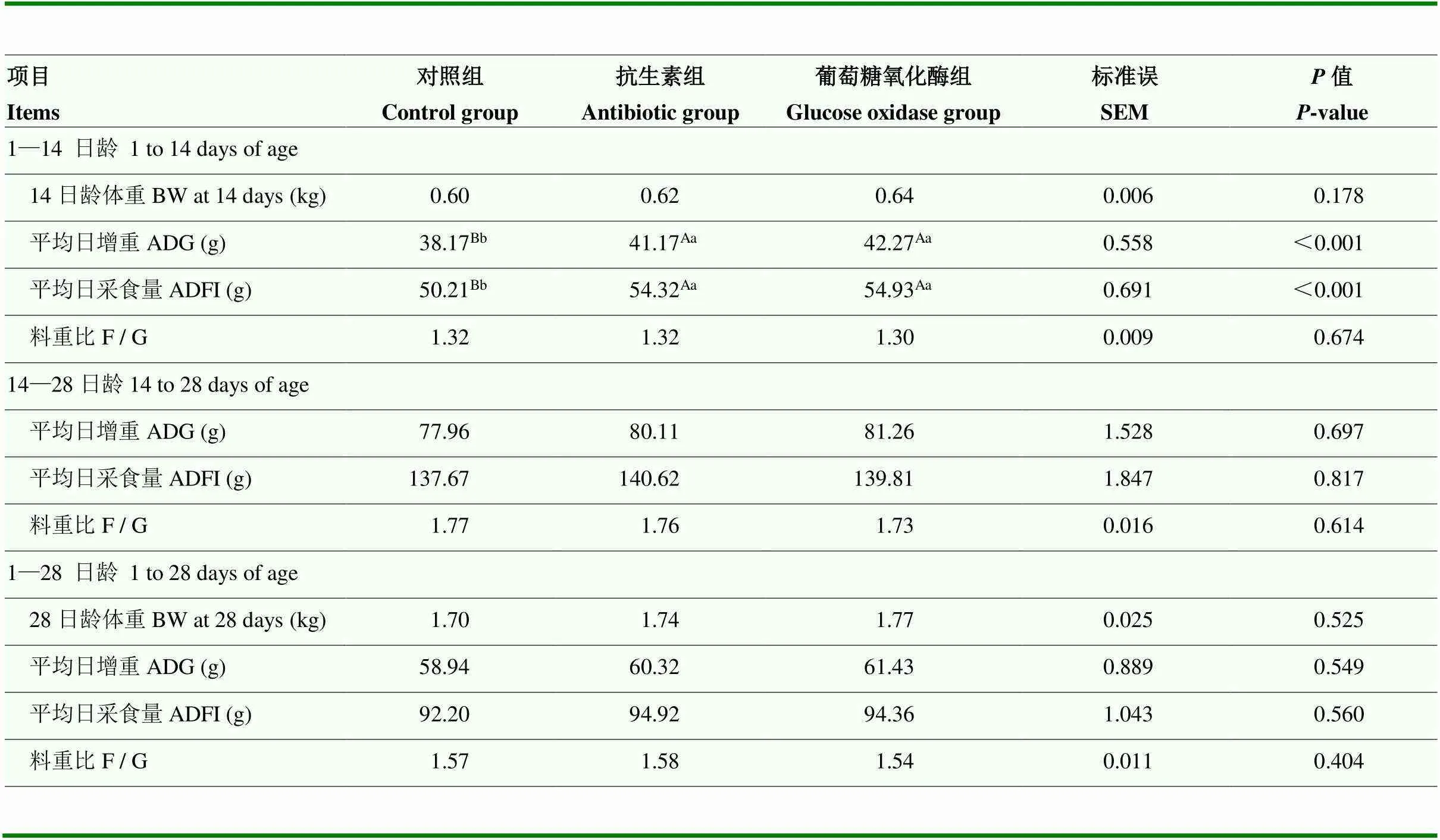
表4 葡萄糖氧化酶对大肠杆菌攻毒肉鸭生长性能的影响
同行无字母或数值标相同字母表示差异不显著(>0.05),不同小写字母表示差异显著(<0.05),不同大写字母表示差异极显著 (<0.01)。下表同
In the same row,values with no letter or the same letter means no significant difference (>0.05), while with different small letter means significant difference (<0.05), and with different capital letter means extremely significant difference (<0.01). The same as below
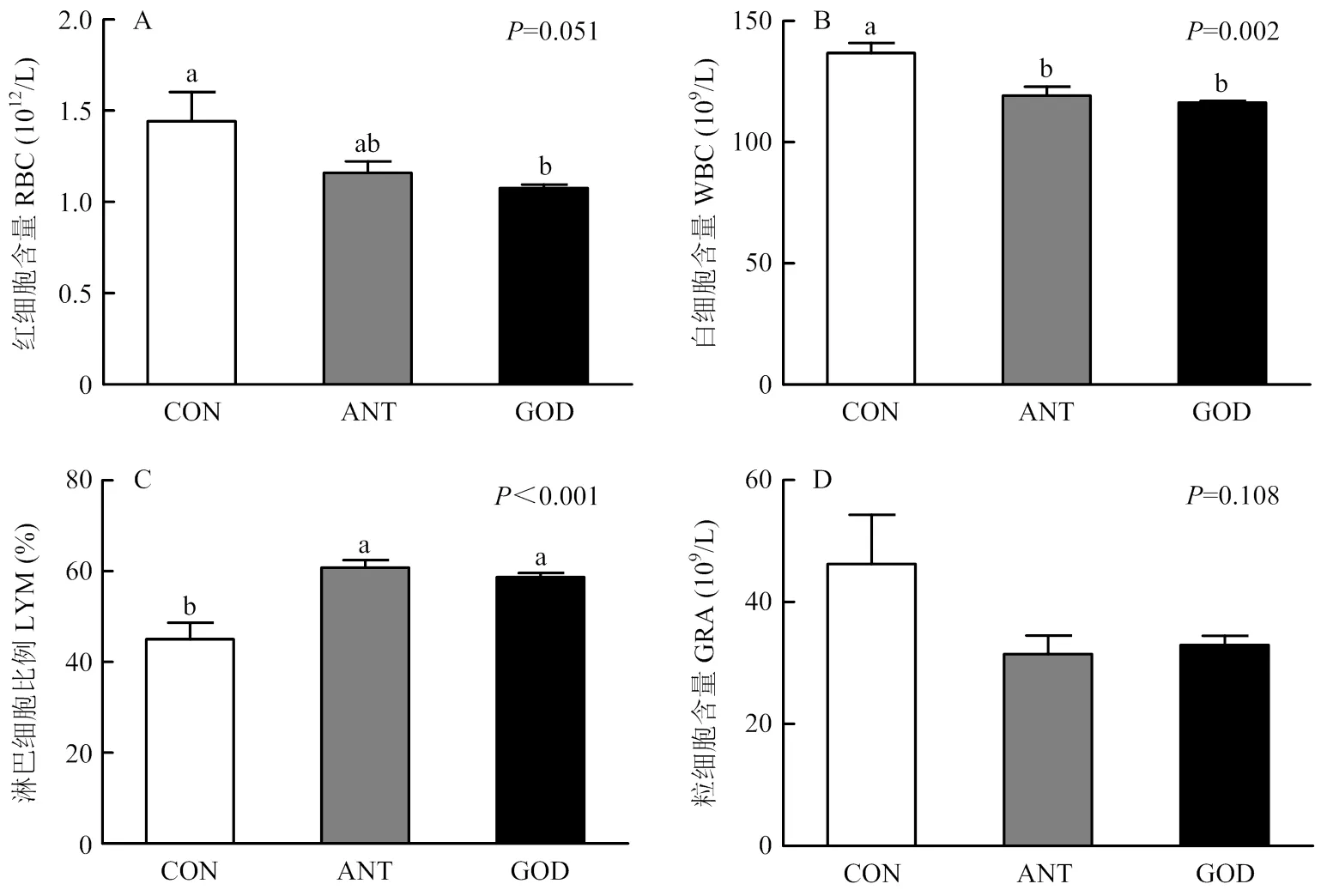
A:28日龄肉鸭红细胞含量;B:28日龄肉鸭白细胞含量;C:28日龄肉鸭淋巴细胞比例;D:28日龄肉鸭粒细胞绝对值;CON:对照组;ANT:抗生素组;GOD:葡萄糖氧化酶组;RBC:红细胞;WBC:白细胞;LYM:淋巴细胞;GRA:粒细胞。数据柱形标注不同小写字母表示差异显著(P<0.05)。下图同
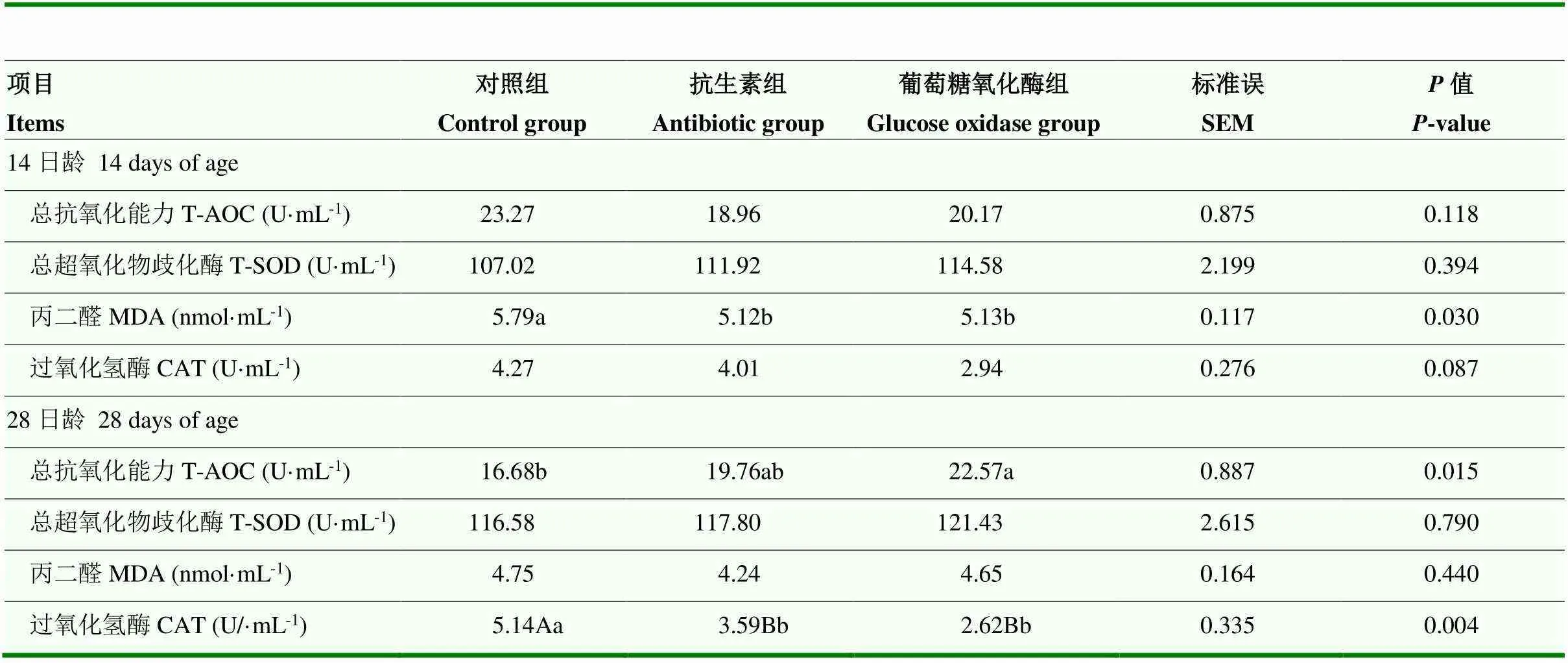
表5 葡萄糖氧化酶对大肠杆菌攻毒肉鸭抗氧化功能的影响
2.4 葡萄糖氧化酶对大肠杆菌攻毒肉鸭血清内毒素的影响
由表6可知,与对照组相比,饲粮中添加GOD极显著降低了14、28日龄大肠杆菌攻毒肉鸭血清内毒素含量(<0.01),且与抗生素组间无显著差异。
2.5 葡萄糖氧化酶对大肠杆菌攻毒肉鸭空肠细胞因子浓度的影响
由图3可知,与对照组相比,饲粮中添加GOD和抗生素均可显著降低大肠杆菌攻毒肉鸭14、28日龄空肠IL-1β和IL-6浓度(<0.05)以及28日龄空肠TNF-α浓度(<0.05),且两组间无显著差异。
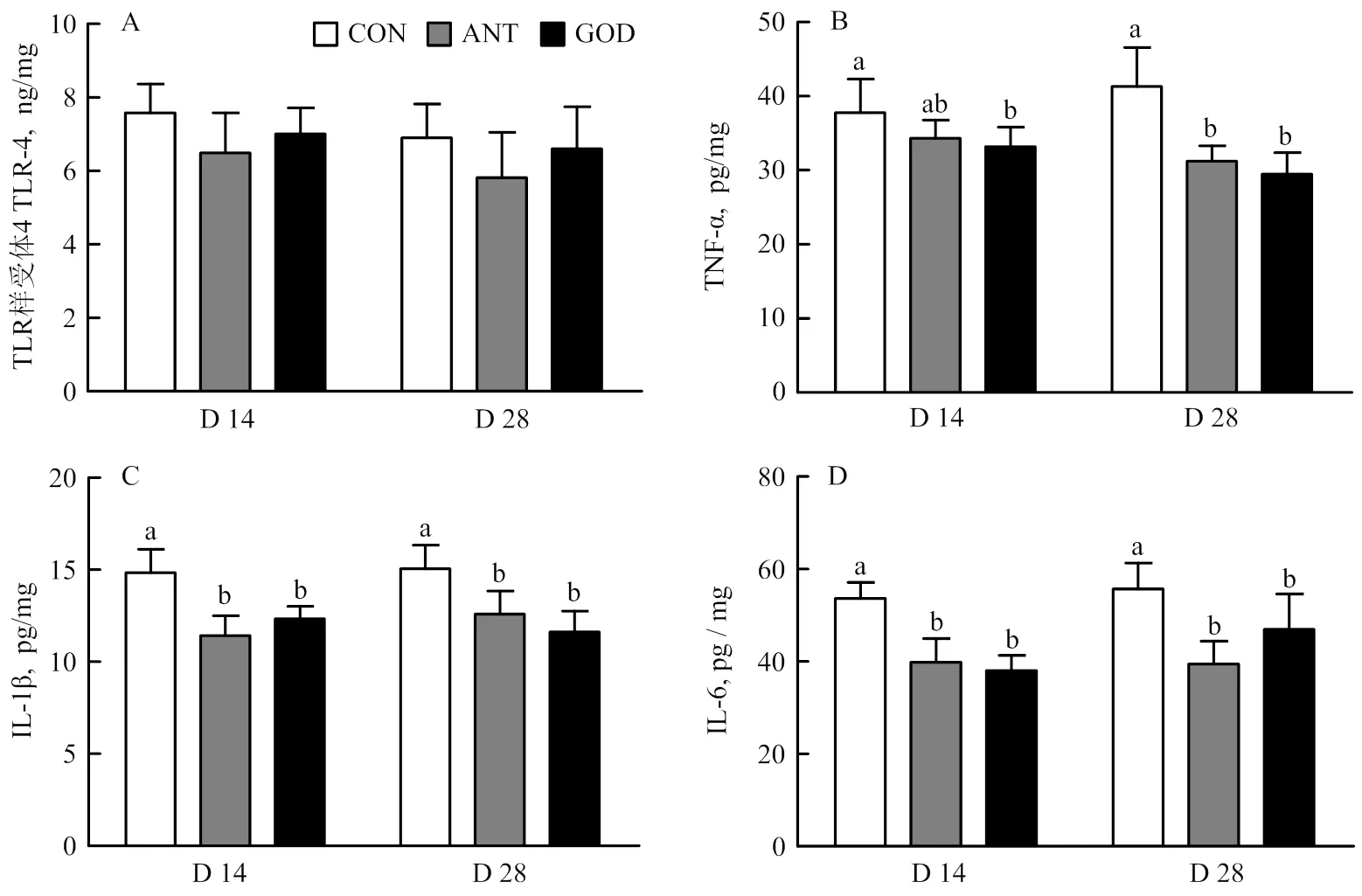
A:肉鸭空肠TLR4的浓度;B:肉鸭空肠TNF-α的浓度;C:肉鸭空肠IL-1β的浓度;D:肉鸭空肠IL-6的浓度;CON:对照组;ANT:抗生素组;GOD:葡萄糖氧化酶组;D:日龄
2.6 葡萄糖氧化酶对大肠杆菌攻毒肉鸭肠黏膜通透性的影响
血清DAO活性和D-LA含量是描述肉鸭肠黏膜通透性的重要标志,由图4可知,GOD组肉鸭14、28日龄血清DAO活性(<0.05)和14日龄血清-LA含量(<0.05)均显著低于对照组,抗生素组肉鸭28日龄DAO活性(<0.05)和14、28日龄-LA含量(<0.05)显著低于对照组,且抗生素组和GOD组肉鸭在血清DAO和-LA水平上无显著差异。
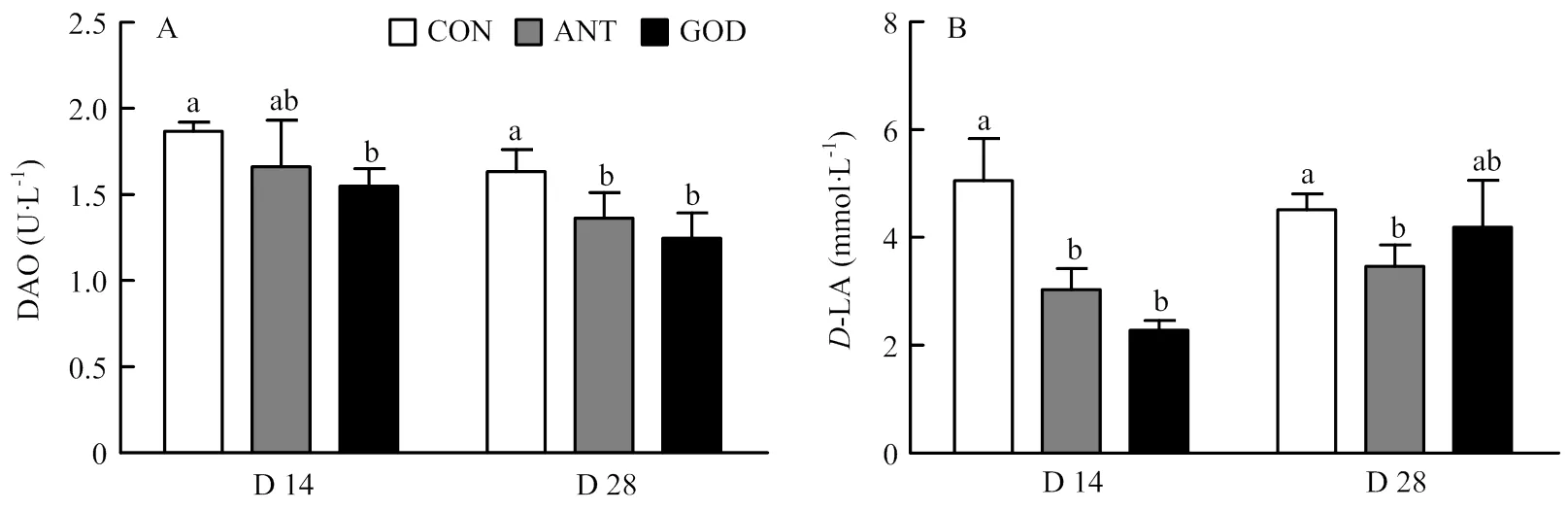
A:肉鸭血清二胺氧化酶含量;B:肉鸭血清D-乳酸含量;CON:对照组;ANT:抗生素组;GOD:葡萄糖氧化酶组;DAO:二胺氧化酶;D-LA:D-乳酸;D:日龄
2.7 葡萄糖氧化酶对大肠杆菌攻毒肉鸭菌群多样性的影响
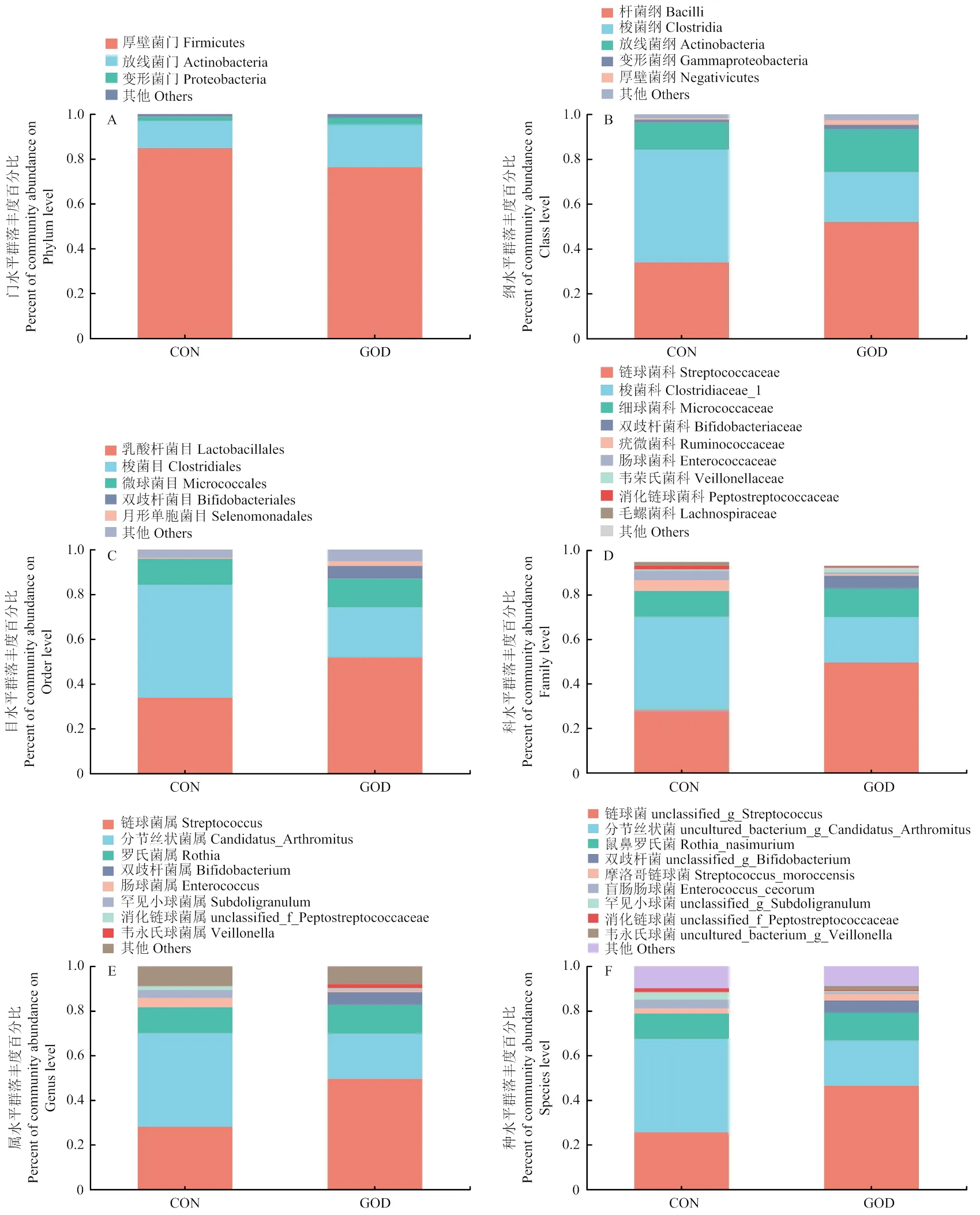
通过对肉鸭回肠食糜进行16srRNA基因测序分析发现,对照组与GOD组alpha多样性指数无显著差异(>0.05,图5);饲粮中添加GOD使得攻毒肉鸭特有的OTUs增加,进而影响了其回肠微生物菌群组成(图6);PCoA分析发现GOD组和对照组间微生物群落结构的组内和组间都有较大的变异(图7),GOD能够影响大肠杆菌攻毒肉鸭肠道菌群结构。
由图8可知,从门水平来看,肉鸭回肠微生物菌群以厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)为主,三类菌的含量达99%以上,饲粮中添加GOD提高了放线菌门的相对丰度,降低了厚壁菌门的相对丰度。从纲水平来看,攻毒肉鸭回肠微生物菌群以杆菌纲(Bacilli)、梭菌纲(Clostridia)以及放线菌纲(Actinobacteria)为主,GOD增加了肉鸭回肠中杆菌纲的相对丰度,同时降低了梭菌纲的相对丰度。从目水平来看,饲粮中添加GOD提高了乳酸杆菌目(Lactobacillales)和双歧杆菌目(Bifidobacteriales)的相对丰度,降低了梭菌目的相对丰度。从科、属和种的水平来分析,饲粮中添加GOD能够提高链球菌科(Streptococcaceae)和双歧杆菌科(Bifidobacteriaceae)的相对丰度,降低梭菌科(Clostridiaceae)和肠球菌科(Enterococcaceae)的相对丰度。
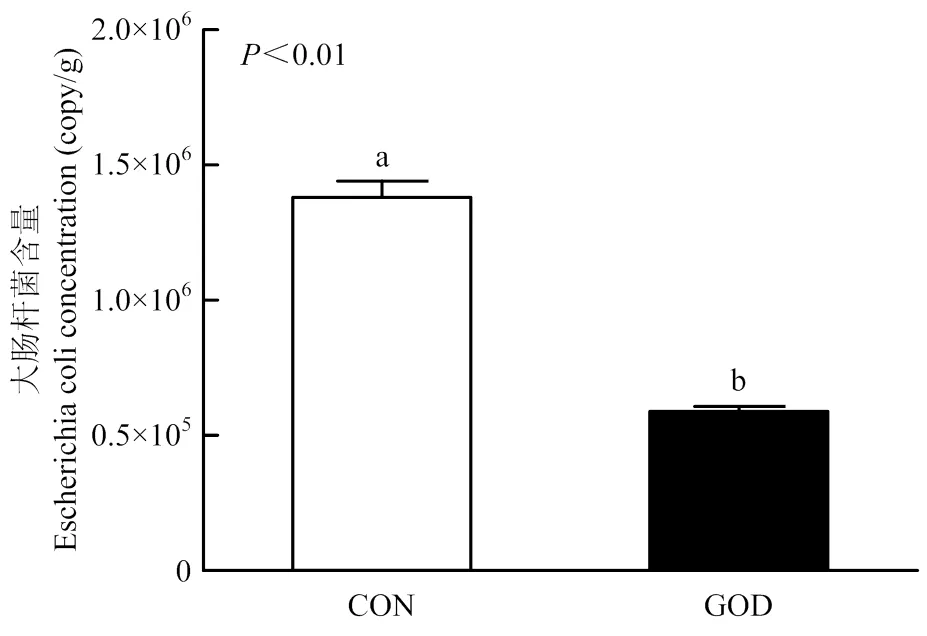
2.8 葡萄糖氧化酶对大肠杆菌攻毒肉鸭回肠大肠杆菌含量的影响
由图9可知,通过对肉鸭肠道大肠杆菌的绝对定量发现,与对照组相比,饲粮中添加GOD能够极显著降低14日龄大肠杆菌攻毒肉鸭回肠中大肠杆菌含量(<0.01)。
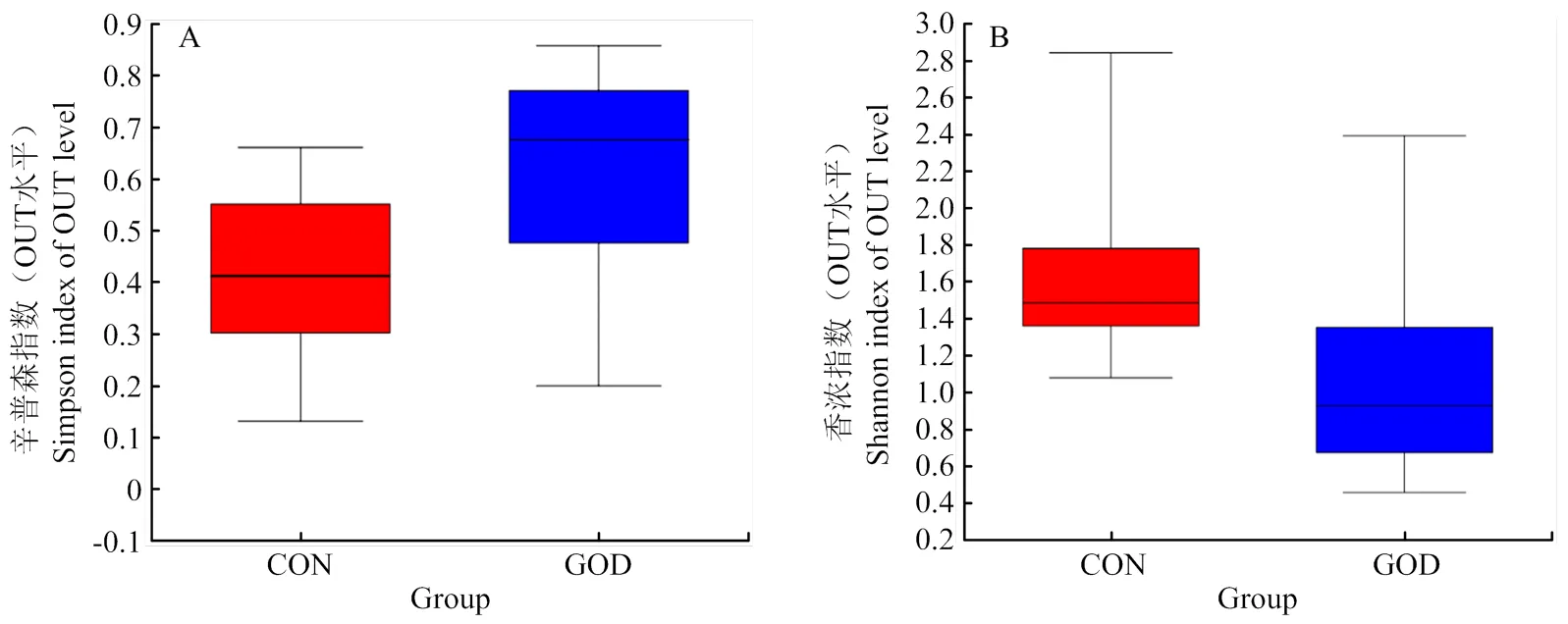
A:Simpson 指数(OTU水平);B:Shannon 指数(OTU水平);CON:对照组;GOD:葡萄糖氧化酶组
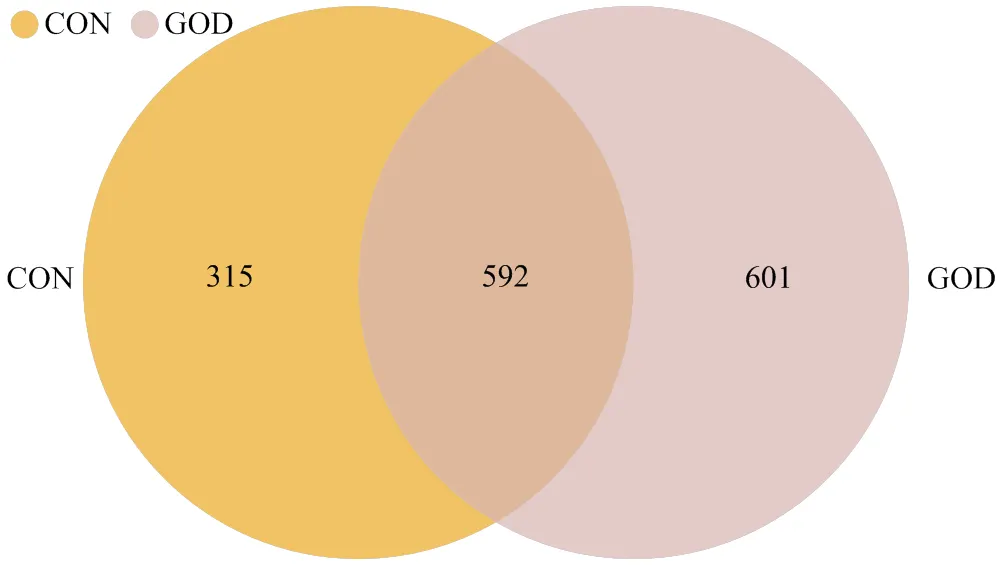
CON:对照组;GOD:葡萄糖氧化酶组
3 讨论
3.1 对大肠杆菌攻毒肉鸭生长性能的影响
本试验结果表明,饲粮中添加GOD和抗生素与对照组相比极显著提高1—14日龄肉鸭平均日增重和平均日采食量,两组间无显著差异。这与以前的研究结果是一致的,即添加GOD能显著改善肉鸡[9-10]、猪[8]和肉鸭[11]的生产性能,降低其死亡率。
3.2 对大肠杆菌攻毒肉鸭血细胞含量的影响
血常规检查通常用于反映大部分早期全身性疾病、判断动物健康状态[12-13]。其中淋巴细胞的数量和活性更是反映机体免疫功能水平的重要指标[14]。研究表明,大肠杆菌通过分泌包括细胞致死肿胀毒素、空泡毒素等具有细胞毒性的毒素物质引起血液中淋巴细胞的降低与机体内红细胞、白细胞和粒细胞含量的升高[15-16],进而使得体内炎症反应加剧[17]。本研究发现饲粮中添加GOD能够显著增加攻毒肉鸭血液中淋巴细胞含量、同时显著降低攻毒肉鸭血液红细胞、白细胞含量,且有降低粒细胞含量的趋势,抗生素对攻毒肉鸭血常规的影响与GOD无显著差别。这表明GOD能够通过增强机体的非特异性免疫,抑制机体炎症反应的发生,提高机体的免疫功能。
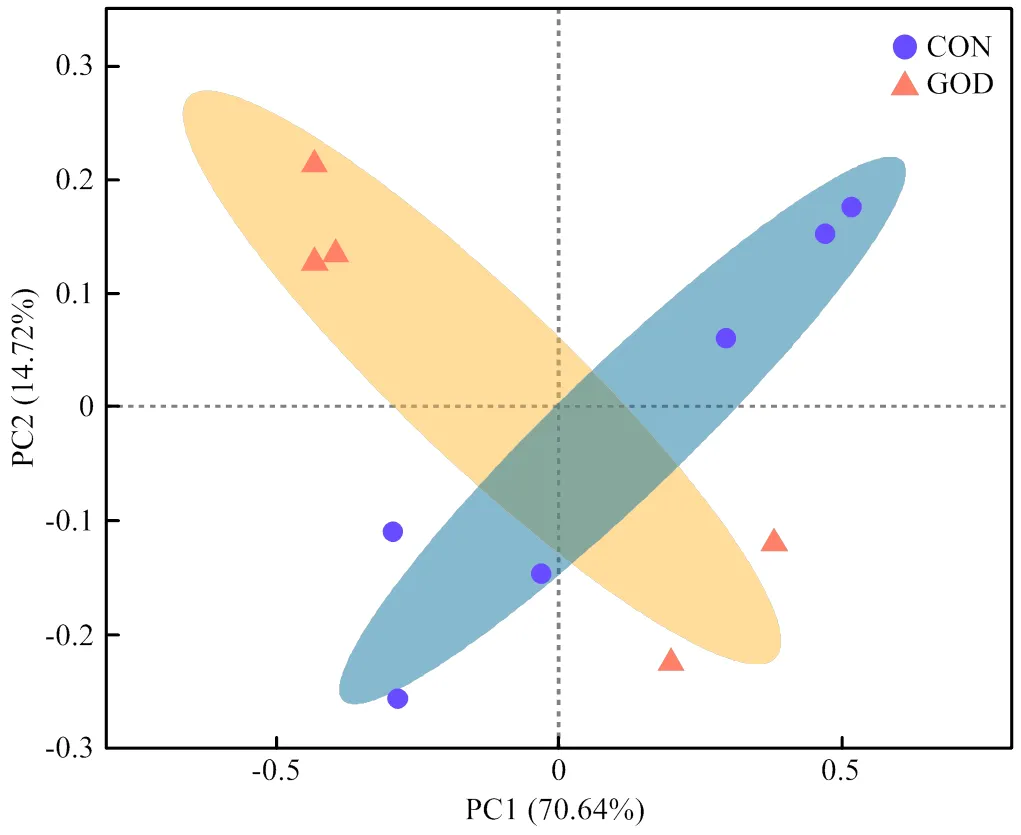
CON:对照组;GOD:葡萄糖氧化酶组
CON:对照组;GOD:葡萄糖氧化酶组
CON:对照组;GOD:葡萄糖氧化酶组
3.3 对大肠杆菌攻毒肉鸭抗氧化功能的影响
氧化还原反应是动物机体内一种重要的生理生化反应,当其处在平衡破坏的不利条件下,自由基过度积累将会对机体组织造成氧化应激损伤[18]。T-SOD是机体重要的抗氧化酶,一般能够通过清除超氧阴离子自由基来防止细胞受到氧化应激损伤。MDA是机体脂质过氧化程度变化的标志,其含量变化与细胞的完整性呈负相关,与脂质过氧化程度呈正相关[19]。T-AOC能够反映机体综合性抗氧化能力。CAT是参与GOD催化氧化葡萄糖过程中的重要物质,能够与GOD共同催化氧化葡萄糖生成葡萄糖酸,且消耗大量氧气,防止氧自由基过度积累造成机体内的氧化损伤。本试验发现,GOD能够提高大肠杆菌攻毒肉鸭血清T-AOC,降低血清MDA含量以及CAT活性,且与抗生素组无显著差别,除GOD自身能发挥抗氧化作用外,本研究结果可能与GOD催化氧化产生的葡萄糖酸也有关。研究发现在肉鸡饲粮中添加GOD能提高血清SOD活性,同时使得血清MDA含量显著降低,这有助于缓解机体氧化应激损伤[20]。马可为等[21]研究表明饲粮中添加不同比例的葡萄糖酸均能显著提高血清SOD含量,且添加0.2%葡萄糖氧化酶能显著降低血清MDA含量,与本试验结果相同。这表明GOD能提高机体的抗氧化性能,消除氧自由基,减少机体氧化应激损伤,维护动物健康。
3.4 对大肠杆菌攻毒肉鸭血清内毒素含量的影响
内毒素也叫脂多糖,其在细菌细胞壁被破坏后释放,对宿主产生毒性。有研究表明,大肠杆菌感染会引起肉鸡血清内毒素增加[22],进而通过内毒素休克反应对机体健康产生不良影响。本试验发现,饲粮中添加GOD能显著降低大肠杆菌攻毒肉鸭血清内毒素含量,与抗生素作用效果一致。这表明GOD能够降低攻毒引起的肉鸭内毒素含量增加,防止发热、炎症反应甚至休克现象的出现,提高机体免疫功能,维护肉鸭健康。
3.5 对大肠杆菌攻毒肉鸭空肠炎症因子含量的影响
炎症反应能诱导机体免疫应答反应的出现,但炎症反应过度却会对动物的健康造成不利影响,有报道称在大量新型冠状病毒引起的肺炎重症感染者体内就出现了“细胞因子风暴”,也就是过度的炎症反应引起机体内细胞因子急剧增加,导致免疫系统紊乱,最终对宿主产生不可逆的伤害[23-24]。有研究发现,大肠杆菌作为病原菌进入畜禽体内后,首先经过与模式识别受体TLR4的识别与结合,而后激活MyD88/NF-kB信号通路,引起细胞因子TNF-α、IL-1b和IL-6等含量增加,而TNF-α、IL-1b等能够通过诱导白细胞的黏附蛋白表达使白细胞浸润增加,引起机体炎症反应,损伤免疫系统正常功能,威胁畜禽健康[25]。另外,白细胞介素是动物机体内细胞因子的一部分,具有传递信息、激活和调节免疫细胞,参与T、B细胞活化、增殖分化,诱导或抑制机体炎症反应等功能[26]。WANG 等[27]研究表明饲喂葡萄糖氧化酶有助于降低黄羽肉鸡肠道中促炎细胞因子和趋化因子的浓度。本研究发现,与对照组相比,饲粮中添加抗生素或GOD均能降低肉鸭空肠细胞因子(TNF-α、IL-1b、IL-6)的含量,且在抗生素组与GOD组间均无显著差异。这表明抗生素和GOD能通过抑制病原菌侵染后促炎信号通路的激活,降低促炎细胞因子的含量,进而缓解畜禽机体炎症反应,减少机体损伤。
3.6 对大肠杆菌攻毒肉鸭肠黏膜通透性的影响
肠黏膜通透性是描述肠道损伤程度的重要指标。-乳酸是肠道细菌的次级代谢产物或肠道细菌自身经发酵和裂解后的产物之一,它会在动物肠黏膜通透性增加时进入血液循环,使得其在血清中的含量增加,因此血清中-乳酸含量是反映肠黏膜通透性变化的重要标志[28]。血液中DAO含量一般用于反映动物肠绒毛的完整性和成熟度,血液中DAO的酶活性变化也常被看作反映肠黏膜通透性的另一个标志,这是因为小肠绒毛尖端的绒毛细胞内含有大量高活性的DAO,但DAO在血液中却含量极低,因此只有当绒毛细胞和肠黏膜受损后DAO才会大量进入肠细胞间隙、血液和淋巴管中,且进入血液后DAO 的酶活性会维持相对稳定,血液中的DAO含量也会相应升高[29-30]。本试验结果显示肉鸭饲粮中添加GOD可以显著降低血清中-乳酸含量和DAO活性,且与抗生素组间无显著差别。这表明GOD可以通过降低肠黏膜通透性,缓解大肠杆菌攻毒引起的肠道损伤,维持肠黏膜完整性。
3.7 对大肠杆菌攻毒肉鸭肠道菌群结构及肠道大肠杆菌含量的影响
本试验发现GOD能够影响攻毒肉鸭回肠菌群结构,增加其回肠特有OTUs的数量,并且提高了乳酸杆菌目()和双歧杆菌目()等益生菌的相对丰度。通过对GOD作用机制分析可知,GOD氧化分解葡萄糖过程中大量耗氧,创造肠道低氧环境,这有利于厌氧有益菌的生长和繁殖,达到了平衡肠道菌群的效果。另外,GOD在氧化葡萄糖过程中产生了葡萄糖酸和H2O2,两者也被证实有平衡菌群的作用[2, 31]。另外,乳酸杆菌()和双歧杆菌()作为和中占有优势地位的重要菌属,可以显著提高动物的肠道免疫功能和肠道屏障功能、影响炎症因子的表达、抑制有害菌增殖,从而改善机体的抗病力[32]。本试验中绝对定量结果也显示饲粮中添加GOD降低了攻毒肉鸭回肠大肠杆菌的含量。这与前人的研究结论一致。大肠杆菌含量的降低对于降低大肠杆菌病及并发性炎症反应的发生、提高肉鸭生长性能具有重要意义。这表明饲粮中添加GOD能够通过提高攻毒肉鸭肠道菌群多样性以及乳酸菌、双歧杆菌等有益菌的相对丰度、降低大肠杆菌含量来平衡肉鸭肠道菌群结构,改善动物肠道健康。
4 结论
饲粮中添加GOD通过平衡大肠杆菌攻毒肉鸭肠道菌群结构、减少细菌内毒素的产生、降低氧化应激对细胞的损伤来维持肠黏膜的完整性、避免因内毒素进入血液后激活炎症信号通路而引起的炎症反应,从而改善肉鸭肠道健康、促进肉鸭生长。GOD能够替代抗生素用于预防或减轻肉鸭因大肠杆菌攻毒引发的疾病。
[1] 卢俊鑫, 邝哲师. 葡萄糖氧化酶在动物生产中的应用. 饲料博览, 2019(8): 10-13. doi: CNKI:SUN:SLBL.0.2019-08-003.
LU J X, KUANG Z S. Application of glucose oxygenase in animal production. Feed Review, 2019(8): 10-13. doi: CNKI:SUN:SLBL.0. 2019-08-003. (in Chinese)
[2] 汤海鸥, 高秀华, 姚斌, 张广民, 王振兴, 孔祥书. 葡萄糖氧化酶体外抑菌和产酸效果试验研究. 饲料工业, 2015, 36(10): 13-16. doi:10.13302/j.cnki.fi.2015.10.004.
TANG H O, GAO X H, YAO B, ZHANG G M, WANG Z X, KONG X S. Study on the bacteriostatic and acid producing effect of glucose oxidase. Feed Industry, 2015, 36(10): 13-16. doi:10.13302/ j.cnki.fi.2015.10.004. (in Chinese)
[3] 穆淑琴, 李宁, 闫峻, 郑梓, 马墉, 李千军, 张春华. 葡萄糖氧化酶对仔猪生长性能和血清生化指标的影响. 中国畜牧兽医, 2018, 45(8): 2212-2218. doi:10.16431/j.cnki.1671-7236.2018.08.021.
MU S Q, LI N, YAN J, ZHENG Z, MA Y, LI Q J, ZHANG C H. Effect of glucose oxidase on growth performance and serum biochemical indexes of piglets. China Animal Husbandry & Veterinary Medicine, 2018, 45(8): 2212-2218. doi:10.16431/j.cnki. 1671-7236.2018.08.021. (in Chinese)
[4] ADRIANO G C, WELLINGTON F C, JOSE A F, STANISLAU B J, DANIEL G, RENATA M S C, JULIANA L P, HELENA T G. Glucose oxidase: A potential option to decrease the oxidative stress in stirred probiotic yogurt. LWT-Food Science and Technology, 2012, 47(2): 512-515. doi: 10.1016/j.lwt.2012.01.037.
[5] CHOI O, KIM B C, AN J H, MIN K, KIM Y H, UM Y, OH M K, SANG B I. A biosensor based on the self-entrapment of glucose oxidase within biomimetic silica nanoparticles induced by a fusion enzyme. Enzyme and Microbial Technology, 2011, 49(5): 441-445. doi:10.1016/j.enzmictec.2011.07.005.
[6] 汤海鸥, 高秀华, 姚斌, 张广民, 王振兴. 葡萄糖氧化酶对肉鸡生长性能的影响及其替代抗生素效果研究. 饲料工业, 2016(6): 18-21. doi: 10.13302/j.cnki.fi.2016.06.004.
TANG H O, GAO X H, YAO B, ZHANG G M, WANG Z X. Study on the effects of glucose oxidase on growth performance and replacing antibiotics in broilers. Feed Industry, 2016(6): 18-21. doi: 10.13302/ j.cnki.fi.2016.06.004. (in Chinese)
[7] 赵国先, 宋海彬, 马可为, 张振红, 计成, 马秋刚. 葡萄糖氧化酶制剂对肉鸡肠道pH及盲肠微生物的影响. 河北农业大学学报, 2009(4): 83-87. doi: 10.3969/j.issn.1000-1573.2009.04.018.
ZHAO G X, SONG H B, MA K W, ZHANG Z H, JI C, MA Q G. Effects of glucose oxidase on intestinal tract pH and cecum microorganism in broiler chickens. Journal of Agricultural University of Hebei, 2009(4): 83-87. doi: 10.3969/j.issn.1000-1573.2009.04.018. (in Chinese)
[8] 陈清华, 陈凤鸣, 肖晶, 李洪兵. 葡萄糖氧化酶对仔猪生长性能、养分消化率及肠道微生物和形态结构的影响. 动物营养学报, 2015(10): 3218-3224.
CHEN Q H, CHEN F M, XIAO J, LI H B. Effects of glucose oxidase on growth performance, nutrient digestibility, and intestinal microflora and morphology of weaned piglets. Chinese Journal of Animal Nutrition, 2015(10): 3218-3224. (in Chinese)
[9] 庞家满, 王江, 李杰, 刘星, 兰云贤. 葡萄糖氧化酶对黄羽肉鸡生产性能和养分代谢的影响. 中国畜牧兽医, 2013, 40(2): 72-75. doi:10.3969/j.issn.1671-7236.2013.02.017.
PANG J M, WANG J, LI J, LIU X, LAN Y X. Effects of glucose oxidase on the production performance and nutrient metabolism in yellow-feathered broilers. China Animal Husbandry & Veterinary Medicine, 2013, 40(2): 72-75. doi:10.3969/j.issn.1671-7236.2013.02. 017. (in Chinese)
[10] WU S R, LI T H, NIU H F, ZHU Y F, LIU Y L, DUAN Y L, SUN Q Z, YANG X J. Effects of glucose oxidase on growth performance, gut function, and cecal microbiota of broiler chickens. Poultry Science, 2019, 98(2): 828-841. doi:10.3382/ps/pey393.
[11] 汤海鸥, 高秀华, 姚斌, 张广民, 王振兴, 李晓存. 葡萄糖氧化酶对肉鸭生长性能、血清指标和屠宰性能的影响及其解除黄曲霉毒素B1效果. 动物营养学报, 2015(8): 2361-2367.
TANG H O, GAO X H, YAO B, ZHANG G M, WANG Z X, LI X C. Effects of glucose oxidase on growth performance, serum parameters and slaughter performance of meat ducks and its antidotal effect on aflatoxin B1. Chinese Journal of Animal Nutrition, 2015(8): 2361-2367. (in Chinese)
[12] 谢晓鹏. 中药方剂对肾型传染性支气管炎病毒致痛风鸡的生产性能和血常规的影响[D]. 南昌: 江西农业大学, 2013.
XIE X P. Effect of traditional Chinese medicine prescription on performance and blood routine of gout chicken caused by IBV[D]. Nanchang: Jiangxi Agricultural University, 2013. (in Chinese)
[13] 张莉. C-反应蛋白和血常规测定的临床意义. 当代医学, 2012, 18(36): 93. doi:10.3969/j.issn.1009-4393.2012.36.068.
ZHANG L. Clinical significance of C-reactive protein and blood routine test. Contemporary Medicine, 2012, 18(36): 93. doi:10. 3969/j.issn.1009-4393.2012.36.068. (in Chinese)
[14] 程振峰. 不同抗生素替代物对生长肥育猪生长、肠道形态与发育影响的研究[D]. 泰安: 山东农业大学, 2018.
CHENG Z F. Study on the effect of antibiotic substitutes on growth, intestinal morphology and intestinal development in pigs[D]. Taian: Shandong Agricultural University, 2018. (in Chinese)
[15] LA RAGIONE R M, WOODWARD M J. Virulence factors ofserotypes associated with avian colisepticaemia. Scientific Reports, 2002, 73(1): 27-35. doi:10.1016/s0034-5288(02) 00075-9.
[16] RODRIGUEZ-SIEK K E, GIDDINGS C W, DOETKOTT C, JOHNSON T J, NOLAN L K. Characterizing the APEC pathotype. Veterinary Research, 2005, 36(2): 241-256. doi:10.1051/vetres: 2004057.
[17] WANG W, WIDEMAN R F, CHAPMAN M E, BERSI T K, ERF G F. Effect of intravenous endotoxin on blood cell profiles of broilers housed in cages and floor litter environments. Poultry Science, 2003, 82(12): 1886-1897. doi:10.1093/ps/82.12.1886.
[18] MURAKAMI A E, RODRIGUEIRO R J, SANTOS T C, OSPINA- ROJAS I C, RADEMACHER M. Effects of dietary supplementation of meat-type quail breeders with guanidinoacetic acid on their reproductive parameters and progeny performance. Poultry Science, 2014, 93(9): 2237-2244. doi:10.3382/ps.2014-03894.
[19] 张幸怡, 李洋, 林聪, 许文斌, 张永根. 辣木叶粉对大鼠生长性能、血液与肝脏抗氧化及免疫指标的影响. 天然产物研究与开发, 2016(11): 1724-1731.
ZHANG X Y, LI Y, LIN C, XU W B, ZHANG Y G. Effects ofleaves on growth performance, antioxidant and immunity function of blood and liver in sprague dawley rats. Natural Product Research and Development, 2016(11): 1724-1731. (in Chinese)
[20] 宋海彬, 赵国先, 刘彦慈, 马可为, 张振红, 计成, 马秋刚. 葡萄糖氧化酶对肉鸡肠道形态结构和消化酶活性的影响. 中国畜牧杂志, 2010, 46(23): 56-59.
SONG H B, ZHAO G X, LIU Y C, MA K W, ZHANG Z H, JI C, MA Q G. Effects of glucose oxidase on intestinal morphology and digestive enzyme activity in broilers. Chinese Journal of Animal Science, 2010, 46(23): 56-59. (in Chinese)
[21] 马可为, 刘彦慈, 张振红, 郝艳霜, 赵国先. 葡萄糖酸对肉鸡抗氧化性能及脂质代谢的影响. 中国饲料, 2017, 22: 11-14. DOI: 10.15906/j.cnki.cn11-2975/s.20172203.
MA K W, LIU Y C, ZHANG Z H, HAO Y S, ZHAO G X. Effects of gluconic acid on antioxidation and lipid metabolism in broilers. China Feed, 2017, 22: 11-14. DOI: 10.15906/j.cnki.cn11-2975/s.20172203. (in Chinese)
[22] WANG W, LI Z, HAN Q, GUO Y, ZHANG B, D'INCA R. Dietary live yeast and mannan-oligosaccharide supplementation attenuate intestinal inflammation and barrier dysfunction induced byin broilers. The British Journal of Nutrition, 2016, 116(11): 1878-1888. doi:10.1017/s0007114516004116.
[23] FANG Y, ZHANG H, XU Y, XIE J, PANG P, JI W. CT manifestations of two cases of 2019 novel coronavirus (2019-nCoV) pneumonia. Radiology, 2020, 295(1): 208-209. doi:10.1148/radiol.2020200280.
[24] HUANG C, WANG Y, LI X, REN L, ZHAO J, HU Y, ZHANG L, FAN G, XU J, GU X, CHENG Z, YU T, XIA J, WEI Y, WU W, XIE X, YIN W, LI H, LIU M, XIAO Y, GAO H, GUO L, XIE J, WANG G, JIANG R, GAO Z, JIN Q, WANG J, CAO B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Canadian Journal of Infectious Diseases & Medical Microbiology, 2020, 395(10223): 497-506. doi:10.1016/s0140-6736(20)30183-5.
[25] BROWNLIE R, ALLAN B. Avian toll-like receptors. Cell and Tissue Research, 2011, 343(1): 121-130. doi:10.1007/s00441-010-1026-0.
[26] 徐海旺, 余魁, 吴梦郡, 刘文凯, 李鹏, 易丹, 王蕾, 侯永清. 复合植物精油对脂多糖诱导的断奶仔猪免疫应激的影响. 中国畜牧兽医, 2018(8): 2197-2203. doi: 10.16431/j.cnki.1671-7236.2018.08.019.
XU H W, YU K, WU M J, LIU W K, LI P, YI D, WANG L, HOU Y Q. The effect of compound plant essential oil on LPS-induced immune-stressed weaned pigs. China Animal Husbandry & Veterinary Medicine, 2018, 45(8): 2197-2203. doi: 10.16431/j.cnki.1671-7236. 2018.08.019. (in Chinese)
[27] WANG Y, WANG Y B, XU H, MEI X Q, GONG L, WANG B K, LI W F, JIANG S Q. Direct-fed glucose oxidase and its combination with B. amyloliquefaciens SC06 on growth performance, meat quality, intestinal barrier, antioxidative status, and immunity of yellow- feathered broilers. Poultry Science, 2018, 97: 3540-3549. doi: 10.3382/ps/pey216.
[28] NIELSEN C, LINDHOLT J S, ERLANDSEN E J, MORTENSEN F V. D-lactate as a marker of venous-induced intestinal ischemia: an experimental study in pigs. International Journal of Surgery (London, England), 2011, 9(5): 428-432. doi:10.1016/j.ijsu.2011.04.004.
[29] WOLVEKAMP M C, DE BRUIN R W. Diamine oxidase: an overview of historical, biochemical and functional aspects. International Journal of Molecular Sciences, 1994, 12(1): 2-14. doi:10.1159/000171432.
[30] FUKUDOME I, KOBAYASHI M, DABANAKA K, MAEDA H, OKAMOTO K, OKABAYASHI T, BABA R, KUMAGAI N, OBA K, FUJITA M, HANAZAKI K. Diamine oxidase as a marker of intestinal mucosal injury and the effect of soluble dietary fiber on gastrointestinal tract toxicity after intravenous 5-fluorouracil treatment in rats. Medical Molecular Morphology, 2014, 47(2): 100-107. doi:10.1007/s00795-013-0055-7.
[31] TSUKAHARA T, KOYAMA H, OKADA M, USHIDA K. Stimulation of butyrate production by gluconic acid in batch culture of pig cecal digesta and identification of butyrate-producing bacteria. The Journal of Nutrition, 2002, 132(8): 2229-2234. doi:10.1093/jn/132.8.2229.
[32] FALONY G, LAZIDOU K, VERSCHAEREN A, WECKX S, MAES D, DE VUYST L.kinetic analysis of fermentation of prebiotic inulin-type fructans byspecies reveals four different phenotypes. Applied and Environmental Microbiology, 2009, 75(2): 454-461. doi:10.1128/aem.01488-08.
Effects of Glucose Oxidase on Growth Performance, Immune Functions and Intestinal Health of Ducks Challenged by
LIU Jiao, CHEN ZhiMin, ZHENG AiJuan, LIU GuoHua, CAI HuiYi, CHANG WenHuan
Feed Research Institute Chinese Academy of Agricultural Sciences/Key Laboratory of Feed Biotechnology of Ministry of Agriculture and Rural Affairs, Beijing 100081
【Objective】 This experiment was conducted to study the effects of glucose oxidase (GOD) on growth performance, immune functions and intestinal health of ducks challenged byO88and its mechanism to find a substitute for antibiotics to prevent duck colibacillosis.【Method】 A total of 144 one-day-old healthymale lean Peking ducklings were selected and randomly divided into three groups with six replicates and eight ducks per replicate. Ducks were fed the three diets supplemented with nothing (Control group), 30 mg·kg-1virginiamycin (Antibiotic group) and 200 U·kg-1GOD in basal diet, respectively.On day 7, all ducks were orally taken 0.2 mLO88(3×109CFU/mL) twice, 8 hours apart. The experiment lasted for 28 days. 【Result】The results showed as follows: 1) Compared with the control group, adding antibiotic or GOD in the diet significantly increased the average daily gain and average daily feed intake of 1 to 14-day-old attacking ducks (<0.01).2) The number of serum white blood cell of 28-day-old attacking ducks was significantly reduced and the percentage of serum lymphocyte was significantly increased by adding antibiotic and GOD in diet (<0.01), and the number of serum red blood cell of 28-day- old attacking ducks was significantly reduced by adding GOD in diet (<0.05). 3) Serum MDA at day 14 (<0.05) and CAT contents at day 28 (<0.01) were significantly reduced by adding antibiotic and GOD, serum T-AOC at day 28 was significantlyincreased (<0.05), and CAT at day 14showed a tendency to decrease by adding GOD (=0.087). 4) Supplementation of antibiotic and GOD significantly decreased endotoxin of 14 and 28-day-old attacking ducks (<0.01). 5) Adding antibiotic or GOD significantly decreased the concentration of IL-1β and IL-6 of ducks at day 14 and 28 and TNF-α at d 28 (<0.05), no significant differences between the GOD and the antibiotic groups(>0.05). 6) The concentration of serum diamine oxidase and-lactic of 14 and 28-day-old attacking ducks were significantly reduced by adding antibiotic and GOD (<0.05), no significant differences between the GOD and the antibiotic groups (>0.05). 7) The addition of GOD increased the number of unique OTUs in ileum, reduced the contents of, and increased the relative abundance of probiotics such asand. 【Conclusion】 In conclusion, addition of GOD in the diet can balance the structure of intestinal flora, reduce the production of bacterial endotoxin and decrease oxidative stress, and then maintain the integrity of intestinal mucosa and prevent activation of inflammatory signal pathway by endotoxin and occurrence of inflammatory reaction, so as to improve intestinal health and growth of ducks infected with. The GOD can be used as antibiotics substitute to prevent or alleviate colibacillosis of ducks.
glucose oxidase; duck;challenge;growth performance; immune function; intestinal health
2020-06-09;
2021-09-27
中国农业科学院科技创新工程协同创新任务(CAAS-XTCX2016011)、国家重点研发计划(2017YFD0601001)
刘娇,Tel:13126721676;E-mail:853652746@qq.com。通信作者常文环,E-mail:changwenhuan@caas.cn
(责任编辑 林鉴非)

