下调ROR1表达削弱黑色素瘤疫苗抗瘤效应
王玲,梅峰,薛蕊,李淼,徐慧,赵枫姝,窦骏
(东南大学医学院 病原生物学与免疫学系,南京 210009)
黑色素瘤是一类高度异质性的肿瘤,其发病率和死亡率近年来持续上升,晚期黑色素瘤患者的10年生存率仅为10%~25%[1-2]。尽管传统的放化疗、免疫调节药物和靶向治疗在临床试验中取得了令人鼓舞的成果,但患者易产生耐药性,造成疾病复发。而肿瘤异质性可能是黑色素瘤靶向治疗耐药的重要原因之一[3-7]。为克服耐药并有效治疗黑色素瘤,亟需寻求新的治疗方法。
受体酪氨酸激酶样孤儿受体1(receptor tyrosine kinase like orphan receptor 1, ROR1)是单次跨膜受体酪氨酸激酶,可促进肿瘤的形成和转移,是疾病诊断的标志物之一,也是肿瘤治疗的理想靶点之一[8-11]。近年来,已有文献报道ROR与许多血液和实体恶性肿瘤的形成有关,如淋巴细胞白血病[12-13]、卵巢癌[14-16]、乳腺癌[17]以及肺癌[18]等。但关于ROR在恶性黑色素瘤中的研究报道相对较少。因此,本研究以鼠源黑色素瘤细胞系B16F10为研究对象,用慢病毒载体介导shRNA下调ROR1分子的表达,通过肿瘤疫苗免疫C57BL/6小鼠实验,观察下调ROR1分子表达后免疫鼠的免疫活性和抗瘤效应,并初步探讨其分子机制。
1 材料与方法
1.1 研究对象黑色素瘤B16F10细胞系,购自中国科学院细胞库;293T、YAC-1、Scramble和Lv-shROR1-B16F10细胞,由东南大学医学院病原生物学与免疫学系窦骏课题组保存并提供。SPF级雌性C57BL/6小鼠,15只,6~8周龄,体质量约16 g,购自扬州大学比较医学中心。

1.3 细胞的培养将B16F10、Scramble和Lv-shROR1-B16F10细胞重悬于含10%小牛血清的RPMI 1640培养液中,于37 ℃、5% CO2恒温培养箱中培养。
1.4 慢病毒的包装及感染将慢病毒重组质粒pHBLV-U6-shROR1-ZGreen和pHBLV-U6-shNC-ZGreen分别与psPAX2、pMD2.G共转染293T细胞48和72 h后收集病毒上清液,4 ℃、96 010×g离心4 h(超速离心法)浓缩病毒,后检测其滴度;再感染B16F10细胞,具体操作详见参考文献[19],得到的细胞分别命名为Lv-shROR1-B16F10和Scramble;随后通过qRT-PCR和Western blotting验证ROR1分子的下调情况。
1.5 黑色素瘤疫苗免疫鼠实验分别将B16F10、Scramble和Lv-shROR1-B16F10 3组(每组5只小鼠)细胞的密度调整至5×106个/mL,于-80 ℃条件冷冻30 min,再于37 ℃水浴锅水溶15 min,反复冻融3次制备成疫苗后皮下免疫小鼠3次,每次间隔10 d;末次免疫10 d后于小鼠背部皮下注射野生型(wild type, WT)B16F10细胞(1×106个/只)。定期测量移植瘤大小,计算肿瘤体积并记录其变化(V=ab2/2, a为长径, b为短径),于第43 d统一剥离瘤体。用qRT-PCR 和Western blotting分别检测各组免疫鼠瘤组织中ROR1mRNA及蛋白表达情况。
1.6 NK细胞细胞毒活性的检测以脾脏细胞为效应细胞,YAC-1 细胞为靶细胞,进行NK细胞细胞毒活性及FACS检测,具体步骤详见参考文献[20]。
1.7 CTL抗肿瘤效应的检测以脾脏细胞为效应细胞,B16F10细胞为靶细胞,进行CTL细胞毒活性及FACS检测,具体步骤详见参考文献[21]。
1.8 补体依赖的细胞毒活性(complement depen dent cytotoxicity,CDC)的检测实验前1 d取B16F10细胞悬液(细胞密度1×106个/mL)500 μL接种于24孔板。待细胞铺底率达到约60%~80%时加入3组细胞疫苗免疫鼠血清,分别设5、10、20、40、80和120 μL 6个梯度,每个梯度设3个复孔,均匀混合并置37 ℃、5% CO2细胞培养箱中培养24 h。分别于0、24 h在显微镜下摄片,最后用胰蛋白酶消化各组细胞,台盼蓝染色,活细胞计数。
1.9 FACS检测免疫鼠脾脏CD4+、CD8+T细胞百分比FACS检测脾脏CD4+、CD8+T细胞百分比,具体步骤详见参考文献[20-21]。
1.10 ELISA检测免疫鼠血清IFN-γ和TGF-β水平按照ELISA检测试剂盒说明书的操作步骤进行,详见参考文献[21]。

2 结果
2.1 慢病毒感染B16F10细胞及稳定感染株的筛选慢病毒重组质粒上带有绿色荧光蛋白基因EGFP,可通过荧光显微镜观察该基因表达情况了解ROR1的表达水平。于荧光显微镜下观察慢病毒感染B16F10细胞72 h,此时的感染效率超过85%(图1A),通过极限稀释法筛选单克隆稳转株并扩大培养(图1B)。

注:A. 慢病毒感染B16F10细胞72 h;B. 筛选稳定感染的B16F10单克隆细胞株并扩大培养(分组左列为荧光显微镜视野,右列为光学显微镜视野)。图1 慢病毒pLv-shROR1感染B16F10细胞72 h及单克隆细胞株的筛选(×200)
2.2 qRT-PCR和Western blotting检测稳定感染株中ROR1mRNA及蛋白的表达qRT-PCR结果显示,与WT组和Scramble组相比,Lv-shROR1-B16F10 组ROR1 mRNA相对表达量显著减少(均P<0.05,图2A)。Western blotting结果显示,与WT组和Scramble组相比,Lv-shROR1-B16F10组ROR1蛋白表达量明显减少,灰度分析显示 Lv-shROR1-B16F10组与其他2组相比表达量显著减少(均P<0.05,图2B、2C)。这说明稳定下调 ROR1 分子表达的 B16F10 细胞株构建成功。

注:A. qRT-PCR检测WT组和各感染组细胞ROR1 mRNA相对表达量;B. Western blotting检测各感染组细胞ROR1蛋白的表达量;C. ImageJ灰度分析统计分析各组Western blotting条带灰度值。图2 感染pLv-shROR1慢病毒的B16F10细胞ROR1 mRNA及蛋白的表达
2.3 黑色素瘤疫苗免疫鼠实验植瘤后严密监测小鼠的出瘤时间,出瘤后每隔3 d测量1次肿瘤大小并记录,绘制移植瘤生长曲线。结果显示,Lv-shROR1-B16F10疫苗组小鼠肿瘤体积大于B16F10疫苗组(P=0.000 1)和Scramble疫苗组(P= 0.000 1)(图3E)。另外,与B16F10疫苗组和Scramble疫苗组小鼠的出瘤时间相比,Lv-shROR1-B16F10 疫苗组小鼠无瘤生存时间更短(P=0.010 5,P=0.048 8,图3C);而3组疫苗免疫鼠的体质量相比差异无统计学意义(均P>0.05,图3D)。

注:A. 荷瘤小鼠大体图;B. 剥离瘤体外观图;C. 荷瘤小鼠不同时间成瘤率的比较;D. 成瘤过程中小鼠体质量的比较;E. 荷瘤小鼠瘤体体积统计图。Ⅰ为B16F10;Ⅱ为Scramble;Ⅲ为Lv-shROR1-B16F10。图3 不同疫苗免疫鼠拮抗黑色素瘤生长的情况
2.4 qRT-PCR和Western blotting检测各组免疫鼠肿瘤组织中ROR1mRNA及蛋白的表达结果显示,与WT组和Scramble疫苗组相比,Lv-shROR1-B16F10疫苗免疫鼠瘤组织中ROR1 mRNA和蛋白表达水平显著升高(均P<0.05,图4A~4C)。这表明,ROR1分子表达下调后,其疫苗抑制免疫鼠体内ROR1分子表达的能力明显减弱,与未下调组相比,ROR1分子表达水平明显增加。因此,根据疫苗免疫鼠的抗瘤效应可知,肿瘤组织中ROR1分子的表达水平与黑色素瘤疫苗免疫原性强弱有关,即黑色素瘤细胞系B16F10中ROR1分子表达水平降低,其疫苗的免疫原性减弱,可引起机体抗肿瘤效应的减弱。

注:A. qRT-PCR检测疫苗免疫鼠瘤组织中ROR1 mRNA的相对表达量;B. Western blotting检测疫苗免疫鼠瘤组织中ROR1蛋白的表达;C. ImageJ灰度分析统计各组Western blotting条带灰度值。图4 各疫苗免疫鼠黑色素瘤组织中ROR1 mRNA及蛋白的表达
2.5 NK细胞细胞毒活性的检测结果显示,Lv-shROR1-B16F10黑色素瘤免疫组NK效应细胞杀伤靶细胞的阳性率较低(图5A)。因此,Lv-shROR1-B16F10肿瘤疫苗免疫鼠的NK细胞杀伤活性比WT组及Scramble免疫组要弱,杀伤靶细胞的百分比显著降低(P=0.002 8,P=0.024 9,图5B)。这说明下调ROR1分子水平能减弱疫苗免疫鼠的NK细胞细胞毒活性。

注:A. FACS检测各疫苗免疫鼠组NK细胞杀伤活性;B. NK细胞杀伤活性FACS结果的统计图。图5 FACS检测各疫苗免疫鼠组脾脏细胞中NK细胞杀伤活性
2.6 CTL细胞毒效应的检测FACS检测结果显示,Lv-shROR1-B16F10疫苗免疫组CTL杀伤活性最低(图6A),差异有统计学意义(均P<0.000 1,图6B)。以上结果表明,下调ROR1分子表达可减弱疫苗免疫鼠脾脏中CTL细胞毒活性。

注:A. FACS检测各疫苗免疫鼠组脾脏细胞中CTL的杀伤活性;B. CTL杀伤活性FACS结果的统计图。图6 各疫苗免疫鼠组脾脏细胞中CTL细胞毒活性的检测
2.7 FACS检测免疫鼠脾脏中CD4+和CD8+T细胞百分比结果显示,与WT组和Scramble疫苗组相比,Lv-shROR1-B16F10疫苗免疫鼠组脾脏细胞中CD4+T细胞和CD8+T细胞百分比显著降低(均P<0.000 1,图7A、7B)。这表明,下调ROR1分子表达后,疫苗免疫鼠的免疫活性细胞(CD4+T和CD8+T细胞)数量明显减少,可能是导致机体特异性杀伤效果减弱的原因之一。
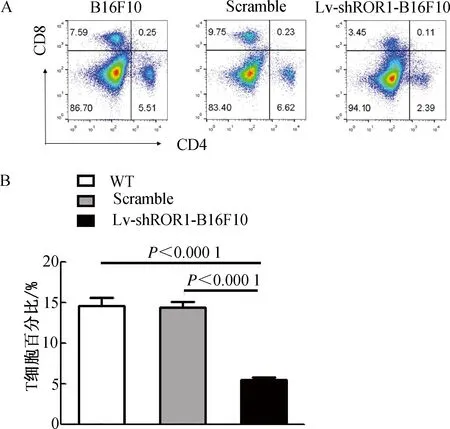
注:A. FACS检测各疫苗免疫鼠组脾脏细胞中CD4+和CD8+T细胞百分比;B. CD4+和CD8+T细胞百分比FACS结果的统计图。图7 FACS检测各疫苗免疫鼠组脾脏细胞中CD4+和CD8+T细胞百分比
2.8 CDC实验检测抗体杀瘤活性结果显示,经Lv-shROR1-B16F10疫苗免疫鼠血清孵育24 h后,B16F10细胞的生存状态良好;而加入WT组和Scramble疫苗组血清后,镜下可见大量细胞碎片(图8A)。同时,Lv-shROR1-B16F10疫苗免疫组血清CDC杀伤B16F10的活性相对于WT组及Scramble免疫组有差异(图8B),且有统计学意义(均P=0.000 1,图8C)。

注:A. 各疫苗免疫鼠组血清CDC活性(×200/×400);B. 肿瘤细胞台盼蓝染色及计数(×100/×200);C. 各疫苗免疫鼠组CDC活性的统计分析图。图8 各疫苗免疫鼠组血清CDC的活性
2.9 ELISA检测免疫鼠血清中IFN-γ和TGF-β分泌水平结果显示,与WT组和Scramble疫苗免疫组相比,Lv-shROR1-B16F10疫苗免疫鼠血清中IFN-γ分泌水平显著降低(P=0.010 9,P=0.026 9,图9A)。与WT组和Scramble疫苗免疫组相比,Lv-shROR1-B16F10疫苗免疫鼠血清中TGF-β分泌水平显著升高(P=0.005 0,P=0.012 4,图9B)。

图9 ELISA检测疫苗免疫鼠血清中IFN-γ和TGF-β水平
3 讨论
恶性黑色素瘤发生转移扩散是导致患者死亡的主要原因[22]。过表达ROR1与多种恶性肿瘤的发生发展密切相关。为此,本研究通过下调黑色素瘤细胞中ROR1分子的表达,研究黑色素瘤疫苗免疫鼠的抗瘤效应。
通过反复冻融的方式制备肿瘤疫苗注射至C57BL/6小鼠体内,末次免疫10 d后再用B16F10细胞攻击免疫鼠。结果发现,与WT组和Scramble疫苗组相比,下调B16F10细胞中ROR1分子水平后,其疫苗诱导的免疫活性减弱,抗肿瘤效果欠佳。其中,Lv-shROR1-B16F10疫苗组的ROR1mRNA及蛋白表达水平最高,说明下调B16F10细胞ROR1表达后,其疫苗免疫原性减弱,免疫效应下降,导致对B16F10细胞所致鼠黑色素瘤细胞的杀伤作用减弱,而使瘤组织中的ROR1表达依然高位(图4)。对NK细胞杀伤率和CTL细胞毒活性的检测发现,Lv-shROR1-B16F10疫苗组NK细胞和CTL杀伤活性低于WT组和Scramble疫苗组(图5、6)。进一步结果证实,Lv-shROR1-B16F10疫苗组CD4+和CD8+T细胞百分比显著低于其他2组(图7)。CDC活性检测实验显示,Lv-shROR1-B16F10疫苗免疫组小鼠血清中抗体与靶细胞抗原结合激活补体系统杀伤B16F10细胞的能力相对于其他2组也明显减弱,其加入免疫鼠血清后细胞生存状态依然良好(图8)。此外,相对其他2组,Lv-shROR1-B16F10疫苗组外周血清中IFN-γ分泌水平受到明显抑制,而具有免疫抑制功能的TGF-β分泌水平有所升高(图9)。以上结果均表明,下调ROR1分子表达能够减弱黑色素瘤疫苗的免疫原性,从而使NK细胞和CTL杀伤活性均有所下降,致使疫苗诱导的抗瘤效应也随之减弱。所以,ROR1分子在黑色素瘤疫苗中抗瘤效应的发挥中起重要作用。然而,ROR1分子仅是黑色素瘤疫苗中的优势抗原之一,经反复冻融的疫苗中包含了大量的优势蛋白,它们在其中发挥的免疫效应及机制还需进一步探索。
总之,鼠源黑色素瘤全细胞疫苗能够诱导机体产生有效的免疫反应,达到拮抗肿瘤的作用。其疫苗的优势在于含高免疫原性的优势抗原ROR1分子,可激发机体产生强烈的免疫效应,抑制肿瘤细胞的生长和存活。然而,下调ROR1表达导致黑色素瘤疫苗免疫活性减弱而影响免疫鼠抗瘤效应,这说明ROR1是黑色素瘤疫苗的重要靶点。但对上调B16F10细胞ROR1表达是否能增强该疫苗的抗瘤效应等问题,尚待探究,以便为该疫苗防治黑色素瘤提供可靠的实验依据。

