人工设计短肽对α-淀粉酶催化作用的影响
鲁明杰,李传博,谢丹丹,迟乃玉,岳松年,窦少华*
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
淀粉酶能够催化α-1,4糖苷键水解,并将淀粉分解为多种重要的物质,如单糖、糊精等[1-3]。它主要从微生物来源生产,分为α,β和γ亚型,应用十分广泛,约占世界酶市场的25%~30%,在食品、制药和洗涤等工业生产领域中起着至关重要的作用[4-6]。
影响淀粉酶活性的因素有很多,包括温度、pH、酶浓度、底物浓度、激活剂和抑制剂等[7-8]。目前,通过生物学科和物理学科相结合来提高淀粉酶的生产水平成为科学研究重点。经常采用的技术手段是通过电场装置向酶解体系中直接加入高频、中频和低频电场以达到改变淀粉酶活性的目的[9]。Zeta电位被认为是一种估计蛋白表面电位的间接工具,是维持最佳蛋白功能的关键物理特性[10-11]。因此,可以选择Zeta电位作为判定蛋白表面由于各种过程而发生的变化的工具。
电场可以使氨基酸表面的正负电荷产生高频率交替位移,从而使酶活性降低、升高。α-淀粉酶活性升高可以加速底物的分解,提高发酵工业效率;α-淀粉酶活性降低,可以有效延长淀粉制品的保质期[12]。毛霉蛋白酶经过高频电场处理后,酶活增长幅度较大,有的甚至高达20%[13]。中等频率电场处理果胶甲酯酶后,发现在0.4 V/cm电场强度下对果胶甲基酯酶活性具有显著效果[14]。低频电场辐射条件下生长的酿酒酵母缩短了生长迟滞期,加快了其对数生长期,且其生长速率相比自然生长提高了14.5%[15]。由此可知,高频和低频电场可以直接作用在酶上,作用快,效果显著,但是也有弊端,如能耗大,不够环保。如果能够人工合成和电场具有相同作用的短肽,则可以有效解决这个问题。
人工设计短肽可以依据实际需求,利用不同氨基酸带电性的不同,合成总电荷量不同的短肽[16]。邓真真等[17]以经典米氏动力学方程为基础,构建复杂体系中酶促反应动力学模型,从理论以及实验角度来全面地对体系中底物的丰度与其相应酶促速率之间的关系进行研究,证明复杂体系中的酶解反应速率几乎与底物的丰度无关。本课题组刘荣娜等[18]通过测定米氏常数(Km)和活化能(Ea)验证了带电蛋白质的加入可以提高酶与底物的亲和力,增加酶的催化效率。因此,以结构清晰的牛血清白蛋白氨基酸序列为模板,人工设计合成带有正电荷和负电荷的两条短肽T8-和T9+。本研究将T8-和T9+两条短肽加入α-淀粉酶酶促反应,并对α-淀粉酶和带电荷短肽反应过程各种因素进行科学分析,在最优测定条件下研究人工设计带电荷短肽的加入对淀粉酶催化作用的影响,可以为酶的食品、医药、农业应用等研究提供新的科学依据。
1 材料与方法
1.1 材料与试剂
NaH2PO4、Na2HPO4、葡萄糖、HCl、NaOH、NaCl、可溶性淀粉、酒石酸钾钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):生工生物工程(上海)股份有限公司;α-淀粉酶(500~1 500 U/mg):美国Sigma-Aldrich公司;4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP)、1-羟基苯并三唑(hydroxybenzotrizole,Hobt)、N,N'-二异丙基碳二亚胺(N,N'-diisopropylcarbodiimide,DIC)、wang树脂、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)、巴豆酸:上海麦克林生化科技有限公司。
1.2 仪器与设备
DK-S26电热恒温水浴锅:上海一恒仪器有限公司;Multiskan GO全波长酶标仪:赛默飞世尔科技公司;Zeta电位仪:Brookhaven Instruments Inc.。
1.3 方法
1.3.1α-淀粉酶活性的测定
采用3,5-二硝基水杨酸测定还原糖[19-20]计算α-淀粉酶活力。α-淀粉酶活力计算公式如下:

式中:C为标准曲线上查得的葡萄糖含量,μmol;Ew为0.2 mL酶
液中含有的酶的质量,mg;t为反应时间,min。
α-淀粉酶活定义:将pH值为6.9,温度为40 ℃时,每分钟水解淀粉产生1.0 mg的葡萄糖所需要的α-淀粉酶量定义为一个酶活力单位(U/mg)。
1.3.2α-淀粉酶最适反应条件的优化
温度对α-淀粉酶活力的影响:分别设置实验温度(30℃、35 ℃、40 ℃、45 ℃),加入200 μL 10-4g/mL的α-淀粉酶溶液,磷酸缓冲盐溶液(phosphatebuffersaline,PBS)浓度0.01mol/L,缓冲液pH 6.9,测定α-淀粉酶的活力。
PBS缓冲液浓度对α-淀粉酶活力的影响:分别设置PBS缓冲液浓度(0、0.01 mol/L、0.02 mol/L、0.03 mol/L、0.05 mol/L、0.10 mol/L),加入200 μL 10-4g/mL的α-淀粉酶溶液,设置温度40 ℃,缓冲液pH 6.9,测定α-淀粉酶的活力。
缓冲液pH对α-淀粉酶活力的影响:分别设置缓冲液pH(6.5、6.7、6.9、7.0、7.1、7.3、7.5),加入200 μL 10-4g/mL的α-淀粉酶溶液,设置温度40 ℃,PBS缓冲液浓度0.01 mol/L,测定α-淀粉酶的活力。
1.3.3 短肽的合成
根据氨基酸的带电性,利用多肽技术合成路线合成直线肽T8-、T9+[16,21]。
合成路线:树脂溶胀→连接首个氨基酸→脱保护→检测(深蓝色为阳性反应)→第一次清洗→缩合→第二次清洗→检测(无色为阳性反应)→肽链的延伸→肽的收缩→氨基酸侧链脱保护→树脂的切割→粗品肽
1.3.4 高效液相色谱分析
分别对两条短肽进行高效液相色谱测定,分析其纯度,色谱条件参考文献[22]。
1.3.5 T8-和T9+对α-淀粉酶活力的影响
先将α-淀粉酶溶液稀释为10-4g/mL,再分别加入200 μL 1 mg/mL T8-、T9+溶液,作用5 min,再按照1.3.1方法测得酶活,考察酶活变化。
依次稀释T8-、T9+溶液浓度为10-4U/mg,10-5U/mg,10-6U/mg,10-7U/mg,10-8U/mg,取溶液200 μL加入α-淀粉酶溶液中,作用5 min,再按照1.3.1方法测得酶活,考察酶活变化。
1.3.6 米氏常数的测定
将含量为2%的淀粉溶液依次稀释至0.25%、0.50%、1.00%和1.50%的底物浓度。分别将200 μL T8-溶液和T9+溶液加入200 μLα-淀粉酶溶液,40 ℃水浴反应5 min,测得还原糖的产量。按照底物浓度和反应速率的关系使用双倒数法作图[21,23],可得到最大反应速率(Vm)和米氏常数(Km)。
1.3.7 活化能的测定
酶能够明显的降低反应所需活化能,从而加快反应速度。温度对反应速度的影响,一般表现为随着温度的升高,化学反应也随之加快,服从Arrhenius公式[24-25]。分别在30 ℃(303 K)和40 ℃(313 K)条件下测量各自的酶促反应速率常数。

式中:K为酶促反应速率常数;R为摩尔气体常数;T为热力学
绝对温度,K;Ea为活化能,J/mol;A为阿伦尼乌斯常数。
(1)根据直线求Ea以为X轴,log K为Y轴,依据四点数据,求出回归方程Y=aX+b,最小二乘积计算出斜率a,将R值代入计算得Ea。
(2)依据两点数据直接计算法,选择在30 ℃(303 K)和40 ℃(313 K)条件下测量各自的酶促反应速率常数K,Ea计算公式为:

1.3.8 Zeta电位的测定
分别将1.4 mLα-淀粉酶溶液、T8-溶液、T9+溶液、淀粉溶液、水加入到Zeta电位样品池中,测得电位[26-27]。然后将α-淀粉酶溶液:T8-溶液、α-淀粉酶溶液:T9+溶液按1∶1比例混合,依次加入到Zeta电位样品池中,测得电位。最后将α-淀粉酶溶液:T8-溶液:淀粉溶液、α-淀粉酶溶液:T9+溶液:淀粉溶液按1∶1∶1比例混合,依次加入到Zeta电位样品池中,测得电位。
1.3.9 统计分析
利用SPSS 26.0和GraphPad Prism 9.0.0软件对试验数据进行统计与分析。实验数据均进行3次平行,以平均值±标准偏差表示。数据分析过程中,当P<0.05,表示具有显著性差异,显著性的置信区间为95%。
2 结果与分析
2.1 最适测定条件的优化
不同浓度缓冲液、pH、温度对α-淀粉酶酶活影响见图1。

图1 不同温度(A)、浓度缓冲液(B)、pH值(C)对α-淀粉酶酶活影响Fig.1 Effect of different temperature (A),buffer concentrations (B),and pH (C) on α-amylase activities
由图1A可知,随着温度的升高,α-淀粉酶的活性呈先增加后降低趋势,在温度为40 ℃时,α-淀粉酶酶活有最大值,为199.66 U/mg,说明α-淀粉酶的最佳测定温度为40 ℃。温度为30~45 ℃时酶活虽然有变化,但是变化并不大,说明在适宜温度范围内,温度对α-淀粉酶酶活有影响,但影响不大。
由图1B可知,随着缓冲液浓度的增加,α-淀粉酶的活性呈不断降低趋势,在缓冲液浓度0.01 mol/L时,α-淀粉酶酶活有最大值,为628.12 U/mg,说明α-淀粉酶的最佳缓冲液浓度为0.01 mol/L。
由图1C可知,随着缓冲液pH的增加,α-淀粉酶的活性呈先增加后降低趋势,在pH值为6.9时,α-淀粉酶酶活有最大值,为626.12 U/mg,说明α-淀粉酶的最佳缓冲液pH值为6.9,α-淀粉酶酶活受pH值影响较大,后续实验应充分注意pH的影响。
2.2 短肽合成结果
人工设计合成的带电荷短肽T9+和T8-的高效液相色谱图见图2,分析结果见表1、表2。

表1 T9+高效液相色谱分析结果Table 1 Analysis results of high performance liquid chromatography of T9+

表2 T8-高效液相色谱分析结果Table 2 Analysis results of high performance liquid chromatography of T8-

图2 T9+(A)及T8-(B)的高效液相色谱图Fig.2 High performance liquid chromatogram of T9+(A) and T8-(B)
结果表明,制备的短肽T9+RKHYRQSTEFKKVHQ通过高效液相色谱仪检测后出现四个峰,有三种微量杂质,可忽略不计,第三个峰为短肽T9+,纯度为98.04%,分子质量为1 972.26,溶解性正常,符合所需实验要求。制备的短肽T8-YEDEFHNDQEYSETD通过高效液相色谱仪检测后出现两个峰,第二个峰为短肽T8-,纯度为98.88%,分子质量为1 920.85,溶解性正常,符合所需实验要求。
2.3 T8-和T9+对α-淀粉酶作用的影响
2.3.1α-淀粉酶活力
不同种类及浓度短肽对淀粉酶活力的影响见图3。由图3可知,短肽T8-和T9+质量浓度为10-4g/mL时,加入T8-后,α-淀粉酶酶活为314.27 U/mg,与空白组(未加入短肽)酶活304.72 U/mg相比增加3.13%,加入T9+后,α-淀粉酶酶活为300.58 U/mg,与空白组酶活相比降低1.36%。说明带不同种电荷的短肽对α-淀粉酶酶活有相反的作用,且随着加入T8-和T9+溶液浓度的减小,α-淀粉酶酶活变化的趋势减小,在短肽质量浓度为10-4g/mL时酶活影响最大,可能是由于所带电荷的不同引起α-淀粉酶酶活发生不同的变化。总体来讲,人工设计带负电荷短肽T8-对α-淀粉酶的催化作用有正效应,人工设计带正电荷短肽T9+对α-淀粉酶的催化作用有负效应。
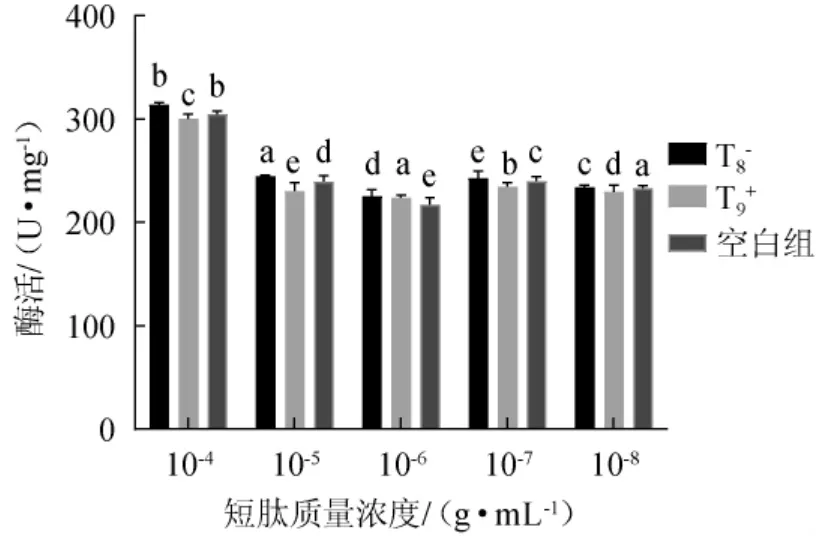
图3 不同种类及浓度短肽加入对酶活的影响Fig.3 Effects of adding different kinds and concentrations of short peptides on enzyme activity
2.3.2 米氏常数的测定
反应速率由不同底物浓度下所产生的还原糖含量可求得,依据双倒数作图法,做出加入不同短肽后α-淀粉酶的米氏方程曲线,得到的α-淀粉酶的反应动力学参数见表3。
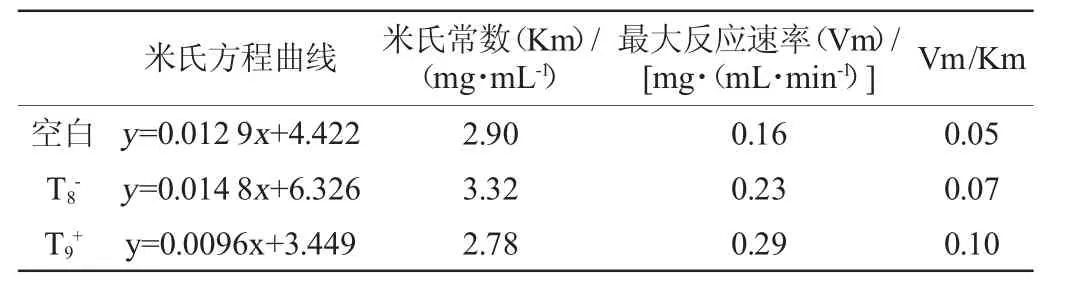
表3 加入不同短肽溶液的α-淀粉酶动力学参数Table 3 Kinetic parameters of α-amylase with different short peptides
由表3可知,加入T8-溶液,米氏常数Km升高,Vm/Km增加;加入T9+溶液,米氏常数Km值降低,Vm/Km也增加,说明不同带电荷短肽的加入使酶与底物的亲和力发生改变[23]。
2.3.3 活化能的测定
反应速率与活化能密切相关[8],不同种类及浓度短肽对活化能的影响见图4。由图4可知,加入T8-和T9+后酶的活化能有明显的改变。加入T8-后,活化能从原来的2 152.89 J/mol降低为497.44 J/mol,活化能降低,酶活升高,说明T8-起到提高酶活性的效果。加入T9+后,活化能为4 942.90 J/mol,增加130%,说明T9+起到降低酶活性的效果。其中,质量浓度为10-5g/mL时,活化能改变最小,质量浓度为10-6g/mL时,活化能改变最大,其余质量浓度短肽对活化能的影响也非常明显。说明不同质量浓度T8-和T9+的加入对活化能分别起到降低和升高活化能的作用,且影响较大。
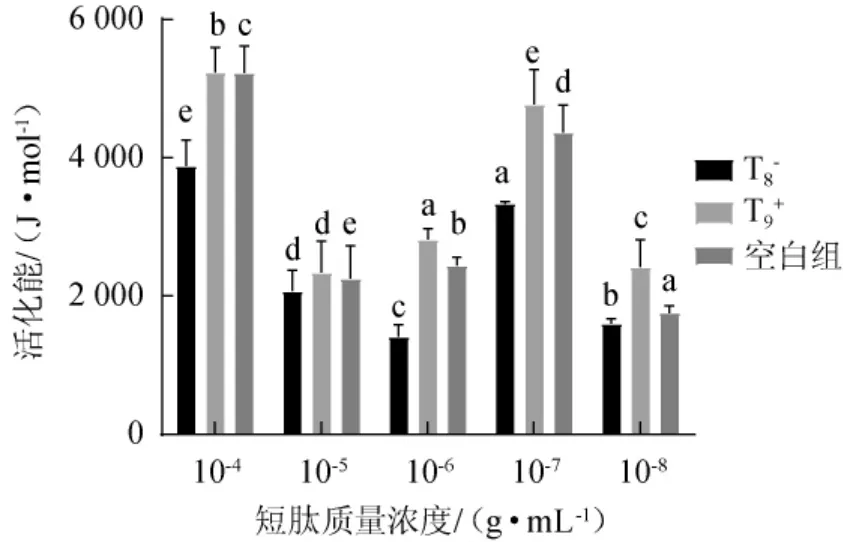
图4 不同种类及浓度短肽加入对活化能的影响Fig.4 Effects of adding different kinds and concentrations of shortpeptides on activation energy
2.3.4 电位变化
T8-、T9+、酶、底物淀粉溶液按比例加入后摇匀,进行电位测定,结果见表4。由表4可知,将T8-和T9+加入到酶和底物淀粉体系后,原有体系电位值分别增加了32%和47%,说明T8-和T9+的加入,影响了α-淀粉酶的酶促反应,从而影响了Zeta电位,也说明可将电位的变化作为观察酶性质的一个指标。

表4 不同物质的Zeta电位Table 4 Zeta potential of different substances

续表
3 结论
本实验利用多肽固相合成法合成带电荷短肽T8-和T9+,并探讨其对α-淀粉酶的活性、米氏常数(Km)、活化能和Zeta电位的影响。T8-使α-淀粉酶体系活化能降低,反应易发生,可作为激活剂应用在食品发酵中提高发酵速率。T9+使α-淀粉酶体系活化能升高,反应难发生,可作为抑制剂应用在食品贮藏中延迟腐败速率。人工设计的短肽,结构简单,组分单一,能耗小成本低,危害性低,将其应用在食品生产、发酵、酿造以及纺织工业具有极大的创新意义和应用价值。因此,可以进一步验证酶与底物的催化作用和短肽表面所带电荷的相关性,为增加或降低酶的活化能提供有力支撑。

