高压注浆环境下水泥水化产物对地下水pH值影响研究
袁胜超
(1.华北有色工程勘察院有限公司,河北 石家庄 050021;2.河北省矿山地下水安全技术创新中心,河北 石家庄 050021)
1 引言
矿山帷幕注浆技术在大水矿山水患治理、保证井下作业安全、减少矿山排水运行成本方面具有重要作用,已在国内众多水患矿山成功实施并取得了良好效果。由于目前使用的注浆材料为黏土、水泥以及水玻璃等物质,其反应后的产物为水化硅酸钙、氢氧化钙、水化铝酸钙等碱性物质[1],使得地下水pH值升高,人为地破坏了地下水环境。另外,在全球性淡水缺乏的形势下,该地下水作为污染源随着矿山开采排放注入河床,进一步污染了地表水资源,破坏了周边生态环境。而采取对排放水进行处理后再注入河床的方式,则矿山需要付出很大的经济代价。
以某矿山为例,该矿目前排水量为70728 m3/d,同时该矿正在实施矿山帷幕注浆工程,所用浆液为黏土水泥混合浆液,在注浆过程中矿山发生多次因排放水pH值超标导致矿山停产及帷幕注浆工程停工现象,经对排放水测试,pH值为10(排放标准为6~9),pH值超标阻碍了矿山的正常生产,影响了帷幕注浆的施工进度,破坏了当地的生态环境。
注浆过程中均采用高压注浆,高压帷幕注浆能有效缩短整个浆液体系的初凝时间,研究显示注浆压力从1.5 MPa提升至2.0 MPa时,浆液初凝时间缩短约1 h[2-3]。而高压注浆条件是否是导致地下水pH值快速升高的主要因素,也是本文的研究目标。
2 水泥水化反应机理
目前注浆采用的浆料水泥材料中,硅酸三钙(3CaO·SiO2)和硅酸二钙(2CaO·SiO2)是其主要成分,且能通过水化反应(式1和式2)生成强碱性的氢氧化钙(Ca(OH)2)[4],为加速水化反应加入了水玻璃(NaO·nSiO2)[5]。为模拟水化反应特进行了水化学试验研究,本次选取了氢氧化钙、硅酸钠及其两者的混合溶液,通过测定pH值来研究哪种物质为主要影响因素。
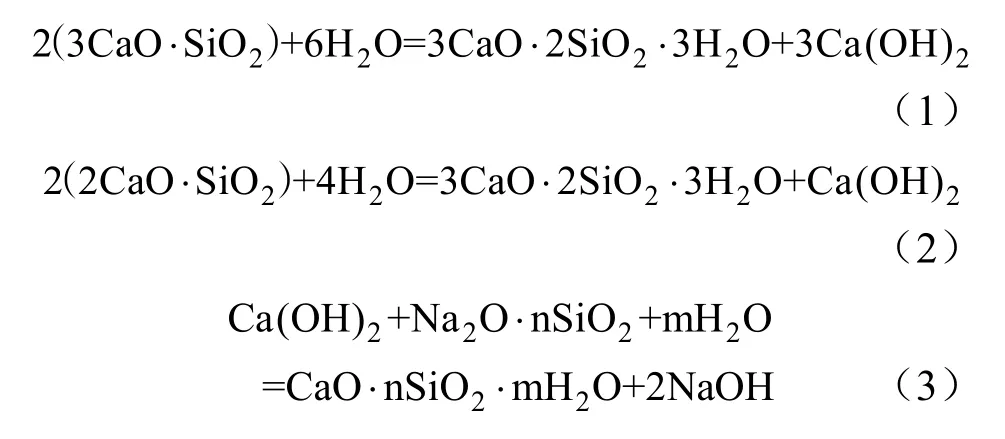
2.1 Ca(OH)2溶液对pH值的影响
Ca(OH)2溶解度低易达饱和,因此研究了0.01~0.27 mol/L浓度下的Ca(OH)2溶液,并测定了饱和溶液的pH值,如图1所示。作为一种强碱性的物质,溶液中存在少量Ca(OH)2时也会导致水环境的pH值急剧增大,在氢氧化钙为0.00333 mol/L时,水体pH值能达到11.65,且随着物质的量增大,水体pH值也增大,在室温条件下饱和Ca(OH)2溶液的pH值约为12.55。
2.2 Na2SiO3·5H2O溶液对pH值的影响
试验中采用不同Na2SiO3·5H2O的量来模拟水玻璃对水环境pH值的贡献,其具体影响程度如图2所示。与 Ca(OH)2的区别是,由于 Na2SiO3·5H2O溶解度大,水体pH值会随Na2SiO3·5H2O浓度的增大而增加。同样,当 Na2SiO3·5H2O浓度达 0.0033 mol/L时,水体pH值能达到11.44,并随浓度的增加,水体pH值增大。

图1 Ca(OH)2溶液pH值

图2 Na2SiO3·5H2O溶液pH值
2.3 混合溶液对pH值的影响
水泥浆液中加入水玻璃,会和水泥水化过程中产生的 Ca(OH)2进一步反应,生成 NaOH[6],故研究了 Na2SiO3·5H2O 和 Ca(OH)2在物质的量之间的关系。
在上述单项溶液基础上,以Ca(OH)2定量,不断投入Na2SiO3·5H2O,通过反应后pH值变化,如图3所示,可见在Ca(OH)2达到饱和之前,相同浓度下 Ca(OH)2的 pH 值大于 Na2SiO3·5H2O 溶液的pH值,是影响水环境pH值的主要因素。当Ca(OH)2达到饱和后,相同浓度下Na2SiO3·5H2O的pH值大于Ca(OH)2溶液的pH值,并且当两者等量混合后,溶液pH值的增量变大,大于Ca(OH)2达饱和之前的两物质等量混合后的溶液pH值。

图3 定量氢氧化钙下硅酸钠对水环境pH值的影响
实际应用中,水泥为主要注浆材料,而水玻璃作为主材的添加剂,水泥相对于水玻璃是过量的,其水化反应的过程中Ca(OH)2会不断被释放出来,逐渐从少量至过量,因此试验模拟了不同配单号下的一定水玻璃浓度在不同 Ca(OH)2浓度的条件下水环境pH值的变化,其结果如图4所示。在Na2SiO3·5H2O为0.0067 mol/L时,用不断增加的Ca(OH)2浓度来表示水泥水化反应的进行,随着Ca(OH)2量的增加,水体pH值不断增大,直到和溶液中的Na2SiO3·5H2O完全反应后,水体中的Ca(OH)2才会有所剩余,并随水化反应的进行最终达到局部饱和,最终溶液的pH值基本稳定,期间最大 pH值可达 12.56。当Na2SiO3·5H2O为0.0133 mol/L时,同样,随着Ca(OH)2量的增加,水体pH值不断增大,如图4所示,其溶液最大pH值可达12.57。由此可知,Na2SiO3·5H2O在可控量范围内随着Ca(OH)2量的增加,进行相关化学反应后pH值会相应增加,随着反应的进行,后期 Ca(OH)2对水体 pH值影响较大,但由于Ca(OH)2溶解度有限,pH值最终会趋于稳定。

图4 定量硅酸钠下氢氧化钙对水环境pH值的影响
结合现场注浆实际,固体注浆材料中54.51%为水泥,水玻璃仅占水泥质量的3%,因此水泥相对于水玻璃是过量的,而通过文献查阅,相对初凝的反应过程而言,水泥中的 3CaO·SiO2(占 37. 5%~60%),2CaO·SiO2(占 15%~37. 5%)主要生成物为Ca(OH)2,经综合分析得出,水泥水化反应生成的Ca(OH)2是导致矿区水体pH值升高的主要原因。
3 高压注浆条件下pH值升高研究
由于现场采用高压注浆方式,为研究高压注浆条件是否为pH值升高主要原因,选择现场采用的配比浆液分别在常压、2 MPa、4 MPa、6 MPa 的注浆压力条件下进行初凝时间及pH值测定,试验仪器采用高压固结试验装置,试验流程如图5所示。

图5 试验流程
同一配比的注浆混合浆液在不同注浆压强下的初凝时间如图6所示。由图6可知,在2 MPa注浆压强下,浆液在 40 min左右其测试电流基本不变,表明浆液已从可塑状转为不可塑的初凝状态。同理,在4 MPa和6 MPa压强下,浆液的初凝时间分别约为30 min和23 min。以上数据显示,在同种浆液条件下,随注浆压强的增大,浆液的初凝时间缩短[7-8]。
图6 不同压强下浆液的初凝时间
由上述研究可知,Ca(OH)2是浆液 pH值偏碱性最直接的原因,而帷幕灌浆采用高压注浆的方法已被证实可以缩短浆液的初凝时间,通过分析,初凝过程中会有Ca(OH)2的释放,而Ca(OH)2与浆液中水玻璃(Na2SiO3)反应生成的 NaOH是导致溶液pH值上升超过饱和Ca(OH)2溶液pH值(12.65)的主要原因。
高压注浆环境是否能够导致Ca(OH)2快速释放需要进一步研究。本次试验进行了高压注浆试验测定pH值,同一配比浆液不同压强下浆液初凝过程中析出溶液的pH值如图7所示。在不同压强条件下,溶液的pH值随时间的增加而增大,且随着注浆压强从2 MPa增大至6 MPa的过程中,同一时刻浆液的pH值的大小关系(单位时间内释放的OH-量)为随着压强增加,pH值增大,表现为 6 MPa下溶液pH值>4 MPa下溶液pH值>2 MPa下溶液pH 值,以未到达初凝时间 20 min为例,0、2 MPa、4 MPa、6 MPa压力条件下 pH 值分别为 12.09,12.16,12.24,12.27。结合浆液初凝时间和压强的关系可知,压强的增大能缩短浆液初凝时间,而浆液的初凝过程中水泥的水化反应能释放大量Ca(OH)2,并且 Ca(OH)2能进一步与水玻璃发生化学反应生成溶解度更大的NaOH,因此增大注浆压强能增大单位时间内OH-的释放量,但从数据上分析,pH值随着压力的增大,变化相对缓慢,由 0增大到6 MPa后,pH值变化仅为0.18,因此高压注浆条件是影响浆液pH值增大的因素之一,但不是主要因素。

图7 不同压强下析出溶液pH值与时间的关系
对初凝后的混合浆液结石体使用清水,按照初凝后混合浆液结石体与清水质量1∶4的比例浸泡,研究水溶液pH值的变化,其结果如图8所示。可见初凝的混合浆液柱在释放 OH-时可分为 3个阶段,0~60 min为第1阶段,是OH-的快速释放阶段(水体pH值快速增长阶段);60~1320 min为第2阶段,是OH-的缓速释放阶段(水体pH值缓慢增长阶段);1320 min之后为第3阶段,是OH-释放平衡阶段(水体pH值相对稳定阶段)。利用现场使用的两种配比浆液进行了相关试验,其中配单 9使用的水泥量比配单5多100 kg/m3,由图8可知,在第1阶段中两者释放OH-的速度和量相差较小,其60 min时溶液的pH值分别为8.84和8.74,在第2阶段期间配单9释放OH-的速度开始大于配单5,最终两者均在1320 min之后的第3阶段基本达到平衡,其平衡时溶液pH值分别为11.25和10.14。
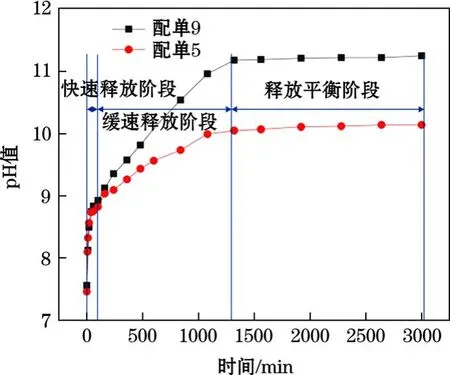
图8 OH-离子释放阶段
采用不同配比浆液注浆时,水泥使用量为pH值增大的关键,且缓速增长期决定了 pH值的大小,为后期降低pH值的研究提供了理论基础。
4 结论
通过本项研究得出如下结论:
(1)水泥水化反应生成的Ca(OH)2是导致矿区水体pH值升高的主要原因;
(2)高压注浆条件是影响地下水pH值增大的因素之一,但不是主要因素;
(3)在水化反应过程中,OH-离子释放分为快速释放、缓速释放及释放平衡阶段。

