低钾条件下TWIK-1双孔钾通道对小鼠心肌细胞膜电位的影响及其机制研究*
李东梅, 杨雅雯, 党喜同, 左东川
(西南医科大学心血管医学研究所,医学电生理学教育部重点实验室,四川泸州646000)
低钾血症(血清钾浓度低于3.5 mmol/L)是常见的电解质紊乱之一,可导致心律失常,危及生命[1-3]。心肌细胞静息状态下的膜电位呈现超极化,是维持心肌细胞正常兴奋性和传导性的必要条件。心肌细胞在静息状态下主要开放背景钾离子通道,因此心肌细胞的静息膜电位接近钾离子平衡电位(约-80 mV)。根据Nernst 方程,当细胞外钾离子浓度(extracellular K+concentration,[K+]e)降低时,细胞内钾离子外流增强,心肌细胞静息膜电位应处于超极化状态,例如小鼠和大鼠的心肌细胞[4-5]。但以往在成人心肌细胞及羊和狗浦肯野纤维的研究表明,当[K+]e降低时,心肌细胞静息膜电位呈现异常去极化(约为-40 mV)[6-10]。尽管这一异常的电生理现象与低钾血症诱发的心律失常密切相关,但其具体分子机制仍不明确。
双孔钾通道是近年发现的一类新型钾离子通道超家族,包含15 个亚型。双孔钾通道属于背景钾离子通道,参与细胞静息膜电位的维持[11-14]。TWIK-1双孔钾通道属于双孔钾通道家族,是从人类肾组织中克隆出的第一个双孔钾通道亚型[15]。尽管TWIK-1通道在心肌细胞高度表达,但其调控心肌细胞电生理特性的病理生理意义尚不明确。双孔钾通道在结构上与其它类型钾通道不同,属于二聚体而不是四聚体,其功能性亚基含有4个跨膜片段、2个孔区(P1和P2)及位于孔区的选择性过滤器。TWIK-1通道的离子选择过滤器是位于P1孔区的一段高度保守的非对称性氨基酸序列(TxGYG)[16]。我们的前期研究表明,在低[K+]e条件下,TWIK-1通道的离子选择性发生改变而介导内向钠离子电流,而位于通道P1 孔区选择性过滤器的第118 位苏氨酸(T118)在这一过程中起到关键作用[17]。这说明,在低[K+]e条件下,TWIK-1通道的功能不再是维持细胞静息膜电位超极化,而是使静息膜电位去极化。我们推测,TWIK-1 通道功能的异常可能在低钾诱发心肌细胞静息膜电位异常去极化的过程中起到了重要作用。本实验以小鼠HL-1细胞为心肌细胞模型,探讨在低[K+]e条件下TWIK-1通道功能的改变对心肌细胞静息膜电位的影响及其机制。
材料和方法
1 主要试剂
DMEM 培养液、青霉素-链霉素和胰酶细胞消化液(Gibco);胎牛血清(HyClone);河鲀毒素(tetrodotoxin,TTX)和CoCl2(Sigma)。
2 主要方法
2.1 细胞培养与转染 携带人TWIK-1和TWIK-1-T118i突变体基因序列的慢病毒载体(滴度1×1011TU/L)由赛业生物科技包装。载有各基因序列及绿色荧光蛋白(green fluorescent protein,GFP)的慢病毒预先用DMEM 培养液以1∶1 000的比例稀释,分装于EP管中,保存于-80 ℃冰箱中备用。
中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞与HL-1 小鼠心肌细胞均来自西南医科大学心血管医学研究所(医学电生理学教育部重点实验室)。2 种细胞均培养在含有10%胎牛血清的DMEM 培养液。细胞接种于含有玻片的培养皿中。待细胞生长至80%融合时,转染组细胞加入预先稀释好的病毒,放入孵育箱共同培养48 h 后,用于膜片钳实验。所转染病毒均携带GFP,用于检测细胞是否转染成功。
2.2 电生理 采用HEKA膜片钳系统(EPC10)在电流钳模式下记录细胞静息膜电位;在电压钳模式下记录全细胞电流,斜坡刺激方案为电压从-140 mV去极化到100 mV,跨度为2 200 ms[17-18]。采用电阻为2~3 欧姆的玻璃电极,形成封接,破膜后进行记录。记录CHO 细胞的电极内液组成为(mmol/L):140 KCl,1 MgCl2,10 EGTA,1 K2-ATP,5 HEPES(pH 7.4)。电极外液组成为(mmol/L):135 NaCl,5 KCl,2 CaCl2,1 MgCl2,15 glucose,10 HEPES(pH 7.4)。记录HL-1 心肌细胞的电极内液组成为(mmol/L):20 KCl,120 potassium aspartate,1 MgCl2,5 Na2-ATP,0.5 Na2-GTP,10 EGTA,5 HEPES(pH 7.4)。电极外液组成为(mmol/L):140 NaCl,5.4KCl,1.8 CaCl2,1 MgCl2,10 glucose,10 HEPES(pH 7.4)。
为了检测低[K+]e对细胞膜电位及全细胞电流的影响,细胞外液中钾离子浓度降低至2.7 mmol/L,同时,相应提高外液中NaCl 的浓度,以维持外液总渗透压不变。为了记录低[K+]e条件下TWIK-1 通道介导的内向钠电流,低钾外液中加入2 mmol/L CoCl2及500 μmol/L TTX 以阻断心肌细胞电压门控钙通道及钠通道电流[18]。
3 统计学处理
所记录电生理数据采用IGOR Pro软件进行制图和统计分析,以均数±标准差(mean±SD)表示。
结 果
1 低[K+]e时,表达人 TWIK-1 通道的 CHO 细胞静息膜电位发生去极化
CHO 细胞经载有TWIK-1基因序列的慢病毒转染48 h后,膜片钳可记录到典型的TWIK-1通道全细胞电流(图1A)。当[K+]e为5.4 mmol/L 时,CHO 细胞的静息膜电位为(-77.0±0.9)mV,当[K+]e降为2.7 mmol/L 时,CHO 细胞的静息膜电位首先呈现超极化,随着细胞外低钾溶液灌流时间的延长,静息膜电位缓慢去极化到(-58.0±1.2)mV,当[K+]e恢复到5.4 mmol/L 时,静息膜电位恢复到静息水平(图1B)。此外,当[K+]e从 5.4 mmol/L 降为 2.7 mmol/L 时,TWIK-1 通道全细胞电流的反转电位由(-77.0±0.9)mV去极化到(-59.0±1.3)mV(图1C)。
2 低[K+]e时,TWIK-1通道介导的内向钠离子电流引起CHO细胞静息膜电位去极化
为了进一步验证TWIK-1通道介导的内向钠离子电流是低[K+]e引起CHO细胞静息膜电位去极化的关键,我们将细胞外低钾溶液的钠离子替换为N-甲基-D-葡萄糖胺(N-methyl-D-glucamine,NMDG)。膜片钳结果显示,当[K+]e从5.4 mmol/L 降为2.7 mmol/L 时,表达人TWIK-1 通道的CHO 细胞的静息膜电位维持在(-93.0±2.5)mV,去极化现象消失(图2A),且全细胞电流的反转电位维持在(-90.0±3.5)mV(图2B)。在表达人TWIK-1-T118i 突变体通道的CHO 细胞,当[K+]e从 5.4 mmol/L 降为 2.7 mmol/L 时,静息膜电位维持在(-94.0±3.5)mV,去极化现象消失(图2C)。
3 低[K+]e时,表达人TWIK-1 通道的HL-1 小鼠心肌细胞静息膜电位发生去极化
我们采用HL-1 小鼠心肌细胞系作为心肌细胞模型,观察2.7 mmol/L[K+]e对其膜电位及全细胞电流的影响。我们的实验结果显示,在对照组HL-1 细胞,当[K+]e从5.4 mmol/L降为2.7 mmol/L时,静息膜电位发生超极化,维持在(-88.0±2.0)mV(图3A),并且全细胞电流的反转电位维持在(-83.0±3.5)mV(图3B)。而在表达TWIK-1 通道的HL-1 细胞,当[K+]e从 5.4 mmol/L 降为 2.7 mmol/L 时,静息膜电位首先呈现超极化,随着细胞外低钾溶液灌流时间的延长,静息膜电位发生缓慢去极化,维持在(-43.0±3.0)mV,且全细胞电流的反转电位维持在(-41.0±2.5)mV(图3C、D)。此外,用表达人TWIK-1-T118i突变体通道的HL-1 细胞作为阴性对照,当[K+]e从5.4 mmol/L 降为 2.7 mmol/L 时,HL-1 细胞静息膜电位维持在(-88.0±3.0)mV,去极化现象消失,且全细胞电流的反转电位维持在(-84.0±3.5)mV(图4)。
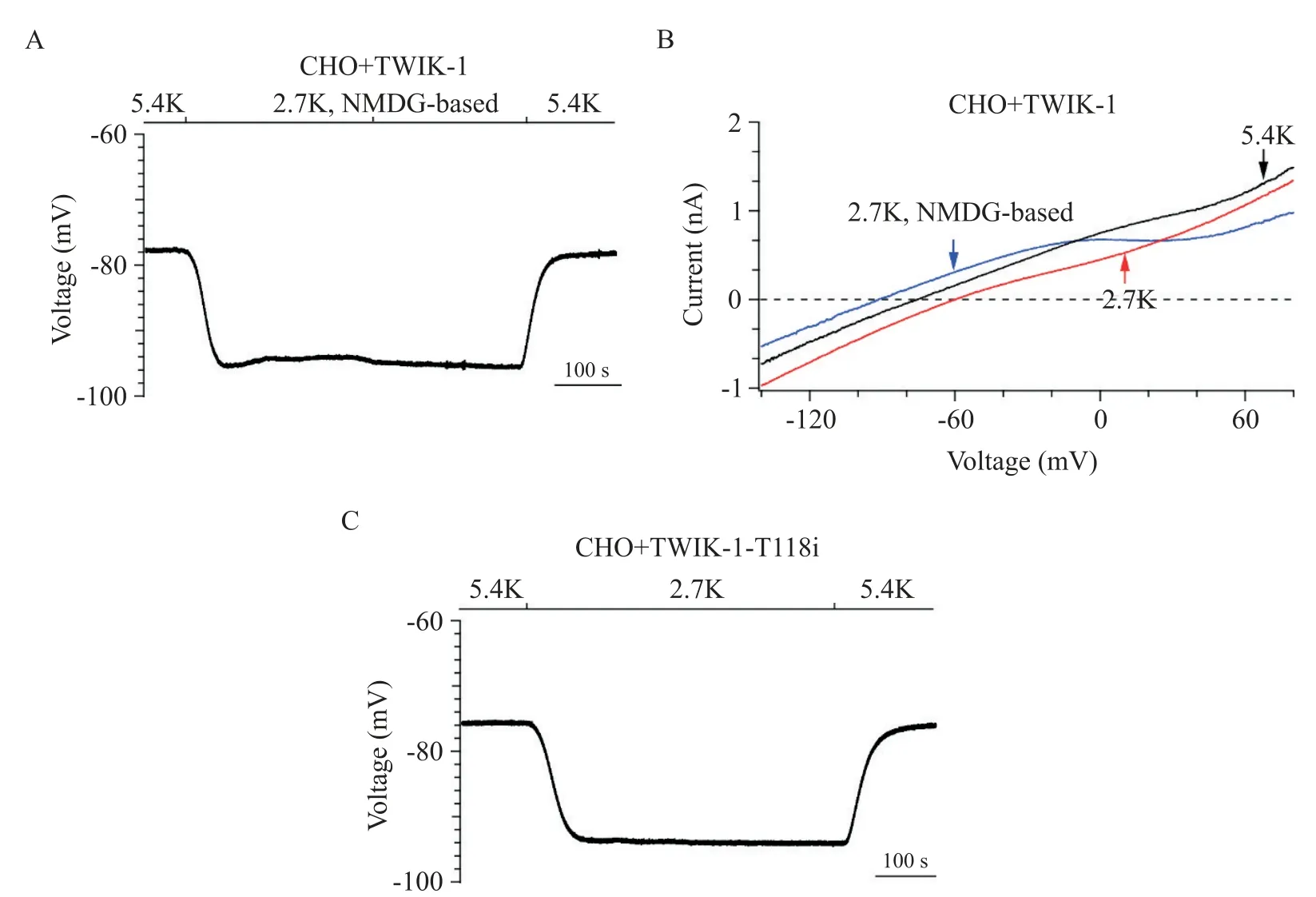
Figure 2. The inward Na+currents conducted by TWIK1 channel contributed to membrane potential depolarization of the CHO cells at 2.7 mmol/L[K+]e(2.7K). A:representative resting membrane potential of the CHO cells expressing human TWIK-1 channel was shown when N-methyl-D-glucamine(NMDG)-based bath solution was reversibly changed from 5.4 mmol/L[K+]e(5.4K)to 2.7K;B:representative whole-cell ramp currents in the CHO cells engineered to express human TWIK-1 channel before and after Na+-based bath solution was changed from 5.4K(black line)to 2.7K(red line)or changed to NMDG-based bath solution containing 2.7K(blue line);C:representative resting membrane potential of the CHO cells expressing human TWIK-1-T118i channel was shown when NMDG-based bath solution was reversibly changed from 5.4K to 2.7K. Mean±SD. n=7.图2 细胞外低钾条件下,TWIK-1通道介导的内向钠离子电流引起CHO细胞静息膜电位去极化
讨 论
TWIK-1 双孔钾通道在心肌细胞高度表达,但其调控心肌细胞电生理特性的病理生理意义尚不明确。Christensen 等[19]将斑马鱼心脏的TWIK-1基因敲除,发现心跳速率明显变缓,说明TWIK-1 通道参与了心肌细胞自律性的调控。我们的前期研究结果表明,在细胞外低钾条件下,TWIK-1 通道离子选择性发生改变并介导内向钠离子电流[17-18]。心肌细胞静息膜电位的维持依靠背景钾离子通道,TWIK-1 通道属于背景钾离子通道。我们推测,在低[K+]e条件下,TWIK-1 通道功能的改变可能会对心肌细胞静息膜电位产生影响。因此,我们首先在异源表达系统CHO细胞,观察了TWIK-1通道功能的改变对静息膜电位的影响。本研究结果表明,在低[K+]e条件下,转染TWIK-1 通道的CHO 细胞的静息膜电位呈现去极化。这一结果说明,在低[K+]e条件下TWIK-1通道功能的改变能够引起静息膜电位去极化。以往研究表明,小鼠心肌细胞的静息膜电位在低[K+]e条件下呈现超极化而不是去极化,并且小鼠心肌细胞不表达TWIK-1 通道[20-22]。因此,我们采用 HL-1 小鼠心肌细胞作为心肌细胞模型,观察TWIK-1通道功能的改变对心肌细胞静息膜电位的影响。本研究结果表明,在低[K+]e条件下,转染 TWIK-1 通道的 HL-1 小鼠心肌细胞静息膜电位发生去极化(约-40 mV)。这一结果与以往在成人心肌细胞观察到实验结果一致[4-6]。上述研究结果表明,在低[K+]e条件下,TWIK-1 通道功能的改变能够引起心肌细胞静息膜电位去极化。
心肌细胞静息膜电位异常去极化是低钾血症诱发心律失常的主要病理基础之一,但其发生机制尚未完全阐明。静息膜电位是由细胞膜离子通道介导的内向电流和外向电流的动态平衡决定的。细胞膜离子通道介导的外向电流减弱或内向电流增强均会引起静息膜电位发生去极化[23]。Sheu等[24]和Gadsby等[25]在羊和成人心肌细胞的研究表明,去除细胞外液的钠离子后,低钾诱发的心肌细胞静息膜电位去极化现象消失。上述研究说明钠离子内流是低钾导致心肌细胞静息膜电位异常去极化的关键因素。为了证明TWIK-1 通道介导的钠离子内流能够引起心肌细胞静息膜电位去极化,我们首先在转染TWIK-1通道的CHO 细胞证明了TWIK-1 通道介导的钠离子内流引起CHO 细胞静息膜电位去极化,因为当细胞外液的钠离子替换为NMDG 时,低钾诱发的静息膜电位去极化现象消失。其次,我们在HL-1 小鼠心肌细胞证明了TWIK-1 通道介导的钠离子内流能够引起心肌细胞静息膜电位去极化,因为转染TWIK-1-T118i 突变体通道的HL-1 小鼠心肌细胞的静息膜电位呈现超级化,而TWIK-1-T118i 突变体通道在低[K+]e条件下不介导内向钠离子电流[19-20]。
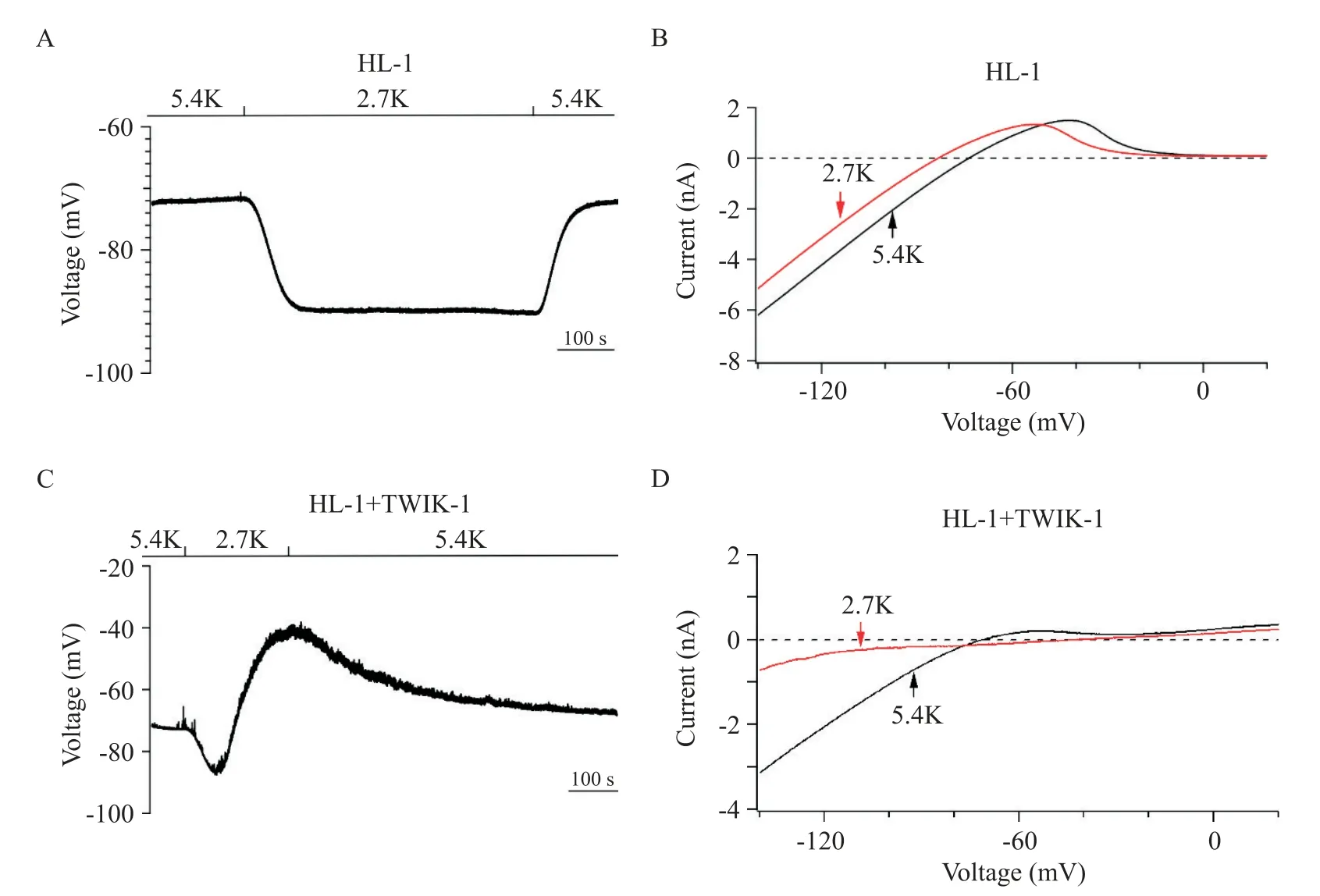
Figure 3. Membrane potential depolarization occurred in mouse HL-1 cardiomyocytes with ectopic expression of TWIK1 channel at 2.7 mmol/L[K+]e(2.7K). A:representative resting membrane potential of HL-1 cardiomyocytes was shown when Na+-based bath solution was reversibly changed from 5.4 mmol/L[K+]e(5.4K)to 2.7K;B:representative whole-cell ramp currents in HL-1 cardiomyocytes before and after Na+-based bath solution was changed from 5.4K(black line)to 2.7K(red line);C:representative resting membrane potential of HL-1 cardiomyocytes with ectopic expression of human TWIK-1 channel was shown when Na+-based bath solution was reversibly changed from 5.4K to 2.7K;D:representative wholecell ramp currents in HL-1 cardiomyocytes with ectopic expression of human TWIK-1 channel before and after Na+-based bath solution was changed from 5.4K(black line)to 2.7K(red line). Mean±SD. n=5.图3 表达人TWIK1通道的HL1小鼠心肌细胞在细胞外低钾条件下膜电位发生去极化
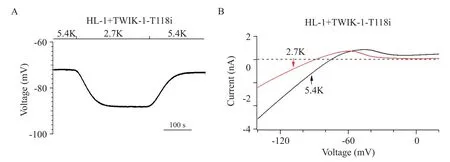
Figure 4. Mouse HL-1 cardiomyocytes with ectopic expression of TWIK1-T118i channel showed hyperpolarized membrane potential at 2.7 mmol/L[K+]e(2.7K). A:representative resting membrane potential of HL-1 cardiomyocytes with ectopic expression of human TWIK-1-T118i channel was shown when Na+-based bath solution was reversibly changed from 5.4 mmol/L[K+]e(5.4K)to 2.7K;B:representative whole-cell ramp currents in HL-1 cardiomyocytes with ectopic expression of human TWIK-1-T118i channel before and after Na+-based bath solution was changed from 5.4K(black line)to 2.7K(red line). Reversal potential of TWIK-1 channel currents at 2.7K was(-84.0±1.5)mV. Mean±SD. n=5.图4 表达人TWIK1-T118i通道的HL1小鼠心肌细胞在细胞外低钾条件下膜电位发生超极化
综上所述,本研究证明了在低[K+]e条件下TWIK-1 通道介导的内向钠离子电流能够引起小鼠心肌细胞静息膜电位去极化。鉴于TWIK-1 通道在人心肌细胞高度表达而在小鼠心肌细胞不表达,因此,在低[K+]e条件下,TWIK-1 通道功能的改变是否能够引起人心肌细胞静息膜电位异常去极化仍需通过基因敲除等方法在人心肌细胞进一步验证。

