穗花狐尾藻种植水对铜绿微囊藻的影响
高云霓,武 静,杨 惠,张 方,刘 畅,骆琨峰
(河南师范大学水产学院,河南 新乡 453007)
化感作用是沉水植物与藻类相互作用的重要方式,是影响浅水湖泊稳态转换和沉水植被恢复重建的重要机制之一[1-3]。相对于绿藻等真核藻类,沉水植物可以通过释放化感物质对铜绿微囊藻(Microcystisaeruginosa)等蓝藻产生较强的抑制作用[4]。穗花狐尾藻(Myriophyllumspicatum)被认为是化感抑藻活性最强的沉水植物[1,3-5]。相比硅藻和绿藻,穗花狐尾藻化感物质对蓝藻铜绿微囊藻生长的抑制作用最强[6]。围隔试验证实,水中蓝藻生物量被种植的穗花狐尾藻持续抑制[7]。穗花狐尾藻化感物质没食子酸持续暴露期间,蓝藻生物量被显著抑制,而绿藻、褐藻和隐藻没有受到明显影响[8]。
自然水体中,沉水植物和藻类此消彼长过程同时还会受到营养环境条件的影响[9-10]。从生态系统的层面,随着富营养化进程的加剧,许多浅水湖泊逐步由水生植物占优势的清水稳态转变为浮游藻类占优势的浊水态[10-12]。不同营养水平湖泊中穗花狐尾藻代谢物指纹图谱显著不同[12],铜绿微囊藻的生长和毒素合成水平也不同[13-14]。自然水体中沉水植物对藻类的化感作用过程不可避免也会受到营养环境条件的影响,但由于水体生物非生物环境的复杂性,相关研究还比较少。葛芳杰等[15-16]前期研究发现穗花狐尾藻体内酚酸类化感物质的合成会受到光照、氮磷营养水平的调节。不同光照和温度下铜绿微囊藻对化感物质的生长响应显著不同[17]。但不同营养环境条件下沉水植物对铜绿微囊藻的化感作用效应,目前还不清楚。
为进一步明确自然水体中沉水植物种植水对蓝藻化感作用的影响,选取室外条件下自然繁殖生长的穗花狐尾藻种植水,通过比较常见的蓝藻水华优势种铜绿微囊藻产毒株和非产毒株对营养加富和穗花狐尾藻原种植水的生长生理响应,初步分析营养环境和穗花狐尾藻释放到水中的化感物质对铜绿微囊藻的影响。
1 材料与方法
1.1 材料来源与培养
试验藻种铜绿微囊藻产毒株(FACHB 905)和非产毒株(FACHB 526)均购自中国科学院淡水藻种库。无菌BG11培养基培养,光照强度为2 000 lx,光暗周期为12 h∶12 h,温度为(25±1) ℃,每天手动定时摇瓶3次,每隔7 d重新接种1次,连续多代驯化培养,待反映藻细胞最大光合活性的叶绿素荧光参数Fv/Fm值稳定在0.40以上,即可用于正式试验。
穗花狐尾藻2018年采自湖北洪湖,栽种于河南师范大学水产学院基地种植桶中。种植桶中铺 10 cm 底泥,添加自来水自然条件下培养,2019年春季自然繁殖生长,选取长势良好,无其他植物干扰的种植桶,于8月连续晴天一周后采集穗花狐尾藻种植水用于正式试验。测得种植桶中穗花狐尾藻植物质量浓度约为1.0 g/L,其中底泥为水产基地晒干后的塘泥,测得总碳、总氮和总磷质量比分别为 16.40 g/kg、0.89 g/kg和0.80 g/kg。
1.2 试验设计
采集的穗花狐尾藻种植水抽滤过0.22 μm孔径的滤膜,去除颗粒杂质和微生物干扰后用于抑藻试验。试验设置2个穗花狐尾藻种植水处理组:第1组为营养加富组,受试藻暴露在添加了无菌BG11培养基的穗花狐尾藻种植水中,测得水中总碳、总氮和总磷质量浓度分别为(35.07±0.67) mg/L、(248.61±0.01) mg/L和(7.25±0.02) mg/L;第2组为原种植水组,直接在制备好的穗花狐尾藻种植水中添加受试藻细胞,测得水中总碳、总氮、总磷质量浓度分别为(32.81±0.67) mg/L、(1.61±0.01) mg/L 和(0.12±0.02) mg/L。同时,每株藻均设置未添加穗花狐尾藻种植水的对照组,在无菌BG11培养基中正常培养。每组均设置3个平行试验。
种植水制备和铜绿微囊藻接种均在无菌操作台上进行,所用器皿均提前做好灭菌处理。试验在250 mL锥形瓶中进行,瓶中加入100 mL种植水或BG 11培养基,接种指数生长期的铜绿微囊藻藻细胞,起始密度在3.0×105~4.0×105个/mL范围内,相当于680 nm处吸光度(OD680)值约0.03,摇匀,透气膜封口后,移至光照培养箱按上述条件持续培养 9 d,每天手动摇匀3次,避免藻细胞沉底和营养光照不均。
在接种后0 d、3 d、6 d、9 d分别取样测定各培养瓶中的铜绿微囊藻OD680值,计数藻细胞密度,测定铜绿微囊藻叶绿素荧光参数(Fv/Fm、ФPSⅡ)和膜脂过氧化产物丙二醛(MDA)的浓度。其中Fv/Fm指光合系统Ⅱ(PSⅡ)的最大光合效率,是PSⅡ光化学反应可能达到的最大产量的评估;ФPSⅡ是PSⅡ的实际光合效率,表示开放的反应中心捕获实际激发能的效率[18]。
1.3 指标测定方法
铜绿微囊藻OD680值用紫外-可见分光光度计(UV752,上海佑科)测定,藻细胞密度用浮游植物计数框在光学显微镜(E100, Nikon Eclipse)下计数。Fv/Fm和ФPSⅡ用掌上水体叶绿素荧光仪(AquaPen AP110-C,捷克)在室温下将样品置于黑暗中20 min后测定[19]。MDA浓度用南京建成生物试剂盒测定。种植水中营养盐总磷和总氮质量浓度分别采用中性和碱性过硫酸钾消解,紫外-可见分光光度计(UV752,上海佑科)测定,总碳质量浓度使用TOC有机碳含量分析仪(multi 3100)测定[20]。
1.4 数据处理
采用Microsoft Excel 2016软件分析数据和绘图,数据均以“平均值±标准差”的形式表示。穗花狐尾藻种植水对铜绿微囊藻产毒株和非产毒株OD680值、藻细胞密度、Fv/Fm和ФPSⅡ的抑制率按式(1)计算,对MDA浓度的促进率按式(2)计算。
(1)
(2)
式中:Y、Z分别为抑制率和促进率;AC、AT分别为某项指标在对照组和处理组中同一时间的数值。
采用SPSS 22.0软件对数据进行统计分析,组间差异显著性采用单因素方差分析,多重比较采用LSD检验,P<0.05表示有显著性差异。
2 结果与分析
2.1 铜绿微囊藻的生长响应
铜绿微囊藻OD680值和细胞密度测定结果均显示穗花狐尾藻种植水对两株藻的生长有显著抑制作用(P<0.05)。没有添加种植水的对照组中产毒株和非产毒株OD680值9 d时分别增大了15.7倍和14.7倍。添加穗花狐尾藻种植水的处理组铜绿微囊藻OD680值增幅显著低于对照组,其中营养加富种植水组产毒株和非产毒株OD680值9 d时分别增大12.3倍和13.6倍,原种植水组增幅最小,分别增大3.7倍和7.3倍(图1)。与对照组OD680值相比,9 d时营养加富种植水对产毒株和非产毒株生长的平均抑制率分别为21.3%和6.9%,原种植水则分别为77.5%和50.5%。
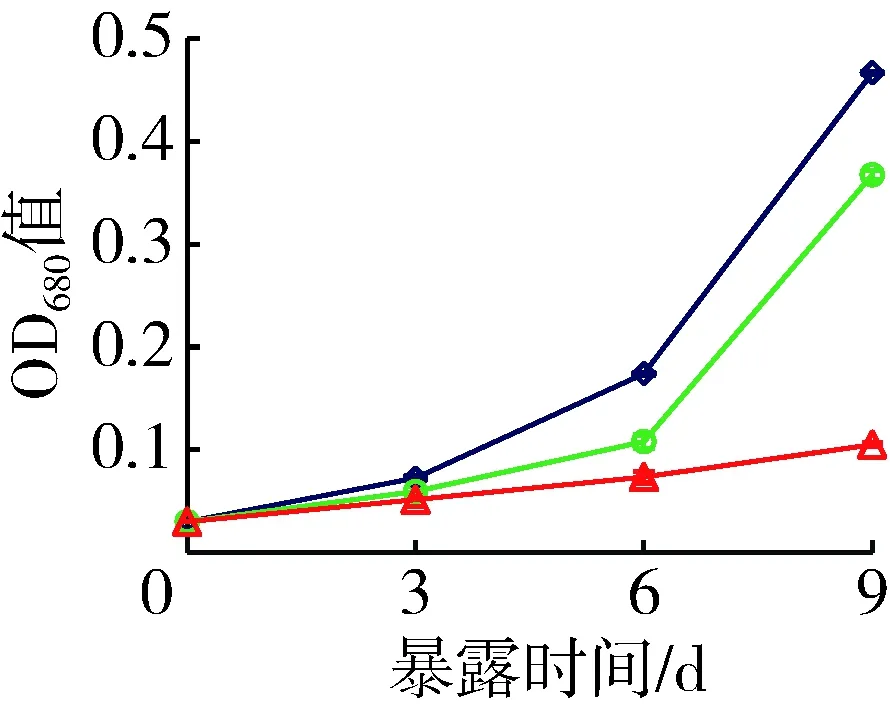
(a) 产毒株

(b) 非产毒株
对照组中铜绿微囊藻产毒株和非产毒株藻细胞密度9 d分别增加了21.0倍和18.9倍,而营养加富组藻细胞密度分别增大了18.1倍和16.1倍,原种植水组分别增大了10.5倍和11.9倍,添加了穗花狐尾藻种植水的处理组中藻细胞密度显著降低(P<0.05)(图2)。与对照组藻细胞密度相比,营养加富种植水对产毒株和非产毒株生长抑制率分别为23.5%和20.9%,原种植水分别为60.7%和49.3%。铜绿微囊藻OD680值和细胞计数的结果均显示,未添加BG11培养基的穗花狐尾藻原种植水对产毒株和非产毒株铜绿微囊藻生长的抑制作用显著增强(P<0.05)。
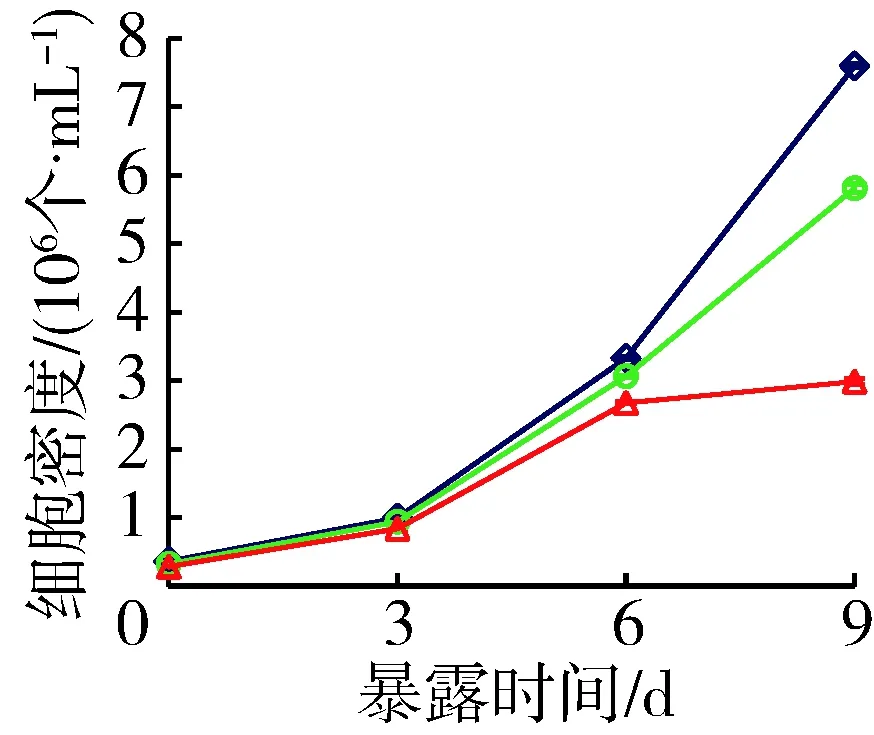
(a) 产毒株
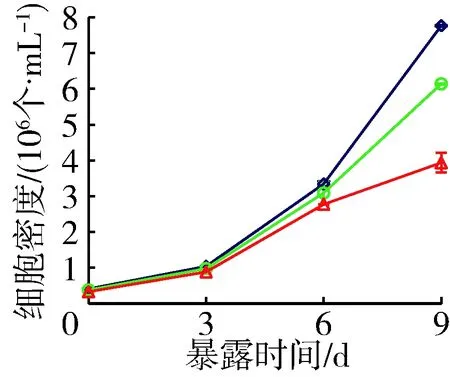
(b) 非产毒株
2.2 铜绿微囊藻叶绿素荧光参数变化
穗花狐尾藻种植水对铜绿微囊藻产毒株和非产毒株Fv/Fm和ФPSⅡ表现出一定程度的抑制。对照组中产毒株和非产毒株Fv/Fm值试验期间分别保持在0.57~0.61和0.56~0.59之间(图3)。与对照组相比,9 d时营养加富种植水对产毒株和非产毒株Fv/Fm值的平均抑制率分别为3.2%和3.8%,原种植水则分别为4.7%和8.7%。

(a) 产毒株

(b) 非产毒株
试验期间对照组铜绿微囊藻产毒株和非产毒株ФPSⅡ值分别保持在0.56~0.68和0.49~0.63之间,光合活性高(图4)。与对照组相比,穗花狐尾藻种植水对产毒株和非产毒株ФPSⅡ具有显著的抑制作用。9 d时营养加富种植水对产毒株和非产毒ФPSⅡ的平均抑制率分别为7.4%和17.6%,原种植水分别为15.4%和23.4%。叶绿素荧光参数结果显示,未添加BG11培养基的穗花狐尾藻原种植水对产毒株和非产毒株生长的抑制作用显著增强(P<0.05)。
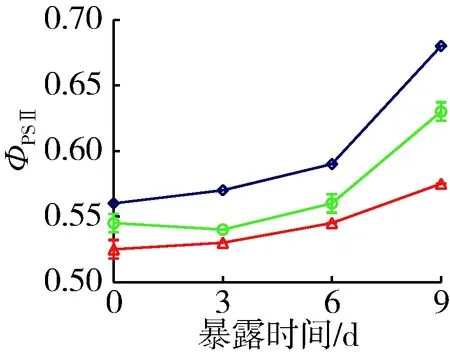
(a) 产毒株
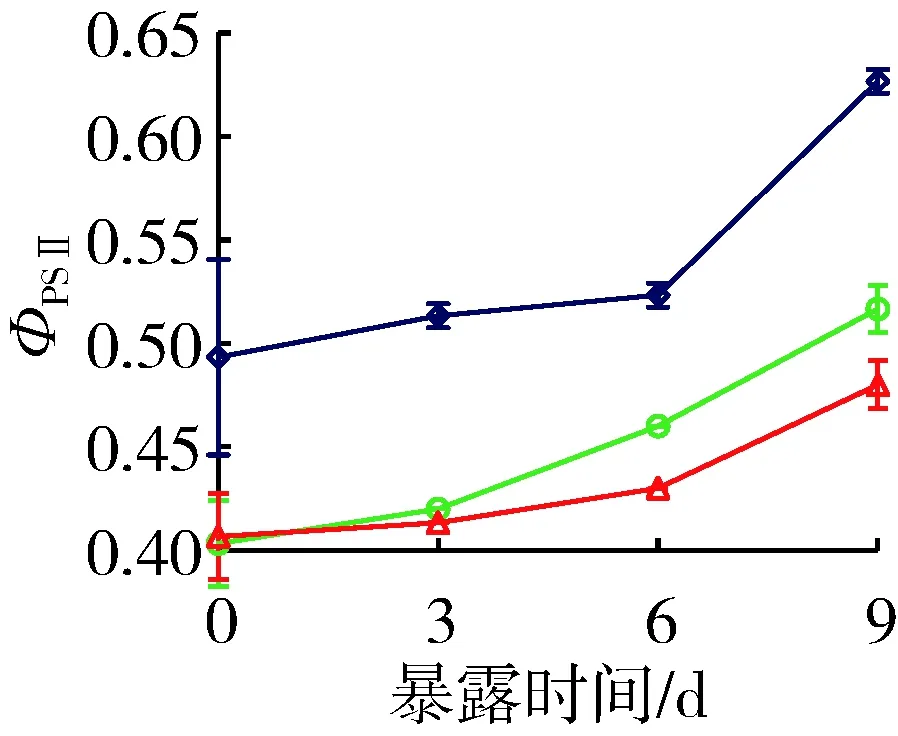
(b) 非产毒株
2.3 铜绿微囊藻MDA浓度变化
添加穗花狐尾藻种植水后,铜绿微囊藻产毒株和非产毒株MDA浓度显著增大(P<0.05,图5)。对照组中,产毒株MDA浓度由开始时的 0.59 nmol/L 上升到9 d时的1.38 nmol/L,非产毒株MDA浓度则由0.93 nmol/L上升至1.69 nmol/L。与对照组相比,营养加富组产毒株和非产毒株MDA浓度9 d时分别增大5.6%和9.1%,原种植水组分别增大11.1%和18.2%。
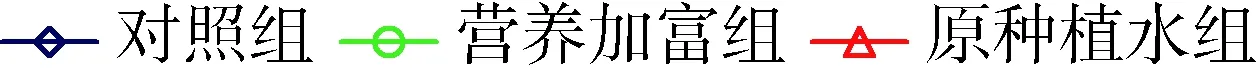
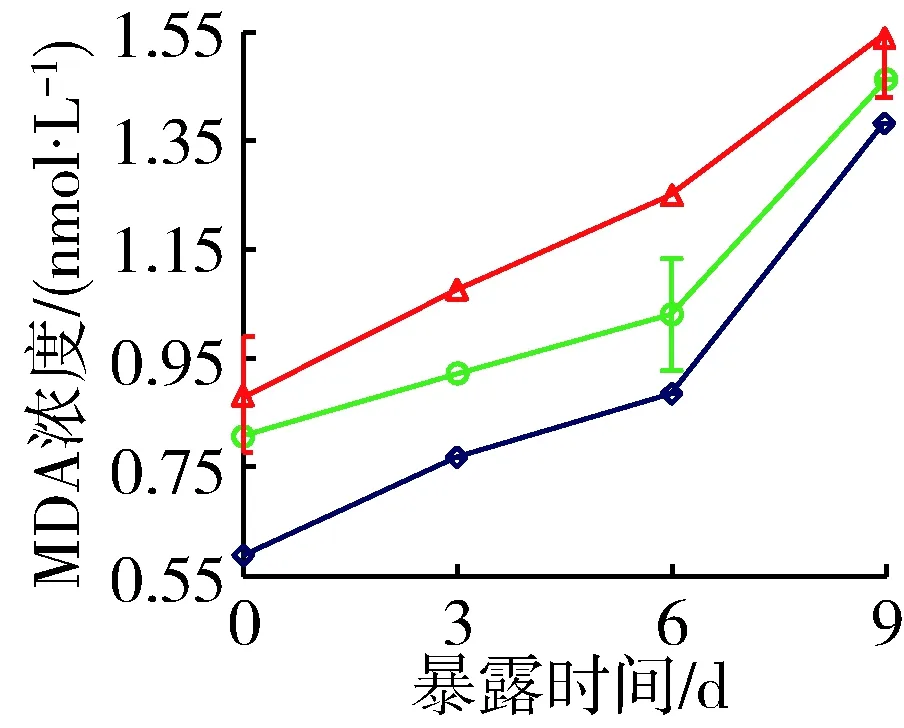
(a) 产毒株
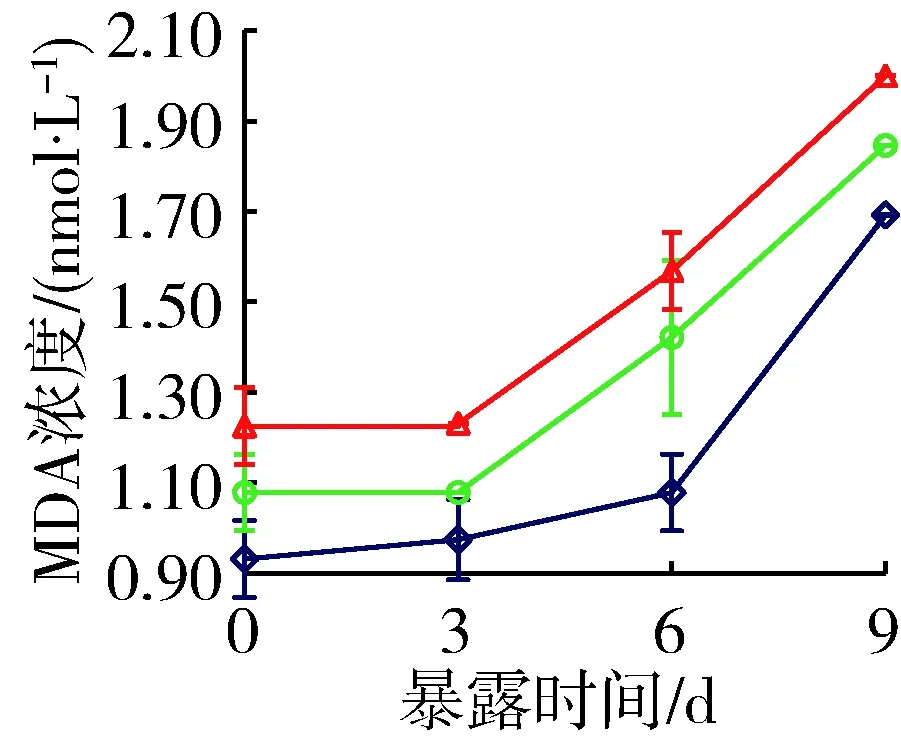
(b) 非产毒株
3 讨 论
排除营养限制、悬浮物和微生物干扰的营养加富穗花狐尾藻种植水对铜绿微囊藻产毒株和非产毒株的生长过程具有明显的抑制作用,抑制率大部分在20%左右,说明穗花狐尾藻可能释放化感活性物质抑制铜绿微囊藻生长。而穗花狐尾藻原种植水对铜绿微囊藻生长的抑制率在50%左右。原种植水中总氮质量浓度均值为1.61 mg/L,总磷为 0.12 mg/L,相当于湖泊Ⅳ类水标准。1992—2012年太湖总氮质量浓度年均值介于1.5~3.0 mg/L之间,总磷在0.05~0.15 mg/L之间,微囊藻占优势的蓝藻水华依然严重[21]。在暴发微囊藻水华的巢湖夏季总氮和总磷质量浓度分别为1.27~3.96 mg/L和0.044~0.200 mg/L[22]。营养加富种植水中总碳、总氮和总磷质量浓度分别为55.45 mg/L、248.67 mg/L 和7.24 mg/L,碳氮磷营养水平分别增大了1.7倍、153.5倍和59.3倍,显著高于常年暴发蓝藻水华的太湖和滇池[21,23];同时铁、锰等藻类生长所需的各种微量元素也得到了补充。铜绿微囊藻生态适应性很强,在较宽的营养范围内均可以生长,能耐受超富营养水平[24-25]。本试验中受试的铜绿微囊藻长期在室内BG11培养基中生长,尽管原种植水中的营养水平不低,但营养组成和浓度水平与BG11培养基有显著差别,临时改变微囊藻生长的营养环境,可能会影响铜绿微囊藻的生长生理活动。若微量元素如铁受限制,铜绿微囊藻产毒株的生长和毒素合成会受影响[26]。由此可见,穗花狐尾藻生长的低营养环境及其释放并遗留在水中的化感物质的共同作用,是穗花狐尾藻抑制铜绿微囊藻生长、影响其生理过程的原因,但具体的影响机制有待深入研究。
富营养水体中水华蓝藻通常是产毒株和非产毒株共存[27]。铜绿微囊藻产毒株能合成并释放微囊藻毒素到水环境中,对其他水生生物产生毒害作用,饮用水源地中若含有产毒微囊藻,其释放到水环境中的藻毒素则会威胁饮水安全和人类健康[28]。已有研究显示,铜绿微囊藻产毒株通常在温度升高或氮磷浓度水平增加的情况下比非产毒株生长繁殖更快[29-30]。产毒株在低CO2水平下具有优势,而非产毒株可以在低光照条件下生长,并在高CO2水平下占据竞争优势[31]。本文试验结果显示穗花狐尾藻种植水对产毒株和非产毒株的生长均有显著抑制作用,且产毒株比非产毒株更敏感。穗花狐尾藻化感物质焦酚对铜绿微囊藻产毒株的抑制效果也高于非产毒株[32]。这为利用沉水植物化感物质降低产毒微囊藻比例,优化微囊藻种群结构,从而降低微囊藻毒素合成和释放水平,减轻其生态危害,提供了一种思路。
相对于生长指标,穗花狐尾藻种植水对铜绿微囊藻光合作用效能和膜脂过氧化水平的影响在试验结束时较低,但在试验前3 d大部分指标已表现出与对照组的显著差异,进一步从生理响应层面证实穗花狐尾藻种植水对产毒株和非产毒株的抑制效应。但产毒株和非产毒株的生理响应规律并非完全一致,具体表现在穗花狐尾藻种植水对铜绿微囊藻产毒株叶绿素荧光参数的抑制效果较弱,明显低于对非产毒株的影响,而对产毒株的膜脂过氧化水平的诱导在试验前期显著高于非产毒株。这有可能与产毒株和非产毒株对穗花狐尾藻种植水的生理响应机制不同有关。铁限制条件下产毒株藻毒素合成增强,氮饥饿条件下,非产毒株的光合作用和碳氮代谢蛋白质更加丰富[33-34]。穗花狐尾藻释放的化感物质中,壬酸对铜绿微囊藻细胞膜有显著影响,而焦酚会改变酯酶活性,并显著降低藻细胞内叶绿素荧光强度[35]。穗花狐尾藻种植水中化感物质种类多样[5,36],不同营养水平下穗花狐尾藻种植水对铜绿微囊藻细胞的生理代谢过程的影响机理更加复杂,有必要在明确种植水中化感物质的基础上针对特定营养因子开展系统研究。
4 结 论
a.穗花狐尾藻种植水显著抑制铜绿微囊藻产毒株和非产株毒的生长(P<0.05),影响其生理过程,但低营养水平下的抑制作用更强(P<0.05)。
b.营养加富穗花狐尾藻种植水暴露9 d后,对铜绿微囊藻产毒株和非产毒株生长的抑制率分别为23.5%和20.9%,对ФPSⅡ的抑制率分别为7.4%和17.6%,MDA浓度分别增大5.6%和9.1%。
c.穗花狐尾藻原种植水对铜绿微囊藻产毒株和非产毒株生长的抑制率分别为60.7%和49.3%,对ФPSⅡ的抑制率分别为15.4%和23.4%,MDA浓度分别增大11.1%和18.2%。

