心脏外科手术后房颤差异表达基因筛选及功能分析
韦玮,顾建军,朱业,顾翔
扬州大学临床医学院附属苏北人民医院心内科,江苏扬州225000
心房颤动(简称房颤)是临床最常见的心律失常之一,也是心脏外科手术后最常见的心律失常类型[1]。不同心脏疾病患者术后房颤(POAF)发生率有所差异,其中冠状动脉旁路搭桥术(CABG)患者POAF发生率近30%,约40%和50%分别发生在单独瓣膜手术或瓣膜联合CABG的患者中[2-4]。POAF大多始发于心脏外科手术后3 d内,并且发生率在术后第2天达到高峰[5]。尽管POAF通常被认为是自限性的疾病,但它可导致中风率、病死率增加。目前认为老龄、冠状动脉弥漫性病变、左心房扩大、炎症及氧化应激均与POAF有关[6]。已有研究提供多种预防POAF的策略,包括使用β受体阻滞剂、抗心律失常药、秋水仙碱及后心包切除术等[7],然而临床上并不常规预防POAF。POAF临床风险预测模型、全基因组关联研究等又容易受到偏倚和无法衡量的混杂因素的影响。随着新型基因芯片测序技术的发展,使得从基因层面分析POAF发生的潜在分子机制成为可能。本研究筛选了心脏外科手术后POAF的差异表达基因,并进行功能分析。现报告如下。
1 资料与方法
1.1 数据来源 从美国国家生物技术信息中心(NCBI)的GEO数据库获取1个基因表达谱数据集GSE143924,样本来源于心外科手术患者心外膜脂肪组织(EAT)。根据术前特征对15例POAF患者(病例组)和15例术后窦性心律患者(对照组)进行匹配,测序芯片采用[HuGene-2_0-st] Affymetrix Human Gene2.0 ST Array[gene symbol version]。在GEO2R数据平台内,按自动设计的方案对数据做差异表达基因分析。
1.2 差异表达基因筛选 筛选利用GEO2R在线分析平台对实验组和对照组差异表达基因进行分析,以P<0.05且|logFC|>0.5筛选差异表达基因,logFC>0.5为表达上调、logFC<-0.5为表达下调。
1.3 差异表达基因功能分析 分析将筛选得到的差异表达基因导入R软件进行聚类分析,绘制火山图。利用DAVID6.8在线富集分析系统对差异表达基因进行基因本体功能(GO)富集分析,分析目的基因在细胞组分、分子功能、生物过程三个层面上的主要相关因素;进行京都基因与基因百科全书(KEGG)信号通路分析,分析差异基因功能及其在细胞中的信号通路。通过STRING在线数据库进行差异表达基因的蛋白质相互作用分析,构建蛋白与蛋白相互作用(PPI)网络,用Cytoscape3.7.1软件中的cytoHubba插件选取Degree前10位的基因为POAF的关键基因。筛选条件为P<0.05。
2 结果
2.1 差异表达基因筛选结果 共筛选出病例组和对照组的差异表达基因共254个,其中病例组较对照组表达上调82个(HLA-DQA1、TRAJ14、TRAJ21、TRAJ31、TRAJ27、CD24、FCER2、TRAJ48等),表达下调172个(SYT4、UPK3B、HP、ANXA8、CDH19、PLA2G2A、ZBTB16、MT1JP等)。火山图见OSID码。
2.2 差异表达基因GO、KEGG富集分析结果 GO分析结果显示,254个差异表达基因主要参与质膜、膜的组成部分等,参与生物学过程主要有细胞黏附、免疫反应、炎症反应等,涉及分子功能主要包含丝氨酸型内肽酶活性、蛋白质酪氨酸激酶活性等。KEGG富集分析结果显示,差异表达基因主要参与补体和凝血级联反应、金黄色葡萄球菌感染等信号通路。分别选取富集表达数最高的5条进行注释,见表1、表2。
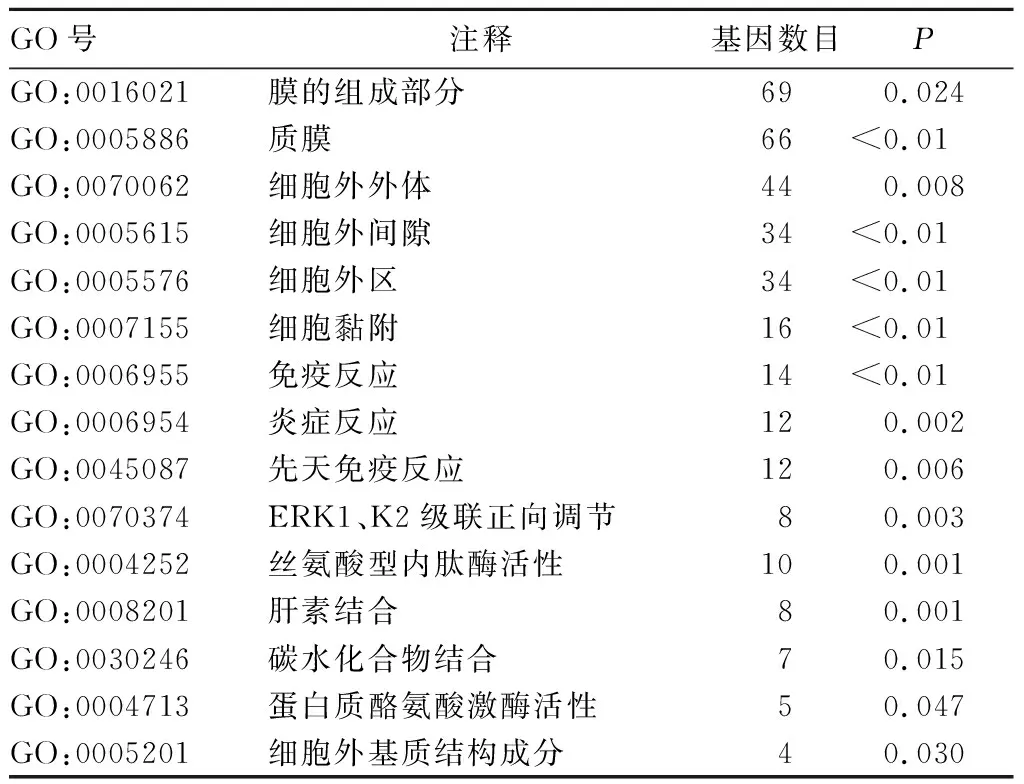
表1 差异表达基因GO分析结果

表2 差异表达基因KEGG富集分析结果
2.3 心脏外科手术后POAF关键基因筛选结果 通过STRING在线数据库建立差异表达基因PPI网络,筛选得到10个关键基因分别为TLR2(degree=12)、CDH2(degree=11)、VTN(degree=10)、CCL2(degree=10)、KDR(degree=9)、C1QA(degree=9)、BMP2(degree=8)、ZAP70(degree=8)、HP(degree=8)、CFB(degree=8)。
3 讨论
POAF是心脏外科手术后常见并发症,了解其发病原因和早期变化,对于避免房颤的持续和复发、开展有针对性的预防措施具有重要意义。本研究通过GEO数据库,检索到POAF的基因芯片数据集GSE143924,利用GEO2R对数据进行差异表达基因分析,得到254个差异表达基因,这提示POAF是多基因相互作用的结果。将这些差异表达基因进行GO和KEGG富集分析,结果显示,涉及的信号通路主要与自身免疫及感染性免疫应答有关,参与的生物学过程主要是免疫反应、炎症反应。
利用STRING在线数据库分析建立的PPI网络得到十个关键基因,即TLR2、CDH2、VTN、CCL2、KDR、C1QA、BMP2、ZAP70、HP、CFB。TLR2编码的蛋白质是TLR家族的成员,存在于免疫细胞中,该家族在病原体识别和先天免疫激活中起着重要作用。ICHIKI等[8]发现,非瓣膜性房颤组患者TLR2表达水平明显升高,提示感染性炎症可能参与非瓣膜性房颤的发病。GURSES等[9]研究显示,与对照组相比,房颤患者的左心房和外周血中TLR2表达水平更高。活化的TLR2可能通过Mal/MyD88依赖性机制募集下游IRAK4/1,并引起NF-κB的活化和促炎细胞因子的产生,多因素共同作用,最终导致房颤[10]。CDH2基因编码经典的钙黏蛋白和钙黏蛋白超家族成员。N-钙黏蛋白(N-CDH2)在发育和成熟心肌中高度表达,主要位于闰盘横向区域的筋膜黏附层和相邻心肌细胞之间紧密侧向接触的区域。N-CDH2在心脏间隙连接的形成和功能维持中起着重要作用。N-CDH2的缺失会改变连接蛋白的表达并导致心脏闰盘间隙连接缺失,产生致心律失常的底物[11]。VTN编码pexin家族成员,是一种在组织和循环中发现的蛋白,它调节细胞黏附、迁移,控制止血和细胞外周蛋白水解的蛋白水解级联反应[12]。在损伤的心脏中,CCL2诱导可能涉及TLR信号、神经体液级联或促炎细胞因子介导的通路的激活[13],其介导的心肌纤维化主要归因于单核细胞和巨噬细胞的募集和活化,致使纤维化介质的合成增加[14]。KDR也称VEGFR2,编码的是一种Ⅲ型受体酪氨酸激酶。在WANG等[15]研究中,AF患者的血浆sVEGFR-2水平降低,表明这些患者淋巴管生成抑制作用可能减弱。C1QA编码血清补体亚组分C1q的α链多肽,该链与C1r和C1s结合以产生血清补体系统的第一成分。SHAH等[16]制作C1q-/-小鼠模型研究显示,C1q缺乏会加重肺血管炎症并增强肺内皮对损伤的易感性。BMP2编码转化生长因子β蛋白超家族的分泌配体。小鼠模型实验显示,BMP2单倍体功能不足在心律失常的发生中起重要作用[17]。ZAP70编码属于蛋白质酪氨酸激酶家族的酶,其活性主要受酪氨酸磷酸化的正、负向调节[18]。HP编码前原蛋白,该前原蛋白经加工可产生触珠蛋白。触珠蛋白是一种急性期蛋白,具有强大的抗炎和抗氧化活性,其血浆水平与许多炎症性疾病及心血管疾病呈负相关[19]。CFB编码补体因子B,其相关途径包括先天性免疫系统、补体和凝血级联反应。补体激活有三种独立但交互的途径,即经典途径、凝集素途径和替代途径,补体因子B是替代途径的重要组成部分[20]。CFB是TLRs的下游效应子,在小鼠心肌细胞和巨噬细胞中,LPS可诱导TLR4激活,进而使CFB表达上调[21]。
本研究结果提示,在POAF的发生发展中主要有炎症反应及免疫反应参与,这与已有研究报道一致。炎症被认为在术后新发房颤的发病中起关键作用[22]。研究表明,在进行心脏外科手术的患者中,CD4+CD28-T细胞亚群触发的炎症反应可促进心肌组织中微瘢痕的形成,影响心脏的电传导,导致POAF[23]。另外,有证据显示,补体系统激活和促炎细胞因子相互作用与POAF的发作有关,这提示了细胞免疫对心脏传导系统的潜在影响,特别是其功能紊乱可引起心房纤维化[24-25]。
本研究数据集中样本取自POMI-AF队列的心脏外科手术患者的EAT。EAT是一种特异性内脏脂肪,主要分布在房室沟和室间沟周围或沿冠状动脉分布,也有少量存在于心房心耳上[26]。有学者认为,EAT通过产生多种具有促炎和抗炎特性的生物活性物质,在心肌组织发挥旁分泌作用[27]。此外,在心肌深层还发现了EAT浸润,这可能通过改变去极化波的传播及心房心肌重塑而触发心律不齐[28]。并且在POAF组中EAT分泌的凝溶胶蛋白基因表达显著降低[26]。因此,了解EAT的作用也许能对术后房颤的发生机制提供新的参考。
总之,本研究结果一定程度上揭示了POAF的发生发展涉及的生物学因素、途径,这也为今后预测高危患者及指导该病的预防和治疗提供了新的理论依据。但是,本研究结果未进行实验验证,也未挖掘miRNA在POAF发生发展中的作用,这些将是我们下一步研究的方向。

