乙型脑炎病毒微滴式数字PCR 检测方法的建立
薛晓宁 徐翮飞 张 娟 侯 伟 张 瑾(通信作者)
青岛国际旅行卫生保健中心(山东,青岛,266071)
乙型脑炎病毒属于黄病毒属黄病毒科,病毒主要在蚊与蚊中传播, 还可在猪和水鸟等动物中传播,经感染的蚊虫叮咬可传播到人[1]。大部分感染者没有症状或者出现轻微症状,少数感染者发展为脑炎,出现包括突发头疼、高热、定向障碍、昏迷等症状。四分之一的重症患者死亡,30%存活的重症患者存在永久性中枢神经系统损伤[2]。
因为感染者血液中达不到足够高的病毒,通过PCR 方法检测血液中病毒核酸相对困难。 目前主要是通过检测血浆或者脑脊液中的特异性抗体对乙型脑炎进行实验室诊断[3]。 数字聚合酶链式反应(digital polymerase chain reaction,dPCR) 是第三代PCR 技术,是一种核酸分子绝对定量技术。 其中应用最广泛的是微滴式数字PCR(ddPCR),把核酸分子稀释到一定浓度,生成一定数目的微滴,然后进行PCR 扩增,读取阳性微滴数目,计算出样品的原始浓度[4],在低浓度的核酸含量下也可灵敏和准确地进行绝对定量。
本研究建立了乙型脑炎病毒核酸ddPCR 检测方法,并与实时荧光定量PCR(qPCR)相比较,初步判断ddPCR 在检测乙型脑炎病毒中的应用前景。
1 材料与方法
1.1 样本来源
乙型脑炎病毒核酸来自乙型脑炎病毒灭活疫苗。 用于特异性检测的常见虫媒病毒核酸(登革病毒,寨卡病毒,基孔肯亚病毒,黄热病毒)均为本实验室保存。 所有样本均通过商品化试剂盒检测。
1.2 仪器和试剂
bio-rad T100 普通RCR;QX200TM Droplet DigitalTM PCR 系统包括微滴生成仪和微滴读取仪(Biorad 公司);Quantistudio 5 荧光定量PCR(ABI公司)。 One-Step RT-ddPCR Advanced Kit for Probes (1864021,Biorad 公司);One Step Prime-ScriptTMRT-PCR Kit(Perfect Real Time)(Takara);乙型脑炎病毒核酸检测试剂盒购自上海之江生物有限公司。委托上海生工生物有限公司以pUC57 为克隆载体合成包括扩增片段在内500 bp 长度的基因序列,最终获得pUC57- JEV 作为标准质粒。
1.3 引物和探针设计及优化
从NCBI 网站获得乙型脑炎病毒NS3 基因,用Primer Express 3.0 设计特异扩增乙型脑炎病毒的引物和探针。 序列如下: JEV-F 5’AGAGCACCAAGGGAATGAAATAGT3’,JEV-R 5’AATAGGTTGTAGTTGGGCACTCTG3’,Probe-JEV 5’-FAM-CCACGCCA-CTCGACCCATAGACTG-TAMRA-3’。 引物和探针均由Invitrogen 生物有限公司合成。 采用设计好的引物和探针建立qPCR 和ddRT-PCR 方法, 包括扩增循环条件的优化及引物、探针浓度的优化。
1.4 qPCR 反应体系和反应条件
反应体系为20 μL,其中包括One Step RT-PCR Buffer III 10 μL, 引物和探针 (各10umol) 0.4 μL,TaKaRa Ex Taq HS 0.4 μL,PrimeScript RT enzyme Mix Ⅱ0.4 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,RNA 2 μL,RNase Free dH2O 5.6 μL。反应条件:42 ℃5 min, 95 ℃10 s,95 ℃5 s,60 ℃34 s (收集荧光信号)共40 个循环。
1.5 ddPCR 反应体系和条件
根据优化结果, 确定ddPCR 反应体系为:Supermix 5 μL,Reverse transcriptase 2 μL,300 mmol/L DTT 1 μL,10 μMol/L 引物1.4 μL(终浓度700 nmol/L),10 μMol/L 探针0.5 μL(终浓度250 nmol/L),RNA模板1 μL, RNase-free Water 7.7 μL,共20 μL。 将配制好的20 μL PCR 反应液, 转移至微滴发生卡样本孔中,再加入70 μL 微滴发生油至油孔中,利用微滴生成器制备反应微滴。 将每个样品的微滴分别转移至96 孔PCR 反应板中对应的反应孔中,在普通PCR仪上进行扩增。 反应条件设置为:42 ℃60 min;95 ℃10 min;95 ℃30 s,56.9 ℃1 min,共40 个循环;98 ℃10 min;4 ℃∞。ddPCR 反应结束后用微滴分析仪对微滴进行分析,Quantasoft 1.7.4 软件完成对数据的自动处理。
1.6 特异性验证
用该方法对实验室乙型脑炎病毒进行ddPCR特异性检验,实验室保存的多种虫媒病毒核酸,包括:登革病毒(DFV),寨卡病毒(ZIKV),基孔肯亚病毒(CHIKV),乙型脑炎病毒(JEV),黄热病毒(YFV),按照上述优化条件进行检测,验证ddPCR 反应的特异性,同时设阴性对照(NTC)和阳性对照(阳性质粒)。
2 结果
2.1 ddPCR 反应条件的确定
ddPCR 方法的准确性与PCR 扩增体系中的引物、 探针浓度和反应温度密切相关。 为获得最佳ddPCR 效果,对引物、探针浓度和反应温度进行了优化。以pUC57- JEV 标准质粒为模板,200~900 nmol/L 设置引物浓度,50~300 nmol/L 设置探针浓度,选择55~65 ℃设置梯度温度,分别进行ddPCR。 根据阳性荧光扩增值与本底间差异,以及阳性液滴产生的数量进行选择,最佳引物浓度为700 nmol/L,最佳探针浓度为250 nmol/L 。 最佳退火温度为56.9 ℃时,阳性微滴与阴性微滴区分得最开,且之间空白处微滴数目最少(图1)。

图1 不同退火温度ddPCR 扩增乙型脑炎病毒核酸一维散点图(A)和不同引物浓度ddPCR 扩增乙型脑炎病毒核酸一维散点图(B)
2.2 灵敏度分析
紫外分光光度法测定pUC57- JEV 标准质粒浓度,稀释,终浓度为1×106,然后进行10 倍梯度稀释,qPCR 检测到1×102的pUC57-JEV 标准质粒,ddPCR 检测到1×101的标准质粒, 检出限为16.1 copies/μL(图2)。

图2 梯度稀释扩增pUC57-JEV 标准质粒 A. qPCR; B. ddPCR
2.3 重复性实验
按已优化的ddPCR 检测条件进行重复性实验,以pUC57-JEV 为模板,使用新建立的体系进行3 个浓度3 次重复测定。 结果显示,相同浓度模板的反应之间阳性微滴数接近, 变异系数分别为3.45%、3.65%、4.17%(表1), 说明建立的ddPCR 检测体系重复性好。
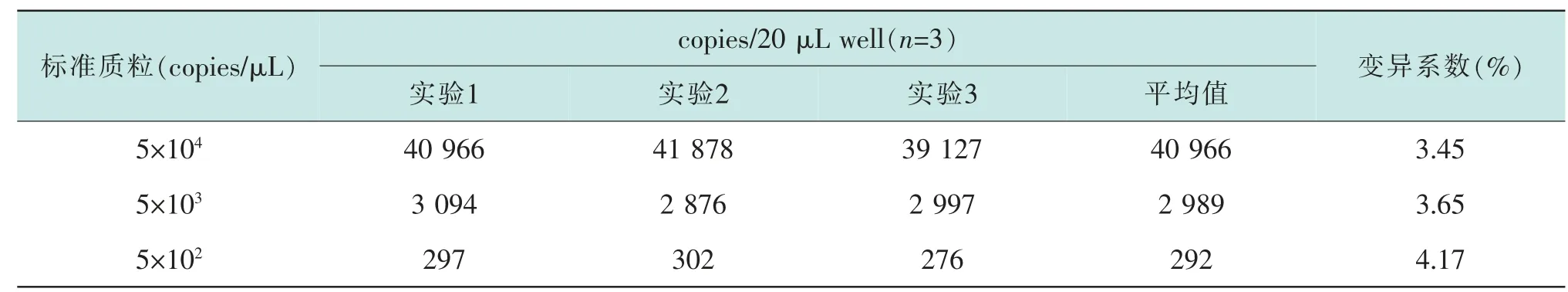
表1 不同浓度标准质粒重复性检测结果
2.4 特异性实验
将JEV、YFV、DFV、CHIKV、ZIKV 的RNA 进行ddPCR 方法特异性检测, 结果表明: 除了pUC57-JEV 质粒标准品和JEV RNA 有特异性扩增外,其他4 种病毒和阴性对照扩增结果均为阴性 (图3),表明建立的ddPCR 扩增体系特异性高。

图3 ddPCR 检测乙型脑炎核酸特异性验证
3 讨论
乙型脑炎又叫日本脑炎,是一种严重的蚊媒传播的人兽共患病,可引起猪流产或早产,感染人群可导致严重的脑炎,致死性高,可造成巨大经济损失和公共卫生负担。青岛是山东省东部沿海城市,乙脑发病率一直低于全国同期发病水平,2007-2012年曾连续6 年无报告病例[5]。 但2013 年出现乙脑疫情暴发,2013-2018 年间青岛乙脑报告病例44 例,年平均发病率为0.08/10 万。 病例多为45 岁以上人群,病死率高达13.64%,后遗症发生率为38. 64%[6]。乙脑目前没有特效的治疗药物,早发现、早诊断、早治疗是改善预后的关键因素。
临床目前主要是通过检测血浆或者脑脊液中的特异性抗体对乙型脑炎进行实验室诊断。 但因为黄病毒属病毒间存在较强的交叉免疫, 抗体检测敏感性和特异性存在局限性[7]。目前基于病原体核酸扩增的巢氏PCR、实时荧光PCR、LAMP 等技术已经用于乙型脑炎病毒的检测,但乙型脑炎病毒感染后患者血液中病毒载量通常比较低,病毒血症持续时间也很短,这些方法检测血液中病毒核酸相对困难[8]。ddPCR 是继普通PCR 和qPCR 之后的第三代PCR技术,在反应过程中,反应混合液被分割成10 000~20 000 个油滴, 目标核酸被随机分配到独立微滴种,每个油滴对应1 个反应单元,可以检测样本中极低含量核酸分子,研究表明ddPCR 的灵敏度可以达到1 copy/μL。 本研究针对乙型脑炎病毒NS3 基因序列设计特异引物和Taqman 探针, 建立了乙型脑炎病毒核酸qPCR 和ddPCR 检测方法,并对这两种方法的检测灵敏度进行了比较和分析。 ddPCR 检测方法的敏感度能够达到16.1 copies/μL,检测灵敏度明显优于荧光PCR(100 copies/μL),在机体低病毒含量的情况下用于病原体检测具有明显优势。 该方法与其它主要蚊媒传播病原体, 如黄热病毒、寨卡病毒、登革病毒以及基孔肯亚病毒不发生交叉反应,特异性强,能有效应用于临床样本中乙型脑炎病毒的检测。
本研究建立的乙型脑炎病毒ddPCR 为临床诊断乙型脑炎提供了有力的技术储备,同时也为病毒定量检测提供了一种新方法。

