垃圾焚烧过程中氧化物对Cd和Zn迁移分布的影响
吴 安,唐 彪,徐浩然,吴亭亭
(华东理工大学 资源与环境工程学院,上海 200237)
随着城市经济的快速发展,城市生活垃圾产生量逐年增加。焚烧可使垃圾质量减少70%~80%,体积减少80%~90%,是目前城市生活垃圾较好的处理方式之一[1]。但垃圾中的重金属元素焚烧后仍分布在飞灰和底渣中,底渣中有害重金属的浸出毒性超过了许多国家的相应标准,飞灰则被认为是危险废物[2],如处理不当,不但会影响农业生产,还会对人类健康和生态环境造成影响[3]。
Cd和Zn是两种典型的存在于生活垃圾中的重金属元素。Cd在土壤中有很强的化学活性,容易被农作物吸收,进入人体生成镉硫蛋白,通过血液循环在人体器官中积累,最终引起慢性疾病[4]。而大量的Zn进入人体会导致人体对肿瘤的防御能力下降,甚至促进肿瘤生长[5]。因此,研究重金属Cd和Zn在垃圾焚烧过程中的迁移特性具有重要意义。
国内外许多学者研究了硫化物、氯化物和水分等因素对各类重金属迁移分布的影响。例如,SHAN等[6]通过实验证明,单质硫和硫化物会和Cd反应形成相对稳定的CdS,从而减少重金属Cd的挥发;MENG等[7]通过实验室管式炉模拟研究了城市生活垃圾中的水分对重金属Pb、Zn、Cu和Cd迁移分布的影响。我国的城市生活垃圾中含有灰土等成分,其主要组成为Mg、Al及Si的氧化物,因此,研究这些氧化物对Cd和Zn迁移特性的影响十分必要。
本工作以实际生活垃圾作为研究对象,由于其Cd和Zn含量较低,为了便于表征采用额外添加重金属溶液的方式来减小实验误差。重点研究了垃圾焚烧过程中Al2O3、SiO2和MgO在不同温度及不同添加量下对Cd和Zn迁移分布的影响,并利用HSC Chemistry热力学软件进一步模拟反应过程中Cd和Zn的形态分布,以期为垃圾焚烧的无害化处理提供理论基础。
1 实验部分
1.1 实验原料
实验原料来自上海老港垃圾焚烧厂,由布料、塑料、木屑、纸类和厨余垃圾组成。实验前,将各单一垃圾样品置于50 ℃烘箱中24 h以去除外水(即在空气干燥基下进行实验研究),用粉碎机粉碎至80目粒径,最后参照上海市生活垃圾的组成,按一定比例混合均匀后作为实验原料。单样和混样的元素分析、工业分析和配比见表1。其中,C、H、N元素通过元素分析仪(VARIO ELIII型,德国ELEMENTAR公司)测得,S元素通过高温燃烧中和法[8]测得,Cl元素通过离子色谱仪(ICS-1100型,美国赛默飞公司)测得。
研究中选择的氧化物添加剂为Al2O3、SiO2和MgO(上海西陇生化科技有限公司)。有研究表明,氧化物具有一定的孔隙结构,故对重金属具有一定的物理吸附作用,且在焚烧过程中氧化物可与重金属发生反应,从而对部分重金属起到化学吸附作用并将其固定在底渣中[9]。表2给出了3种氧化物的比表面积、孔体积和孔径[10]。可以看出,SiO2的比表面积远大于MgO和Al2O3的比表面积,因此SiO2的物理吸附效果最好,而Al2O3的物理吸附效果较差。但在高温下,不仅需要考虑氧化物的物理吸附能力,还要考虑其化学吸附能力,通常物理吸附和化学吸附是同时进行的。
1.2 实验装置
本实验的反应器采用管式炉,实验装置如图1所示,主要由供气装置、燃烧装置、飞灰收集装置和尾气吸收装置组成。供气装置包括压缩机、储气罐、流量控制器和玻璃转子流量计;燃烧装置由管式炉、石英管、刚玉舟和温控仪组成;飞灰收集装置使用玻璃纤维滤筒;尾气吸收装置使用酸、氧化物、碱和硅胶联合吸收(吸收剂含量均为质量分数)。

图1 实验装置
1.3 实验方法
在每次实验中,将3份(2.0000±0.0010) g的样品分别放入3个刚玉舟中,添加一定质量分数(2.5%,5.0%,7.5%,10.0%)的氧化物。混合均匀后,分别加入(CH3COO)2Cd·2H2O和Zn(CH3COO)2·2H2O的混合溶液5 mL。由于实际生活垃圾中重金属Zn的浓度通常要高于Cd,因此将重金属溶液中Cd和Zn的浓度分别配制为400.00 mg/L及3000.00 mg/L,样品中原有Cd和Zn的含量分别为2.16 mg/kg和410.37 mg/kg。实验温度设置为600,700,800,900 ℃。实验开始前,将气流控制在6.0 L/min,开启温控仪开始加热。在达到实验温度后,迅速将3个刚玉舟推入管式炉中心位置,反应15 min后取出刚玉舟。置于干燥皿中冷却后,残留在刚玉舟中的物质作为底渣,吸附在滤筒上的物质作为飞灰,以吸收瓶中重金属Cd和Zn的含量表征其在烟气中的分布。
采用美国EPA 3050B酸消解法[11]对底渣和飞灰进行消解,消解后用电感耦合等离子体发射光谱仪(ICP-AES,ICP-8000型,北京达丰瑞仪器)测定重金属浓度。在对烟气收集瓶中的重金属进行检测时,发现其浓度低于ICP-AES的检测下限,故认为Cd和Zn只分布于底渣和飞灰当中。因此,采用质量占比,即焚烧后底渣中重金属的质量与焚烧前垃圾中重金属质量的比值,对实验结果进行评价分析。
1.4 热力学平衡模型
HSC Chemistry热力学模拟软件基于吉布斯最小自由能法计算体系的热力学平衡。该算法可将反应体系划分为独立和非独立组分,并且不考虑反应体系中的相互影响。在恒温、恒压条件下,体系中总吉布斯自由能最小原理决定了平衡时的物质组成[12]。吉布斯最小自由能法将反应系统当作一个孤立系统,并且忽略体系内部的影响因素,在温度、压力不变的条件下,当反应体系中总吉布斯自由能为零时达到平衡。
热力学计算前根据表1的元素分析数据和添加的重金属浓度设定每种元素的摩尔数,其中3种氧化物按垃圾质量的5%设定摩尔数。燃烧所需的空气只输入N2和O2的量,过量空气系数设为1.5。设定焚烧温度为100~1000 ℃,压力为1个大气压,根据软件自带数据库中重金属化合物的形态,经过平衡计算可以得到100~1000 ℃的温度范围内Cd和Zn的主要存在形式及各形式的Cd和Zn所占的摩尔分数。
2 结果与讨论
2.1 氧化物对Cd迁移分布的影响
2.1.1 实验结果分析
图2显示了不同温度下3种氧化物添加量(w)对底渣中Cd质量占比的影响。从图2可以看出,无论添加哪种氧化物,随着氧化物添加量的增加,底渣中Cd的质量占比均有所增加,这表明氧化物能降低Cd的挥发,使Cd固定于底渣中。而在氧化物加入量相同的情况下,随着温度的升高,底渣中Cd的质量占比降低,这是因为温度的升高使得Cd的各类化合物具有更高的挥发性,使得更多的Cd迁移到飞灰中。Cd在氧气充足的环境下会生成CdO,并与垃圾中存在的少量Cl生成CdCl2[13]。重金属氯化物的熔沸点一般比较低,故在反应过程中易向飞灰迁移,而氧化物的加入可降低重金属氯化物的生成[14]。Al2O3和SiO2可与CdO反应生成稳定的铝酸盐和硅酸盐,如式(1)和式(2)所示[15]。MgO虽不能直接与重金属Cd发生反应,但它属于碱性氧化物,与HCl(垃圾中存在少量Cl,在高温焚烧条件下会与垃圾中的H结合生成HCl)反应的能力比重金属更强[16],从而减少重金属氯化物的生成,抑制了Cd的挥发,并使Cd残留在底渣中,反应机理如式(3)所示[17]。
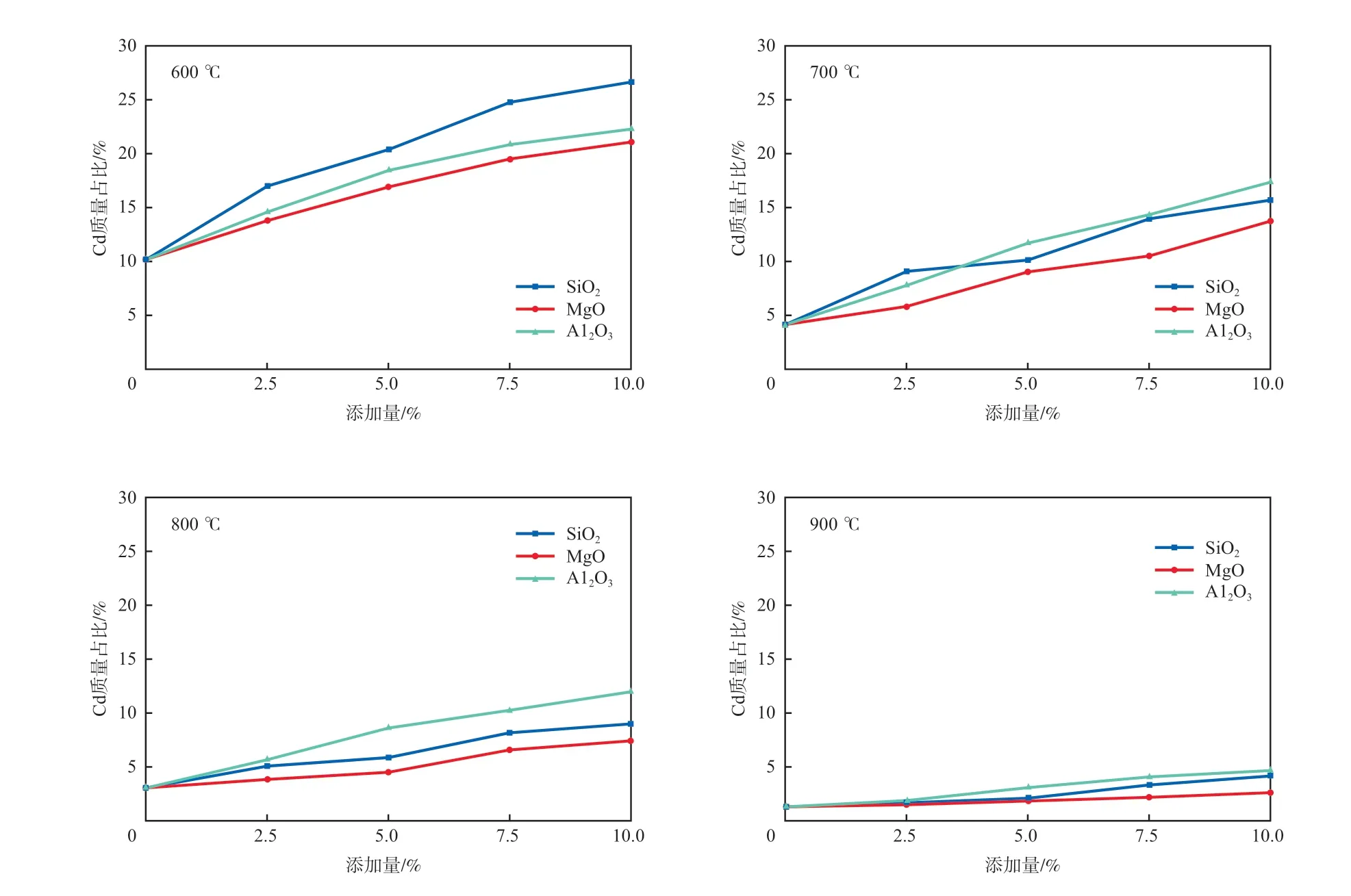
图2 不同温度下3种氧化物添加量对底渣中Cd质量占比的影响
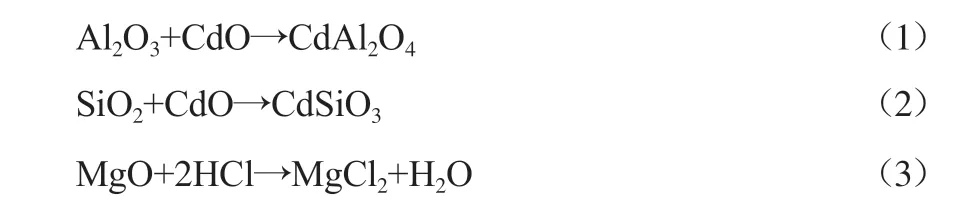
在600 ℃的条件下,氧化物对Cd的吸附效果为:SiO2>Al2O3>MgO。比表面积最大的SiO2物理吸附效果最好,作为化学吸附的初始过程,物理吸附效果会直接影响到化学吸附效果[18]。虽然Al2O3比表面积小于MgO,但Al2O3可直接与Cd反应产生化学吸附作用;而MgO与Cl结合在反应体系中减少了CdCl2的生成,从而间接起到化学吸附作用,因此Al2O3相较于MgO对Cd的吸附效果更好。在700 ℃的条件下,SiO2对Cd的吸附效果与Al2O3相似;进一步提升反应温度,Al2O3对Cd的吸附效果大于SiO2。这是因为碱金属离子在高温下会破坏[SiO4]中的桥氧键,从而破坏SiO2的空间结构并降低其吸附能力,故随着反应温度的升高SiO2对重金属的吸附能力不及Al2O3[19]。
2.1.2 热力学模型分析
图3a显示了Mg和Cl对Cd热力学平衡分布的影响。因为MgO不能直接与Cd反应,所以需要模拟MgO和Cl的共同作用对Cd分布的影响。模拟结果表明,在各温度下体系中大约有80%的重金属Cd以CdO的形式存在,可以推测碱性氧化物MgO相较于重金属具有更强的与HCl反应的能力,从而减少重金属氯化物的生成,降低了重金属Cd的挥发。并且,在100~500 ℃的温度范围内,底渣中只有20%左右的Cd以CdCl2的形式存在。随着反应温度的升高,CdCl2开始挥发至飞灰中。当温度进一步升高到800℃左右时,体系中开始产生少量的CdCl。
图3b显示了SiO2对Cd热力学平衡分布的影响。由模拟结果可以推测,在100 ℃时,体系中Cd与SiO2发生反应,并以CdSiO3的形式存在于体系中。随着反应温度的升高,体系中CdSiO3的含量开始下降,而CdO的含量开始增加。这是因为高温破坏了[SiO4]中的桥氧键,导致SiO2的空间结构被破坏,从而降低了SiO2对重金属的吸附能力。
图3c显示了Al2O3对Cd热力学平衡分布的影响。模拟结果表明,随着反应温度的升高,体系中CdAl2O4的含量逐渐增加,而CdO的含量逐渐减少。并且,在高温下CdAl2O4含量不会下降,所以Al2O3在高温下对重金属的吸附能力优于SiO2。
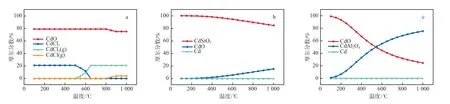
图3 3种氧化物对Cd热力学平衡分布的影响
2.2 氧化物对Zn迁移分布的影响
2.2.1 实验结果分析
图4显示了不同温度下3种氧化物添加量对底渣中Zn质量占比的影响。从图4可以看出,无论添加哪一种氧化物,底渣中Zn的质量占比均随着氧化物添加量的增加而增加,这表明氧化物可以减少重金属Zn的挥发,从而使Zn固定于底渣中。Zn相较于Cd不同的地方在于,当添加相同质量的同种氧化物时,随着温度的升高,底渣中Zn的质量占比变化不明显。这是因为相较于Cd,Zn是一种不易挥发的重金属,故温度对Zn迁移分布的影响小于Cd。
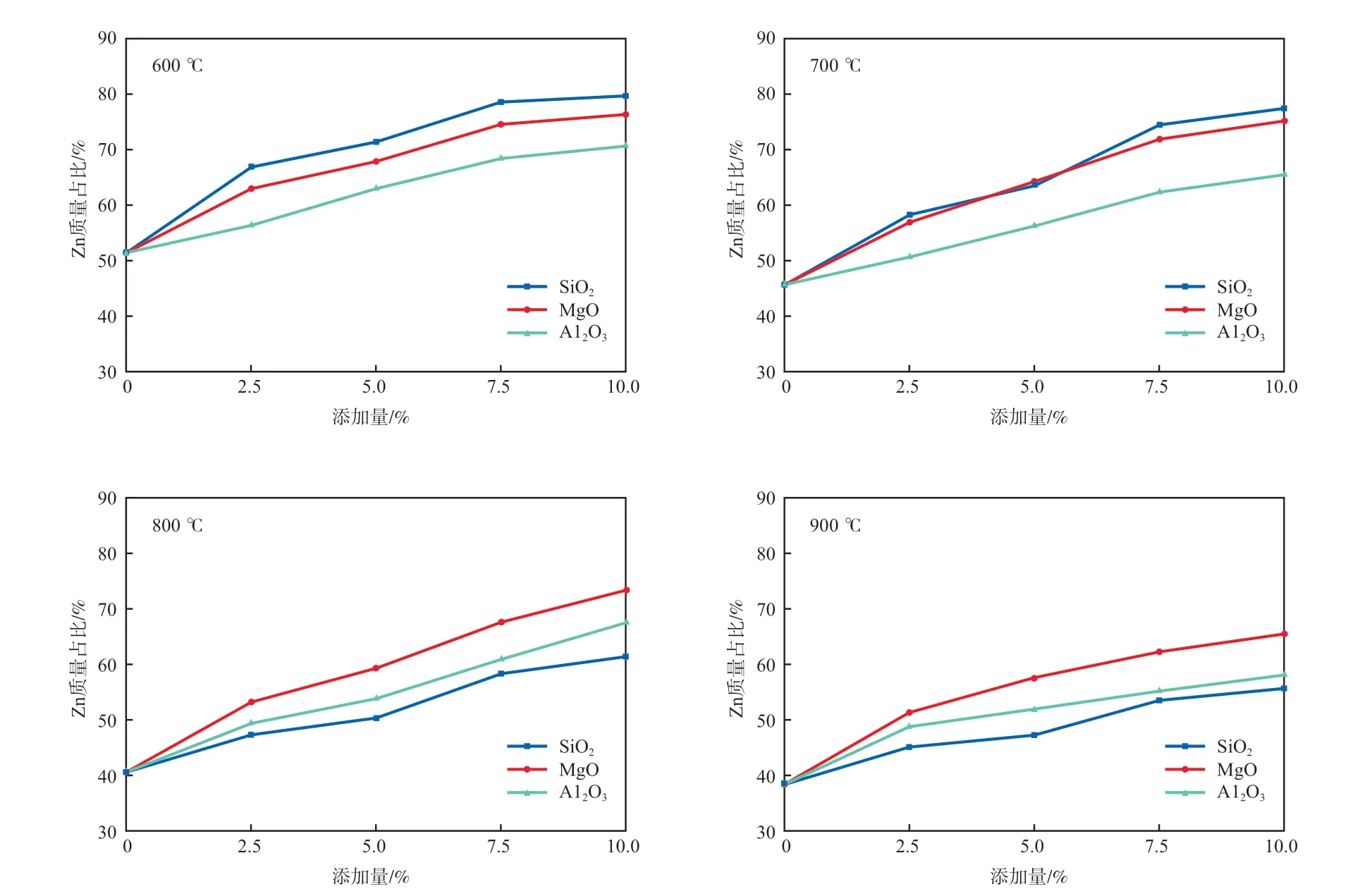
图4 不同温度下3种氧化物添加量对底渣中Zn质量占比的影响
如上所述,在垃圾焚烧过程中存在Cl,Zn会与Cl反应生成熔沸点较低的ZnCl2。添加氧化物可以减少ZnCl2的生成,从而减少重金属Zn的挥发。Al2O3和SiO2可与ZnO反应生成铝酸盐和硅酸盐,这些物质均不易挥发,如式(4)~(6)所示[20]。MgO虽不能与Zn直接发生反应,但MgO是一种碱性氧化物,相较于重金属,MgO与HCl反应的能力更强,从而减少了重金属氯化物的生成,抑制了Zn的挥发,让更多的Zn残留于底渣中[21]。
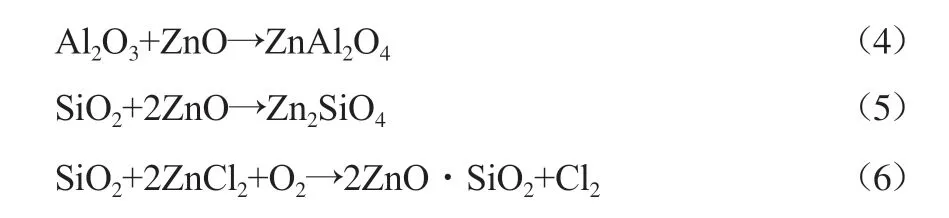
在600 ℃的条件下,氧化物对Zn的吸附效果为:SiO2>MgO>Al2O3。与重金属Cd不同的地方在于,MgO对Zn的吸附能力强于Al2O3。虽然间接吸附效果比直接吸附效果弱,但当MgO作为间接吸附降低了Cl的含量时:对于Cd而言,虽然加入MgO降低了CdCl2的生成,但Cd仍会通过自身的气态形式挥发;至于Zn,它是一种不易挥发的重金属,降低Cl的含量就等于阻止了Zn挥发的唯一方式。因此,MgO对Zn的吸附作用十分显著。在700 ℃的条件下,SiO2和MgO对Zn的吸附效果相似;伴随着进一步的升温,SiO2对Zn的吸附效果变为最差。这是因为碱金属离子在高温环境下会破坏[SiO4]中的桥氧键,导致SiO2空间结构的损坏,降低了SiO2的吸附能力。因此,随着反应温度的升高,SiO2对Zn的吸附能力变为最弱。
2.2.2 热力学模型分析
图5a显示了Mg和Cl对Zn热力学平衡分布的影响。因为MgO不能直接与Zn反应,所以需要模拟MgO和Cl的共同作用对Zn分布的影响。模拟结果表明,虽然体系中存在Cl,但在各温度下大约有90%的重金属Zn以ZnO的形式存在,从而可以抑制Zn的挥发。并且,可以推测,当温度低于400 ℃时,约有10%的Zn会以ZnCl2的形式残留于底渣中。伴随着温度的升高,底渣中的ZnCl2会逐渐挥发至飞灰中。
图5b显示了SiO2对Zn热力学平衡分布的影响。由模拟结果可以推测,在100 ℃时,体系中的Zn与SiO2发生反应,并以Zn2SiO4的形式存在于体系中。随着反应温度的升高,体系中Zn2SiO4的含量开始下降,而ZnO和ZnSiO3的含量开始上升。可以推测,Zn2SiO4在高温下不稳定,易分解为ZnO和ZnSiO3。
图5c显示了Al2O3对Zn热力学平衡分布的影响。由模拟结果可以推测,在100 ℃时,体系中的Zn与Al2O3发生反应,并以ZnAl2O4的形式存在于体系中。随着反应温度的升高,体系中只有少量ZnAl2O4发生分解,ZnO含量略有增加,可以推测ZnAl2O4在高温下会分解生成ZnO。

图5 3种氧化物对Zn热力学平衡分布的影响
2.3 氧化物对Cd和Zn迁移分布的影响比较
氧化物对重金属Cd和Zn迁移分布的影响可归纳为3个方面:一是由于氧化物本身孔隙结构引起的物理吸附作用,但这种效应会受到反应温度的影响,如比表面积最大的SiO2在高温条件下的吸附效果不是最好的;二是氧化物与体系中的Cl发生反应,减少了重金属氯化物的生成,从而间接起到了化学吸附作用;三是氧化物可与重金属发生反应,氧化物具有一定的孔隙结构,重金属很容易扩散至氧化物内部,并占据其中的活性点位,在氧化物表面成键形成化学吸附,氧化物和产物的晶格发生共晶熔化后把重金属包裹并固定于其内,从而形成稳定的晶体[22]。
通过比较图2和图4可以发现,在相同反应温度和相同氧化物添加量的条件下,底渣中Zn质量占比的增量高于Cd。例如在600 ℃且2.5%添加量的条件下,无论添加什么氧化物,Cd在底渣中的质量占比总是不到20%,而Zn的质量占比超过50%。这一方面是因为Cd本身属于挥发性金属,另一方面是由于重金属Cd和Zn通过氧化物的孔隙结构进入到其内部形成化学吸附,并在氧化物层间的活性点位上形成化学键,而吸附能力受离子半径、原子量和电负性等因素的综合影响[23]。结合上述两个方面,氧化物抑制Zn挥发的效果要优于Cd。
3 结论
a)在各温度条件下,重金属Cd和Zn在底渣中的质量占比均随着3种氧化物添加量的增加而增大,由于不同氧化物对Cd和Zn的作用机理存在差异,因此在各温度下不同氧化物对Cd和Zn的吸附效果有所不同。
b)在相同反应温度和相同氧化物添加量的条件下,3种氧化物抑制Zn挥发的效果要优于Cd。
c)根据热力学模拟结果可知:Al2O3和SiO2会与重金属Cd和Zn反应生成各种不易挥发的金属化合物,抑制了Cd和Zn的挥发;而MgO可与体系中的Cl结合,减少重金属氯化物的产生量,从而抑制了Cd和Zn的挥发。模拟结果进一步对实验结果进行了验证。

