子宫内膜癌组织中miR-128-2基因启动子DNA甲基化水平与miR-128-2、DJ-1表达及临床病理因素相关性的研究
朱其舟,舒宽勇,陈和平,肖仲清*
子宫内膜癌是我国常见的女性生殖系统恶性肿瘤之一,严重危害女性健康。众多研究表明抑癌基因异常失活或原癌基因高度激活及其相关调控因子表达失调与子宫内膜癌发生发展存在着密切关系。深入探讨子宫内膜癌发生发展相关的特异性蛋白分子及其分子调控机制,对其治疗及预后具有重要意义。
DJ-1(RS/PARK7/CAP1)蛋白是1997年首次报道[1]的一种丝裂原依赖性癌基因产物。近年来随着研究深入,发现DJ-1在不少肿瘤的发展、侵袭和转移中可能起重要作用[2]。我们前期研究发现,DJ-1蛋白在子宫内膜癌细胞中过表达,并可促进细胞增殖和抑制细胞凋亡,从而利于子宫内膜癌发生发展[3-4]。然而,在子宫内膜癌细胞中DJ-1蛋白表达上调的调控机制尚未阐明。研究表明DNA甲基化介导的miRNAs沉默是导致其所调控的肿瘤相关靶基因表达上调的重要机制之一[5]。我们前期通过生物信息学软件预测和文献调研发现miR-128-2可能是DJ-1表达的重要调控因子。此外,研究发现miR-128-2基因启动子区存在DNA甲基化修饰,并且作为肿瘤抑制因子参与调控多种肿瘤细胞增殖[5-6]。以上强烈提示子宫内膜癌细胞中DJ-1表达上调很可能与DNA甲基化调控的miR-128-2表达缺失密切相关。
为此,本研究拟分别对新鲜子宫内膜癌组织和正常子宫内膜组织中miR-128-2 DNA甲基化水平以及miR-128-2表达水平和DJ-1表达水平进行检测,并分析miR-128-2基因启动子区DNA甲基化水平与miR-128-2表达、DJ-1表达以及临床病理因素之间的相关性,拟从组织学水平寻找miR-128-2基因启动子区DNA甲基化参与子宫内膜癌细胞中DJ-1表达的表观遗传调控证据。
1 材料与方法
1.1 实验材料
1.1.1 组织标本 本研究所采用的63例子宫内膜癌组织及其相配对的癌旁子宫内膜组织(距肿瘤边缘>1.5 cm)标本均取自江西省妇幼保健院(2019年9月至2020年10月),同时收集患者病理资料。患者术前未接受过相关治疗(包括手术、放化疗或内分泌治疗等)。病理学诊断依据为世界卫生组织(WHO)发布的子宫内膜肿瘤组织学类型修订方案,临床分期依照国际妇产科联盟(FIGO)诊断标准,由两位病理医师根据诊断标准进行证实,确诊子宫内膜癌及分期。本研究取得了江西省妇幼保健院伦理委员会批准,所有研究对象均签署知情同意文书。
1.1.2 主要试剂 TRIzol总RNA提取试剂盒购自北京全式金公司;FastKing RT Kit(With gDNase)、SuperRealPreMix Plus(SYBR Green)、miRcute Plus miRNA First-Strand cDNA Kit、miRcute Plus miRNA qPCR Kit(SYBR Green)购自TIANGEN公司;EasyPure Genomic DNA kit购自北京全式金公司;EZ DNA Methylation-Gold Kit购自美国Zymo research公司;Power SYBR Green PCR Master Mix购自德国Qiagen公司;总蛋白提取PIRA裂解液、BCA蛋白浓度测定试剂盒购自北京普利来公司;DJ-1一抗购自美国abcam公司;GAPDH多克隆抗体购自美国Santa Cruz公司;兔抗山羊IgG/辣根酶标记、山羊抗兔IgG/辣根酶标记购自北京中杉金桥公司。
1.2 实验方法
1.2.1 荧光实时定量 甲基化特异性PCR(qMSP)法检测子宫内膜癌组织中miR-128-2基因启动子DNA甲基化水平
1.2.1.1 组织DNA提取及转化 组织DNA提取参照北京全式金公司EasyPure Genomic DNA kit说明书进行操作。提取DNA后进行亚硫酸氢盐修饰,参照EZ DNA Methylation-Gold Kit试剂盒(ZYMO)说明书进行。
1.2.1.2 定量甲基化特异性PCR检测 ① miR-128-2的DNA甲基化引物(M)和非甲基化引物(U)来自参考文献[7-8],具体序列详见下页表1。引物由广州锐博生物公司合成。 ② 以修饰后DNA模板配制qMSP反应体系:Power SYBR Green PCR Master Mix10 μL、引物(50 nM)1 μL、修饰后DNA模板1μL、RNase-free ddH2O 8 μL,将其放入实时定量PCR仪中进行反应,反应条件为:95℃ 15 min,然后以94℃ 30 s,50℃ 45 s,72℃ 1 min进行40个循环。扩增结束后,加一步熔解曲线来检测引物特异性,95℃ 15 s,60℃ 45 s,95℃ 15 s。每个试验重复3次。qMSP结果分析:根据公式计算miR-128-2的DNA甲基化水平:miR-128-2的DNA甲基化程度(%)=[1/(1+2-ΔCt)]×100%,ΔCt=CtU-CtM(U:非甲基化,M:甲基化)。

表1 qMSP所用引物
1.2.2 Real time quantitative-PCR(qRT-PCR)法检测子宫内膜癌组织中miR-128-2和DJ-1 mRNA表达水平
1.2.2.1 组织中总RNA提取 组织按照北京全式金公司的TRIzol试剂盒操作说明书提取总RNA,琼脂糖凝胶电泳检测已提取RNA的完整性,Bio-Rad微量核酸蛋白测定仪检测总RNA浓度和纯度,以RNA浓度最低者对所有样本进行标准化处理。
1.2.2.2 miRNA逆转录和实时定量PCR反应 ① miRNA逆转录反应参照TIANGEN公司miRcute Plus miRNA First-Strand cDNA Synthesis Kit说明书进行操作。选择完整性良好的RNA,将其反转录成 cDNA。② miRNA逆转录后的定量PCR反应(qPCR)参照TIANGEN公司miR-cute Plus miRNA qPCR Detection Kit说明书进行操作,以U6为内参照,miR-128-2及U6引物来自参考文献[9-10],由广州锐博生物公司合成,具体引物序列详见表2。③ 按照试剂盒说明书制作反应体系:2×miRcute Plus miRNA、PreMix(SYBR&ROX)10.0 μL、Forward Primer(10 μM)1.0 μL、Reverse Primer(10 μM)1.0 μL、cDNA模板 2.0 μL、RNase-Free ddH2O 补至20 μL,并置于荧光定量PCR仪中反应,进行qPCR结果分析,以U6作为内参,计算miR-128-2相对表达水平,计算公式:miR-128-2相对表达水平=2-ΔΔCt,ΔCt=CtmiR-128-2-CtU6,ΔΔCt=ΔCt实验组-ΔCt对照组。
1.2.2.3 mRNA逆转录和实时定量PCR反应 ① mRNA逆转录反应参照TIANGEN公司FastKing RT Kit(With gDNase) 说明书进行操作。DJ-1和内参照GAPDH引物来自参考文献[11],由广州锐博生物公司合成,具体引物序列详见表2,参照TIANGEN公司SuperRealPreMix Plus(SYBR Green) kit建议体系,组织均以GAPDH为内参进行PCR扩增。反应体系为2×SuperReal PreMix Plus10 μL、正向引物(10 μM)0.8 μL、反向引物(10 μM)0.8 μL、cDNA模板2 μL、50×ROX Reference Dye 0.4 μL、RNase-free ddH2O 6 μL。反应程序预变性:95℃ 15 min;PCR反应:40个循环,95℃ 10 s,60℃ 30 s;熔解曲线:95℃ 15 s,60℃ 45 s,95℃ 15 s。② qPCR结果分析:以GAPDH作为内参,计算DJ-1 mRNA相对表达水平,计算公式:DJ-1 mRNA相对表达水平=2-ΔΔCt,ΔCt=CtDJ-1-CtGAPDH,ΔΔCt=ΔCt实验组-ΔCt对照组。

表2 qPCR所用引物
1.2.3 Western Blot测定组织中DJ-1蛋白表达水平 ① 取出冻存组织50 mg,液氮下研磨成粉状,按照蛋白质提取试剂盒说明加入细胞裂解液,按照北京普利来公司蛋白提取试剂盒说明提取组织总蛋白,提取时中加入Aprotinin及Leupeptin蛋白酶抑制剂;用BCA法测蛋白浓度;按配胶试剂盒说明配置12%分离胶和5%积层胶;相同蛋白总量的样本经上样缓冲液(十二烷基硫酸钠SDS、巯基乙醇、二硫苏糖醇DTT及溴酚蓝等) 95℃变性 5 min 后加样恒压电泳,积层胶85v,分离胶120v,以裂解液加上样缓冲液作为空白对照;待预染蛋白Marker提示靶蛋白区分离后停止电泳;切胶,留取靶蛋白区,把聚丙烯酰胺凝胶上已分离的蛋白印迹转至PVDF膜,转膜“三明治”夹稳流(90mA)湿转90 min;丽春红染色;将PVDF素膜置于TTBS中,缓摇10 min,然后膜于封闭液中37℃摇床缓慢平摇3 h,将封闭好的PVDF膜放入杂交袋中,加入封闭液稀释的一抗(DJ-1抗体以1∶1 000稀释,GAPDH抗体以1∶3 000稀释),4℃孵育过夜或室温平摇3 h,TTBS洗膜20 min×3次;加入封闭液稀释的HRP标记二抗(稀释比例均为1∶3 000),共同孵育60 min,孵育结束,TTBS洗膜20 min×3次;采用ECL化学发光法曝光,通过自动凝胶成像系统进行曝光拍摄。② 图像分析:在ImageTool图形分析软件上读取目的条带的密度扫描值。以各组GAPDH条带的扫描值标化其相应组的目的蛋白表达量,进行定量分析。
1.3 统计学处理
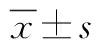
2 结果
2.1 DJ-1 mRNA及蛋白在子宫内膜癌组织与癌旁组织中的表达差异
我们课题组前期工作证明DJ-1在子宫内膜癌中高表达,但其表达上调的分子机制尚未阐明。为了进一步探讨子宫内膜癌中DJ-1表达上调的分子机制,我们应用qRT-PCR及Western blot技术再次检测了63例子宫内膜癌组织及其癌旁组织中DJ-1 mRNA及蛋白的表达水平差异。结果与前期工作相一致,与癌旁组织相比,DJ-1 mRNA(见图1)及蛋白(见图2)在子宫内膜癌组织中呈过表达,差异有统计学意义(P<0.01)。
2.2 miR-128-2在子宫内膜癌组织与癌旁组织中的表达差异
生物信息软件预测及相关文献提示DJ-1可能是miR-128-2的靶基因。为了探讨子宫内膜癌中DJ-1表达上调是否与miR-128-2有关,我们利用qRT-PCR技术进一步对63例子宫内膜癌组织及其配对的癌旁组织中miR-128-2表达水平进行了检测。结果如下页图3所显示,与癌旁组织相比,miR-128-2在子宫内膜癌组织中的表达明显减少,差异具有统计学意义(P<0.01)。

图1 qRT-PCR法检测,与癌旁组织相比,DJ-1 mRNA在子宫内膜癌组织中表达上调。**P<0.01。
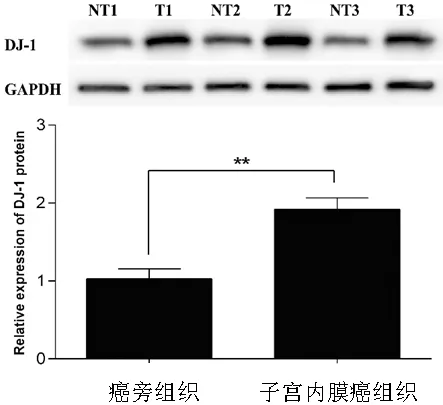
图2 Western blot法检测,与癌旁组织相比,DJ-1蛋白在子宫内膜癌组织中表达上调。**P<0.01。T:肿瘤组织;NT:癌旁组织。
2.3 miR-128-2基因启动子区DNA甲基化水平在子宫内膜癌组织与癌旁组织中的差异
研究表明miRNAs等抑癌基因表达下调或缺失在肿瘤发生、进展过程中扮演着重要角色。而启动子区高DNA甲基化,则是抑癌基因失调的一个重要原因。miR-128-2被报道存在DNA甲基化修饰,并作为抑癌基因参与了多种肿瘤细胞增殖的调控。我们使用CpG Island Searcher软件也发现miR-128-2基因启动子区的-166至+181位点347bp序列内存在10个CpG(见下页图4A)。重要的是,我们通过qMSP分别检测了63例子宫内膜癌组织及其对应的癌旁组织中miR-128-2基因启动子区的DNA甲基化水平。结果如下页图4B所示,与癌旁组织相比,子宫内膜癌组织中miR-128-2基因启动子区DNA甲基化水平明显升高(P<0.01)。
2.4 子宫内膜癌组织中miR-128-2 DNA甲基化与miR-128-2、DJ-1 mRNA表达的相关性
为了进一步明确子宫内膜癌中miR-128-2启动子DNA甲基化、miR-128-2表达以及DJ-1 mRNA表达之间的关系,我们使用统计软件评估了子宫内膜癌组织中miR-128-2 DNA甲基化与miR-128-2及DJ-1 mRNA相对表达水平之间的相关性。结果如57页图5所示,在子宫内膜癌组织中miR-128-2启动子区DNA甲基化水平与miR-128-2表达水平呈显著负相关(Pearson相关系数r=-0.9693,P<0.001),而与DJ-1 mRNA表达水平呈显著正相关(Pearson相关系数r=0.8762,P<0.001);此外,miR-128-2表达水平与DJ-l mRNA表达水平呈显著负相关(Pearson相关系数r=-0.8140,P<0.001)。
2.5 miR-128-2 DNA甲基化水平、miR-128-2及DJ-1 mRNA表达水平与子宫内膜癌患者临床病理参数的关系
结合患者临床病理资料,我们进一步分析了miR-128-2基因启动子区DNA甲基化水平、miR-128-2及DJ-1 mRNA表达水平与子宫内膜癌患者临床病理特征的关系。结果显示详见下页表3,miR-128-2 DNA甲基化、miR-128-2及DJ-1 mRNA表达与子宫内膜癌患者的病理类型、细胞分化程度无关,而与肌层浸润深度、淋巴结转移及FIGO分期有关,差异有统计学意义(均P<0.05)。

图3 qRT-PCR法检测,与癌旁组织相比,子宫内膜癌组织中miR-128-2表达下调。**P<0.01。
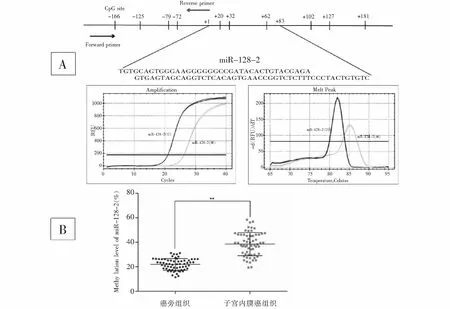
图4(A) miR-128-2启动子CpG岛、CpG位点(短垂直线)和qMSP区域示意图(从正向引物到反向引物)。4(B) qMSP法检测,与癌旁组织相比,子宫内膜癌组织中miR-128-2甲基化增加。**P<0.01。

图5 Pearson相关检验法对63例子宫内膜癌组织中miR-128-2 DNA甲基化、miR-128-2表达和DJ-1 mRNA表达相关性进行统计分析,均P<0.001。

表3 子宫内膜癌组织中miR-128-2 DNA甲基化水平、miR-128-2及DJ-1 mRNA表达水平与临床病理特征之间的关系
3 讨论
近年来,随着人口平均寿命延长及生活习惯变化,子宫内膜癌发病率呈逐年上升和年轻化趋势,其发生和发展是多因素、多阶段、多步骤的一系列复杂过程,是癌基因、抑癌基因等多种基因表达的异常改变及协同作用的结果。进一步发现和识别子宫内膜癌发生发展机制中特异表达改变的关键调控因子,不仅有利于了解其发生发展机制,而且还将为临床诊治提供新的靶点和干预环节。
DJ-1作为癌基因首次由日本研究者Nagakubo等[1]发现并报道,该基因位于人1号染色体短臂远端(1p36.12-1p36.33),长为23,629bp,包含8个外显子,其中外显子1A和1B不编码,而外显子2~7含有开放性阅读框,其编码的DJ-1蛋白含有189个氨基酸残基、分子量约为20 kd。研究表明DJ-1蛋白高度保守,属于ThiJ/PfpI超家族,主要以同源二聚体的形式广泛存在于机体各个组织器官,并参与了基因转录调节、细胞转化、抗氧化应激、分子伴侣、抑制细胞凋亡、促进细胞增殖及调节细胞自噬等多种细胞生命活动[12]。
早期研究主要集中在DJ-1基因纯合缺失和错义突变与帕金森病等神经退行性疾病的发生发展之间关系的领域。然而,自2001年Naour等[13]首次发现DJ-1蛋白异常过表达与乳腺癌密切相关后,DJ-1与肿瘤的关系引起了学者们广泛关注。相继有不少研究提示DJ-1的表达改变可能是多种肿瘤发生、发展的关键调控因素。我们前期研究证实DJ-1蛋白在子宫内膜癌中过表达,并可能作为重要的生物标志物对子宫内膜癌诊断具有潜在临床价值[3,14]。本研究再次证实DJ-1蛋白在63例子宫内膜癌组织中均呈现高表达。但有关DJ-1蛋白在子宫内膜癌中表达上调的上游分子调控机制目前尚未完全明确。
miRNAs作为一种可调控基因表达的内源性非编码单链小RNA分子,是体内重要的转录后调节因子。研究表明,许多miRNAs位于CpG岛中或附近,其表达水平易受异常DNA甲基化所调控[15]。具有抑癌作用的miRNAs因高DNA甲基化而转录沉默,导致其靶向调控的下游促癌基因异常上调表达,从而促使众多肿瘤发生发展[5,15-16]。因此,从miRNAs基因启动子区DNA甲基化表观遗传学的视角出发,探讨肿瘤特异性相关基因表达上调的内在调控机制是一条重要和关键的途径。
miR-128-2是近来颇受关注的与肿瘤发生进展密切相关的miRNA分子,与miR-128-1是同属于miR-128基因的两个亚型[17]。miR-128-2与miR-128-1分别定位于人类染色体3p22.3和2q21.3上,位于ARPP-21(cAMP-regulated phosphoprotein)和R3HDM1(R3H domain containing 1)基因的内含子内,两者在机体多种组织中均有表达,但其表达模式并不相同[18]。近来研究表明,miR-128-2和miR-128-1在多种肿瘤细胞中均呈现异常表达,这种异常表达通过调控下游靶基因表达,最终使其在肿瘤细胞增殖、凋亡、侵袭和转移等方面起到重要调控作用。有趣的是,miR-128-2和miR-128-1在不同的恶性肿瘤中表达不同,并可能发挥着截然不同的作用。一方面有证据显示miR-128-1在肝细胞癌[19]、乳腺癌[20]等肿瘤中表达上调,可能是一个潜在的促癌基因。然而,同时又有研究提示miR-128-2在神经胶质瘤[21]、胃癌[22]、非小细胞肺癌[23]、MLL-AF4急性淋巴细胞性白血病[24]等肿瘤中表达显著下调,发挥着类似抑癌基因的作用。
我们前期通过生物信息学软件预测和文献调研发现miR-128-2可能是DJ-1表达的重要调控因子。更为重要的是,miR-128-2基因启动子区被报道存在DNA甲基化修饰,并且作为肿瘤抑制因子参与了多种肿瘤细胞增殖的调控[5-6]。此外,我们使用CpG Island Searcher软件也检测出miR-128-2基因启动子区存在DNA甲基化修饰位点。据此,我们推测子宫内膜癌中DJ-1异常过表达很可能与miR-128-2基因启动子区高DNA甲基化致其表达沉默有关。于是,为了验证上述推测,我们首先在子宫内膜癌组织水平上寻找相关证据,检测子宫内膜癌组织中miR-128-2基因启动子区DNA甲基化水平及其表达情况。结果发现,与癌旁正常组织相比较,子宫内膜癌组织中miR-128-2基因启动子区DNA甲基化水平显著增加,而其表达水平显著下调;同时,通过相关性分析发现子宫内膜癌组织中miR-128-2 DNA甲基化水平与其表达水平呈负相关,而与DJ-1 mRNA水平呈正相关,此外,miR-128-2表达水平与DJ-1 mRNA水平呈负相关。上述结果提示启动子区异常DNA甲基化可能是影响子宫内膜癌中miR-128-2表达,进而影响DJ-1表达的调控机制之一。除此之外,通过临床资料我们进一步发现miR-128-2 DNA甲基化水平、miR-128-2以及DJ-1表达水平均与子宫内膜癌患者的病理类型、分化程度无关,而与肿瘤浸润深度、淋巴结转移和临床分期相关,提示miR-128-2 DNA甲基化可能与子宫内膜癌侵袭转移有关,并且可能是子宫内膜癌疗效判定和预后评估的潜在指标。
综上,本研究在组织水平佐证了子宫内膜癌中DJ-1表达上调可能与miR-128-2基因启动子区高DNA甲基化及其表达沉默有关,但仍需进一步实验明确子宫内膜癌中DJ-1与miR-128-2之间是否存在反向直接调控关系,以及启动子区高DNA甲基化是否miR-128-2表达沉默的上游调控机制之一。

