TGF-β1通过TAK1/β-catenin促进卵巢癌SK-OV-3细胞紫杉醇耐药的机制研究
胡传翠,李波,赵达
卵巢癌是恶性程度最高的妇科肿瘤,患者的预后差,化疗耐药率高是其预后不良的重要原因[1]。转化生长因子(transforming growth factor,TGF)对于卵巢癌具有双重调控作用[2],同时参与肿瘤耐药,是卵巢癌靶向治疗的潜在靶点之一[3],研究TGF介导卵巢癌耐药的分子机制有利于提高患者的生存情况[4]。Wnt信号通路参与调控肿瘤细胞的恶性进展[5]。研究发现Wnt/β-catenin信号通路可促进卵巢癌发生化疗耐药,通过干预相关Wnt通路分子可以促进化疗药物的杀伤作用[6-7]。转化生长因子β活化激酶1(transforming growth factor-β activated kinase 1,TAK1)属于丝裂原活化蛋白三激酶(mitogen activated protein three kinases,MAP3Ks)家族[8]。但除了介导MAPK信号外,TAK1还可调控Wnt相关信号通路[9]。本课题将初步研究TGF-β1对于卵巢癌紫杉醇耐药的作用,对于TAK1、β-catenin表达的调控作用以及敲减TAK1/β-catenin后对于TGF-β1促紫杉醇耐药的逆转作用。
1 材料与方法
1.1 材料
1.1.1 细胞株 SK-ΟV-3人上皮性卵巢癌细胞株购于上海中科院细胞所。
1.1.2 细胞实验相关试剂 DMEM细胞培养基、胎牛血清、胰蛋白酶、青霉素+链霉素、lipofactemine3000、均购自美国Invitrogen公司;TGF-β1购自美国R&D公司;一抗(抗TAK1、抗β-catenin、抗cleaved caspase3、抗GAPDH)、二抗均购自美国CST公司;紫杉醇购自美国MCE公司;CCK-8细胞增殖能力检测试剂盒购自日本Dojindo公司;蛋白提取试剂盒、BCA蛋白定量试剂盒、ECL化学发光试剂盒均购自美国Pierce公司;siRNA购自上海吉玛制药技术有限公司。
1.2 实验方法
1.2.1 卵巢癌细胞培养 SK-OV-3人上皮性卵巢癌细胞株培养于含10% FBS的DMEM培养基中。
1.2.2 siRNA转染 本文所涉及siRNA,包括NC-siRNA、TAK1-siRNA、β-catenin-siRNA均购自上海吉玛制药技术有限公司。使用Lipofactemine3000进行siRNA转染,48 h后进行后续实验,步骤详细参照说明书。
1.2.3 CCK-8细胞增殖活力检测 SK-OV-3细胞接种于96孔板后使用lipo3000进行siRNA转染,转染第3天后添加40 nM紫杉醇或10 ng/mL TGF-β1继续处理24 h,后参照说明书进行细胞增殖能力检测。简要步骤如下,每孔加入10 μL CCK-8后37 ℃孵育1 h,酶标仪检测A490 nm处的吸光度值。细胞增殖抑制率=(1-shRNA-NF-κB平均吸光度值)/(shRNA-NC平均吸光度值-空白孔平均吸光度值)× 100%。
1.2.4 细胞蛋白抽提及Western blotting实验 使用RIPA提取细胞总蛋白,BCA法蛋白定量后进行SDS-PAGE电泳。使用PVDF膜湿转法进行转膜,5%脱脂奶粉封闭1 h后加入一抗4℃孵育过夜。次日,TBST洗膜后加入相应种属的辣根过氧化物酶标记的二抗,室温孵育1 h后使用ECL发光法检测蛋白表达量。
1.3 统计学方法
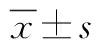
2 结果
2.1 转化生长因子-β1促进SK-OV-3细胞中β-catenin及TAK1的表达
WB的结果显示,与对照组相比,TGF-β1可显著促进上皮性卵巢癌细胞系SK-OV-3中β-catenin及TAK1的蛋白表达,差异有统计学意义,见下页图1。
2.2 siRNA敲减效率验证
本研究使用siRNA干扰SK-OV-3细胞中TAK1及β-catenin的表达,使用WB验证敲减效率。WB结果显示TAK1-siRNA可显著敲减(70±8)%的蛋白表达量(下页图2A;P<0.01,n=3),β-catenin可显著敲减(73±6)%的蛋白表达量(下页图2B;P<0.001,n=3)。
2.3 转化生长因子-β1通过β-catenin促进SK-OV-3对紫杉醇耐药
为进一步探究TGF-β1是否促进SK-OV-3发生耐药,且是否通过β-catenin介导耐药,本部分使用CCK-8及WB检测TGF-β1及β-catenin-siRNA处理后SK-OV-3细胞增殖及凋亡的变化。CCK-8结果显示40 nM紫杉醇可以显著抑制SK-OV-3细胞的增殖活力,而外源添加10 ng/mL TGF-β1处理24 h可促进肿瘤细胞的增殖活力(下页图3A)。通过RNA干扰下调SK-OV-3中β-catenin的表达后,TGF-β1促进肿瘤细胞对紫杉醇耐药的作用减弱。WB的结果显示,紫杉醇显著促进凋亡相关执行蛋白cleaved caspase3的表达,TGF-β1抑制了caspase3的剪切,而下调β-catenin表达后逆转了TGF-β1的作用(下页图3B)。

注:使用WB检测TGF-β1对SK-OV-3中β-catenin及TAK1蛋白表达的调控作用(n=3)。**,P<0.01;***,P<0.001。Ctrl为对照组,使用t检验进行统计学分析。图1 TGF-β1促进SK-OV-3细胞中β-catenin及TAK1的表达

注:WB检测TAK1-siRNA(A)及β-catenin-siRNA(B)的敲减效率。**,P<0.01;***,P<0.001。NC-siRNA为对照组,使用t检验进行统计学分析。图2 siRNA敲减效率验证
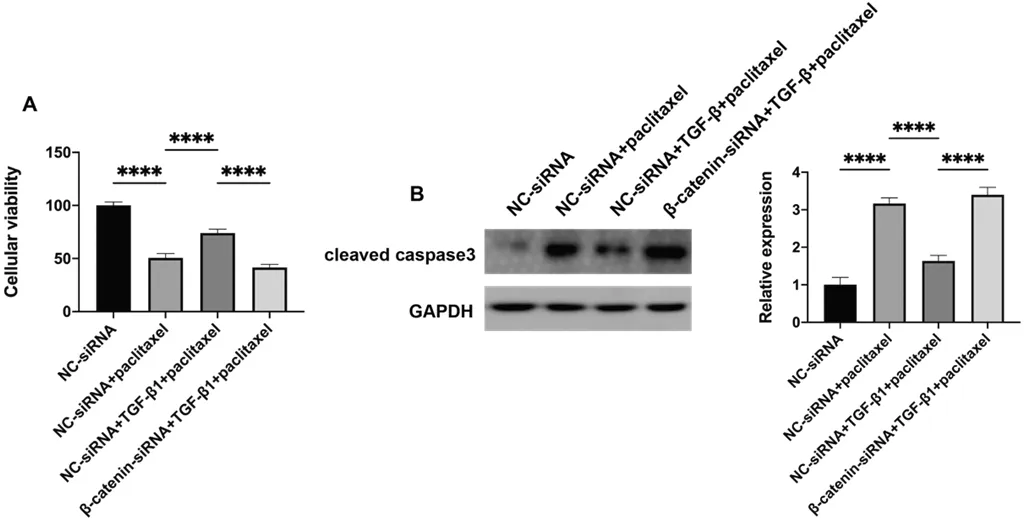
注:(A)CCK-8检测TGF-β1/β-catenin通路在SK-OV-3对紫杉醇耐药中的作用。(B)WB检测TGF-β1及β-catenin-siRNA对凋亡相关蛋白cleaved caspase表达的作用。****,P<0.0001。NC-siRNA为对照组,进行单因素方差分析。图3 TGF-β1通过β-catenin促进SK-OV-3对紫杉醇耐药
2.4 转化生长因子-β1通过TAK1/β-catenin促进SK-OV-3对紫杉醇耐药
TGF-β1可通过TAK1调控MAPK级联反应及细胞凋亡,且TAK1可调控T细胞淋巴瘤中Wnt/β-catenin信号通路[10]。本研究使用CCK-8及WB检测TGF-β1及TAK1-siRNA处理SK-OV-3后对于细胞增殖及凋亡的变化。CCK-8结果显示下调SK-OV-3中TAK1的表达可逆转TGF-β1介导的对紫杉醇耐药的作用(图4A)。WB的结果显示,10 ng/mL TGF-β1可以显著促进SK-OV-3细胞中TAK1及β-catenin的蛋白表达,而下调TAK1后可以抑制TGF-β1促进β-catenin表达的作用以及促进cleaved caspase3表达的作用(图4B)。
3 讨论
本研究发现,在卵巢癌中TGF-β1可促进肿瘤细胞对紫杉醇耐药,下调TGF-β1的下游TAK1及β-catenin后可以拮抗耐药的发生,促进肿瘤细胞的死亡。同时TGF-β1可通过TAK1调控β-catenin的表达,提示TGF-β1/TAK1/β-catenin信号通路在卵巢癌紫杉醇耐药过程中发挥着重要的作用。研究报道TGF-β1在卵巢癌中发挥着重要的作用,通过调控信号通路转导、自噬、肿瘤代谢重编程发挥促进耐药的作用[11-14]。唾液酸转移酶在多种癌症中上调,研究发现ST3GAL1在卵巢癌组织和卵巢癌细胞系中上调,可促进肿瘤细胞的增殖、迁移/侵袭以及紫杉醇耐药。TGF-β1可上调ST3GAL1表达,进而促进耐药及肿瘤细胞的上皮-间充质转化,促进卵巢癌的恶性进展[11]。糖皮质激素广泛用于肿瘤化疗,以减轻化疗药物的不良反应。研究发现地塞米松可上调卵巢癌细胞表面的TGF-β受体Ⅱ,增加肿瘤细胞对于TGF-β1的反应性,通过整合素β1、TGF-β1信号通路促进肿瘤细胞对细胞外基质的粘附作用并促进对于紫杉醇的耐药[12]。另外,来自于肿瘤微环境中的TGF-β1也参与了肿瘤耐药性的获得。骨髓间充质干细胞可以促进前列腺癌对多西紫杉醇的耐药,机制研究发现间充质干细胞分泌的TGF-β1可以促进肿瘤细胞的自噬过程,并介导对于化疗药物的耐药,通过自噬抑制剂可以逆转该过程[13]。另外,TGF-β1还可通过调控肿瘤代谢重编程促进耐药的发生。葡萄糖-6-磷酸脱氢酶是磷酸戊糖途径的关键酶,参与非小细胞肺癌的顺铂耐药。TGFβ1通过激活FOXM1-HMGA1-G6PD正反馈环路维持G6PD的表达及活性,干预该通路可以减弱肿瘤细胞的耐药性[14]。上述研究同样支持本研究的发现,TGF-β1是一个潜在的分子靶点,深入研究相关分子调控机制有利于改善卵巢癌耐药现状。TAK1可在不同的细胞环境中被激活,如肿瘤坏死因子α、脂多糖和TGF-β[15]。研究报道紫杉醇耐药的卵巢癌细胞中TAK1的表达量增加,并且磷酸化程度越高,其耐药性越高。使用TAK1的抑制剂5Z-7-恶唑烯醇可以改善体外实验及动物实验中,卵巢癌细胞对紫杉醇的耐药[15]。本研究发现TGF-β1可促进卵巢癌细胞中TAK1的表达,敲减TAK1可逆转TGF-β1介导的紫杉醇耐药。TAK1激活与相关位点的磷酸化密切相关,如T184、T187、T344、S389、T444、T511等[10,16]。在淋巴瘤中,通过药理学和遗传学的方法干扰TAK1 T344、S389、T444和T511位点的磷酸化可以抑制β-catenin的激活[10]。这也与本研究的结果一致,TAK1可调控β-catenin的表达。β-catenin通路的激活与卵巢癌耐药密切相关,同时相关分子的单核苷酸多态性也可作为化疗疗效的预测指标[17]。卵巢浆液性癌中,c-Kit与PHB结合后促进PHB酪氨酸259位点的磷酸化,进一步调控β-catenin/ABCG2信号通路调控肿瘤细胞对铂类药物治疗的耐受性[18]。本研究尚未研究TGF-β1对于TAK1磷酸化修饰的调控作用,在进一步研究中将深入研究TAK1中受TGF-β1调控的磷酸化位点以及相关位点对于β-catenin及紫杉醇耐药表型的分子调控机制。

注:(A)CCK-8检测TGF-β1/TAK1/β-catenin信号通路在SK-OV-3对紫杉醇耐药中的作用。(B)WB检测TGF-β1及TAK1-siRNA对β-catenin及cleaved caspase3表达的作用。**,P<0.01;***,P<0.001;*** *,P<0.0001。NC-siRNA为对照组,进行单因素方差分析。图4 TGF-β1通过TAK1/β-catenin促进SK-OV-3对紫杉醇耐药
综上所述,TGF-β1在卵巢癌紫杉醇耐药机制中发挥了重要的作用。本研究证实TGF-β1可通过TAK1调控β-catenin的表达并促进耐药的发生,通过抑制TAK1及β-catenin可拮抗TGF-β1的作用并逆转肿瘤细胞对紫杉醇的耐药,为靶向TGF-β1的分子治疗提供了新的理论基础。

