TRF2通过调节HIF-1α介导的血管生成对宫颈癌细胞上皮-间质转化的影响
郑芳,肖新益
宫颈癌是常见的妇科恶性肿瘤,发病率位于全球癌症第六位,严重威胁女性的生命健康[1],局部浸润及淋巴转移是宫颈癌患者死亡的主要原因[2]。上皮-间质转化与肿瘤血管的增长是肿瘤生长和转移的重要过程,而且肿瘤上皮-间质转化与血管生成有关[3-5]。TRF2是端粒重复结合因子2,通过转录激活血小板源生长因子受体β促进内皮细胞血管的生成[6]。研究发现,TRF2在肝癌、皮肤癌和结肠癌等中高表达,且其表达与肿瘤进展相关[7],且TRF2具有调控结肠癌肿瘤细胞的血管生成、上皮-间质转化及转移的功能,能够促进黑色素瘤的发生与转移[8-9],说明TRF2在肿瘤发生发展中发挥促癌因子的作用。但TRF2在宫颈癌发生发展及转移中的作用目前尚未有研究报道。因此,本研究通过探究TRF2在宫颈癌组织及细胞中的表达,阐明TRF2对宫颈癌细胞增殖、侵袭及转移,血管生成和上皮间质转化的影响,以期为控制宫颈癌转移研究提供参考依据。
1 材料与方法
1.1 细胞与组织来源及主要试剂
18例宫颈癌组织及癌旁正常组织均来自黄石市爱康医院于2018年3月至2020年2月收治的宫颈癌病例,均经术后组织病理检查确诊为宫颈癌。宫颈癌患者年龄26~75岁,临床分期:I期(11例),II期(6例),III期(1例);病理类型:鳞状细胞癌(14例),腺癌(4例);淋巴转移(1例),未转移(17例)。所有患者术前均未行化疗或放疗,取其宫颈癌组织标本和癌旁正常组织标本,保存于-80 ℃。宫颈癌细胞Hela与宫颈上皮细胞HcerEpic 均购自上海细胞生物学研究所,常规传代培养。DMEM培养基、胎牛血清与胰酶购自中国赛默飞世尔科技有限公司。HUVEC细胞专用培养基购自武汉普诺赛生命科技有限公司。苏木素-伊红染色试剂盒购自中国索莱宝公司。si-NC、si-TRF2、Lipofectamine 3000及BCA 蛋白定量试剂盒购自美国Invitrogen公司。大鼠源TRF2、E-cadherin、N-cadherin、Vimentin、Snail、HIF-1α及VEGF-A抗体及二抗(山羊抗鼠)购自美国CST公司。
1.2 细胞培养、转染及分组
宫颈癌细胞Hela与宫颈上皮细胞HcerEpic用含15%胎牛血清的DMEM培养基于37℃、5% CO2培养箱中培养,根据细胞生长密度更换新鲜培养基。HUVEC细胞用其专用培养基于37℃、5% CO2培养箱中培养。收集对数生长期的宫颈癌细胞Hela,调整细胞浓度为3.5×106个,接种于6孔板内,待细胞生长密度至65%~75%时,根据Lipofectamine 3000试剂说明书分别转染si-NC与si-TRF2,分别设置为si-NC组与si-TRF2组。
1.3 免疫组织化学法
对宫颈癌组织样本和癌旁正常组织进行常规石蜡切片,切片脱蜡后蒸馏水浸洗1 min后,进行抗原修复后,滴加3%的过氧化氢于切片组织上,室温孵育10 min,PBS冲洗5次,每次2 min。滴加稀释好的山羊血清,孵育40 min,去除玻片周围液体,滴加TRF2抗体,置于4℃冰箱内孵育过夜。PBS冲洗切片5次,每次2 min,去除玻片周围液体,滴加二抗37℃孵育25 min。PBS冲洗切片,滴加DAB显色液,自来水冲洗终止染色后,Harris苏木素复染45 s,水洗后用1%的盐酸酒精分化,再用自来水水洗返蓝。将切片置于无水乙醇Ⅰ-无水乙醇Ⅱ-二甲苯Ⅰ-二甲苯Ⅱ脱水后,平置于通风橱晾干,镜检拍照。
1.4 Western blot
用含有苯甲磺酰氟(PMSF)的RIPA缓冲液裂解各组Hela细胞及HcerEpic细胞。利用BCA试剂盒检测各细胞蛋白浓度。SDS-PAGE凝胶电泳分离等量蛋白后转膜。用5%脱脂牛奶4℃封闭1 h,加如TRF2(1∶1 500)、E-cadherin(1∶1 200)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)、Snail(1∶8 000)、HIF-1α(1∶1 000)及VEGF-A(1∶1 200),4°C孵育过夜。TBST漂洗后,加入HRP标记的山羊抗鼠二抗(1∶5 000)温育1 h。滴加ECL显影曝光后,计算蛋白相对表达量。
1.5 克隆形成实验
收集各组Hela细胞,胰酶消化后,调整细胞至2 000个细胞/ mL,接种于6孔板内(接种密度为1×104个/孔)。培养7天后观察细胞,弃上清,PBS洗涤细胞3次,加入1 mL 4%多聚甲醛,4℃固定细胞1 h,PBS洗涤细胞3次,加入1 000 μL结晶紫染色液作用细胞2 min,ddH2O洗涤细胞3次,晾干后拍照,在显微镜下计数大于10个细胞的克隆数且计数。克隆形成率=(克隆数/接种细胞数)×100%。
1.6 Transwell实验
Transwell板的上室涂加100 μL的Matrigel,将各组Hela细胞以每孔5×104个细胞接种到上室,下室加入体积分数15%胎牛血清的DMEM培养基,培养48 h。采用棉签擦拭上室细胞,PBS洗涤细胞。体积分数95%乙醇固定细胞10 min,结晶紫染色液作用15 min,PBS洗涤3次,倒置显微镜下观察并计数。
1.7 细胞划痕迁移实验
将各组Hela细胞培养24 h后,用微量胰蛋白酶消化,将密度为1×105个细胞/孔的Hela细胞平铺在6孔板上。设置3个平行孔。使用200 μL的无菌枪头轻轻划过6孔板,每次平行划5次左右。将处理后的6孔板置于37℃恒温培养箱中培养48 h,PBS冲洗3次。用倒置显微镜对各孔中同一划线位置细胞拍照。采用Image J软件测量各图中细胞未爬行区域的空白面积,并计算划痕愈合率。划痕愈合率=(0 h空白面积-48 h空白面积)/0 h空白面积×100%。
1.8 小管形成实验
将Matrigel基质胶在4 ℃融化使其充分溶解后,吸取50 μL加入96孔板中并在37℃下培养2 h以固化基质胶。收集各组Hela细胞的上清,离心去除细胞上清中的细胞碎片。利用各组细胞上清和HUVEC的专用培养基重悬HUVEC细胞,调整细胞浓度为2×105个/mL,加入预先铺好基质胶的96孔板内,于37℃、5% CO2培养箱中培养18 h。在显微镜下观察各组小管形成情况。
1.9 统计学处理
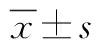
2 结果
2.1 TRF2在宫颈癌组织及细胞中的表达
免疫组织化学法实验结果(图1a)显示,宫颈癌组织中TRF2的表达高于癌旁正常组织;Western blot实验结果(图1b)显示,宫颈癌细胞Hela中TRF2的蛋白表达高于宫颈上皮细胞HcerEpic,差异有统计学意义(P<0.05)。

a:TRF2在宫颈癌组织及癌旁组织中的表达(免疫组化); b:TRF2在宫颈癌细胞Hela和宫颈上皮细胞HcerEpic中的表达。相对于HcerEpic细胞,**P<0.01。
2.2 沉默TRF2对宫颈癌细胞增殖、侵袭及迁移的影响
克隆形成实验(图2a)、Transwell实验(图2b)及细胞划痕实验(图2c)结果显示,与si-NC组相比,si-TRF2组Hela细胞的克隆形成数量、侵袭细胞数及划痕闭合均减少,差异均有统计学意义(P<0.05)。

a:沉默TRF2对子宫颈癌细胞增殖的影响;b:沉默TRF2对宫颈癌细胞侵袭的影响;c:沉默TRF2对子宫颈癌细胞迁移的影响。相对于si-NC,*P<0.05。图2 沉默TRF2对宫颈癌细胞增殖、侵袭及迁移的影响
2.3 沉默TRF2对宫颈癌细胞血管生成能力的影响
小管形成实验结果(图3a、b)显示,与si-NC组相比,si-TRF2组细胞血管形成能力减弱,差异有统计学意义(P<0.05)。
2.4 沉默TRF2对宫颈癌细胞上皮-间质转化标志物表达的影响
Western blot实验结果(图4a、b)显示,与si-NC组相比,si-TRF2组Hela细胞的E-cadherin蛋白表达水平升高,而N-cadherin、Vimentin及Snail的蛋白表达水平降低,差异均有统计学意义(P<0.05)。
2.5 沉默TRF2对宫颈癌细胞HIF-1α/VEGF信号通路的影响
Western blot实验结果(图5a、b)显示,与si-NC组相比,si-TRF2组Hela细胞的HIF-1α与VEGF-A的蛋白表达水平降低,差异有统计学意义(P<0.05)。

注:沉默TRF2对子宫颈癌细胞的血管生成的影响。相对于si-NC,*P<0.05。图3 沉默TRF2对宫颈癌细胞血管生成能力的影响

注:TRF2沉默对子宫颈癌细胞EMT标志物表达的影响。相对于si-NC,*P<0.05。图4 沉默TRF2对宫颈癌细胞上皮间-质转化标志物表达的影响

注:TRF2沉默对宫颈癌细胞HIF-1α/ VEGF信号通路的影响。与si-NC相比,*P<0.05。图5 沉默TRF2对宫颈癌细胞HIF-1α/VEGF信号通路的影响
3 讨论
上皮-间质转化是肿瘤转移级联中的第一步,其关键过程是极性分布静止的上皮细胞转化为无极性分布且运动活跃的间质样细胞[10],活跃的间质样细胞则促进肿瘤细胞迁移、侵袭及抵抗细胞凋亡,而且通过产生大量细胞外基质(ECM)组分,促进肿瘤的发生与转移[11]。
近年研究显示,TRF2的异常表达参与调控肿瘤的发生发展[7]。TRF2是端粒保护蛋白复合体因子2,定位于染色体16q22.1,其基因全长30 kb,分子结构域分为碱性区(basic)、二聚化区(dimerization)、定向序列(NLS)和DNA结合区(Myb)[12]。研究显示,TRF2通过参与T环与D环的形成,抑制经典的非同源末端连接(C-NHEJ)DNA修复机制和ATM依赖的DDR,以此确保其染色体结构完整以及避免其染色体的不正确修复[13],在肿瘤发生发展中扮演重要角色。Roy等[14]研究显示,TRF2在头颈癌组织中高表达,沉默TRF2可显著降低头颈癌细胞中p38的磷酸化水平进而抑制肿瘤细胞的增殖及耐药性。Picco等[15]研究显示,TRF2参与调控黑色素瘤细胞的凋亡。与Roy等研究相似,本研究发现TRF2在宫颈癌组织及细胞中高表达,沉默TRF2可抑制宫颈癌细胞增殖、侵袭及迁移,说明TRF2在宫颈癌中也发挥其促癌因子的作用。
上皮-间质转化是一个涉及细胞的形态和行为改变的可逆的生物学过程。而且研究已证实,肿瘤的上皮-间质转化与细胞的增殖、侵袭及迁移密切相关[16-17]。巴彩霞等[18]研究显示,肿瘤细胞发生上皮-间质转化后能够离开原发灶,入侵和转移至其他组织及器官;Tsai等[19]研究显示,肿瘤细胞发生上皮-间质转化后,侵袭及迁移能力明显增强。研究显示,上皮特征[E-钙黏蛋白(E-cadherin)、紧密连接蛋白及细胞角蛋白]的缺失和间充质特征[N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)和纤连蛋白(Snail)]的获得,会使癌细胞具有更快更强的侵入性[20-21]。李雪莲等[22]研究显示,山慈菇通过促进E-cadherin的表达,抑制Snail、N-cadherin和Vimentin的表达,阻止乳腺癌细胞的上皮-间质转化;赵晓珍等[23]研究显示,肺岩宁方通过上调E-cadherin的表达,下调N-cadherin 表达,抑制肿瘤异质粘附能力和运动能力抑制肺癌的侵袭和转移,说明调控上皮特征蛋白与间充质特征蛋白表达,可影响肿瘤细胞的侵袭及上皮-间质转化。因此,在本研究对TRF2是否影响上皮特征蛋白与间充质特征蛋白表达进行了研究,结果显示沉默TRF2不仅促进了宫颈癌细胞E-cadherin的表达,而且抑制N-cadherin、Vimentin及Snail蛋白表达,这说明TRF2调控上皮特征蛋白与间充质特征蛋白表达,以此影响宫颈癌细胞的上皮-间质转化。
上皮-间质转化后肿瘤组织中微血管数目与微淋巴管密度均增多[5]。肿瘤血管形成是肿瘤生长的必须途径,通过不断地为肿瘤提供营养和排除代谢产物促进肿瘤的发生发展[24]。HIF-1α是血管形成主要调控因子,可上调VEGF-A表达,促进VEGF-A与血管内皮细胞表面VEGFR-2结合,使肿瘤局部毛细血管和淋巴管通透性增加,诱导内皮细胞移行并刺激其增殖、分化和成熟,形成原始内皮细胞团,并通过内皮细胞的增殖分化与外膜覆盖,最终形成新生的肿瘤血管[25]。郭科军等[26]研究发现,HIF-1α通过上调VEGF表达,诱导组织中血管的形成,促进宫颈癌前病变的进展和宫颈癌的生长及浸润,说明HIF-1α与VEGF具有调控宫颈癌血管生成的作用。El等[27]研究显示,TRF2通过结合和激活PDGFR的启动子来调节血管生成;Zizza等[8]研究显示,沉默TRF2降低结肠癌肿瘤细胞分泌体中的VEGF-A,抑制内皮细胞的分化和血管的生成。本研究结果显示沉默TRF2能够降低血管形成相关分子HIF-1α与VEGF-A的表达水平,抑制HUVECs细胞血管壁的形成。
综上所述,沉默TRF2的表达能够抑制宫颈癌细胞的增殖、侵袭、转移及上皮-间质转化,这可能是由于沉默TRF2抑制了HIF-1α介导的血管生成。
致谢:感谢华中科技大学公共卫生学院覃元老师在统计学分析中给予的指导和帮助。

