南瓜果实愈伤期间果皮和果肉苯丙烷代谢和愈伤组织的比较
梁 伟,朱亚同,孔 蕊,柴秀伟,谢鹏东,毕 阳,*,Dov PRUSKY
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.农业研究组织新鲜农产品采后科学部,以色列 里雄莱锡安 7505101)
南瓜是重要的园艺作物,在世界范围内种植广泛,据联合国粮食及农业组织统计,2020年全球南瓜产量超过2 000万 t,其中我国南瓜产量约占50%[1]。依据植物学性状南瓜可划分为中国南瓜(Cucurbita moschata)、印度南瓜(C. maxima)和美洲南瓜(C. pepo)[2],其果肉富含胡萝卜素、维生素、氨基酸和碳水化合物[3],果皮富含果胶、纤维素和有机酸[4],是优质的营养来源。虽然南瓜表皮坚硬,但采后遭受机械损伤后易发生腐烂[5-6]。前期观察发现,损伤深浅造成的南瓜腐烂程度不一,浅层或仅伤及果皮的损伤可有效修复愈合,但伤及果肉的深度损伤愈合速度缓慢,会导致腐烂的发生。因此,有必要去探究浅层和深层损伤之间存在的差异。苯丙烷代谢在愈伤过程中具有重要作用,不仅为聚酚软木脂(suberin poly phenolic,SPP)和木质素的合成提供底物,还能合成酚类等抑菌物质[7]。研究发现,果实不同部位的苯丙烷代谢存在很大差异,甜瓜果皮较果肉具有较高的苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)、肉桂酸-4-羟化酶(cinnamic acid 4-hydroxylase,C4H)和4-香豆酰-辅酶A连接酶(4-coumarate coenzyme A ligase,4CL)活力[8];梨果皮的PAL、4CL、肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)和过氧化物酶(peroxidase,POD)活力也显著高于果肉[9];与果肉相比,柑橘果皮中PAL、C4H和CAD的表达量更高[10]。此外,桃[11]、番荔枝[12]和菠萝蜜[13]果皮中的肉桂酸、香豆酸、阿魏酸、总酚和类黄酮等苯丙烷代谢产物的含量均显著高于果肉。尽管已有果皮与果肉苯丙烷代谢差异的报道,但有关南瓜果实愈伤期间果皮和果肉苯丙烷代谢及愈伤组织形成差异的研究尚鲜见报道。本研究通过对人工模拟损伤的南瓜果实在室温黑暗条件下愈伤,分析愈伤期间果皮和果肉苯丙烷代谢关键酶活力,中间和最终产物含量以及H2O2含量和过氧化物酶活力变化,观察果皮和果肉中SPP和木质素的积累情况,比较南瓜果皮和果肉苯丙烷代谢活力和愈伤组织积累的差异,探究南瓜果实损伤后果皮和果肉愈伤组织形成的现象和相关机理,比较表皮和果肉的不同程度损伤对伤口愈合能力的影响,以期为南瓜采后处理提供科学依据。
1 材料与方法
1.1 材料与试剂
‘贝贝’南瓜果实(Cucurbita maximavar.Bocchan)于2020年8月购自甘肃省兰州市榆中县康源现代农业有限公司。
1.2 仪器与设备
HWS24型电热恒温水浴锅 上海一恒科技有限公司;SW-CJ-2FD型超净工作台 苏净集团苏州安泰空气技术有限公司;LDZX-30KBS立式压力蒸汽灭菌锅上海申安医疗器械厂;SPX-30085H-II型恒温培养箱上海新苗医疗器械制造有限公司;DFT-50研样机 上海谷宁仪器有限公司;CX21FSIC光学显微镜、CX21FS1C型正置万能显微镜 日本Olympus公司;UV-2450紫外-可见光分光光度计 日本岛津公司;H-1850R型台式高速冷冻离心机 长沙湘仪设备检测有限公司;1510型酶标仪 美国赛默飞世尔仪器有限公司;Ci6x分光光度仪日本爱色丽有限公司;CentriVap真空离心浓缩仪 美国Labconco公司;ACQUITY Arc四元梯度超快速液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 南瓜果实的人工损伤和取样
选取外观一致,成熟度相近,大小均匀,平均质量为(300±50)g,无可见病害和机械损伤的南瓜果实,用泡沫箱包装(50 个/箱),于次日运抵甘肃农业大学采后生物与技术实验室,在冷库(温度(4±2)℃、相对湿度55%~65%)中贮藏待用。
南瓜果实的损伤处理参照Wang Bin等[14]的方法并略作修改,果实用清水温和洗涤3 次去泥土,再用体积分数1%的次氯酸钠浸泡3 min进行消毒处理,用无菌水冲洗干净,晾干后用无菌刮皮刀模拟损伤,沿着果实赤道部位刮出半径2.0 cm、深度0.5 mm的圆形伤口(外圈损伤较浅为果皮部分,内圈损伤较深为果肉部分)。待水分晾干后单果套发泡网袋,室温(22±2)℃、相对湿度55%~60%的黑暗条件下愈伤。分别于愈伤第0、1、3、5、7天时取果皮和果肉愈伤组织及愈伤组织下3 mm厚的样品(每个南瓜果实果皮、果肉取样质量分别约为2 g和3 g,每次取样质量不少于80 g),用液氮速冻样品后采用DFT-50研样机研磨成粉状颗粒后装入50 mL离心管,保存于-80 ℃超低温冰箱。
1.3.2 苯丙烷代谢相关酶活力的测定
PAL活力的测定参照Kozukue等[15]的方法并作适当修改。称取1.0 g冷冻粉末,于3 mL pH 8.8硼酸缓冲液(含40 g/L聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP),2 mmol/L乙二胺四乙酸)、5 mmol/Lβ-巯基乙醇)中混合后静置提取1 h,4 ℃、10 000×g下离心30 min,上清液即为粗酶液。反应体系:3 mL 50 mmol/L pH 8.8硼酸缓冲液,0.5 mL 20 mmol/LL-苯丙氨酸,37 ℃水浴10 min,加入0.5 mL粗酶液,混合后迅速测定290 nm波长处的光密度值作为初始值(OD0),将混合液在37 ℃水浴锅中保温1 h后在290 nm波长处的OD值作为终止值(OD1),以硼酸缓冲液作为对照。以每小时OD值变化0.01为一个酶活力单位(U),酶活力以U/gmf表示。
C4H活力的测定参照文献[16]并作适当修改。称取1.0 g冷冻粉末,于3 mL 1 mol/L Tris-HCl缓冲液(pH 8.8,含40 g/L聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、10 mmol/Lβ-巯基乙醇、4 mmol/L MgCl2、5 mmol/L抗坏血酸、2 μmol/L NADPNa2、10 μmol/L亮抑酶肽、1 mmol/L苯甲磺酰氟化物和体积分数10%的甘油)中混合后静置提取1 h,在4 ℃、10 000×g条件下离心30 min,上清液即为粗酶液。反应体系:1.0 mL粗酶液,5 mL 50 mmol/L、pH 8.8 Tris-HCl缓冲液,25 ℃孵育30min,添加100 μL 6 mol/L HCl终止反应,测定340 nm波长处的OD值,以1 mol/L Tris-HCl缓冲液 (pH 8.8)作为对照。以每小时OD值变化0.01为1 个酶活力单位(U),酶活力以U/gmf表示。
4CL活力的测定参照文献[17]并作适当修改。 称取1.0 g冷冻粉末,加入3 mL上海源叶生物科技有限公司的提取液,然后于4 ℃,10 000×g条件下离心30 min,上清液即为粗酶液。反应体系:0.45 mL 7.5 μmol/L Mg2+(硫酸镁或氯化镁),0.15 mL 50 nmol/mLp-香豆酸,0.15 mL 2.5 μmol/mL ATP,0.15 mL 38 nmol/mL CoA以及0.5 mL酶液。40 ℃下反应10 min后,立即在333 nm波长处测定OD值。以每分钟OD值变化0.001为1 个酶活力单位(U),酶活力以U/gmf表示。
CAD活力的测定参照Goffner等[18]的方法并作适当修改。称取1.0 g冷冻粉末,于3 mL 1 mol/L Tris-HCl缓冲液(pH 8.8,含40 g/L PVP、15 mmol/Lβ-巯基乙醇、体积分数10%偏聚乙二烯和体积分数2%聚乙二醇)中混匀提取1 h,在4 ℃、10 000×g条件下离心30 min,上清液即为粗酶液。反应体系:0.2 mL酶提取液,0.8 mL反应液(含10 mmol/L烟酰胺腺嘌呤二核苷酸磷(nicotinamide adenine dinucleotide phosphate,NADP),5 moml/L反式肉桂酸),37 ℃水浴30 min,0.1 mL 1 mol/L HCl溶液终止反应(如有沉淀离心除去)后在400 nm波长处测OD值,以0.2 mL 1 mol/L磷酸盐缓冲液(pH 7.6)与0.8 mL反应液作为对照。以每分钟OD值变化0.001为1 个酶活力单位(U),酶活力以U/gmf表示。
POD活力的测定参照Venisse等[19]的方法并作适当修改。称取1.0 g冷冻粉末,加入3 mL乙酸-乙酸钠缓冲液(含1 mmol/L聚乙二醇,质量分数1% Triton X-100和质量分数4%交联聚乙烯吡咯烷酮,pH 5.5)混匀充分提取,4 ℃ 10 000×g条件下离心30 min,上清液即为粗酶液。反应体系:3.0 mL 25 mmol/L愈创木酚,500 μL粗酶液,300 μL 5 mmol/L H2O2。以蒸馏水作为对照,记录混合反应体系在470 nm波长处15 s~2 min的OD值。以每分钟OD值变化1为1 个酶活力单位(U),酶活力以U/gmf表示。
1.3.3 肉桂酸、对香豆酸、咖啡酸、阿魏酸、芥子酸和p-香豆醇、松柏醇、芥子醇含量的测定
参照Ayaz等[20]方法并作适当修改。称取1.0 g冷冻粉末,加入3 mL 70%(体积分数)甲醇溶液在40 Hz常温超声提取30 min,8 000×g离心20 min,上清液经CentriVap真空离心浓缩仪浓缩后,用溶液(甲醇、水、冰醋酸体积比为70∶30∶1)复溶至1 mL,过0.22 μm微孔滤膜,将滤液转移至2 mL自动进样瓶中。采用Waters Symmetry®C18色谱柱(4.6 mm×250 mm,5 μm)进行四元梯度超快速液相色谱仪分析。色谱条件:以100%甲醇(A)和1%乙酸(B)为流动相。按0~10 min:30% A、70% B;10~12 min:45% A、55% B;12~15 min:65% A、35% B;15~18 min:30% A、70% B;18~20 min:30% A、70% B;18~20 min:30% A、70% B进行梯度洗脱,流速0.8 mL/min,进样量5 μL。芥子酸和咖啡酸在325 nm波长处检测,阿魏酸在322 nm波长处检测,对香豆酸在310 nm波长处检测,肉桂酸在276 nm波长处检测,松柏醇在263 nm波长处检测,p-香豆醇在273 nm波长处检测,芥子醇在322 nm波长处检测。通过对比标准化合物的保留时间来对其进行定性。通过内标法对样品峰面积进行定量,酚酸含量以μg/gmf表示。各酚酸标准曲线方程为:肉桂酸:y=57 736x-87 455,R2=0.999 1;对香豆酸:y=5 302.3x-10 503,R2=0.998 9;咖啡酸:y=51 891x-99 316,R2=0.998 7;阿魏酸:y=29 640x-51 025,R2=0.998 9;芥子酸:y=32 847x-52 047,R2=0.999 3;p-香豆醇:y=9 754.1x-19 764,R2=0.999 1;松柏醇:y=26 401x-51 211,R2=0.998 6;芥子醇:y=893.5x-17 488,R2=0.999 2。
1.3.4 总酚和木质素水平的测定
总酚含量测定参照Scalbert等[21]的方法并作适当修改。称取1.0 g冷冻粉末,加入3 mL 0.5%乙酸和70%丙酮进行提取,将混合液于4 ℃黑暗环境下放置24 h,4 ℃、8 000×g离心30 min,收集上清液用于总酚的测定。测定体系:1 mL提取液、2 mL福林-酚稀释液(蒸馏水,体积比1∶10稀释)、2 mL质量分数7.5 % Na2CO3、50 ℃静置5 min,以甲醇作为参比空白,测定760 nm波长处吸光度。根据没食子酸标准曲线方程计算总酚含量(y=0.017x-0.077,R2=0.996),结果以每100 g样品所含没食子酸质量计,单位mg/100 gmf。
木质素水平测定参照Morrisson[22]的方法并作适当修改。称取1.0 g冷冻粉末,加入3 mL预冷的95%的乙醇溶液后离心,取沉淀物依次用95%乙醇溶液、乙醇-正己烷(1∶2,V/V)各冲洗3 次后置于烘箱中干燥,干燥物加入1 mL质量分数25%溴化乙酰-冰醋酸溶液,70 ℃恒温水浴 30 min,加入1 mL 2 mol/L NaOH溶液终止反应。再加2 mL冰醋酸和0.1 mL 7.5 mol/L的羟胺盐酸后离心取上清液0.5 mL,冰醋酸定容至5 mL,280 nm波长处测定OD值。木质素水平用每克样品的OD280nm表示。
1.3.5 H2O2含量的测定
H2O2含量的测定参考Prochazkova等[23]的方法并作适当修改。称取1.0 g冷冻粉末,加入丙酮后提取10 min,4 ℃离心30 min取上清液用于含量测定。反应体系:1 mL上清液、100 μL 20%(质量分数)TiCl4、100 μL质量分数20%浓氨水,混合液反应10 min后,离心10 min,取沉淀用丙酮洗涤3 次,加2.0 mL 1 mol/L H2SO4溶液进行溶解,测定410 nm波长处的OD值,通过H2O2标准曲线(y=0.748 8x+0.006,R2=0.997)计算H2O2含量,单位为μmol/gmf。
1.3.6 聚酚软木脂及木质素沉积情况观察
SPP的沉积情况观察参照Lulai等[24]的方法并作适当修改。用不锈钢双面刀片垂直于果皮和果肉伤口表面切出厚度0.2~0.3 mm左右的薄片。将切片置于载玻片上,滴加蒸馏水并盖上盖玻片在荧光显微镜下观察拍照,激发波长340~390 nm,接收波长420 nm。
木质素的沉积观察参照文献[25]并作适当修改。在垂直于果皮和果肉伤口表面切出0.2~0.3 mm的薄片,蒸馏水冲洗8 次,置于载玻片上滴加质量分数1%间苯三酚溶液及浓盐酸染色1 min,在光学显微镜下拍照观察。
果皮和果肉的SPP和木质化细胞层的厚度参照van Oirschot等[26]的方法,光学显微镜下观察拍照后通过IS Capture软件测定。
1.4 数据统计与分析
上述测定至少重复3 次。全部数据采用Excel 2016软件处理,实验结果用平均值±标准误表示,通过SPSS 24.0软件中的Duncan检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 愈伤期间果皮和果肉5 种酚酸和总酚含量的变化
肉桂酸、p-香豆酸、咖啡酸、阿魏酸、芥子酸是构成愈伤组织主要成分SPP的重要单体。愈伤期间,果皮和果肉中的肉桂酸、咖啡酸、阿魏酸和总酚含量随愈伤时间的延长不断增加,果皮的含量显著高于果肉,第7天时分别高出果肉29.17%、10.25%、28.76%和17.22%(P<0.05)(图1A、C、D、F)。果皮和果肉的p-香豆酸和芥子酸含量呈单峰型变化,果皮的含量显著高于果肉,第5天时达到峰值,分别高出果肉24.76%和14.15%(P<0.05)(图1B、E)。上述结果表明,愈伤期间,南瓜果皮的肉桂酸、p-香豆酸、咖啡酸、阿魏酸、芥子酸以及总酚的合成速率和积累量显著高于果肉。

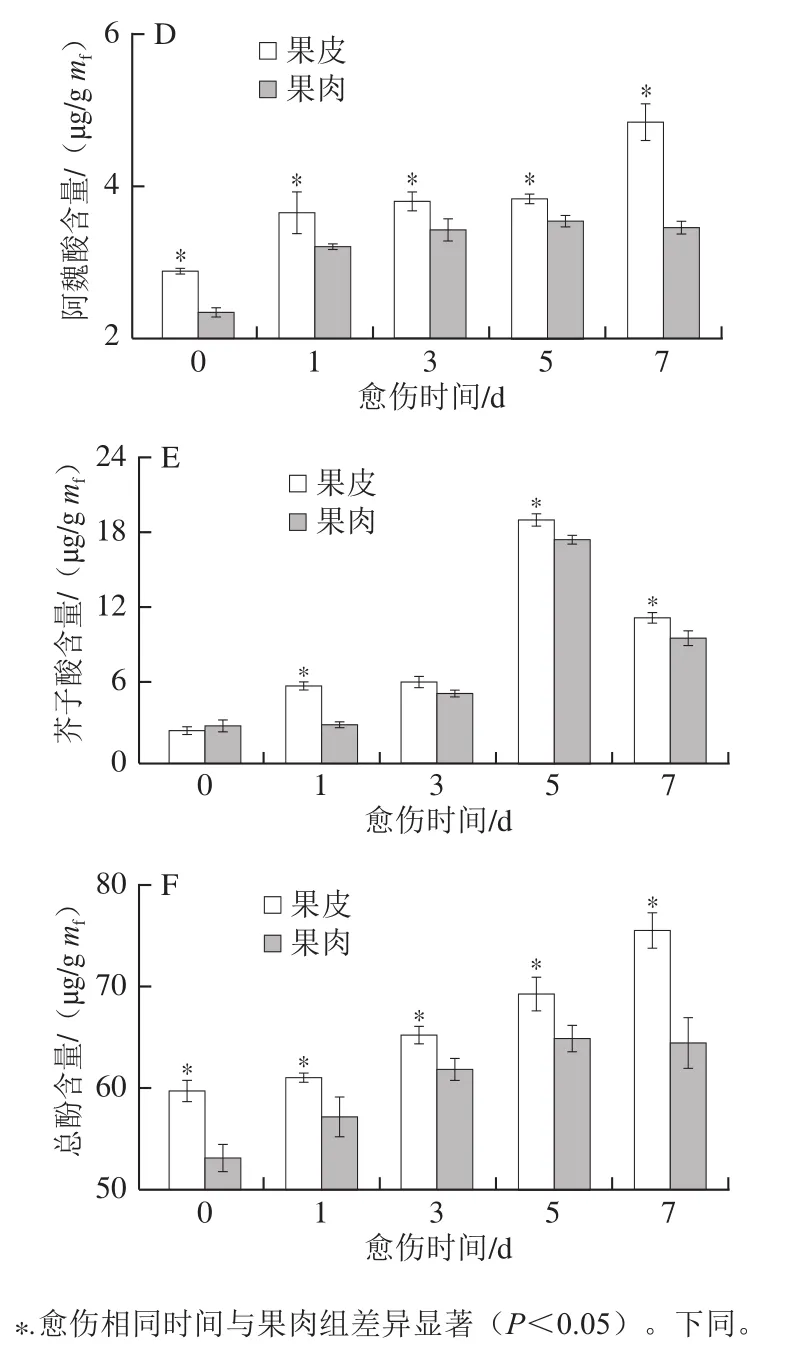
图1 愈伤期间南瓜果皮和果肉肉桂酸(A)、p-对香豆酸(B)、咖啡酸(C)、阿魏酸(D)、芥子酸(E)和总酚(F)含量的变化Fig. 1 Changes in contents of cinnamic acid (A), p-coumaric acid (B),caffeic acid (C), ferulic acid (D), sinapic acid (E) and total phenolics (F) in pumpkin peel and pulp during wound healing
2.2 果皮和果肉的3 种木质素单体和木质素水平的变化
肉桂醇、松柏醇和芥子醇是构成愈伤组织主要成分木质素的3 种重要单体。愈伤期间,果皮和果肉中的p-香豆醇含量在愈伤前期趋于稳定,第5天时迅速上升,果皮中含量显著高于果肉,第7天时果皮中含量高出果肉20.81%(P<0.05)(图2A)。果皮和果肉的松柏醇、芥子醇和木质素水平随愈伤时间的延长不断增加,果皮的含量显著高于果肉,第7天时分别高出果肉35.35%、22.47%和32.83%(P<0.05)(图2B~D)。上述结果表明,愈伤期间南瓜果皮的p-香豆醇、松柏醇、芥子醇以及木质素的合成速率和积累量显著高于果肉。
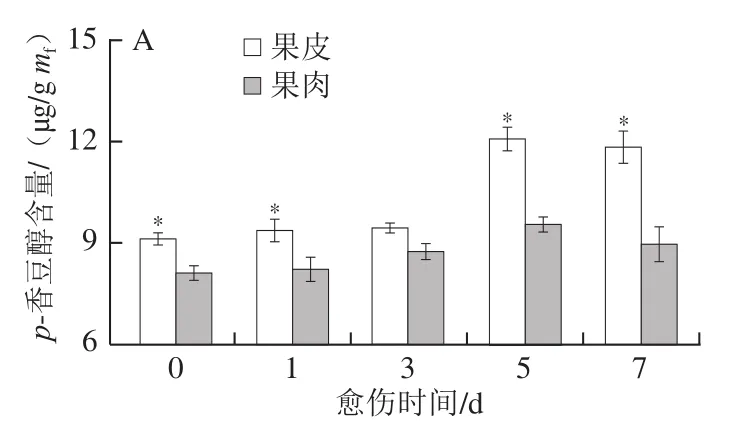
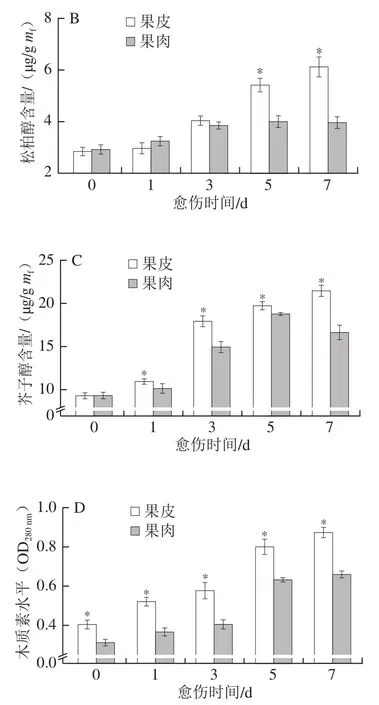
图2 愈伤期间南瓜果皮和果肉p-香豆醇(A)、松柏醇(B)、芥子醇(C)含量和木质素水平(D)的变化Fig. 2 Changes in contents of p-coumaroyl alcohol (A), coniferyl alcohol (B), sinapis alcohol (C) and levels of lignin (D) in pumpkin peel and pulp during wound healing
2.3 果皮和果肉的SPP和木质素积累的变化
SPP和木质素是愈伤组织的重要成分。愈伤期间,果皮和果肉的SPP的积累速度和积累量均逐渐增加,果皮和果肉的积累差异出现在第3天,之后果皮的积累速度和积累量始终高于果肉(图3A)。同样,果皮和果肉的SPP细胞层厚度随愈伤时间的延长不断增加,果皮的细胞层厚度在愈伤期间始终显著高于果肉(P<0.05),第7天时高出果肉17.55%(图3C)。愈伤期间,果皮和果肉的木质素积累速度和积累量均逐渐增加,果皮和果肉的积累差异出现在第3天,之后,果皮积累速度和积累量均高于果肉(图3B)。同样,果皮和果肉的木质素细胞层厚度随愈伤时间的延长不断增加,果皮的细胞层厚度在愈伤期间始终显著高于果肉(P<0.05),第7天时高出果肉24.37%(图3D)。上述结果表明,愈伤期间,果皮较果肉具有更快的SPP和木质素积累速率和更高的积累量。
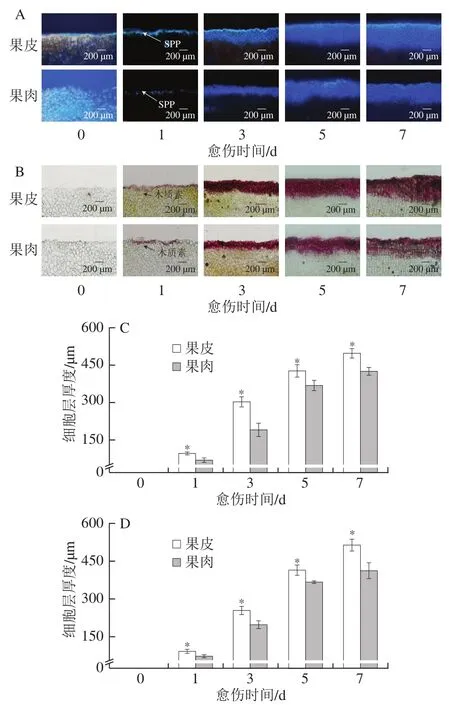
图3 愈伤期间南瓜果皮和果肉的SPP(A)和木质素积累(B)以及SPP(C)和木质素(D)细胞层厚度的变化Fig. 3 Changes in SPP (A) and lignin (B) accumulation and thickness of SPP (C) and lignin (D) cell layers in pumpkin peel and pulp during wound healing
2.4 愈伤期间果皮和果肉苯丙烷代谢关键酶活力的变化
苯丙烷代谢关键酶的活力对酚类物质的合成具有重要作用。愈伤期间,果皮和果肉的PAL和C4H活力均呈单峰型变化,果皮的活力始终高于果肉,在第5天和第3天时分别达到峰值,分别高出果肉24.71%和31.76%(P<0.05)(图4A、B)。果皮和果肉的4CL和CAD活力随愈伤时间的延长总体不断增加,果皮的活力显著高于果肉,第5天和第7天分别出现峰值,分别高出果肉21.65%和20.62%(P<0.05)(图4C、D)。上述结果表明,愈伤期间南瓜果皮比果肉具有更高的苯丙烷代谢关键酶活力。

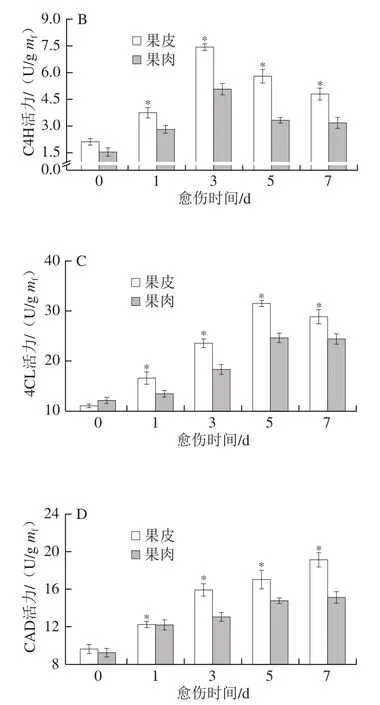
图4 愈伤期间南瓜果皮和果肉PAL(A)、C4H(B)、4CL(C)和CAD(D)活力的变化Fig. 4 Changes in activities of PAL (A), C4H (B), 4CL (C) and CAD (D)in pumpkin peel and pulp during wound healing
2.5 果皮和果肉的H2O2含量和POD活力的变化
H2O2含量和POD活力在一定程度上反映了SPP和木质素单体的聚合水平。愈伤期间,果皮和果肉的H2O2含量随愈伤时间的延长不断增加,果皮的H2O2含量始终显著高于果肉(P<0.05),第7天时果皮的H2O2含量高出果肉32.75%(P<0.05)(图5A)。果皮和果肉的POD活力随愈伤时间的延长不断增加,果皮的POD活力始终显著高于果肉(P<0.05),第7天时果皮的POD活力高出果肉39.93%(图5B)。上述结果表明,愈伤期间南瓜果皮比果肉具有更高的H2O2含量和POD活力。
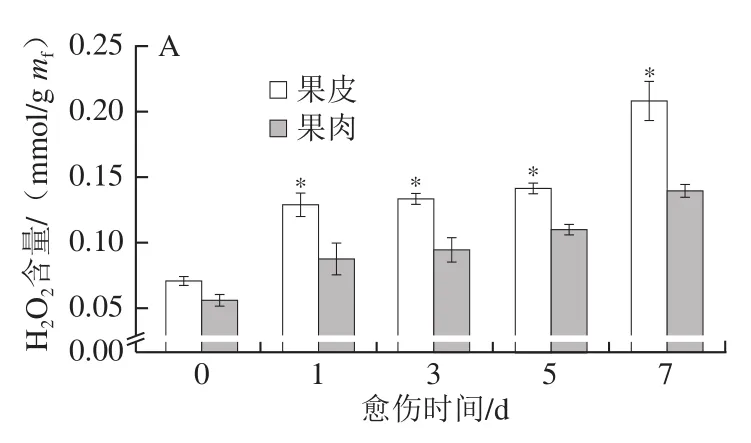
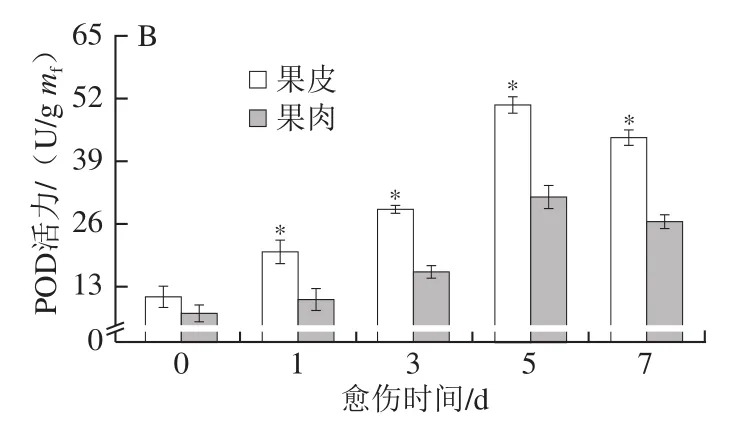
图5 愈伤期间南瓜果皮和果肉H2O2含量(A)和POD活力(B)的变化Fig. 5 Changes in H2O2 content (A) and POD activity (B) in pumpkin peel and pulp during wound healing
3 讨 论
苯丙烷代谢既为SPP和木质素提供所需的底物,也可产生具有抗菌活性的酚类物质[7]。PAL作为苯丙烷代谢的关键酶和限速酶,催化L-苯丙氨酸脱氨基生成反式肉桂酸[27],反式肉桂酸在C4H作用下羟基化生成p-香豆酸,p-香豆酸在香豆酸-3-羟基化酶作用下经过羟基化和酯化生成咖啡酸,咖啡酸经儿茶酚氧位甲基转移酶生成阿魏酸,阿魏酸首先羟化生成5-羟基阿魏酸,接着在5-羟基阿魏酸-O-甲基转移酶作用下催化生成芥子酸,这些酚酸是SPP合成的重要单体[28-29]。生成的酚酸在4CL的催化下分别生成肉桂酸-CoA、香豆酸-CoA、咖啡酸-CoA、阿魏酸-CoA和芥子酸-CoA,这些酚酸-CoA在CCR的催化下分别形成芥子醛、松柏醛和香豆醛,又经CAD作用转化形成p-香豆醇、松柏醇、芥子醇和香豆醇等木质素合成的底物,然后在POD和漆酶催化下分别形成对-羟基苯基木质素、愈创木基木质素和紫丁香基木质素[30-31]。本研究中,愈伤期间果皮较果肉具有更高的PAL、C4H、4CL和CAD活力(图4),该结果与在甜瓜果实中观察到的类似[8]。此外,愈伤期间果皮中的肉桂酸、p-香豆酸、咖啡酸、阿魏酸、芥子酸和总酚(图1)以及p-香豆醇、松柏醇、芥子醇和木质素(图2)含量高于果肉,该结果与在西瓜果实中观察到的结果类似[32]。代谢组学分析表明,香蕉果皮中莽草酸、苯丙氨酸和阿魏酸等物质的丰度显著高于果肉[33],莽草酸是苯丙氨酸的合成前体,苯丙氨酸是苯丙烷代谢的底物,阿魏酸又是木质素合成的前体物质[34-35]。有报道表明,柑橘果皮的脱落酸水平显著高于果肉[36],而脱落酸在激素水平上对马铃薯块茎愈伤具有促进作用[37]。柑橘的转录因子CsMYBF1在果皮中高表达,参与了酚类物质的合成[38]。酚类物质合成集中于果皮的主要原因是酚类物质积极参与了对外界病原菌侵染和紫外辐射的抵御[39]。因此,南瓜果皮可能是由于具有较高的脱落酸和转录因子水平,激活了苯丙烷代谢关键酶基因,从而促进了更多的酚类物质合成。
SPP和木质素是果实伤口处愈伤组织的主要成分[14]。SPP主要由羟基肉桂酸及其衍生物阿魏酸通过酯键和醚键连接形成[40],具有减少水分蒸腾,抑制病原菌侵染的功能[41]。木质素主要由肉桂醇、松柏醇和芥子醇聚合形成,具有强化细胞壁,增加机械强度,维持植物细胞壁结构完整性,形成物理屏障抑制病原菌的侵染和扩展的功能[42]。H2O2和POD在SPP和木质素单体聚合过程中具有重要作用[43-44]。H2O2在愈伤中具有双重作用,既可作为信号分子激活防卫反应,也可作为氢供体参与木质素单体与芳香结构域的氧化交联[45]。H2O2主要来源于NADPH氧化酶(NADPH oxidase,NOX),NOX通过转移电子产生超氧阴离子,后者由于存活时间很短,很快在超氧化物歧化酶的作用下被歧化成H2O2[46]。本研究中愈伤期间果皮H2O2的积累量要显著高于果肉(P<0.05)(图5A),该结果与在甜瓜和葡萄果实中观察到的类似[47-48]。由于南瓜果皮中Ca2+含量显著高于果肉[49],而钙依赖蛋白激酶(calcium-dependent protein kinases,CDPK)能够感知Ca2+浓度并与其结合而被激活,CDPK再通过磷酸化下游的NOX,导致超氧阴离子的产生[46]。有研究发现,甜瓜和苹果果皮中的SOD活力和转录水平均高于果肉,表明果皮具有更强的超氧阴离子歧化能力[47,50]。因此南瓜果皮中较高浓度的Ca2+可能参与了H2O2生成。作为重要的氧化还原酶,POD被损伤所显著诱导[41]。该酶一方面参与了木质素单体的氧化聚合[51],另一方面又可产生大量H2O2,直接抑制病原菌的侵染[52]。本研究中愈伤期间果皮的POD活力高于果肉(图5B),该结果与在甜瓜和西葫芦上观察到的结果类似[47,53]。南瓜果皮中POD活力较高的原因与其直接参与抵御生物和非生物胁迫密切相关[52]。
4 结 论
愈伤期间,南瓜果皮的肉桂酸、p-香豆酸、咖啡酸、阿魏酸、芥子酸和总酚以及p-香豆醇、松柏醇、芥子醇和木质素合成水平显著高于果肉,这主要是因为果皮较果肉具有更高的苯丙烷代谢关键酶PAL、C4H、4CL和CAD的活力。同时,果皮的H2O2含量和POD活力也显著高于果肉,通过氧化交联导致了果皮部位SPP和木质素沉积速率以及积累量显著高于果肉。综上所述,虽然南瓜果实果皮和果肉遭受损伤后均有愈伤反应,但果皮的愈伤能力更强。发生在表皮的损伤可以通过愈伤彻底修复,而伤及果肉的愈伤效果不彻底,会导致贮藏期间腐烂的加重。因此,南瓜果实在采后处理中应尽量减少伤及果肉的损伤。
- 食品科学的其它文章
- 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展
- 茶多酚对小麦淀粉理化特性和面包品质的影响及机理
- 运动对苏尼特羊脂肪代谢和肉品质的影响
- 升温方式对鲢鱼肌球蛋白结构和理化性质的影响
- Thermal Unfolding and Aggregation Process of Recombinant Staphylococcal Enterotoxin M (rSEM) Associated with Potential Toxin Responsible for Staphylococcal Food Poisoning
- 小米麸皮水溶性膳食纤维-Cr(III)配合物的合成、表征及其体外抗氧化活性

