手性酰胺键桥连双发色团型手性(锌)卟啉的合成与性质
顾婷婷, 唐 兴, 张生玉, 张 振*, 梁 旭*
(1. 江苏大学 化学化工学院,江苏 镇江 212013; 2. 江苏省宿迁卫生中等专业学校,江苏 宿迁 223800)
卟啉类衍生物是广泛存在于自然界中一类大环共轭化合物,在天然生命活动中扮演着重要的角色,如,镁卟啉衍生物的(叶绿素)在绿色植物光合作用中的光吸收起核心作用、铁卟啉衍生物(细胞色素a、b和c等)在生物氧化反应的充当电子的传递体,血红蛋白中的手性铁卟啉在维持红细胞的形状中起到了重要的作用等[1]。作为卟啉衍生物的重要分支,手性卟啉衍生物因其新颖的结构与性质,引起了诸多研究人员的关注。从合成方法来看,可在手性卟啉meso-或β-位引入手性基团、引入手性轴配体、调控卟啉环之间相互作用等方式来实现手性卟啉衍生物的合成[2-4]。
手性卟啉衍生物也在多个领域内得到了明确的应用,例如光合作用、生物分子氧化还原催化剂和手性分子[8-9]。手性酰胺键是一种非共轭柔性桥连基团,也是人体蛋白质最基本的结构。利用手性酰胺键桥连,可以得到多种结构的柔性手性卟啉衍生物及其金属配合物,例如meso-四(2-氨基苯基)卟啉[5],meso-四(2,6-二羧基苯基)卟啉,meso-四(2,6-二羟基苯基)卟啉[7],meso-四(2,6-二氨基苯基)卟啉[10-14]等。
本文以L/D-丙氨酸为构建桥连基团的原料,将芘环和卟啉环桥连,得到两例具有对映结构的双发色团手性卟啉衍生物,并通过与Zn2+配位,得到两例具有对映结构的锌配合物(Scheme 1)。并通过光谱学、电化学的方法对于其电子结构进行了深入研究。
1 实验部分
1.1 仪器与试剂
Bruker AV 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);CE FLASH1112A型元素分析仪;Shimadzu UV-2450型紫外可见分光光度计;Varian 9705型荧光光谱仪; JASCO J-815型圆二色光谱仪测试;CHI-730D型电化学工作站[玻碳电极(工作电极)、铂丝电极(辅助电极)和Ag/AgCl电极(参比电极)三电极体系,邻二氯苯(o-DCB)为溶剂,N2氛围,0.1 M高氯酸四丁基铵(TBAP)为电解质]。
1.2 合成
(1) 化合物L/D-3的合成
将化合物10.10 g(0.16 mmol)、 BOC-L-丙氨酸0.06 g(0.32 mmol)和N,N′-二环己基碳酰亚胺(DCC)0.17 g(0.80 mmol)加入25 mL干燥二氯甲烷中,搅拌下反应30 min(TLC跟踪)。粗产品经硅胶柱层析(洗脱剂:二氯甲烷/甲醇=98/2,V/V)纯化得化合物BOC-L-丙氨酸-H2TAPP(化合物L-2)。
将化合物L-2转移至100 mL圆底烧瓶中,加入10 mL盐酸(37%)和30 mL CH2Cl2,搅拌下反应2 h(TLC监测)。将反应液转移至装有100 mL去离子水和50 mL CH2Cl2的烧杯中,用氨水调节pH,分液,收集有机相,依次用水洗涤3次,无水硫酸钠干燥,旋蒸除溶得化合物L-3粗品。经硅胶柱层析(洗脱剂:甲醇/二氯甲烷=5/95,V/V)纯化,收集第二主带(紫红色带),旋转蒸发除去溶剂得L-丙氨酸-H2TAPP(化合物L-3)0.080 g,产率为72%。
用类似的方法,以BOC-D-丙氨酸为原料,合成D-丙氨酸-H2TAPP(化合物D-3)0.067 g,产率为60.3%。
(2) 化合物L/D-4的合成
将化合物L-30.10 g(0.142 mmol)、 1-芘丁酸 0.06 g(0.284 mmol)和N,N′-二环己基碳酰亚胺0.40 g(1.9 mmol)加入到50 mL圆底烧瓶中,用20 mL甲苯溶解;于110 ℃回流反应12 h(TLC跟踪)。蒸除溶剂,粗品经硅胶柱层析(洗脱剂:甲醇/二氯甲烷=5/95,V/V)纯化,收集第三带(紫红色淡带),旋蒸除溶得紫色固体化合物L-40.071 g,产率为52.0%;1H NMR(400 MHz, CDCl3)δ: 8.90(q,J=4.6 Hz, 5H), 8.72(d,J=4.6 Hz, 2H), 8.65(d,J=4.6 Hz, 2H), 8.19(d,J=6.8 Hz, 2H), 8.14(d,J=7.6 Hz, 3H), 8.06(d,J=7.5 Hz, 3H), 7.89~7.77(m, 4H), 7.70(dt,J=16.6 Hz, 8.4 Hz, 9H), 7.64~7.46(m, 10H), 2.68~2.46(m, 2H), 1.31~1.27(m, 3H); MSm/z: 971[M+]; Anal. Calcd for C67H50N6O2: C 82.99, H 5.31, N 8.49, C 82.86, H 5.19, N 8.65。
用类似的方法,以D-3为原料,合成紫色固体化合物D-40.079 g,产率为57.49%;1H NMR(400 MHz, CDCl3)δ: 9.18(s, 1H), 8.84(s, 4H), 8.75(t,J=4.0 Hz, 4H), 8.31(d,J=9.1 Hz, 1H), 8.25 - 7.70(m, 31H), 3.47(t,J=7.4 Hz, 2H), 2.49(d,J=7.4 Hz, 2H), 1.59(d,J=6.9 Hz, 3H), -2.80(s, 2H); MSm/z: 971[M+]; Anal. Calcd for C67H50N6O2: C 82.95, H 5.28, N 8.53, C 82.86, H 5.19, N 8.65。
(3) 化合物L/D-5的合成(以L-5为例)
将化合物L-40.02 g(0.0204 mmol)和乙酸锌0.01 g(0.0545 mmol, 2.5 eq.)加入50 mL的圆底烧瓶中,加入20 mLN,N′-二甲基甲酰胺,N2氛围,于160 ℃回流反应2 h(TLC监测)。蒸除溶剂,粗品经硅胶柱层析(洗脱剂:甲醇/二氯甲烷=5/95,V/V)纯化得紫色固体化合物L-50.015 g,产率为70.8%;1H NMR(400 MHz, CDCl3)δ: 8.90(q,J=4.6 Hz, 4H), 8.73(d,J=4.6 Hz, 2H), 8.67(d,J=4.6 Hz, 2H), 8.28~8.11(m, 5H), 8.08(dd,J=7.4 Hz, 3.2 Hz, 3H), 7.98(q,J=7.2 Hz, 2H), 7.85(d,J=7.9 Hz, 2H), 7.77(d,J=7.8 Hz, 1H), 7.68(dd,J=14.7 Hz, 5.7 Hz, 9H), 7.66~7.57(m, 6H), 7.54(d,J=8.9 Hz, 1H), 7.43(t,J=7.6 Hz, 1H), 7.35(d,J=7.7 Hz, 1H), 7.18(d,J=7.9 Hz, 2H), 3.36(t,J=7.2 Hz, 1H), 2.28(t,J=6.9 Hz, 1H), 2.18~2.10(m, 1H), 1.44(t,J=7.2 Hz, 3H); MSm/z: 1034.54[M+]; Anal. Calcd for C67H48N6O2Zn: C 77.92, H 4.77, N 8.01, C 77.79, H 4.68, N 8.12。
用类似的方法,以D-4为原料,合成紫色固体化合物D-50.021 g,产率为71.5%;1H NMR(400 MHz, CDCl3)δ: 8.84(d,J=1.5 Hz, 4H), 8.77~8.69(m, 4H), 8.33~8.15(m, 7H), 8.09~7.92(m, 8H), 7.90~7.64(m, 14H), 6.31(d,J=7.2 Hz, 1H), 4.97~4.89(m, 1H), 3.46(t,J=7.7 Hz, 2H), 2.51(t,J=7.8 Hz, 2H), 2.41~2.32(m, 2H), 1.61(d,J=6.8 Hz, 3H), -2.79(s, 2H); MSm/z: 1034.54[M+]; Anal. Calcd for C67H48N6O2Zn: C 77.99, H 4.81, N 7.98, C 77.79, H 4.68, N 8.12。
2 结果与讨论
2.1 表征
(1) 光谱表征
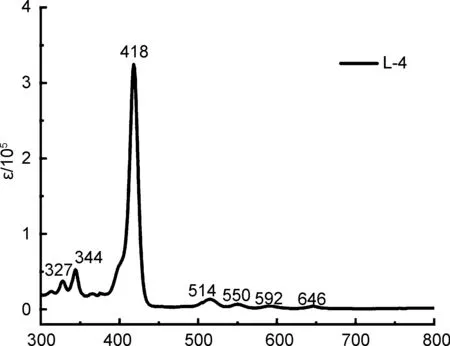
图1 为化合物L/D-4在二氯甲烷溶液中紫外-可见吸收光谱,两种构型的化合物紫外-可见吸收光谱相似,其中波长λ=300~350 nm之间的吸收峰对应为化合物中芘的特征吸收,在λ=418 nm处对应卟啉自由碱Soret带的特征峰,分别在λ=514、 550、 592及646 nm处对应Q带特征吸收,且与四苯基卟啉自由碱吸收光谱相似[4],说明通过非共轭氨基酸桥联的化合物L/D-4结构中芘环结构与卟啉环结构之间的相互作用较弱。与L/D-4相比,L/D-5在λ=419 nm表现出soret带特征吸收,在λ=547, 588 nm处表现出Q带特征吸收,同时摩尔吸光系数增大,其主要原因为Zn2+的引入,引起了卟啉环结构对称性由D2h转为D4h的转变,π轨道能级简并,同时,Zn2+的引入降低了HOMO-LUMO轨道能级差,增强了化合物在紫外-可见光区的吸收。
λ/ nm

λ/nm

λ/nm
手性卟啉L/D-4(图4)及其锌配合物L/D-5(图5)均表现出强的荧光特性。在二氯甲烷中,手性卟啉L/D-4分别在λ=646、 710 nm处的表现出与Q带吸收峰呈现镜像对称的荧光发射峰。随着Zn2+配位,卟啉L/D-5环结构中的电子云密度发生改变,在λ=592、 639 nm处表现出强度关系与L/D-4不同的荧光发射峰。同时,对映异构体之间的荧光发射峰没有显著区别。

λ/nm
λ/ nm
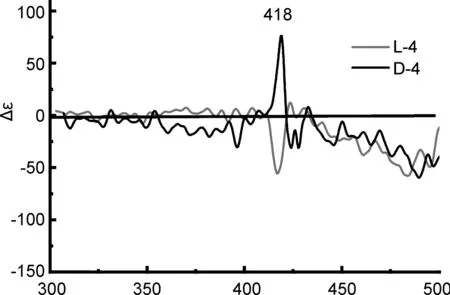
为了研究手性桥连基团与不同发色团之间的手性相互作用,利用圆二色光谱对化合物L/D-4及L/D-5进行了研究。如图5所示,化合物L/D-4在411 nm处产生呈镜像关系的CD信号,对卟啉Soret带区域,但并未在芘环吸收光谱对应区域内表现出典型CD信号,证明卟啉分子与手性酰胺键的激发耦合强度强于芘环。手性锌卟啉L/D-5在卟啉Soret带区域410、 414、 418和424 nm处产生镜像对称、谱项为+/-/+/-(L-5)和-/+/-/+(D-5)的CD光谱信号,说明金属Zn2+对分子的CD光谱信号有一定的调控作用,且在芘环所在区域内。
2.2 电化学性能
在含0.1 M四丁基高氯酸铵(TBAP)的邻二氯苯溶液(o-DCB)中使用三电极系统测试了化合物L/D-5的电化学循环伏安图,微分脉冲伏安图以及不同扫描速度下的循环伏安图,如图6所示(以D-5图略)。

Potential(Vvs Ag/AgCl)
从图中可以看出,化合物L-5有两个还原可逆峰,分别为E1/2=-1.09 V和-1.46 V,两个可逆氧化峰分别为E1/2=1.09 V和1.40 V;化合物D-5有两个还原可逆峰,分别为E1/2=-1.09 V和-1.41 V,两个可逆氧化峰分别为E1/2=1.09 V和1.46 V。构型不同的两种化合物具有相似的电化学性质,氧化以及还原均具有两级可逆峰。具体数据见表1。

表1 化合物L/D-5在o-DCB中的氧化还原电位
根据两个化合物的扫速图分别在其一级氧化和一级还原处对其电流值和扫描速率的平方根取点作图(图略),得到电流值与扫描速率的平方根的关系:电流值与扫描速率的平方根是呈线性关系的,其线性相关性表明化合物L/D-5的氧化和还原过程均是在电极表面呈扩散控制的。
合成了两个手性酰胺键桥连的双发色团卟啉衍生物L/D-4及其金属配合物L/D-5。 L/D-4以及L/D-5的圆二色光谱均呈现镜像对称的关系,加入金属离子之后其CD信号发生了改变表明金属离子的加入对于卟啉的电子云密度以及空间结构均有一定的调控作用。测试了化合物L/D-5的电化学性质。结果表明,化合物虽然构型不同,但电化学性质相似,并且在电极表面的氧化和还原过程均为扩散控制。

