基于生物信息学的息痛散治疗痛风性关节炎的作用机制
南晓强,雷鹏,李娟娥
陕西省人民医院中医科,陕西西安 710068
前言
痛风是一种代谢性风湿疾病,由体内嘌呤代谢紊乱引起的高尿酸血症,进而导致尿酸沉积在关节腔或软组织中[1]。痛风性关节炎是一种由关节和关节周围组织中MSU晶体沉淀引起的炎症性疾病,其主要特征是一个或多个关节突然发作剧烈疼痛和肿胀,关节活动受限、功能障碍和反复发作[2]。起初发作频次较低,但随着疾病的发展,会变得愈加频繁,因而成为痛风患者健康相关生活质量下降的主要原因[3-4]。鉴于过去20多年来痛风发病率的大幅上升,痛风性关节炎成为一个主要、日益严重的公共卫生问题[5]。其治疗复杂而昂贵,部分原因是由于此病常出现心血管疾病、慢性肾脏疾病和糖尿病等合并症[6]。美国风湿病学会(ACR)和欧洲抗风湿联盟(EULAR)推荐治疗痛风性关节炎的口服药物秋水仙碱、非甾体抗炎药(NSAIDs)、糖皮质激素和白介素1(IL-1)阻断剂[7-8]。然而,对这些口服药剂的起效时间往往需要12~24 h,而且可能需经过几天到1 周的时间才能完全达到治疗效应[9]。故目前对于痛风性关节炎的治疗仍缺乏理想的药物。值得注意的是,近年来,全球因痛风性关节炎而住院的人数明显增加,这与类风湿性关节炎患者入院人数减少形成鲜明对比[10]。
网络药理学有效整合了生物信息学及系统药理学等技术,为中医药作用机制的研究提供了新思路和方法,通过药物、成分、靶点和信号通路等揭示多分子药物协同作用于人体的机制[11],与中医学的整体观不谋而合。息痛散是本课题组在痛风性关节炎“痰热瘀毒”发病观指导下组方并经临床使用多年的有效验方,临床应用疗效显著,前期实验亦证明该方可明显减轻痛风性关节炎模型大鼠关节足跖肿胀度,改善大鼠步态学评分,降低血清炎性因子IL-1β、TNF-α 水平[12-13],但其具体作用机制仍需进一步阐明。本研究从网络药理学角度探究息痛散治疗痛风性关节炎的分子机制,为后续基础实验提供思路,以期指导临床用药。
1 材料与方法
1.1 息痛散中活性成分和作用靶点的收集筛选
以“苍术”、“黄柏”、“牛膝”、“桃仁”为关键词,在中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)检索对应的成分,根据吸收、分布、代谢、排泄(Absorption,Distribution,Metabolism,Excretion,ADME)的药动学特性参数筛选活性成分[14]。其中以口服生物利用度(Oral Bioavailability,OB)≥30%、药物相似性(Drug Likeness,DL)≥0.18为筛选条件[15]。以“全蝎”、“忍冬藤”、“石膏”为关键词,通过在TCMID数据库上搜集其成分。将所得到的成分通过TCMSP数据库进行靶点提取。
1.2 息痛散中活性成分潜在作用靶点预测和基因名注释
基于TCMSP 数据库,将息痛散中活性成分依次配对潜在的靶点,采用UniProt 数据库中UniProtKB搜索功能(http://www.uniprot.org/)通过输入蛋白名称并限定物种为“human”,将检索得到的所有蛋白标准化并将其校正为官方名称,即为息痛散活性成分的预测作用靶点。
1.3 痛风性关节炎靶点的收集
使用GeneCards(https://www.genecards.org/)数据库,以“Gouty arthritis”为关键词检索痛风性关节炎相关基因。在NCBI(https://www.ncbi.nlm.nih.gov)gene 数据库,以“Gouty arthritis”关键词,选择物种为“Homo sapiens”,获得痛风性关节炎的基因。结果合并去重后则为痛风性关节炎相关基因。
1.4 蛋白-蛋白相互作用(PPI)网络的构建
使用Cytoscape 3.7.2 软件的插件Bisogenet(Martin等,2010),利用相互作用蛋白数据库(DIP™)、相互作用数据集生物总库(BioGRID)、人类蛋白质参考数据库(HPRD)、完整分子相互作用数据库(IntAct)、分子相互作用数据库(MINT)和生物分子相互作用网络数据库(BIND)获得PPI 数据[16],即获得息痛散治疗痛风性关节炎相关基团。将息痛散预测靶点及痛风性关节炎相关靶点的PPI网络可视化,并应用CytoHubba插件筛选出核心子网络[17]。
1.5 GO和KEGG富集度分析
获得核心靶点后,使用R4.0.2 软件的ClusterProfiler 包[18]对核心靶点进行基因本体(Gene Ontology, GO)和基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析[19],其中GO 分析依据功能的不同,可区分为生物过程(Biological Process, BP)、细胞成分(Cellular Component, CC)、分子功能(Molecular Function,MF)[20]。
1.6 分子对接
从1.4 节中的核心子网络中选择最重要的基因进行后续的分子对接分析。使用AutoDockTools-1.5.6 软件构建关键靶点的分子对接模型,之后将其与息痛散治疗痛风性关节炎的主要成分进行分子对接,然后分析对接结果以验证网络分析结果的可靠性。首先从蛋白质数据库(https://www.rcsb.org/)中下载息痛散治疗痛风性关节炎关键靶点的蛋白质晶体结构,并选择分辨率小于3Å 的蛋白质复合物和配体[21],以保证对接的准确性。从Pubchem 数据库(https://www.pubchem.ncbi.nlm.nih.gov//)下载息痛散中关键化合物的结构,然后用AutoDockTools-1.5.6软件进行加氢、去电。蛋白质结构被设定为刚性大分子后进行分子对接。
1.7 实验验证
1.7.1 痛风性关节炎模型的建立参照Coderre等[21]的方法制备大鼠痛风性关节炎模型。将32只健康SD大鼠随机分为对照组、模型组、息痛散组及秋水仙碱组,每组8只,除对照组,其余3组小鼠经2.5%异氟烷麻醉后,以碘酒、乙醇局部消毒处理,用1 mL灭菌注射针在小鼠右侧踝关节背侧,从45°方向插入至胫骨肌腱内侧,将含0.5 mg尿酸钠溶液20 μL注入到关节腔,造模后各组小鼠踝关节均出现明显肿胀,提示造模成功。对照组注射等量生理盐水。参照人与小鼠体表面积换算法,及前期实验基础[12],按成人每日服用息痛散剂量为中剂量,小鼠每日息痛散给药剂量为15.3 mL/kg,秋水仙碱每日治疗药量为0.6 mg/kg,正常组和模型组给予等量生理盐水灌胃,2次/d,连续4 d。
1.7.2 观察指标受试关节脱钙处理后取组织,Western Blot法检测踝关节滑膜组织PI3K、p-Akt蛋白表达。
1.8 统计学方法
采用SPSS 26.0软件进行统计学处理。所有检测结果均为计量资料,以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 检验。P<0.05为差异有统计学意义。
2 结果
2.1 息痛散化学成分搜集结果
在TCMSP、TCMID 数据库中检索到息痛散所有化学成分共计936 个(截止时间为2021年5月28日),以OB≥30%、DL≥0.18为标准,检索出146个主要活性成分;槲皮素、β-谷甾醇、豆甾醇、山奈酚、黄柏黄酮II、异鼠李素等为息痛散中的主要活性成分。其中苍术26 种,黄柏8 种,牛膝9 种,全蝎41 种,忍冬藤15种,石膏28种,桃仁19种,百部32种。共预测靶标2 129个;方中各药味活性成分和预测靶标数量见表1。
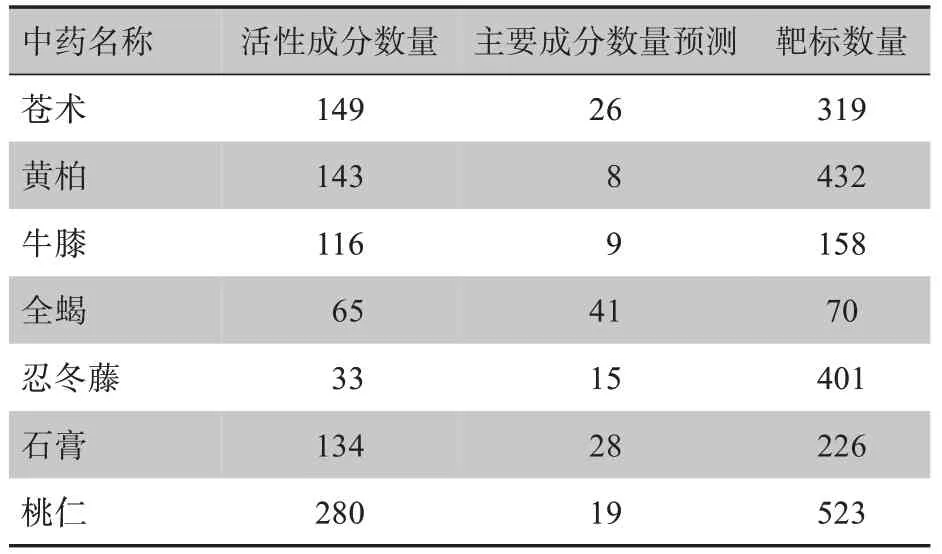
表1 息痛散“化合物-有效成分-靶标”基本信息Tab.1 Basic information on"compound-active ingredienttarget"for Xitongsan
2.2 痛风性关节炎潜在靶点的预测
通过NCBI、GeneCards 等数据库分别收集到痛风性关节炎潜在靶点48、346 个,剔除重复46 个,共收集到348个痛风性关节炎相关靶点。
2.3 息痛散治疗痛风性关节炎潜在靶点PPI网络构建
为揭示息痛散对痛风性关节炎的作用机制,将预测的息痛散靶点的PPI 网络和痛风性关节炎相关靶点的PPI 网络合并起来。如图1a 所示,该网络由4 545 个节点和112 787条边组成。根据以往的研究,以所有节点的2 倍中位度值为截断(George 等,2019),构建1 个针对息痛散治疗痛风性关节炎的子网络,其中包含115 44 个节点和50 808 条边(图1b)。再根据BC、CC、EC、LAC 和NC 的中位的中位截断值进一步筛选158个核心靶点(图1c),即息痛散治疗痛风性关节炎的核心靶基因。
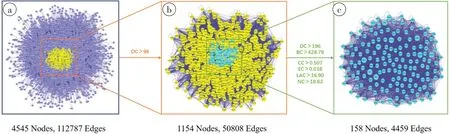
图1 息痛散与痛风性关节炎交集靶点的PPI网络Fig.1 PPI network for the intersection targets of Xitongsan and gouty arthritis
最终将PPI 网络导入Cytoscape 进行进一步分析。通过使用CytoHubba 得到1 个由10 个靶基因组成的关键子网络(图2),以用于后续分子对接。

图2 息痛散治疗痛风性关节炎交集靶点的关键子网络Fig.2 Key sub-network of intersection targets for the treatment of gouty arthritis with Xitongsan
2.4 息痛散干预痛风性关节炎的GO 富集分析和KEGG通路注释分析
利用R4.0.2 软件的ClusterProfiler 包对158 个息痛散干预痛风性关节炎的潜在靶点进行GO 功能富集分析。在GO 功能富集过程中共得到440 条结果,包括BP(181项)、CC(40项)和MF(56项)。以P≤0.01为筛选条件,获得56 个条目。依据count值大小筛选出涉及BP、CC 和MF 的前10 条富集结果,如图3所示。在BP 方面,包括RNA 聚合酶II启动子转录的正调控、炎症反应、药物反应、凋亡过程的调控、脂多糖的细胞反应、免疫应答、DNA 模板转录正调控、细胞增殖正调控等;在CC 中,包括胞浆、细胞核、细胞质、胞外间隙、胞外小体、质膜、线粒体、细胞膜等。而在MF 方面,涉及与蛋白质结合、蛋白质均聚活性、与酶结合、细胞因子活性、蛋白质异二聚活性、蛋白丝氨酸/苏氨酸激酶活性、蛋白激酶活性等。
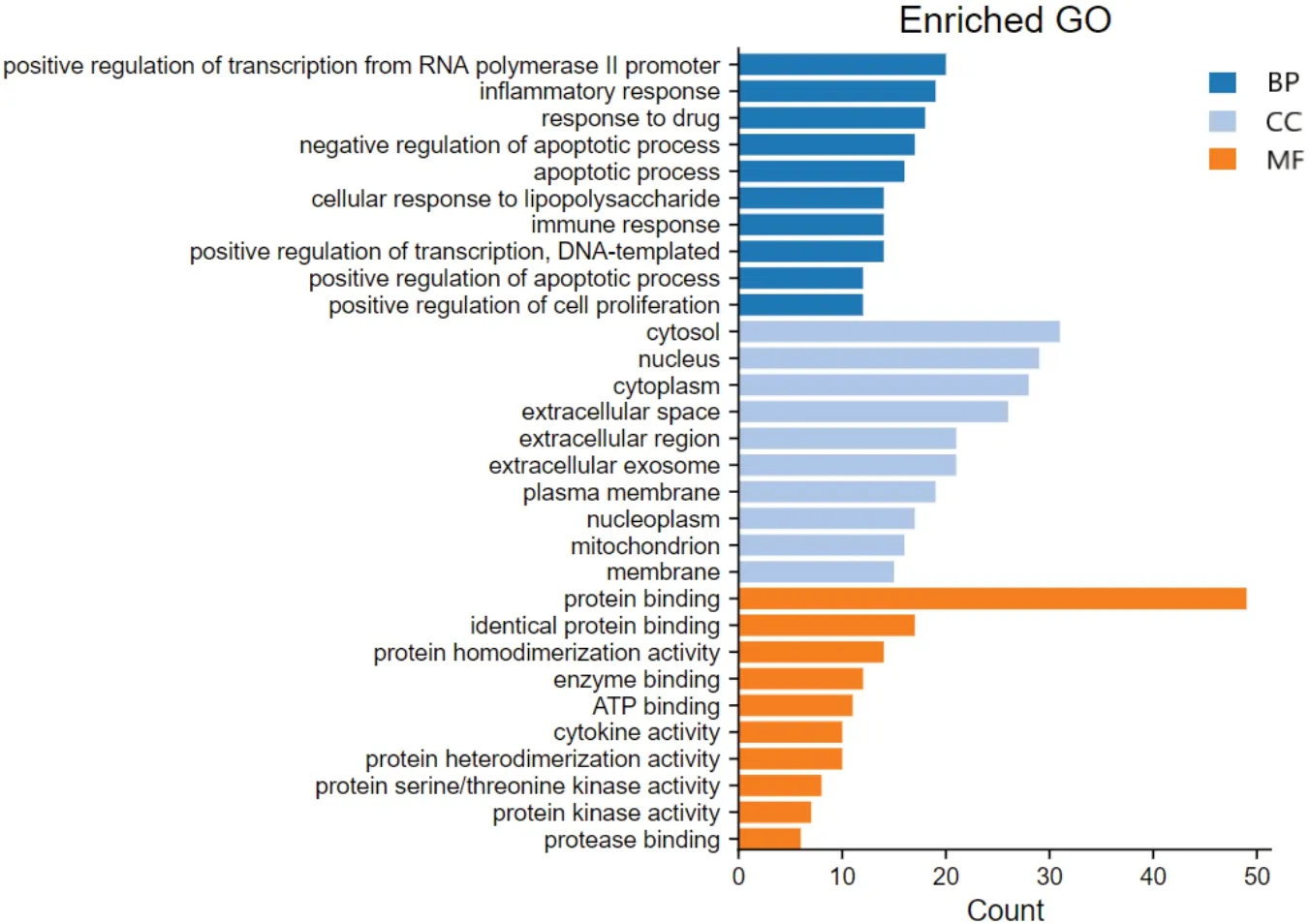
图3 息痛散治疗痛风性关节炎GO基因功能富集分析Fig.3 GO enrichment analysis of Xitongsan in the treatment of gouty arthritis
对158 个潜在治疗靶点进行KEGG 通路分析,结果显示118 条(P<0.01)富集分析结果与息痛散治疗痛风性关节炎的作用机制相关,选取P值较小的20条通路并通过绘制相应气泡图,如图4所示,Y 轴代表代表通路名称,X 轴代表所占百分比,气泡面积代表通路富集基因数,气泡颜色代表P 值的大小。158个治疗靶点主要富集在PI3K/Akt 信号通路、肝炎病毒、TNF 信号途径等发挥抑制炎症反应、调节免疫的作用。
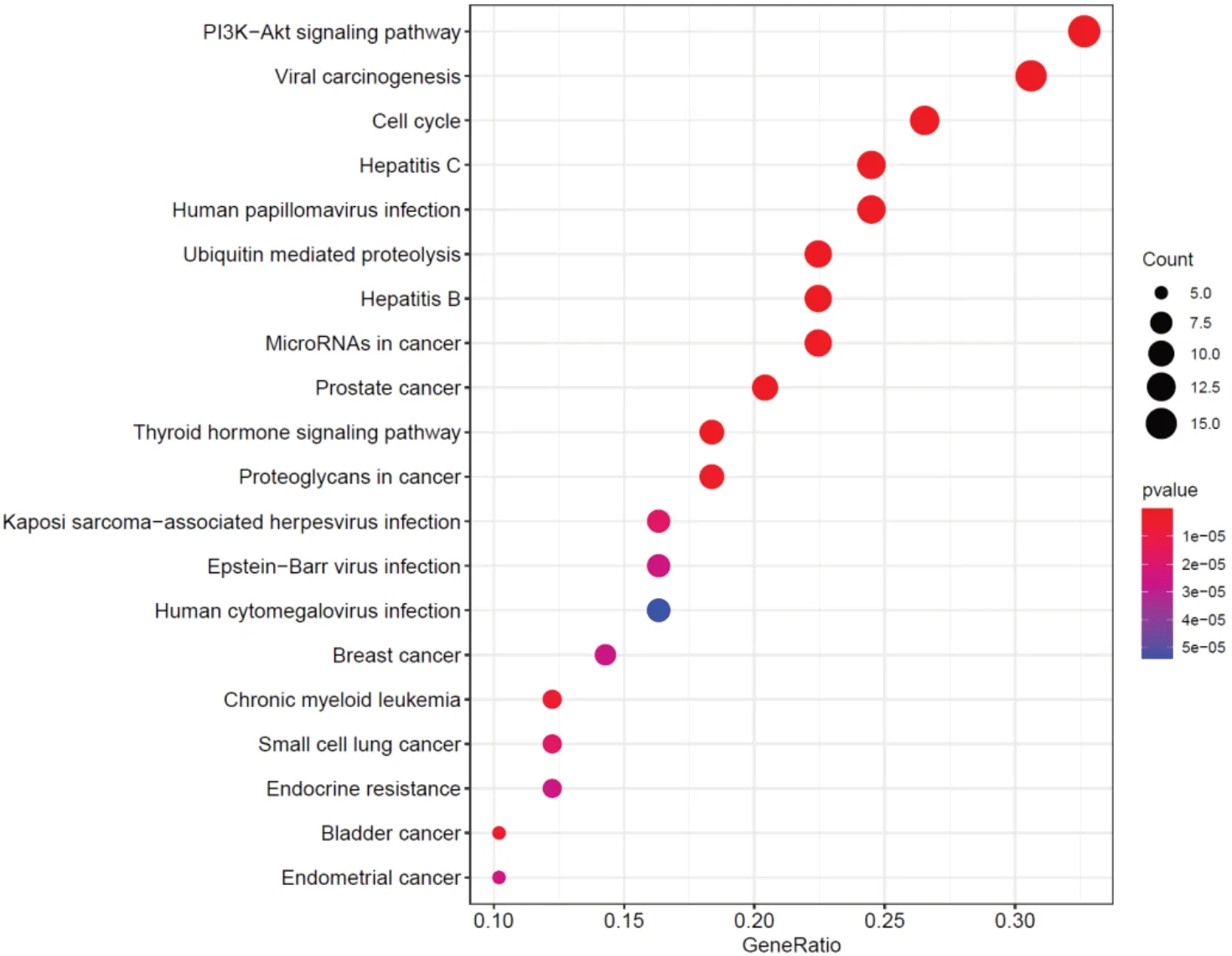
图4 息痛散治疗痛风性关节炎KEGG通路富集的气泡图Fig.4 KEGG enrichment bubble diagram of Xitongsan in the treatment of gouty arthritis
2.5 分子对接
选取PPI 网络中排名前3 的靶蛋白(NTRK1、APP、TP53)与图1中degree值前3的活性成分槲皮素(quercetin)、β - 谷甾醇(beta-sitosterol)、豆甾醇(stigmasterol),利用AutoDock Vina 软件进行分子对接,结果见表2、图5。从图5可看到靶蛋白与分子的具体结合位点,黄色虚线为两者之间的氢键作用力,这是促使分子结合到活性位点的主要作用力。

图5 槲皮素和NTRK1(a)、APP(b)、TP53(c)的分子对接Fig.5 Molecular docking of quercetin with NTRK1(a),APP(b)and TP53(c)
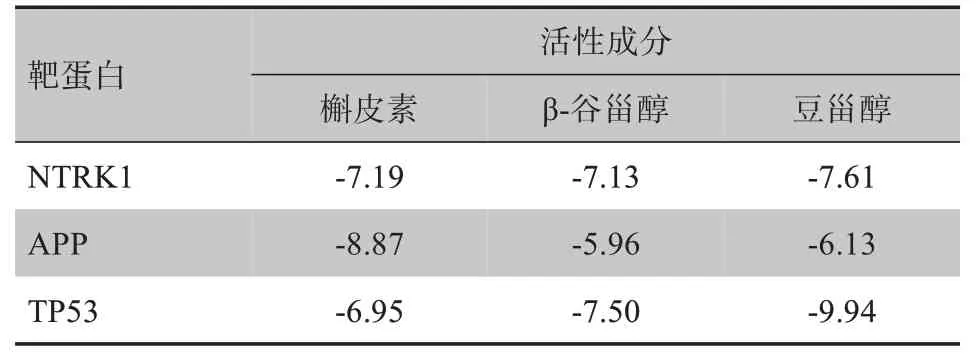
表2 分子对接结果∆G(kcal∙mol-1)Tab.2 Molecular docking results ∆G(kcal∙mol-1)
2.6 息痛散对痛风性关节炎大鼠踝关节滑膜组织PI3K、p-Akt及mTOR蛋白表达的影响
由图6可知,与空白对照组比较,模型对照组大鼠踝关节滑膜组织PI3K、p-Akt 及mTOR 蛋白表达水平明显上调(P<0.05)。经息痛散和秋水仙碱干预后,与模型对照组比较,PI3K、p-Akt 及mTOR 蛋白表达水平显著上调(P<0.05)。息痛散和秋水仙碱组之间差异无统计学意义。
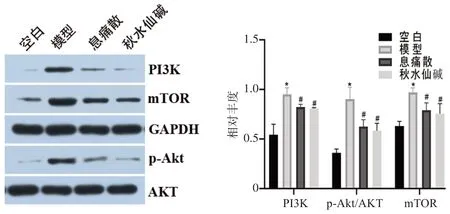
图6 息痛散对痛风性关节炎大鼠中踝关节滑膜组织PI3K、p-Akt及mTOR蛋白的影响Fig.6 Effects of Xitongsan on PI3K,p-Akt and mTOR proteins in synovial tissue of ankle joint in rats with gouty arthritis
3 讨论
痛风性关节炎属于中医“痹病”范畴[22],主要与素体禀赋不足,或调摄不慎,长期嗜欲膏粱厚味,日久导致脾胃运化失常,湿热内蕴有关,患者的症状往往呈现持续反复波动的特点。祖国医学经过数千年的发展,在治疗痛风方面有悠久的历史和丰富的临床经验,尤其在临床治疗方面,效果肯定且毒副作用相对较少,在该病的治疗中显示出优势。因此,结合中医理论,积极寻找开发抗痛风和改善炎症作用的中草药制剂具有重要的意义。
本研究共筛选出息痛散化合物936 个,活性成分146 个,潜在作用靶点2 129 个,通过PPI 与痛风性关节炎重合靶点158个,说明息痛散治疗痛风性关节炎具有多成分、多靶点的特点。
通过筛选息痛散中的主要有效成分并构建成分与作用靶点互作网络及药物-化合物-作用靶点与痛风性关节炎互作网络,根据主要活性成分的关联度,明确核心化合物主要有槲皮素、β-谷甾醇、豆甾醇、山奈酚、黄柏黄酮II、异鼠李素等,其中大部分化合物具有抗炎和调节免疫的作用。其中槲皮素度值最大,靶点数最多,槲皮素是一种广泛存在于水果、蔬菜、植物中的黄酮类化合物,具有良好的抗炎和免疫调节等药理学作用,据报道槲皮素等几种黄酮可减少病毒诱导的噬菌斑和RNA 复制,而对宿主细胞的细胞毒性作用可忽略不计[23]。吴柳等[24]通过实验发现槲皮素可通过上调PI3K/AKT/mTOR 通路降低脓毒症小鼠心肌组织炎症和氧化应激反应,从而减轻心肌损伤。此外国内学者亦指出槲皮素对多种细菌及病毒具有抑制作用,阻断其进入细胞内,并对病毒的血凝素蛋白存在较高的亲和力,从而抑制溶血反应,减少炎症反应[25-26]。植物甾醇是一类具有天然生物活性的甾体化合物,曾被誉为“生命钥匙”参与细胞内各种生命活动,其中含量最丰富的为β-谷甾醇、豆甾醇等。多项研究表明β-谷甾醇具有免疫调节、抗炎的作用[27]。Paniaguaperez 等[28]通过研究β-谷甾醇对小鼠胸膜炎、足肿胀、耳水肿、髓过氧化物酶活性的作用,发现β-谷甾醇作用后小鼠足肿胀、耳水肿被抑制70%以上,胸膜炎渗出液减少46%、中性粒细胞数减少32%,提示β-谷甾醇具抗炎作用。Liao等[29]发现β-谷甾醇可通过抑制巨噬细胞中炎症小体NLRP3 的激活而抑制MAPK 信号通路的活化,导致细胞中的TNF-α、IL-6、IL-8 等炎症因子生成显著减少,从而起到抗炎作用。国外学者发现富含β-谷甾醇的西班牙饲料添加剂可使猪外周血单核细胞数量增加,树突状细胞激活,进而调节免疫反应[30]。此外豆甾醇[31]、山奈酚[32]、异鼠李素[33]作为息痛散的有效成分,可通过抑制体内补体系统的激活而发挥抗炎作用。由上可知,息痛散中筛选出的活性化合物主要有免疫调节、抗炎等作用,因此可能对痛风性关节炎病毒引发的炎症反应有一定干预效应。
通过Cytoscape3.7.2软件构建息痛散治疗痛风性关节炎的PPI网络,发现其关键靶点为NTRK1、APP、TP53、CUL3、CDK2、MCM2、XPO1、ESR1、UBC、EGFR、TNF、IL6、TP53、ALB、MAPK3。大致可分为3 类,即炎症因子、丝裂原活化蛋白激酶(MAPK)及其他。炎症因子主要有TNF、IL-6、IL-10、CXCL8、IL1B、趋化因子2(CCL2)等。研究表明痛风性关节炎患者在初期血清中多种相关细胞因子升高,包括IL-1、IL-7、IL-8、IL-9、IL-10 及TNF-α 等[34]。此外,相比轻症患者,重症患者血浆中IL-2、IL-7、IL-10、GCSF、IP10、MCP1、MIP1A 和TNF-α 等相关细胞因子升高[35]。国内学者观察到痛风性关节炎患者体内亦出现了IL-6、TNF-α、TNF-γ 等细胞因子显著升高,IL-6、TNF-α细胞因子拮抗剂等具有治疗潜力[36-37]。
现代药理研究表明息痛散中的苍术[38]、黄柏[39]、忍冬藤[40]中的相关化学成分可通过减少TNF-α 和白介素的产生和释放,下调TNF-α/IL 对机体的炎症反应,发挥对组织的保护作用。caspase-3 在细胞凋亡中起着不可替代的作用,一般认为caspase-3 是细胞凋亡过程中最主要的终末剪切酶。研究表明槲皮素可降低炎症小鼠模型caspase-3 水平,缓解炎症所致病理学改变。MAPK1、MAPK8 和MAPK14 属于MAPK 家族,涉及MAPK 信号通路中2 条途径,均遵循3 级酶促级联反应,在细胞因子、神经递质等激活后具有调节细胞炎症反应、肿瘤细胞增殖与分化的作用[41]。
GO功能富集分析得到GO条目440个(P<0.01),KEGG 通路富集分析筛选得到118 条(P<0.01)信号通路。GO 富集涉及调节炎症反应、免疫应答、药物反应及细胞凋亡等生物学过程。KEGG 通路富集分析显示在靶点富集中多数通路与炎症相关,包括乙型肝炎、百日咳、利什曼病、丙型肝炎等,预示着息痛散通过作用于相关靶点抗炎,从而达到治疗痛风性关节炎的效果。GO 和KEGG 富集分析的结果主要集中于感染,并涉及TNF 信号通路、PI3K-Akt信号通路、HIF-1 信号通路以及T 细胞受体信号通路等。肿瘤坏死因子(TNF)家族的受体和配体在免疫应答过程中控制淋巴细胞激活和存活中起重要作用。特定TNF 受体(TNFR)家族成员在抗炎免疫中的作用取决于免疫反应的阶段,并且可能随炎症类型而变化。炎症过程中在CD8(+)T 细胞上突出表达的TNFR 家族的4 个成员,即4-1BB(CD137)、CD27、OX40(CD134)、GITR,在炎症初期有促进CD8(+)T 细胞增殖的作用,因而产生大量的促炎因子,从而导致急性损伤[42-43]。Toll 样受体位于NF-κB 通路上游,研究表明TLR1、TLR2、TLR4 和TLR7 与炎症的发病机制有关[44]。
PI3K/Akt 通路是参与调节机体炎症、坏死及凋亡等的重要信号通路[45]。本研究结果表明:模型组大鼠踝关节滑膜组织中PI3K、p-Akt、mTOR蛋白水平显著增加,进而促进大量的炎性细胞因子表达,产生炎症级联反应。给予息痛散治疗后,可显著降低PI3K、p-Akt、mTOR 蛋白的表达,表明息痛散可下调PI3K/Akt信号通路,进而抑制下游炎症因子的表达。
痛风性关节炎发病率正在逐年升高,但治疗缺乏理想药物。目前临床使用的西药治疗此类疾病不良反应明显且价格昂贵。近年来,运用传统中医药理论,充分发挥中医药的独特优势,积极寻找有效治疗痛风性关节炎的中药制剂[46]。息痛散中所含的槲皮素、β-谷甾醇、豆甾醇、山奈酚、黄柏黄酮II、异鼠李素可能是其治疗痛风性关节炎的主要活性成分,作用靶点为NTRK1、APP、TP53、CUL3、CDK2、MCM2、XPO1、ESR1、UBC、EGFR、TNF、IL6、TP53、ALB、MAPK3 等。功效涉及的信号通路包括PI3K/Akt 信号通路、TNF 信号通路、PI3K-Akt 信号通路等。本研究通过网络药理学、分子对接和基础实验相结合的方法,确认息痛散治疗痛风性关节炎的活性成分、关键靶点和信号通路,并基于Western Blot 手段进行初步验证。本研究为息痛散治疗痛风性关节炎机制研究提供了理论依据和线索,为息痛散的临床用药及本课题组后续深入的研究提供重要理论依据和方向,其预测结果还待进一步实验验证。

