质子泵抑制剂导致的急性泛发性发疹性脓疱病:基于真实世界的药物警戒研究
赵 喆,王 涛,唐 彦,陈晓光,赵 彬
中国医学科学院 北京协和医学院 北京协和医院 1药剂科 3皮肤科,北京 100730 2中国医学科学院 北京协和医学院 药物研究所,北京 100050
质子泵抑制剂(proton pump inhibitors,PPIs)是一类强效抑制胃酸分泌的药物,其通过抑制胃壁细胞表面的质子泵(H+-K+-ATP酶)而阻碍氢离子排向胃腔,发挥抑制胃酸分泌的作用,这种作用具有选择特异性及持续性[1]。PPIs主要用于消化道溃疡、胃食管反流、幽门螺杆菌感染等疾病的治疗,以及预防或治疗由非甾体类抗炎药引起的胃十二指肠溃疡[2]。急性泛发性发疹性脓疱病(acute generalized exanthemat-ous pustulosis,AGEP)是由药物导致较罕见的急性发热发疹性疾病,临床表现为在皮肤水肿性红斑的基础上出现大量非毛囊性、浅表性无菌性脓疱,并伴有发热及外周中性粒细胞增多。该病具有自限性,皮疹于停药1~2 周后可自行消退,致死率较低,其常见的致病药物包括抗生素、钙离子通道阻滞剂及抗疟疾药物等[3]。PPIs导致的AGEP最早由兰索拉唑诱发[4],随后奥美拉唑[5]、泮托拉唑[6]被相继报道。近年来,部分学者对PPIs诱发的AGEP进行了研究,但病例数量有限,缺乏大规模系统性安全评价[6]。
与临床随机对照试验相比,真实世界研究可提供更为直接的医疗证据,其通过归纳大量的临床数据,不仅能对临床试验进行合理补充,发现未被满足的医疗需求,还可为临床试验设计提供理论依据,并提高其效率[7],且真实世界研究在上市后药物安全评估和药物警戒中发挥重要作用[8-9]。本研究通过对美国食品药品监督管理局不良反应报告系统(Food and Drug Administration’s adverse events reporting system,FAERS)进行数据挖掘,探讨真实世界中不同PPIs与AGEP发病风险的关联性,并对AGEP发病时间及患者预后进行分析,旨在为临床合理用药提供参考依据。
1 资料与方法
1.1 数据来源
检索2004年1月至2020年6月FAERS数据库中PPIs/AGEP相关的数据。FAERS包含8个子数据集:人口统计信息(DEMO)、药物信息(DRUG)、不良事件(REAC)、患者结局(OUTC)、报告来源(RPSR)、治疗(THER)和用药指征(INDI)。共检索到报告 14 570 082 份,根据FDA推荐的方法进行去重(具有相同的CASEID,选择最新的FDA_DT;CASEID和FDA_DT均相同时,选择较大的PRIMARYID),数据筛查去重后,再对相关药品和不良反应进行检索。
1.2 检索方法
依据MICROMEDEX®(Index Nominum),对所涉及的PPIs药物的通用名及商品名进行规范化整理,并作为检索词。使用国际医学语词典(Medical Dictionary for Regulatory Activities,MedDRA)中的首选术语(preferred term,PT)“Acute generalised exanthematous pustulosis”(代码:10062372)和“Photoinduced acute generalized exanthematous pustulosis”(代码:10070477)作为检索词,从而对数据库中药品和不良反应字段进行数据映射。
1.3 数据挖掘
应用比例失衡测量法及贝叶斯法的基本原理,采用报告比值比(reporting odds ratio,ROR)、比例报告比值比(proportional reporting ratio,PRR)、贝叶斯置信传播神经网络法(Bayesian confidence propagation neural network,BCPNN)以及多项伽玛泊松分布缩减法(multi-item gamma poisson shrinker,MGPS)对PPIs与AGEP的关联性进行评估,4种算法的公式及信号检测标准见表1[10-12]。

表1 PPIs与AGEP关联性评估的算法公式及信号检测标准
1.4 AGEP的发病时间及预后结局
收集不同PPIs导致AGEP的发病时间及死亡、住院等结局信息。发病时间为EVETN_DT(不良事件发生日期)和START_DT(PPI开始使用日期)之差。处理过程中,注意剔除录入错误(如EVETN_DT早于START_DT)和数据缺失的记录。
1.5 偏倚控制
采取以下措施控制偏倚:(1)数据预处理时,检查数据完整性及一致性,对噪音数据进行处理;(2)通过数据映射减少上报偏倚;(3)利用多种信号检出方法评估PPIs与AGEP的关联性,以避免数据库中混杂因素对结果的影响。
1.6 统计学处理
采用SPSS 20.0软件进行统计分析。AGEP患者的基本特征,如年龄、应用的PPIs药物种类、用药指征等计数资料以频数(百分数)表示;不同PPIs导致AGEP的发病时间符合偏态分布,以中位数(四分位数)表示,组间比较采用Kruskal-Wallis检验或Mann-WhitneyU检验;不同PPIs导致AGEP的死亡比例和住院比例的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
2004年1月至2020年6月FAERS数据库共报告PPIs相关不良事件192 406例,AGEP相关不良事件4176例,最终162例PPIs导致的AGEP患者纳入本研究(图1)。其中男性74例(45.68%),女性73例(45.06%),15例(9.26%)性别信息缺失,平均年龄为(59.38±19.66)岁;各年龄段均有病例分布(图2);大部分病例来自欧洲,其次来自北美洲(表2)。2004至2020年,PPIs导致的AGEP病例整体呈增多趋势,但波动较大,以2019年病例数最多(图3)。

图3 PPIs导致的AGEP患者报告年份分布折线图PPIs、AGEP:同表1

表2 PPIs导致的AGEP患者临床基本特征

图1 FAERS数据库中PPIs导致AGEP病例筛选流程图DEMO:人口统计信息;DRUG:药物信息;REAC:不良事件;FAERS:美国食品药品监督管理局不良反应报告系统;PPIs、AGEP:同表1

图2 PPIs导致的AGEP患者年龄分布特征PPIs、AGEP:同表1
PPIs药物主要为奥美拉唑,其次为埃索美拉唑、泮托拉唑。用药指征方面,主要为胃食管反流病,其次为预防用药。
2.2 PPIs与AGEP的关联性分析
2.2.1 不同PPIs与AGEP的关联性
基于失衡测量法及贝叶斯法4种算法及信号检测标准对5种PPIs导致的AGEP进行评价。发现泮托拉唑与AGEP的关联性最强;其次为奥美拉唑和兰索拉唑,埃索美拉唑与AGEP的关联性较弱(雷贝拉唑导致的AGEP病例数较少,暂不分析),见表3。
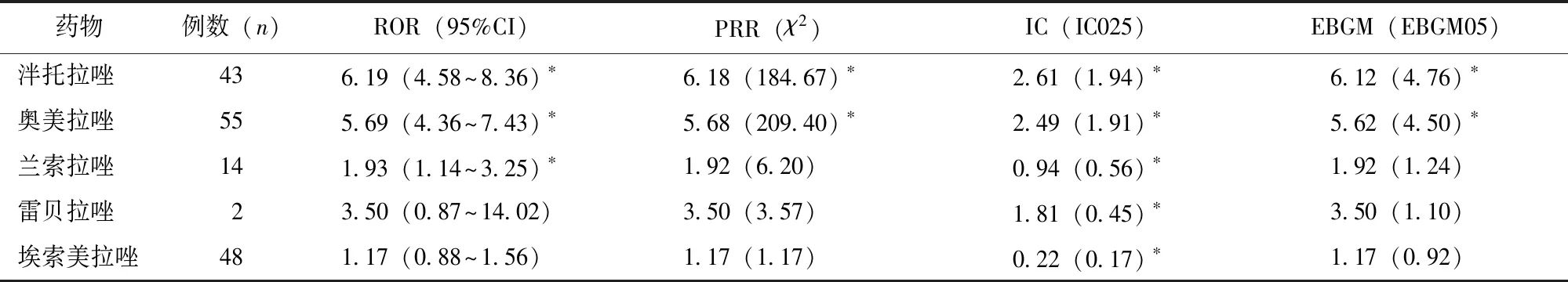
表3 不同PPIs与AGEP的关联性
2.2.2 PPIs导致的AGEP患者发病时间
PPIs导致的AGEP患者发病时间的中位数为6(2,12)d,其中奥美拉唑2(2,8.5)d、埃索美拉唑¥9(5.5,18)d、兰索拉唑9(7,12)d、泮托拉唑3(2,9.75)d,不同PPIs导致的AGEP发病时间无显著性差异(P=0.133)。除雷贝拉唑外,60.00%~83.33%的患者于用药后10 d内发病(图4)。
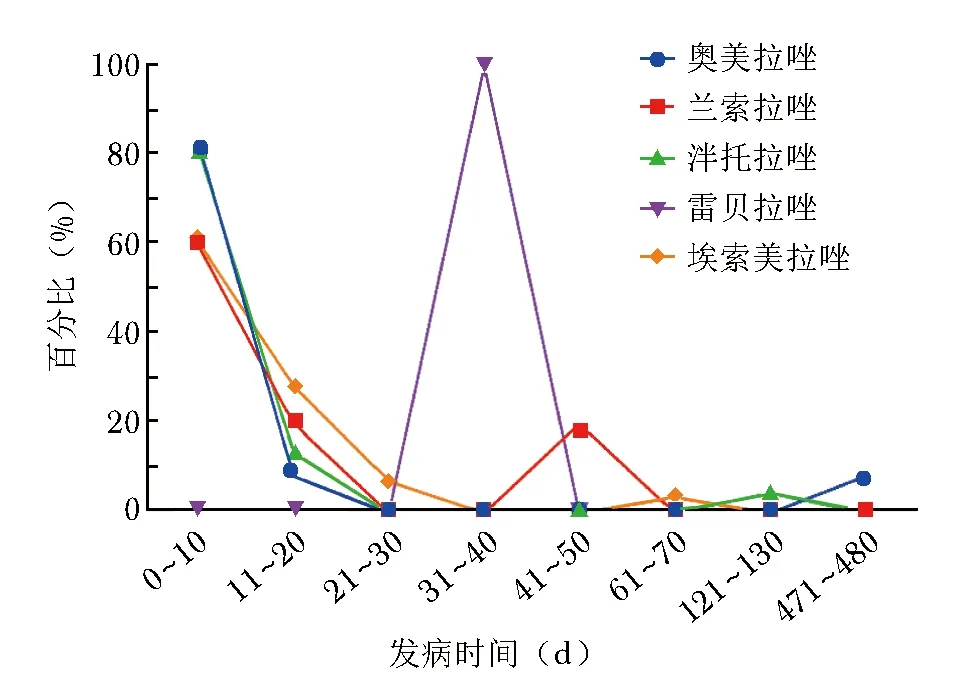
图4 不同PPIs导致的AGEP患者发病时间分布PPIs、AGEP:同表1
2.2.3 PPIs导致的AGEP患者预后
3例(1.86%)患者死亡(兰索拉唑1例,埃索美拉唑2例),128例(79.50%)患者需住院治疗。除雷贝拉唑外,其余PPIs导致的AGEP患者住院比率存在显著差异(P<0.001),以埃索美拉唑导致的AGEP患者住院比率最高(91.49%,43/47,失访1例),其次为泮托拉唑(88.37%,38/43)、兰索拉唑(85.71%,12/14),奥美拉唑(61.82%,34/55)最低。
3 讨论
本研究结果显示,PPIs导致的AGEP患者中,服用的药物主要为奥美拉唑(33.95%),其次为埃索美拉唑(29.63%)、泮托拉唑(26.54%);基于失衡测量法及贝叶斯法的关联性结果显示,除雷贝拉唑外,60.00%~83.33%的患者于用药后10 d内发生AGEP,且以泮托拉唑与AGEP的关联性最强,其次为奥美拉唑和兰索拉唑,埃索美拉唑与AGEP的关联性较弱。除雷贝拉唑外,其余PPIs导致的AGEP患者住院比率均存在显著差异,以埃索美拉唑导致的AGEP患者住院比率最高(91.49%),其次为泮托拉唑(88.37%)、兰索拉唑(85.71%),奥美拉唑(61.82%)最低。
PPIs的不良反应主要有肝肾损害、视觉损害、消化系统损害以及血液系统损害等,极少发生超敏反应(0.2%~0.8%)[13]。Bose等[14]研究发现,由PPIs导致的超敏反应中,绝大部分(86%)是由IgE介导的速发型(Ⅰ型)超敏反应,而仅有14%是由T细胞介导的迟发型(Ⅳ型)超敏反应。近期,有研究者对27例因使用PPIs而发生超敏反应的患者进行了体外淋巴细胞激活试验,发现其外周血细胞释放的穿孔素水平明显高于正常人[15],提示PPIs可以导致迟发型超敏反应的发生。AGEP是一种主要由药物引发的较罕见的急性发热性疾病,其发病机制至今尚未阐明,有研究认为该病是一种由T细胞介导的迟发型超敏反应[16],但相关研究较少,需进一步证实。
药物警戒研究是一项发现、理解、评价并预防药物不良反应的科学研究,其目的在于提升用药安全性和临床合理用药水平。目前,药物警戒研究的难点在于如何获取全面的基于真实世界的药物不良反应数据,并对其进行深入挖掘,从而为临床决策提供理论支持。本研究基于FAERS数据库,并采用失衡测量法及贝叶斯法进行数据挖掘,以探究真实世界中PPIs使用与AGEP的关联性,并进一步比较不同PPIs导致的AGEP发病时间与预后,为临床合理用药提供参考。
本研究结果发现,在FAERS数据库中,2004至2020年PPIs导致的AGEP病例整体呈增多趋势,但波动较大,以2019年病例数最多(22.22%),可能与近年来PPIs广泛使用相关。值得注意的是,绝大多数病例由专业人员上报(85.81%),而患者报告的病例仅占3.70%,提示报告的可信度较高。各年龄段均有病例报告,与AGEP流行病学研究结果相近[17];患者性别方面,尽管有研究报道AGEP病例中女性发病率偏高[18-20],但多数研究认为AGEP发病无明显性别差异[21]。本研究AGEP患者男女发病率分别为45.68%、45.06%,其比例接近1∶1,符合既往报道结果。此外,62.96%的患者PPIs药物使用指征不明确,亦提示可能存在PPIs的不合理使用[22-23]。
本研究进一步采用失衡测量法及贝叶斯法进行数据挖掘,分析了不同PPIs与AGEP的关联性。结果显示在5种PPIs中,以泮托拉唑与AGEP的关联性最强,其次为奥美拉唑和兰索拉唑,埃索美拉唑与AGEP的关联性较弱。泮托拉唑、奥美拉唑及兰索拉唑导致的AGEP在其他个案报道或者回顾性研究中均有提及,其中奥美拉唑的病例报道数最多[5,24]。药代动力学研究表明,泮托拉唑在所有PPIs中具有最高的血药浓度-时间曲线下面积和较强的肝药酶抑制能力[2,25],这些特点可能造成其相对更易引起AGEP,但确切机制仍需进行深入研究。
本研究中各种PPIs导致的AGEP发病时间无显著差异,多数服药者在用药10 d内出现AGEP相关症状,这与AGEP发病急骤的临床特征相吻合[21],提示在服用PPIs初期即应对患者体温变化及有无皮损进行监测。少数患者在长期使用PPIs过程中发生AGEP,提示对于长期使用PPIs的患者,仍需警惕后续发生AGEP的可能,并严格评估药物长期使用的必要性。
AGEP是自限性疾病,停药后病情可自行缓解,死亡率极低[26]。本研究仅3例(1.86%)患者死亡,亦说明AGEP致死风险较低。但本研究结果显示,79.50%的患者需住院治疗,其中以埃索美拉唑导致的住院比率最高(91.49%),此外,由兰索拉唑和泮托拉唑导致的AGEP患者住院比率也均超过85%,提示虽然AGEP致死率不高,但若症状严重,如持续发热,皮损广泛、高龄、多系统受累或免疫受损时,则需住院治疗并给予液体、电解质及营养支持[21]。奥美拉唑引起的住院比率显著低于埃索美拉唑、兰索拉唑和泮托拉唑,可能与奥美拉唑具有较低的生物利用度和血药浓度-时间曲线下面积相关[2]。
本研究是首个基于真实世界数据有关PPIs导致AGEP的药物警戒研究,有助于为临床合理用药提供参考。但本研究亦存在一定局限性:第一,FAERS数据库可能存在漏报、信息不准确或缺失,且由于此数据库缺乏患者既往史、过敏史等信息,故无法完全排除其他疾病的影响;第二,该数据库仅包含出现不良反应的患者,缺乏患者总数,导致无法获取疾病发生率等数据;第三,媒体的关注度及研究报道会对不良事件的上报产生影响[27]。尽管存在如上局限性,但本研究仍然能够展示PPIs导致AGEP的大量关键信息,为相关药物警戒的持续监测提供可能。
综上,不同的PPIs与AGEP发病的关联性、发病时间及预后存在差异,临床医生需高度警惕使用PPIs导致的AGEP发病风险,针对不同药物的特点进行个性化监测。
作者贡献:赵喆负责数据分析及论文撰写;赵彬负责研究设计及数据挖掘;王涛、唐彦负责数据资料整理;陈晓光负责部分图表绘制。
利益冲突:无

