基于游离质粒的木糖诱导型枯草芽孢杆菌转化体系的建立及其应用
田辉,王帅,刘波
中国农业科学院生物技术研究所,北京100081
枯草芽孢杆菌(Bacillus subtilis)是一类通常被认为安全的(generally recognized as safe,GARS)革兰氏阳性菌,因其具有培养条件简单、分泌系统良好、不含内毒素等特点,广泛用于食品加工、药物研制、工程酶生产等方面[1−2]。B.subtilis168于1997年完成全基因组测序[3],为从分子水平上研究B.subtilis提供了可靠的信息平台。便捷的遗传转化体系是实现B.subtilis基因操作技术的关键,目前,B.subtilis主要的转化方法包括以下几种方法。①原生质体转化法[4]。原生质体是在溶菌酶作用下芽孢杆菌消除细胞壁后的细胞,在聚乙二醇(polyethylene glycol)介导下,促进细胞膜对外源DNA的吸附,进而完成转化;②自然感受态法[5]。通过控制芽孢杆菌的培养条件,将枯草芽孢杆菌从营养丰富的培养基中转接至营养贫瘠的培养基中,生长到特定的生长阶段,形成感受态;③电击转化法[6]。在瞬时的电脉冲下,菌体上形成小孔,使DNA分子进入。这些方法普遍流程繁琐,对操作技术要求极高,难以大面积推广。
芽孢杆菌的自然感受态是细胞易于吸收外源DNA的一个特定理化状态[7],主要由ComX和CSF信息素组成的菌体密度感应网络介导[8−10],其中ComK是一个全局调控因子,能激活晚期感受态形成相关基因的表达,主要包括ComC、ComE、ComF等DNA转运蛋白,参与DNA断裂降解过程的核酸酶NucA以及重组交换相关的蛋白RecA、AddB等[11−12],comK仅在严格的培养环境以及菌体生长阶段才开始转录[13],当ComK在胞内达到一定的阈值时,细胞即成为感受态。因此,comK的定量表达是细胞自然感受态形成的关键,并在B.licheniformis[14]以及B.pumilus[15]中得到应用,Zhang等[16]在枯草芽孢杆菌B.subtilis1A751菌株lacA位点,以红霉素抗性筛选标记,整合1个木糖诱导启动子调控的Pxyl-comK表达盒,建立了该菌株高效转化体系,对于质粒转化高达1×104CFU·μg−1。然而在基因组上整合一个诱导细胞感受态形成的元件存在两个弊端:①菌株增加额外选择性标记(通常为抗生素抗性基因);②木糖诱导启动子Pxyl存在一定的渗漏转录进而使comK持续表达,细胞内comK表达量本底高,导致细胞长期处于自然感受态状态,从而吸收环境(培养基)中DNA片段并可能整合到染色体上,致使细胞性状发生改变。因此,诱导感受态形成后,再消除感受态形成的元件可有效保障细胞性状稳定性。
本研究通过在E.coli和B.subtilis穿梭质粒pUBC01上引入Pxyl调控comK表达的元件,将其以游离质粒的形式导入B.subtilis并获得重组菌株B.subtilisK1,通过木糖诱导时间的摸索与质粒消除等手段,确定该菌株最优的转化条件以及建立Pxyl⁃comK元件灵活的移除方法,以期在B.subtilis中创建一套便捷高效、不残留筛选标记、不影响菌株稳定性的遗传转化体系。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒B.subtilisWB600为本实验室保存;B.subtilisSCK6购自美国Bacillus Genetic Stock Center(BGSC);大肠杆菌E.coliTop10感受态细胞购自康为世纪有限公司;含有质粒pUBC01的B.subtilisWB600-01为本实验室保存;质 粒pUBC01[17]为 本 实 验 保 存;质 粒pHY300-p43-egfp是 由 质 粒pHY300-PLK[18]骨架 上添加有p43-egfp表达盒[19]构建获得,为实验室保存;pUBC01-Pxyl-comK为本实验室构建;研究中所使用的引物详见表1。
1.1.2 试剂与仪器高保真DNA聚合酶以及无缝克隆试剂盒购于南京诺维赞技术有限公司;琼脂糖购自莫纳生物科技有限公司;琼脂糖凝胶DNA回收试剂盒及质粒小提试剂盒购自天根生化科技(北京)有限公司;限制性内切酶AscⅠ、PacⅠ购自赛默飞世尔科技(中国)有限公司;卡那霉素和四环素购自北京索莱宝科技有限公司;引物均由生工生物工程(上海)股份有限公司合成;其他试剂均为进口或国产分析纯。
PCR仪及基因电击导入仪(Bio-Rad公司);立式冷冻离心机(HITACHI公司);电泳仪(北京君意东方电泳设备有限公司);凝胶成像分析系统(天能科技有限公司);恒温金属仪(杭州奥盛仪器有限公司);恒温培养箱(上海一恒科技有限公司);恒温培养振荡器(上海旻泉仪器有限公司);紫外可见分光光度计(上海尤尼科仪器有限公司);蓝光透射仪[天根生化科技(北京)有限公司]。
1.1.3 培养基及相关试剂LB液体培养基(固体添加2%琼脂粉):1%蛋白胨、0.5%酵母膏、1%氯化钠,121℃灭菌;碘液:2 g碘化钾,1 g碘,将碘化钾溶于少量水中,全部溶解后再加碘,搅拌充分溶解后,加水定容至300 mL,避光保存。
1.2 研究方法
1.2.1 质粒pUBC01-Pxyl-comK的构建以B.sub⁃tilisSCK6基因组为模板,引物PxylF/TTRR扩增Pxyl-comK表达盒,将其扩增片段凝胶回收后,重组法连入AscⅠ和PacⅠ同时酶切后的pUBC01质粒,热激转化E.coliTop10感受态,涂布含有50 μg·mL−1卡那霉素的LB平板,过夜培养。用质粒上引物01seqF/01seqR,进行菌液PCR验证,取阳性转化子的菌液送生工生物工程(上海)股份有限公司测序,选取测序正确的菌株,用质粒小提试剂盒提取pUBC01-Pxyl-comK质粒。采用高渗法[6]转化B.subtilisWB600,得到菌株B.subtilisK1。

表1 研究所用引物列表Table 1 List of primers used in research
1.2.2B.subtilisK1的优化分别挑取含有质粒pUBC01的B.subtilisWB600-01和 含 有 质 粒pUBC01-Pxyl-comK的B.subtilisK1菌株,置于含有20 μg·mL−1卡那霉素的50 mL LB液体培养基中,37℃,220 r·min−1,过夜培养,分别将菌液按5%的比例转接至新鲜的含有20 μg·mL−1卡那霉素的100 mL LB液体培养基中,B.subtilisWB600-01转接1组,B.subtilisK1转接2组(每组设3个平行)。培养OD600至1.0左右时,在B.subtilisWB600-01以及B.subtilisK1其中1组中添加木糖至终浓度为1%(质量体积比分数),B.subtilisK1的另一组不添加木糖。每隔1 h取出100 μL新鲜的培养液,添加100 ng的pHY300-P43-egfp质粒,37℃,220 r·min−1,共培养1.5 h,涂布含有10 μg·mL−1四环素的LB平板,37℃,倒置培养,次日统计转化子数目。挑取转化子于450 μL LB(含有10 μg·mL−1四环素)的EP管中,37℃,220 r·min−1,培养3 h,置于蓝光透射仪下观察荧光。
1.2.3 质粒pUBC01-Pxyl-comK的消除分别取含有pHY300-P43-egfp质粒的B.subtilisK1菌株的100 μL菌液,于含有10 μg·mL−1四环素的5 mL LB培养液中,以及同时含有10 μg·mL−1四环素和20 μg·mL−1卡那霉素的5 mL LB培养液中,在2类LB培养液中各添加1%的木糖,培养12 h后,稀释涂布于对应抗性LB平板上,37℃倒置培养。长出单菌落后,挑取单菌,同时点接至四环素抗性(10 μg·mL−1)和卡那霉素抗性(20 μg·mL−1)LB平板,对比2个平板的菌落生长情况,同时,通过引物01seqF/01seqR验 证pUBC01-Pxyl⁃comK,引 物pHseqF/pHseqR验证pHY300-p43-egfp。
1.2.4 菌株B.subtilisK1基因敲除选择B.subti⁃lisK1的α-淀粉水解酶编码基因(amyE)作为整合位点,以B.subtilisWB600基因组为模板,用amyE-LF和amyE-LR扩 增amyE左 臂 同 源 序 列amy-L;用amyE-RF和amyE-RR扩增右臂同源序列amy-R;用Tet-F/Tet-R扩增pHY300-P43-egfp上四环素抗性表达盒Tet;同时以amyE-L,amyE-R以及Tet回收片段为模板,用引物amyE-LF/amyE-RR,通过overlap-PCR程序将上述3个片段融合成片段LTR,回收LTR片段并转化B.subtilisK1诱导感受态细胞,涂布含有10 μg·mL−1四环素LB平板,37℃倒置培养。次日,挑取转化子,用位点侧翼引物amyE-VF/amyE-VR进行PCR验证。分别挑取WB600菌株以及ΔamyE菌株,点接于含有1%淀粉的LB固体平板上,培养24 h,均匀喷洒碘液,观察水解透明圈的形成情况。
2 结果与分析
2.1 表达盒Pxyl-comK扩增以及穿梭质粒的构建
构建含有Pxyl⁃comK表达盒的穿梭质粒,在枯草芽孢杆菌中建立以游离型质粒为基础的木糖诱导感受态的遗传转化体系。以B.subtilisSCK6菌株基因组为模板,扩增Pxyl-comK表达盒,片段大小为2.4 kb(图1A),回收的片段连入pUBC01质粒,通过质粒上引物验证,pUBC01质粒对照为0.3 kb,阳性转化子为2.7 kb。挑取的4个转化子均为阳性转化子,测序正确后,将pUBC01-Pxyl⁃comK质粒电击转化B.subtilisWB600得到菌株B.subtilisK1,即完成了诱导感受态菌株的创建(图1B)。
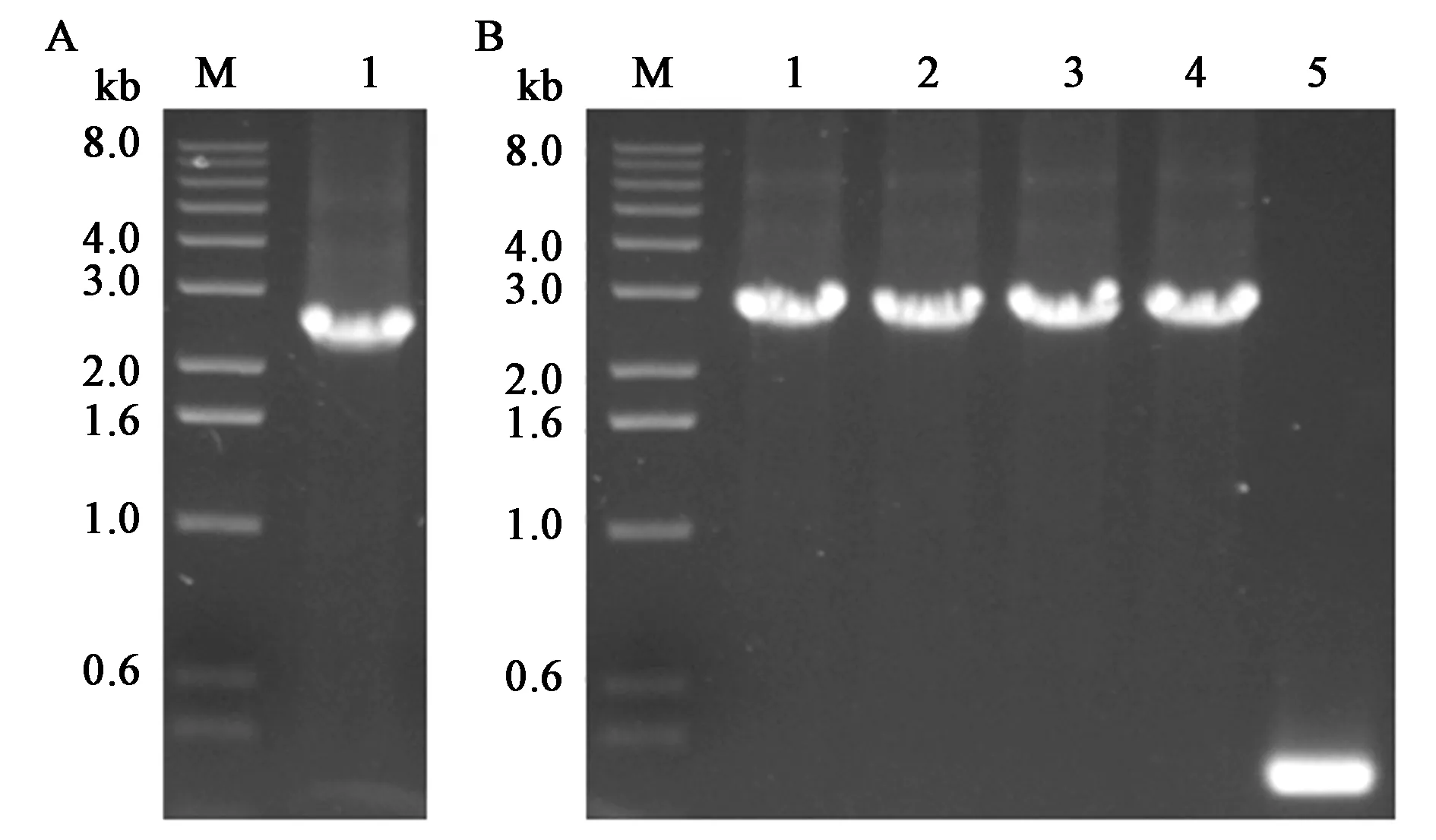
图1 Pxyl⁃comK表达盒的扩增以及pUBC01-Pxyl-comK的PCR鉴定Fig.1 Amplification of Pxyl⁃comK cassette and verification of plasmid pUBC01-Pxyl-comK by PCR
2.2 木糖诱导B.subtilis K1感受态的优化及荧光观察
含有质粒pUBC01的B.subtilisWB600-01在添加木糖和pHY300-P43-egfp质粒共培养后,未产生转化子,说明B.subtilisWB600出发菌株,在LB培养条件下,不会吸收外源DNA。对于菌株B.subtilisK1,随着木糖诱导时间的延长,pHY300-P43-egfp质粒转化效率逐步升高,在第4小时,转化效率最高,达到4.8×103CFU·μg−1;到第5~6小时,转化效率逐渐降低,可能ComK在胞内维持合适的浓度,更利于感受态的形成以及质粒转化。此外,不添加木糖的B.subtilisK1对照组,从2 h开始,有少量的转化子出现,可能是木糖诱导启动子Pxyl存在一定的本底转录而导致comK渗漏表达,促进细胞形成感受态而吸收外源DNA片段(图2)。
木糖诱导的B.subtilisK1感受态添加质粒pHY300-p43-egfp后转化效率显著提高,产生的转化子对10 μg·mL−1的四环素表现出明显的抗性。由于转化质粒上含有p43-egfp表达盒,可通过荧光检测判断阳性转化子。随机挑取的8个转化子均能产生显著的荧光,进一步证明该木糖诱导转化体系具备较高的准确性(图3)。
2.3 pUBC01-Pxyl-comK质粒的消除
由于Pxyl-comK存在微量的本底转录,有影响菌株稳定性的风险,可采取质粒消除的策略进行规避。挑取含有绿色荧光的转化子,分别在添加1%木糖的单抗或双抗LB培养液中过夜培养,稀释涂布,挑取单菌到四环素抗性LB平板上,同时,转接到卡那霉素抗性LB平板上。双抗培养条件下,挑取的单菌既能在四环素平板上生长,又能在卡那霉素平板生长,说明双抗培养能使WB600同时 保 持pUBC01-Pxyl⁃comK和pHY300-p43-egfp质粒(图4A、B)。四环素单抗培养条件下,挑取的96个单菌中,只有7个对卡那霉素有明显的抗性,即大部分菌株实现pUBC01-Pxyl⁃comK质粒成功丢失(图4C、D)。对C平板上的1~5号单菌进行PCR验证,挑取的5个单菌含有pHY300-p43-egfp质粒的扩增条带,而不含有pUBC01-Pxyl⁃comK质粒的扩增条带,与抗性实验结果一致,说明pUBC01-Pxyl⁃comK作为可移动的诱导感受态质粒,可在添加卡那霉素条件下培养,使之在B.subtilisK1稳定遗传,以便后续的遗传转化,也可完成单轮转化后使之消除,以保障菌株性状稳定(图5)。
2.4 WB600的基因amyE的敲除
为探究木糖诱导B.subtilisK1感受态可否适用于染色体基因的编辑,构建以四环素抗性基因Tet为筛选标记的PCR整合片段。分别扩增了amyE-L、amyE-R以及Tet片段,三者通过overlap-PCR融合在一起,形成LTR整合片段(图6A),回收PCR产物直接转化B.subtilisK1感受态,用位点侧翼引物amyE-VF/VR验证转化子,WB600出发菌株理论条带大小为2.1 kb,发生位点整合的转化子理论条带为2.8 kb。挑取的4个单菌的条带显著高于对照,且符合预期大小,说明PCR产物可与位点发生同源双交换整合(图6B)。amyE为α-淀粉酶,可催化淀粉水解,并通过淀粉碘液反应鉴定,该酶对应的编码序列也是芽孢杆菌中常用的整合位点[20−21]。在含有1%可溶性淀粉的LB平板上,喷洒碘液后,WB600野生型有明显的透明圈产生,而amyE敲除菌株不产生透明圈,且菌体形态较小(图7)。上述的实验结果表明该木糖诱导转化体系同样适用于对芽孢杆菌染色体的基因编辑,是一套快速便捷且完善的遗传转化体系。
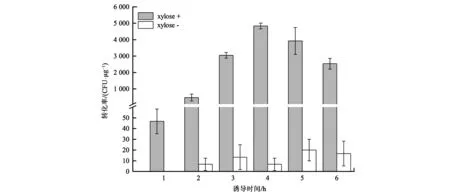
图2 B.subtilis K1菌株不同诱导时间的单位转化效率Fig.2 The transformation efficiency of strain B.subtilis K1 under different induced times
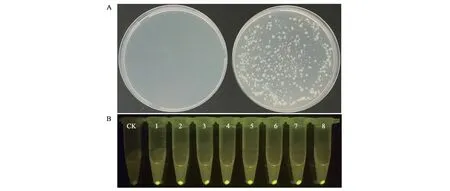
图3 转化结果以及荧光的观察Fig.3 The result of transformation and fluorescence visualization
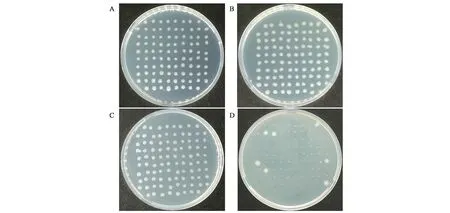
图4 抗生素抗性验证质粒pUBC01-Pxyl⁃comK的消除Fig.4 Identification of plasmid pUBC01-Pxyl⁃comK elimination by antibiotic resistance assay
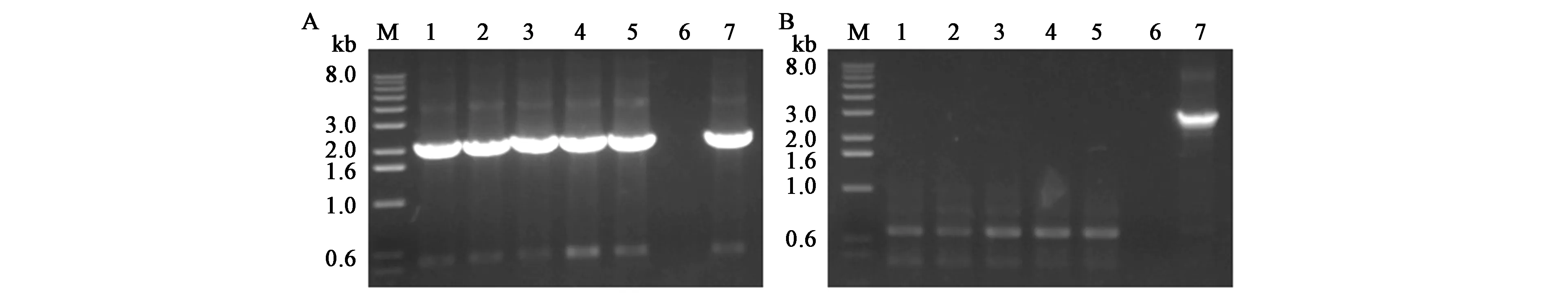
图5 PCR验证pHY300-p43-egfp以及pUBC01-Pxyl-comK质粒Fig.5 PCR verification of pHY300-p43-egfp and pUBC01-Pxyl-comK plasmids
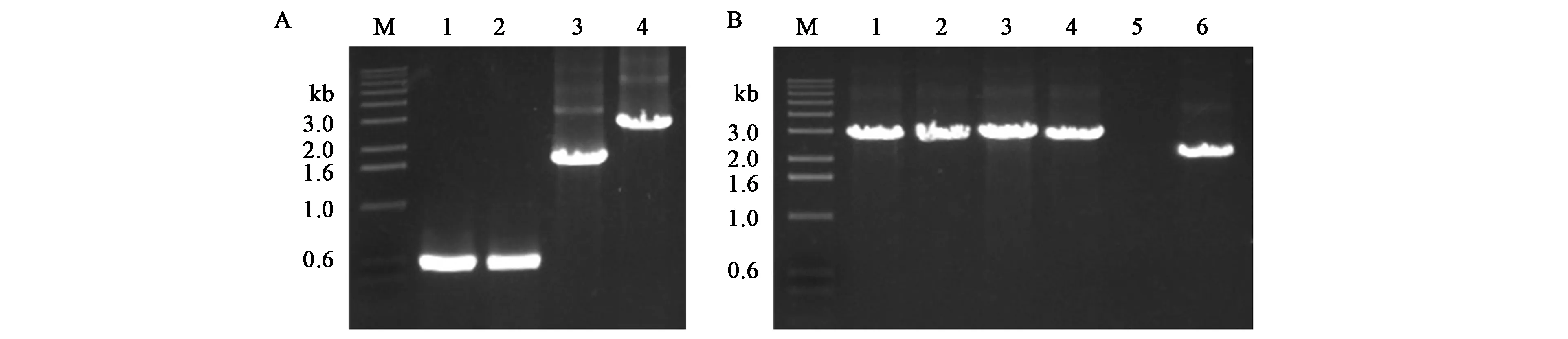
图6 整合片段的扩增及amyE敲除菌株的PCR验证Fig.6 Amplification of integration fragments and PCR vertification of strains with amyE knocked out
3 讨论
枯草芽孢杆菌因具有蛋白分泌能力强、培养发酵方便等特点,广泛地应用于酶的生产以及小分子化合物的合成。除了深入对芽孢杆菌代谢调控机制的研究以及发酵培养工艺的优化,构建快速便捷、成功率高的遗传操作技术,也是加快芽孢杆菌应用的重要手段。
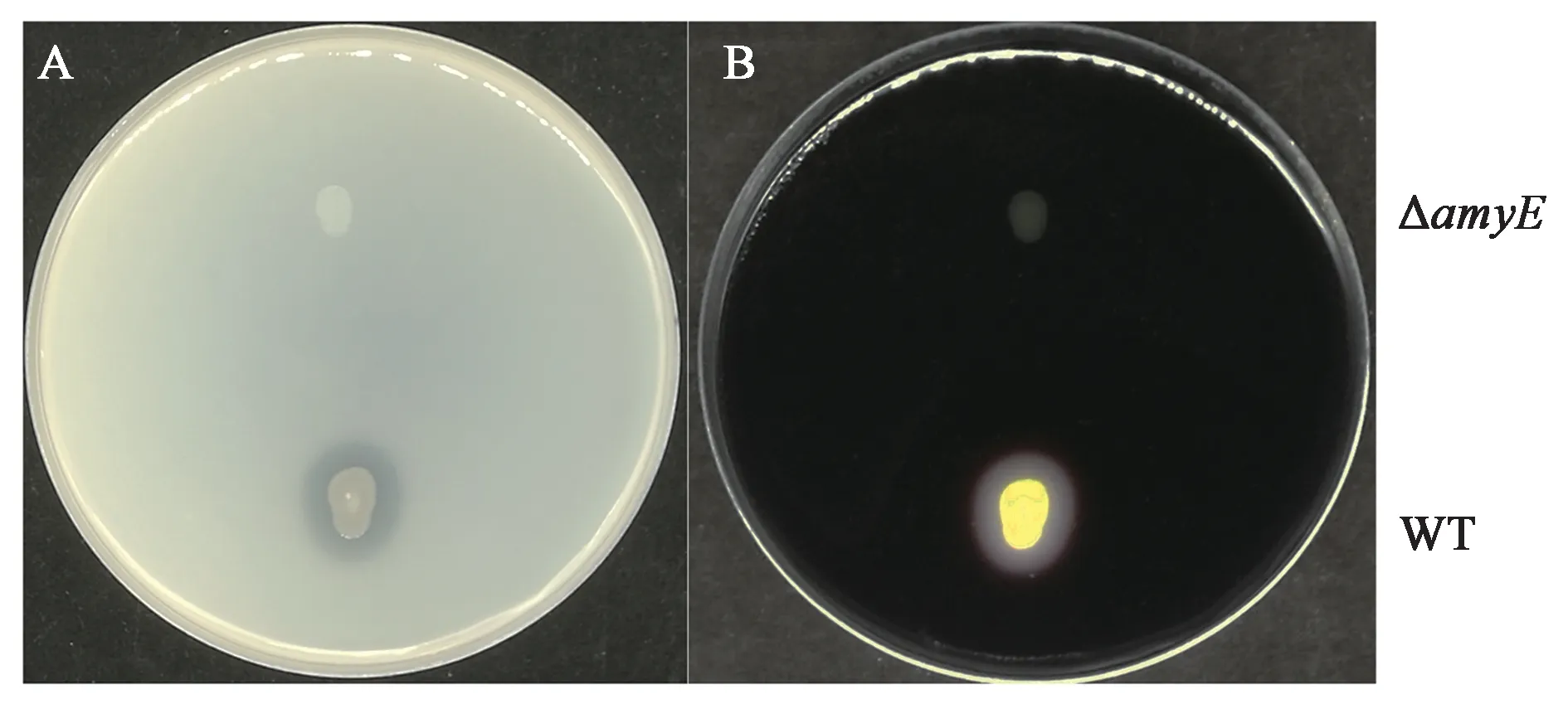
图7 淀粉水解实验Fig.7 Starch hydrolysis experiment
选取枯草芽孢杆菌感受态形成的关键调控基因comK,将含有Pxyl-comK表达盒的质粒转化B.subtilisWB600中,实现了质粒pHY300-P43-egfp高达4.8×103CFU·μg−1的转化效率,能达到质粒常规转化以及突变体建库的要求,后期可通过优化培养基成分以及木糖的诱导浓度,或采用多聚体质粒转化等方法进一步提高其转化效率[6,22−23]。此外,由于Pxyl启动子有一定的本底转录[24],即使在不添加木糖培养条件下,渗漏表达的ComK也会调控下游感受态形成相关基因的转录,使细胞吸收外源DNA,影响菌体生长以及性状的稳定性。将Pxyl-comK表达盒搭载在游离质粒上,在完成诱导转化后,可在无选择压力条件下连续培养,质粒会丢失,避免因comK渗漏表达而导致的菌株性状不稳定。此外,该诱导芽孢杆菌感受态的方法同样适用于染色体基因的编辑,含有同源臂以及四环素抗性筛选标记的PCR产物可直接转化芽孢杆菌诱导感受态,敲除amyE基因,使B.subtilisWB600失去水解淀粉的活性。在芽孢杆菌中建立的木糖诱导型遗传转化体系与常规芽孢杆菌的转化体系[4−6]相比,具有流程简便、周期短等优点,充分利用Comk调控芽孢杆菌感受态形成的特性,又能通过质粒消除规避其造成的负面影响,是一套较完善的芽孢杆菌转化体系,未来可在该诱导感受态的基础上,结合诱导毒性蛋白MazF这种负向筛选的手段[25−26],在枯草芽孢杆菌中建立绿色的、无筛选标记残留的基因敲除体系,从而避免由于抗生素抗性基因漂移造成的风险。

