盐酸地巴唑片质量分析研究*
陈宇堃,梁蔚阳,陈 旻
(广东省药品检验所·国家药品监督管理局血液制品质量控制重点实验室·广东省药品监督管理局血液制品质量控制研究重点实验室,广东 广州 510663)
地巴唑片对血管平滑肌有直接的松弛作用,可降低外周阻力,从而降低血压,对胃肠平滑肌也有一定解痉作用[1]。国外研究发现,地巴唑的血管舒张作用与阻断非活化钙通道而减少Ca2+进入平滑肌细胞有关[2]。查询国家药品监督管理局数据,地巴唑片国内有46家生产企业,58个国药准字批号,规格主要为3,5,10,20 mg,11家生产企业仍在产。经调研国内生产企业,地巴唑片生产历史较久远,不能确定其原研厂家。该制剂现行质量标准收载于《中华人民共和国卫生部药品标准》(1989年版)化学药品及制剂第一册。根据结构式[3],地巴唑(片)的通用名应为盐酸地巴唑(片),故本研究中统一使用其通用名。原国家食品药品监督管理总局曾将盐酸地巴唑片列入2014年度全国药品质量评价抽验计划。本次抽样共完成11家企业、183批次样品的法定标准检验,并抽取其中77批次样品开展探索性研究。通过对盐酸地巴唑片进行模拟处方制剂试验、有关物质、溶出度、含量均匀度及含量测定的研究,全面分析盐酸地巴唑片的有效性和安全性,全面了解各企业的产品质量状况。现报道如下。
1 仪器与试药
1.1 仪器
Waters 2695/2487型和E2695/2998型高效液相色谱仪,Waters Acquity H Class UPLC/G2 QTOF型超高效液相色谱-飞行质谱联用仪(美国Waters公司);Agilent 1200型高效液相色谱仪(美国Agilent公司);Millipore超纯水仪(美国Millipore公司);Sartorius CPA225D型电子天平(德国Sartorius公司);SOTAX AT7型溶出仪(瑞士Sotax公司);Malvern M2000型粒度分布仪(英国Malvern公司);Bruker AVANCEⅢHD 600型超导脉冲傅立叶变换核磁共振波谱仪(瑞士Bruker公司);TA DSC Q2000型差示扫描量热仪(美国TA公司);PANalytical EmpyreanX型射线衍射仪(荷兰Panalytical公司);UV-2450型紫外分光光度计(日本Shimadzu公司)。
1.2 试药
盐酸地巴唑对照品(中国食品药品检定研究院,批号为100420-201002,含量为98.9%);邻苯二胺对照品(江阴市华亚化工有限公司,批号为10511140401,含量为99.3%);苯乙酸对照品(河北诚信有限责任公司,批号为12011140501,含量为99.5%);盐酸地巴唑原料(企业I,批号I1~I3;企业L,批号L1~L3);盐酸地巴唑片(企业A,批号A1~A16;企业B,批号B1~B14;企业C,批号C1;企业D,批号D1;企业E,批号E1~E10;企业F,批号F1~F26;企业G,批号G1;企业H,批号H1~H16;企业I,批号I1~I17;企业J,批号J1~J20;企业K,批号为K1~K61;规格均为10 mg);甲醇、冰醋酸、三乙胺均为色谱纯;盐酸、三氯甲烷、丙酮均为分析纯;水为超纯水。
2 方法与结果
2.1 法定检验
对183批次盐酸地巴唑片样品按现行质量标准[4]进行检验,检验项目包括性状、重量差异及含量测定。合格98批次,合格率为53.55%。84批次为性状不合格,1批次为性状及重量差异均不合格。1)性状:现行质量标准[4]规定,盐酸地巴唑片应为白色片,85批次样品性状不合格原因均为片剂表面存在不同程度和数量的黑色、灰色或褐色斑点(见图1)。涉及9个企业,表明样品表面存在斑点现象较普遍。2)重量差异:1批次样品(批号H1)不合格,不合格率为0.55%。提示个别企业盐酸地巴唑片的生产工艺有待改进。3)含量测定:样品均符合规定,含量均在93.1%~109.5%范围内,平均100.0%。企业批间变异系数为1.1%~3.4%,批内变异系数为0.1%~4.2%,提示部分企业生产工艺存在一定问题。法定检验结果显示,大部分企业各批次的结果一致,但部分企业不同批号批次与相同批号批次的结果有差异,说明部分企业生产工艺存在一定问题。

图1 不合格样品典型图Fig.1 Typical picture of unqualified samples
2.2 探索性研究
针对在法定检验中发现的问题,选取11个企业共77批次样品作为供试品,参照2020年版《中国药典(四部)》[5]和其他文献资料[6-8]开展探索性研究。
1)模拟处方工艺制剂试验
根据企业K提供的原辅料、处方和工艺,模拟处方制剂过程。结果发现,部分辅料存在色点。而压片过程中,压片机若缺乏及时保养维护就会导致片剂表面有色泽深浅不同的斑点。
2)有关物质
现行质量标准[4]中无“有关物质”项,参考相关文献的液相色谱法[5-6],并对其做进一步优化及专属性、耐用性试验等方法学考察,分析盐酸地巴唑片中的有关物质。色谱条件:采用Waters 2695/2487型高效液相色谱仪,色谱柱为Kromasil C18柱(250 mm×4.6 mm,5μm),流动相为水-甲醇-冰醋酸-三乙胺(45∶55∶0.5∶0.5,V/V/V/V),流速为1.0 mL/min,检测波长为220 nm,柱温为30℃,进样量为10μL(供试品溶液质量浓度为1.0 mg/mL)。以盐酸地巴唑的合成原料邻苯二胺和苯乙酸与适量盐酸地巴唑一起溶解,溶液按拟订色谱条件进样测定。有关物质典型色谱图见图2。色谱图中,峰3为最大未知杂质峰,该峰在强制降解试验时,除光破坏时峰面积减小外,其余破坏试验无明显变化;猜测该物质可能为盐酸地巴唑的工艺杂质。

图2 典型色谱图1.O-phenylenediamine 2.phenylacetic acid 3.the largest unknown impurity 4.bendazol hydrochlorideFig.2 Typical chromatograms
取最大未知杂质10 mg,用甲醇溶解,制成质量浓度为100μg/mL的供试品溶液。结合超高效液相色谱-飞行质谱联用(UPLC-QTOF-MS)法和核磁共振波谱(NMR)法,对该杂质进行研究[7],发现其为2-(羟基苯基)苯并咪唑,结构式见图3。盐酸地巴唑生产工艺是以邻苯二胺与苯乙酸为起始原料,在氮气保护下,采用分段升温降温方法,使邻苯二胺与苯乙酸产生苯并咪唑关环反应,生成2-苄基苯并咪唑。猜测2-苄基苯并咪唑在脱色过程中接触活性炭时,与残留的氧气发生反应,生成2-(羟基苯基)苯咪唑。推测的未知杂质产生途径见图4。
目前关于网络安全的法律法规都已出台,公司信息中心也制定了网络安全管理制度,但宣传教育的力度还不够。网上活跃的大量黑客交流信息,也为一些别有用心人的对网络破坏活动奠定了技术基础。

图3 最大未知杂质的结构Fig.3 Structure of the largest unknown impurity
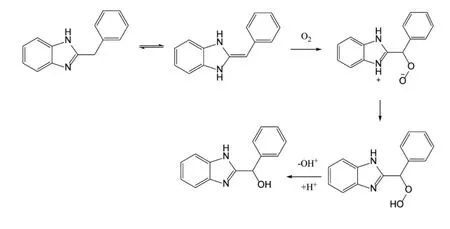
图4 最大未知杂质产生途径Fig.4 The producing pathway of the largest unknown impurity
对77批次盐酸地巴唑片杂质含量进行箱式分析,可发现企业J和K的样品杂质含量批间变异系数较大,企业C和D的样品杂质含量批间差异较小,详见图5。

图5 不同企业样品杂质量比对箱式图A.The content of the largest unknown impurity B.The content of other impuritiesFig.5 Comparison box plot of the content of impurity in the samples from different manufactures
3)溶出度
现行质量标准[4]中无此项,崩解时限项下采用水作为溶剂,规定在15 min内应完全溶解。盐酸地巴唑为难溶性药物,根据生物药剂学(BSC)分类系统定义,为低溶解度高渗透性物质。崩解时限不能完全体现其在人体内的溶出情况。对盐酸地巴唑片进行pH 1.0,2.0盐酸溶液,pH 3.8醋酸盐缓冲液,pH 4.5,5.8,6.8磷酸盐缓冲液,水7种溶出介质的溶出曲线试验,并同时考察11个企业的样品在pH 1.0盐酸溶液中溶出行为的差异。
采用2020年版《中国药典(四部)》通则0931溶出度与释放度测定法第二法(桨法),转速为50 r/min,溶出体积为900 mL。采用紫外-可见分光光度法在270 nm波长处测定。
取样品(批号J16)适量,分别在前述7种溶出介质中绘制溶出曲线。在5,10,15,30,45,60,90,120 min取样,滤过,取续滤液,作为供试品溶液,并同时补充相同体积的溶出介质(溶出曲线见图6 A)。

图6 平均溶出曲线图A.Different dissolution media B.Different manufacturesFig.6 The average dissolution profile
取11家企业的样品(批号A3,B2,C1,D1,E2,F3,G1,H10,I1,J16,K1)各适量,分别在pH 1.0盐酸溶液中绘制溶出曲线。在5,10,15,30,45,60,90,120 min时取样,滤过,取续滤液,作为供试品溶液,并同时补充相同体积的溶出介质(溶出曲线见图6 B)。
由图6 A可知,当溶出介质为水,pH 1.0,2.0盐酸溶液,以及pH 3.8醋酸盐缓冲液时,盐酸地巴唑片在10 min内的溶出率可超过95%。当溶出介质为pH 4.5磷酸盐缓冲液时,45 min溶出率可达95%。溶出介质为pH 5.8,6.8磷酸盐缓冲液时,曲线拐点出现在45 min,而在60 min的溶出率达85%。对比企业J的制剂工艺,可发现主要辅料为淀粉和糊精,未采用其他崩解剂。而盐酸地巴唑在pH 5.8,6.8磷酸盐缓冲液中的溶解度较低,所以片剂在这2个溶出介质中的溶出速率较慢。
4)含量均匀度
现行质量标准[4]无此项。含量均匀度是小剂量固体制剂及较难混匀的非均相制剂的重要质量指标之一。抽验盐酸地巴唑片样品的规格均为10 mg,按2020年版《中国药典(四部)》通则0941含量均匀度检查法要求,采用紫外-可见分光光度法在270 nm波长处测定吸光度,并计算含量。结果样品的含量均匀度均值在89.7%~107.7%之间,有9批次样品的A+2.2 S值>15.0(企业E,H,K分别有1,3,5批次)。通过与重量差异项数据的比较可见,重量差异与含量均匀度存在相关性(见图7)。

图7 重量差异与含量均匀度折线图Fig.7 Broken line chart of weight difference and content uniformity
5)含量测定
现行质量标准中采用高氯酸滴定法测定盐酸地巴唑原料及片剂的含量。而测定原料含量时需用到醋酸汞溶液,醋酸汞毒性大,易污染环境;且测定片剂含量时,会以较大量的三氯甲烷和丙酮为溶剂,该2种溶剂均属易制毒化学品,需进行特殊管理。参考文献[6],通过高效液相色谱法测定盐酸地巴唑原料及片剂的含量,并进行方法学验证。色谱条件,流动相为水-甲醇-冰醋酸-三乙胺(45∶55∶0.5∶0.5,V/V/V/V),检测波长为220nm,进样量为10μL(供试品溶液质量浓度为20μg/mL)。
对于盐酸地巴唑原料,两组数据的均值无显著差异(P>0.05)。但由于仅有6批次的检验数据,样品量过少,无法判断其是否服从正态分布。对于盐酸地巴唑片,2种方法的数据结果服从近似正态分布,通过Levene检验进行方差齐性检验,P=0.059,表明两组数据符合方差齐性,两者精密度无显著性差异。行配对t检验,结果表明,两组数据的均值无显著差异(P=0.136>0.05)。
3 讨论
通过探索性研究发现,1)部分盐酸地巴唑片表面存在不同程度和数量的黑色、灰色或褐色斑点,可能是由辅料引入,且压片机缺乏及时保养维护也会造成片剂表面存在斑点。2)现行质量标准中缺乏有关物质项。在探索性研究中,对盐酸地巴唑的起始原料和工艺杂质进行分离,并对工艺杂质进行了结构推断,确认该杂质为2-(羟基苯基)苯并咪唑。部分企业的最大未知杂质量和未知杂质总量批间差异较大。3)现行质量标准中缺乏溶出度项。探索性研究发现,盐酸地巴唑片的溶出速率随着溶出介质pH的升高而减慢,到达平衡时间延长。大部分企业样品在pH 1.0盐酸溶液介质中30 min时达到平衡,部分企业在15 min达到平衡;77批样品在30 min时溶出度大于85%。4)现行质量标准中缺乏含量均匀度项。根据2020年版《中国药典(四部)》通则0941要求,该片剂应进行含量均匀度检查。探索性研究发现,77批次样品中有9批次样品的A+2.2 S值>15.0。5)现行质量但标准中采用高氯酸滴定法测定盐酸地巴唑片的含量,且测定过程中使用大量的三氯甲烷和丙酮作为溶剂,毒性较大。探索性研究时,选择高效液相色谱法测定盐酸地巴唑片含量,并与高氯酸滴定法的测定结果进行比较,结果两组数据均值无显著差异。
本研究中采取法定检验结合探索性研究模式对盐酸地巴唑片进行评价性抽验,从标准到质量进行了较全面的分析和评价。由法定检验可知,目前盐酸地巴唑片性状不符合规定情况较严重;部分企业产品在重量差异和含量测定项目中,批间与批内存在较大差异。通过探索性研究可知,在有关物质、溶出度、含量均匀度项目中,部分企业存在批间与批内差异较大的问题。同时,盐酸地巴唑片的现行质量标准制定于1989年,在项目设置等方面存在不足,已不能满足现阶段对产品质量有效控制的基本要求。
综上所述,盐酸地巴唑片总体质量水平一般,建议相关企业改进和完善生产工艺,提高产品质量。同时,由于现行质量标准不完善,有效性和安全性指标设立不足,不能完全有效控制药品质量,需尽快提高质量标准。

