谷子ZF⁃HD 基因家族的鉴定及生物信息学分析
李珊,刘永琪,朱垠豪,葛星辰,段明,韩渊怀,3,马芳芳,3*
(1. 山西农业大学 农学院,山西 太谷 030801;2. 山西农业大学 实验教学中心,山西 太谷 030801;3. 杂粮种质创新与分子育种山西省重点实验室,山西 太谷 030801)
谷子(Setaria italica(L.)Beauv.)为禾本科狗尾草属的一种重要的杂粮作物,在距今6 000~7 000 年前的新石器时代中早期完成驯化,成为农耕文化的主栽作物,广泛种植于亚洲与欧洲温带和热带地区。中国是谷子的原产地,主要栽培在北方的干旱半干旱地区和盐碱地地区,常年的播种面积约133. 3 万hm2左右[1]。谷子对干旱及其他不良环境的耐受性和适应性较强,同时小米富含蛋白质、矿质营养元素、维生素、类胡萝卜素、叶酸等营养物质且不含麸质,对于患有动脉硬化、糖尿病和心脏病的人来说是很好的饮食选择[2,3]。转录因子(transcription factor,TF),也被称为反式作用因子。现如今抗逆基因的转录调控在植物响应逆境胁迫的研究报道已经非常普遍,转录因子可以单独或者与其他转录因子协同作用于逆境响应靶基因启动子区域中的启动子元件,与之结合从而激活或者抑制这些基因的转录,进而提高植物对逆境胁迫的耐性与抗性,促进植物在生长发育、形态建成过程中逐渐形成抵抗逆境的各种应答体系[4]。
ZF-HD(Zinc Finger Homeodomain)转录因子是植物特有的转录因子,它的显著特征是包含一个锌指结构域(zinc fingre,ZF)和一个同源异形盒结构域(homeodomain,HD),也是由此命名。生物体中都存在同源异形基因,参与调节它们的生长发育、形态建成以及对逆境的抗性和耐受性,最早于1984 年在果蝇中发现[5]。所有同源异形基因都有一个由180 个碱基的核酸序列组成的同源异形框(homeobox),这个区域非常稳定,可以转录翻译折叠形成一个60 个氨基酸组成的高度保守的三螺旋结构域,称为同源异形盒结构域,能够与特定的DNA 序列相互作用[6]。根据HD 蛋白氨基酸序列之间的相似程度将其分为7 个不同的亚家族,分别为:ATHB8、GL2、ZM-HOX、HAT1、HAT2、KNOX 和BEL。 之后在水稻中共鉴定出107 个HD 蛋白基因,并将其细分为10 个亚家族,分别为ZF-HD、HD-Zip I-IV(Homeodomain-leucine zip⁃per)、PHD(Homeodomain-finger)、KNOX I-II(Knottedl-like homeobox),WOX(Wuschel-relat⁃ed homeobox)和BLH 家族[7]。锌指结构是一种存在于可以调控基因表达的DNA 结合蛋白中的结构,它的典型特征是可以通过两对保守的半胱氨酸和/或组氨酸残基与Zn2+结合自我盘曲折叠形成稳定的独特的“手指”状的多肽空间构型[8,9]。锌指蛋白最初在非洲爪蟾的卵母细胞中发现[10],Shi等通过锌指蛋白中组氨酸(His)与半胱氨酸(Cys)残基位置与数目的不同将其分为C2H2、C2HC、C6、C2HC5、C3HC4、C4HC3、C4、C3H 等多种类型,其中C2H2类型是锌指蛋白在生物体中存在的主要类型[11]。
目前国内外许多研究证明ZF-HD 转录因子在植物生长发育、开花和抵抗外界不良环境时发挥着重要作用。已有研究表明在拟南芥中共有17个ZF⁃HD基因家族成员,它们作为转录因子,具有独特的生理特性,其中13 个成员在拟南芥花器官发育阶段的表达量显著升高[11];胁迫诱导ZHD1和NAC 转录因子的共表达增强了拟南芥ERD1基因的表达,从而提高拟南芥的抗逆性[12,13]。在水稻中鉴定出7 种与OsDREB1B基因启动子结合的锌指TFs,这些TFs 与启动子结合并相互作用抑制OsDREB1B的表达,参与对不同非生物胁迫的反应,并在抵抗生物胁迫中发挥作用[14]。此外在葡萄基因组中共鉴定了13 个ZHD基因(VvZHD),这些VvZHD基因表达表现出明显的时空特异性,并在不同胁迫和激素处理条件下差异表达,表明葡萄VvZHDs可能参与调控葡萄对各种生物和非生物胁迫的反应[15]。茶叶CsZF⁃HDs在不同非生物胁迫和激素诱导(干旱、低温、外源SA、MeJA、ABA 和GA3)下差异表达[16]。烟草ZH⁃HD基因家族中NtZF⁃HD21基因在干旱处理后被诱导高表达,通过亚细胞定位分析和病毒诱导基因沉默(VIGS)等方法证明了NtZF-HD21 蛋白是一种核蛋白并且NtZF⁃HD21基因的沉默降低了烟草的抗旱性[17]。通过对玉米中24 个ZF⁃HD家族基因在干旱、高盐胁迫处理和ABA 诱导下的表达模式进行分析发现,基因ZmZHD11和ZmZHD12强烈响应这3 种处理,并且在干旱处理和高盐胁迫下表达量显著升高,表明这2 个基因在逆境胁迫下通过改变ABA 合成代谢和信号传导途径来抵抗逆境[18]。在大白菜中大多数BraZF⁃HD基因在开花和长日照处理中高表达,表明BraZF⁃HD家族基因成员在控制大白菜开花方面可能具有冗余和独特的功能,此外,这些基因大多在非生物胁迫下被显著诱导,这意味着它们可能在这些过程中也发挥重要作用[19]。通过上述的研究表明ZF-HD 转录因子确实在植物生长发育、形态建成过程中遭受逆境时发挥重要的调控作用。
本研究通过利用生物信息学方法对谷子ZFHD 家族蛋白的理化性质、保守结构域以及家族基因系统进化、基因结构、启动子、在不同组织及干旱胁迫下的表达模式等进行分析,旨在进一步探索ZF⁃HD家族基因在谷子的生长发育、形态建成以及遭受逆境胁迫时的调控作用,为进一步提高谷子的抗逆性提供理论依据。
1 材料和方法
1. 1 数据获取
从Phytozome 数据库(https://phytozome. jgi.doe. gov/pz/portal. html)下载谷子(Setaria italicav2. 2)、拟南芥(Arabidopsis thalianaTAIR10)和水稻(Oryza sativav7_JGI)的全基因组序列、CDS序列、蛋白序列。 并从NCBI 数据库(https://www. ncbi. nlm. nih. gov/pubmed)下载水稻和拟南芥ZF-HD 家族蛋白序列。
1. 2 谷子ZF⁃HD 家族基因的鉴定及在染色体上的定位
利用Pfam 数据库(http://pfam. xfam. org/)下载ZF⁃HD基因的PF04770 结构域种子数据stock⁃holm 文件。利用HMMER 在线软件中的hmmsearch 在谷子的总蛋白质序列中进行搜索[20],筛选阈值小于0. 01 的基因为谷子ZF⁃HD家族基因。 使用Pfam 数据库中Batch search(http://pfam. xfam. org/search#searchBatchBlock)对HM⁃MER 得到的候选基因进行验证。
利用谷子的基因组注释文件,对鉴定验证后的ZF⁃HD家族基因所处染色体条数,基因长度,在染色体上的起始位点等信息进行提取,利用TB⁃tools[21]对这些结果进行可视化,得到基因染色体分布图。
1. 3 谷子ZF⁃HD 蛋白的基本信息和理化性质分析
利用ExPASY-ProtParam 在线软件(https://web. expasy. org/ protparam/)分析统计谷子ZFHD 家族中所有的蛋白序列的氨基酸数目、等电点和分子量等理化性质。
1. 4 谷子与拟南芥、水稻ZF⁃HD 蛋白的系统发生树构建和基因结构分析
利用MEGA 7. 0[22]软水件对谷子与拟南芥、水稻中ZF-HD 蛋白序列进行聚类和进化分析,采用最大似然法(Maximum Likelihood,ML)构建系统进化树,泊松模型(Poisson Model)计算遗传距离,步长检测法(Bootstrp method)检测建树的质量,检测次数为1 000(bootstrap:1 000 replica⁃tions),其它参数选择默认。利用FigTree 软件对系统发生树进行编辑和美化。
利用谷子ZF⁃HD家族基因的CDS 序列和核酸序列文件,通过GSDS 在线软件(http://gsds.cbi. pku. edu. cn/)分析谷子ZF⁃HD基因核酸序列中外显子-内含子(exon-intron)的分布,绘制基因结构图。
1. 5 谷子ZF⁃HD 家族蛋白保守结构域分析
利用在线软件MEME[23](http://meme-suite.org/tools/meme)对谷子ZF-HD 蛋白氨基酸序列中的保守Motifs 进行预测分析,选择预测的Motifs的个数(Select the number of motifs)为8 个,并使用TBtools 工具对谷子ZF-HD 蛋白氨基酸序列上的保守motifs 的数量、外置进行可视化,对于分析ZF-HD 蛋白序列中发挥功能的结构域是否缺失,功能是否丧失有一定的作用。
1. 6 谷子ZF⁃HD 基因启动子区域启动子元件分析
选取谷子ZF⁃HD基因核酸序列起始密码子上游1 500 bp 长度的序列作为启动子区域,将其输入到PlantCARE 在线软件(http://bioinformatics.psb. ugent. be/webtools/plantcare/html)中得到每个谷子ZF⁃HD基因启动子区域中所有的启动子元件,筛选出一些重要的响应元件,通过TBtools进行可视化分析。
1. 7 谷子与拟南芥、水稻ZF⁃HD 基因共线性及选择压力分析
通过用MCScanX[24]软件获取谷子ZF⁃HD基因与拟南芥、水稻全基因组中的共线性基因,分析查找共线性基因在染色体上的位置。 利用TB⁃tools 工具展现这些共线性基因间的关系。 利用Tbtools 中Simple Ka/Ks Calculator(NG)工具计算共线性基因之间的Ka/Ks值,分析谷子ZF⁃HD基因家族进化过程中受到的选择压力作用。
1. 8 谷子ZF⁃HD 蛋白的亚细胞定位预测
通过PSORT Prediction(http://psort1. hgc.jp/form. html)对谷子的ZF-HD 蛋白序列进行亚细胞定位预测。
1. 9 ZF⁃HD 家族基因在谷子不同组织以及干旱胁迫下的表达模式分析
从Phytozome 公共数据库下载ZF⁃HD家族基因的在谷子根、叶、幼芽、穗不同组织的表达量FP⁃KM 值,分析ZF⁃HD家族基因各个组织中的表达差异性和特异性;利用本实验室已有的谷子田间自然干旱胁迫下不同时间点叶片转录组数据,对ZF⁃HD家族基因在不同抗旱性品种早中晚3 个不同时间点的表达情况进行分析。具体处理为:将干旱敏感品种AN04 和抗旱品种YG1 种植于旱棚,出苗3 周后进行自然干旱处理,对照组土壤含水量始终维持在65% 左右,当干旱处理组大部分谷子叶片有萎蔫状态,土壤含水量下降到15%~20% 时,在同天早上8 点(M)、中午12 点(N)和晚上8 点(E)剪取叶片,液氮速冻保存,进行转录组测序。
1. 10 实时荧光定量RT⁃PCR
转录组测序公司测序返回的RNA,利用琼脂糖凝胶电泳和分光光度计检测RNA 的完整性和浓度。 使用宝日医生物技术(北京)有限公司的PrimeScript™RT reagent Kit with gDNA Eraser 试剂盒进行基因组DNA 污染的消除和第一链cDNA的合成。 采用2×M5 HiPer Realtime PCR Super mix(SYBRgreen,with anti-Taq)定量试剂盒进行qRT-PCR 分析,β⁃actin作为内参[25]。反应体系共10 μL,包括2×Super Mix 5 μL,dd H2O 3. 4 μL,cDNA 1 μL,正向引物以及反向引物各0. 3 μL。qPCR 反应条件为95 ℃预变性30 s;95 ℃变性下15 s,60 ℃退火20 s,40 个循环;65~95 ℃条件下检测熔点曲线。通过分析cDNA 梯度稀释的标准曲线获得每个基因的扩增效率,利用2-ΔΔCt方法计算基因的相对表达水平。由生工生物工程(上海)股份有限公司设计并合成引物,引物名称及序列详见表1。

表1 qRT⁃PCR 引物序列Table 1 Primers for qRT⁃PCR
2 结果与分析
2. 1 谷子ZF⁃HD 家族基因鉴定及染色体定位
利用ZF⁃HD家族基因的HMMER 模型在谷子中筛选并鉴定到16 个ZF⁃HD家族成员。利用功能注释文件所获取谷子ZF⁃HD家族基因在染色体上的具体位置信息绘制染色体分布图。从图1 可以看出,谷子共有9 条染色体,ZF⁃HD家族成员不均匀的分布在除4 号染色体外的其它8 条染色体上,2 号染色体分布的家族成员最多(4 个)。
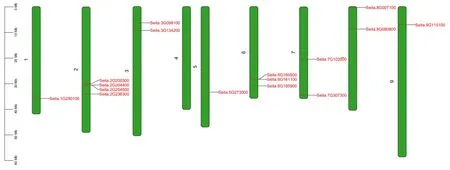
图1 ZF⁃HD 基因染色体定位Fig.1 Chromosome location of ZF⁃HD genes in foxtail millet
2. 2 谷子ZF⁃HD 蛋白基本信息和理化性质分析
从表2 中可以看出,谷子ZF-HD 蛋白氨基酸长度在87~719 之间,其中Seita. 8G007100基因编码的蛋白序列最短,Seita. 9G115100基因编码的蛋白序列最长;蛋白质等电点介于6. 42~9. 15 之间,其中有10 个家族蛋白质等电点大于7 呈碱性,6 个家族蛋白质的等电点小于7 呈酸性;蛋白质分子量在9. 32~76. 18 kDa 之间。
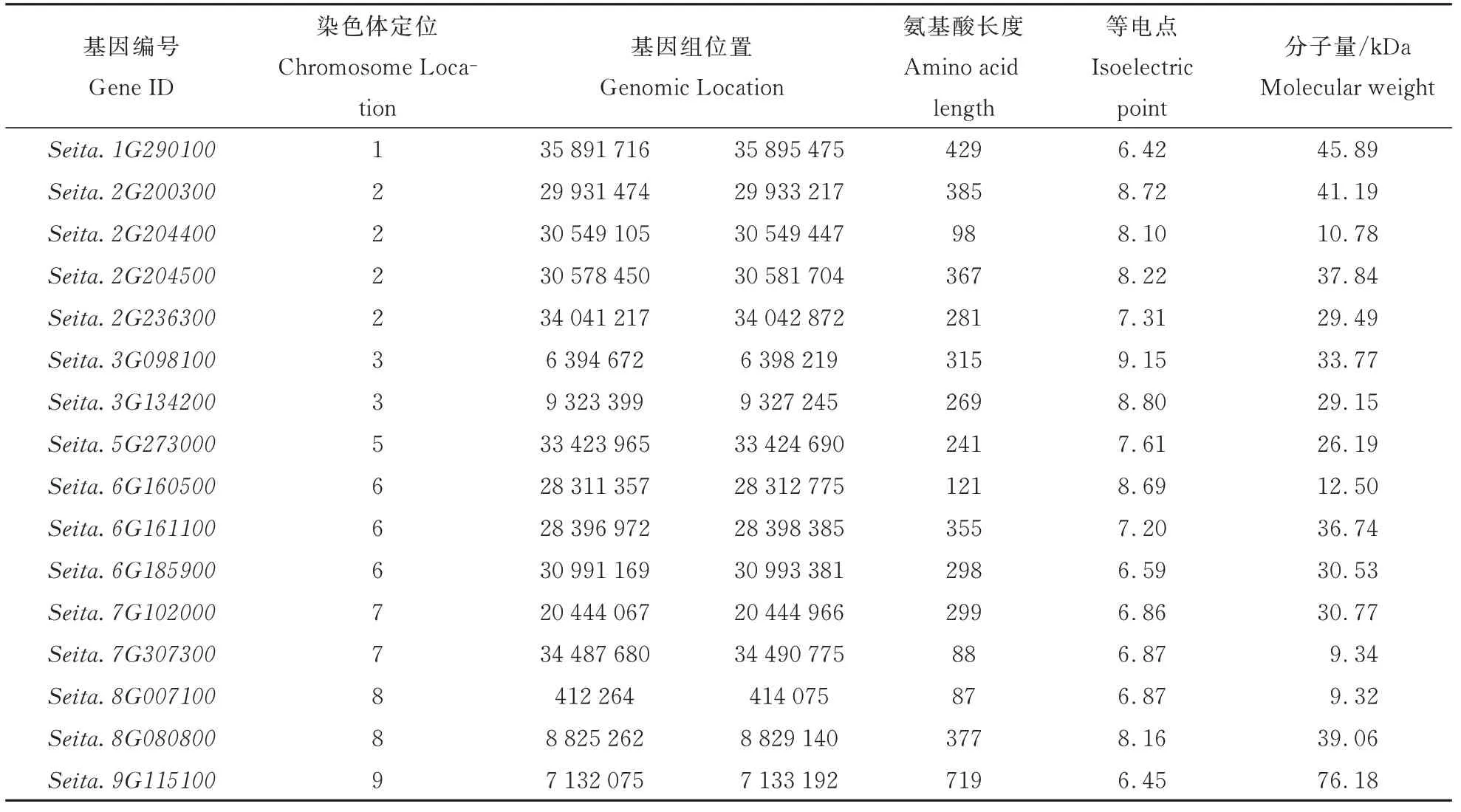
表2 谷子ZF⁃HD 蛋白的序列特征Table 2 Sequence characteristics of ZF⁃HD proteins in foxtail millet
2. 3 谷子与拟南芥、水稻ZF-HD 蛋白的系统发生树构建
利用谷子、拟南芥和水稻中分别16、17、15 条ZF-HD 蛋白序列、构建系统发生树,可以进一步确定3 个物种间ZF⁃HD基因的亲缘关系远近和进化关系。图2 显示:3 个物种共48 个ZF-HD 氨基酸序列构建所得的系统发生树可分为6 大类:ZHDⅠ、ZHDⅡ、ZHDⅢ、ZHDⅣ、ZHDⅤ、MIF。进化树显示ZHDⅢ亚族中只存在3 个拟南芥ZF-HD家族蛋白成员,没有谷子和水稻ZF-HD 家族蛋白成员。 进化树中除了Seita. 7G307300 和Sei⁃ta. 8G007100、Seita. 2G204400 和Seita. 6G160500、Seita. 2G204500 和Seita. 6G161100、Seita. 2G200300和Seita. 5G273000 属于旁系同源蛋白,其它ZFHD 家族蛋白均与水稻ZF-HD 家族蛋白聚为分支末端,表明谷子与水稻ZF-HD 蛋白的同源性显著高于拟南芥。
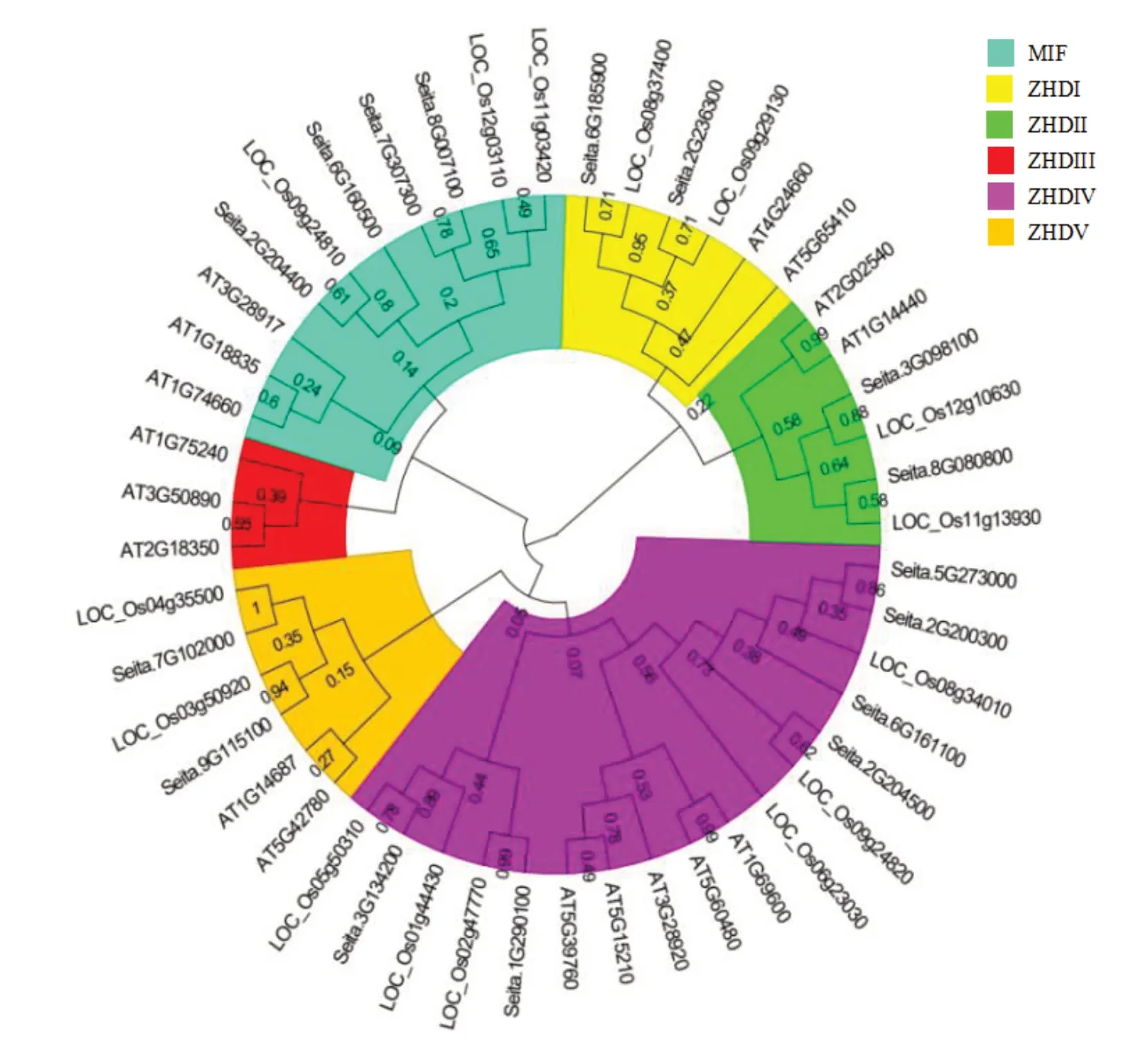
图2 谷子、拟南芥、水稻ZF-HD 蛋白的系统发生树Fig.2 Phylogenetic tree of ZF-HD proteins in foxtail millet,Abidopsis and rice
2. 4 谷子ZF⁃HD 家族基因的基因结构分析
基因结构分析显示(图3),16 个谷子ZF⁃HD基因家族中有87. 5% 的基因不含内含子结构,只有外显子,基因Seita. 2G204400和Seita. 2G200300的核酸序列中包含内含子结构。
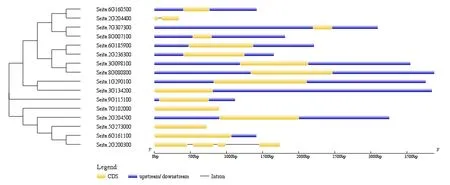
图3 谷子ZF⁃HD 基因的基因结构Fig.3 Gene structure of ZF⁃HD genes in foxtail millet
2. 5 谷子ZF⁃HD 家族蛋白保守结构域分析
本试验对谷子ZF-HD 蛋白序列中8 个Motif进行预测,从图4 中可以看出谷子ZF-HD 蛋白序列中4 个Motif 保守性较高,保守Motif 1 和Motif 3组成了ZF-HD 转录因子中富含半肌氨酸和组氨酸二聚化的锌指结构域,保守Motif 2 和Motif 4,组成了ZF-HD 转录因子的同源异形结构域。所有ZF-HD 家族蛋白进化树结果分成2 大分枝,分枝I 中4 个成员都只含有保守Motif 1 和Motif 3,分枝II 中有10 个ZF-HD 家族蛋白序列都含有Motif 1、2、3 和4,Seita. 2G200300 蛋白序列中缺少保守Motif 1、2、4,Seita. 5G273000 蛋白序列中缺少保守Motif 2。
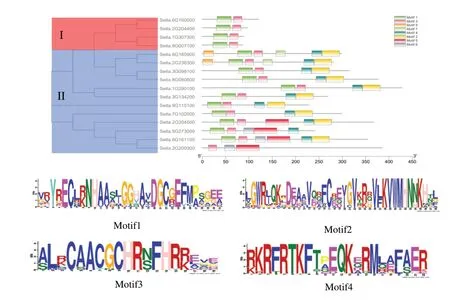
图4 谷子ZF-HD 家族蛋白氨基酸序列保守基序Fig.4 Conserved motifs of amino acid sequences of ZF-HD family proteins in foxtail millet
2. 6 谷子ZF⁃HD 基因启动子元件分析
利用PlantCARE 在线软件对谷子ZF⁃HD家族基因启动子元件进行分析,筛选保留重要的响应启动子元件,通过TBtools 可视化的结果如下图5。谷子16 个ZF⁃HD基因都含有光照响应启动子元件,同时还存在许多其它丰富的启动子元件,例如:ABA、MeJA、水杨酸、生长素、赤霉素等激素响应元件;低温诱导、干旱诱导等非生物胁迫响应元件,其中9 个谷子ZF⁃HD基因含有干旱诱导响应元件。

图5 谷子ZF⁃HD 家族基因启动子元件Fig.5 Promoter elements of ZF⁃HD family genes in foxtail millet
2. 7 ZF⁃HD 基因的共线性分析及选择压力分析
谷子16 个ZF⁃HD家族基因分别、拟南芥、水稻的全基因组进行共线性分析,结果如图6 所示。结果发现谷子ZF ⁃ HD家族基因只有Sei⁃ta. 1G290100和Seita. 6G185900分别与拟南芥AT2G18350和AT5G65410存在共线性,有14 个谷子ZF⁃HD与水稻中13 个ZF⁃HD基因存在共线性,Seita. 2G200300和Seita. 5G273000在水稻和拟南芥中都不存在共线性基因。谷子ZF⁃HD基因家族中共鉴定出4 对片段重复基因,没有串联重复现象。为确定是否有选择压力作用于谷子ZF⁃HD家族基因,以拟南芥和水稻ZF⁃HD基因为参照,估算了进化过程中谷子ZF⁃HD基因的选择压力。通过计算共线性基因选择压力值,发现谷子与水稻共线性基因的进化选择压力值都小于1,表明谷子与水稻的共线性基因在进化中经历了纯化选择,谷子ZF⁃HD家族中所有重复事件基因的Ka/Ks 值也均小于1,说明这些基因均在纯化选择的作用下进化。
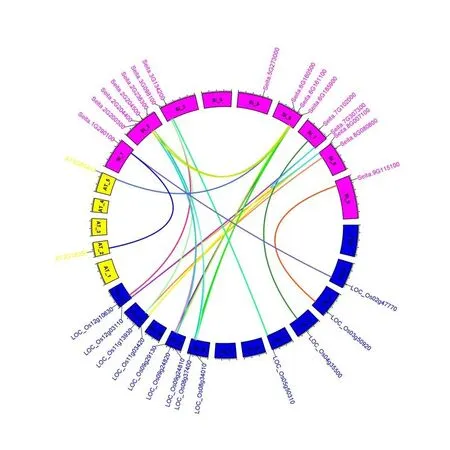
图6 水稻、拟南芥与谷子ZF⁃HD 基因的染色体共线性关系Fig.6 Collinear relationship of ZF⁃HD genes among rice,Arabidopsis and foxtail millet chromosome
2. 7 谷子ZF⁃HD 蛋白亚细胞定位预测
利用PSORT Prediction 在线软件对谷子ZFHD 家族蛋白进行亚细胞定位预测,结果显示(表4):有7 个ZF-HD 家族蛋白成员定位在细胞质中,5 个成员定位到细胞核,Seita. 2G200300 蛋白定位在质膜上,其余蛋白定位在微体(过氧化物酶体)上。
2. 8 谷子ZF⁃HD 基因的表达模式分析
通过Phytozome 公共数据库,查找并整理出ZF⁃HD基因家族成员在谷子根、叶、幼芽、穗4 个组织中表达量FPKM 值,利用TBtools 绘制表达热图。 组织表达分析结果显示(图7-A):除了Sei⁃ta. 2G200300和Seita. 5G273000在谷子各组织中表达量几乎为零外,其余基因在谷子根、叶、幼芽、穗中或多或少都存在差异表达。 在根中,Sei⁃ta. 7G307300的表达量最高,Seita. 8G007100次之,其余基因的表达量都较低。Seita. 1G290100和Seita. 2G204400在穗中的表达量最高。 在叶中,Seita. 2G204500的表达量最高,Seita. 6G161100的表达量次之。eita. 2G204500在幼芽中的表达最高,Seita. 2G204400表达量次之。
利用本实验室已有的转录组数据,对田间自然干旱胁迫下,谷子ZF⁃HD家族基因在不同抗旱性品种(AN04:干旱敏感品种,YG1:抗旱品种)早(M)、中(N)、晚(E)3 个不同时间点的表达情况进行了分析。如图7-B 所示:16 个ZF⁃HD家族基因根据表达情况的不同聚为3 类,分别是在早、中、晚3 个不同时间点高表达和差异表达。 早上Sei⁃ta. 7G307300和Seita. 1G290100在AN04 对照与自然干旱处理之间差异表达,Seita. 3G098100、Sei⁃ta. 6G160500、Seita. 7G307300和Seita. 8G007100在YG1 对照与自然干旱处理间差异表达。中午Sei⁃ta. 7G10200和Seita. 9G115100在YG1 自然干旱处理后表达量显著升高。 晚上Seita. 8G080800、Seita. 2G204400和Seita. 2G236300在YG1 自然干旱处理后表达量显著升高,Seita. 2G204500和Sei⁃ta. 3G134200在自然干旱处理后的AN04 中表达量下降,相反在自然干旱处理后的YG1 中表达量上升。
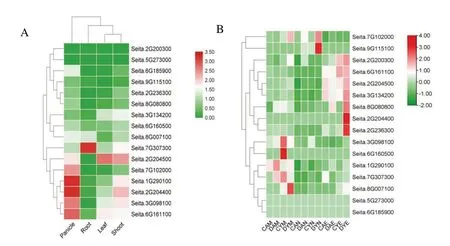
图7 谷子ZF⁃HD家族基因的表达分析Fig.7 Expression analysis of ZF⁃HD family genes in foxtail millet
本研究从谷子ZF⁃HD家族基因中挑选了差异表达较为明显的3 个基因Seita. 2G236300、Sei⁃ta. 3G098100、Seita. 3G134200进行了qRT-PCR验证。从图8 中可以看出,晚上YG1 在干旱胁迫处理后,基因Seita. 2G236300的表达量显著升高。早上干旱处理后的AN04 中基因Seita. 3G098100表达量较对照升高,而在YG1 中表达量降低;相反晚上干旱处理后的AN04 中基因Seita. 3G134200表达量较对照降低,而在YG1 中表达量升高。同时qRT-PCR 表达模式与RNA-Seq 数据集一致,验证了RNA-seq 数据的可靠性,也进一步说明这些基因的表达可能存在昼夜节律,并且在谷子干旱胁迫响应过程中起到重要作用。
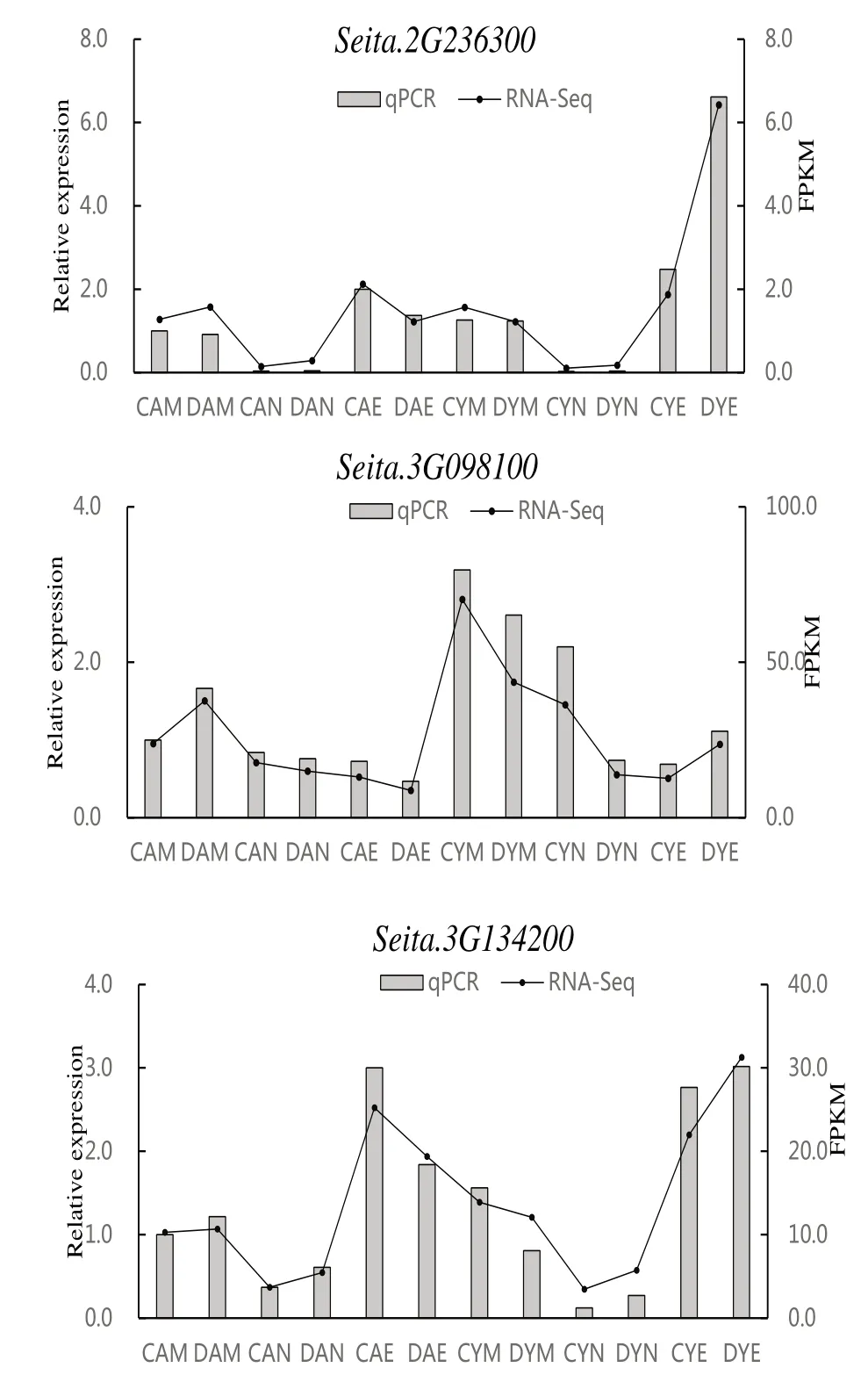
图8 不同处理下3 个ZF⁃HD 家族基因表达模式的qRT-PCR 分析Fig.8 Relative expression patterns of three ZF⁃HD family genes under different treatments
3 讨论
ZF⁃HD基因可以调节植物的生长发育,增强植物对外界环境变化的适应能力[26]。 研究发现ZF⁃HD基因家族只存在于陆生植物中[19],这类基因可能在陆生植物祖先与单细胞藻类趋异后得到了进化。本研究利用生物信息学分析,在谷子中共鉴定出16 个ZF⁃HD家族成员,不均匀的分布在除4 号染色体外的其他染色体上。系统进化树中家族基因聚类结果与Wei[27]等人对拟南芥ZFHD基因家族所分的亚家族相一致,其中ZHDⅢ亚族中只存在拟南芥ZF-HD 家族蛋白成员,可能是拟南芥进化过程中所产生的一个特有的ZF-HD亚家族。谷子ZF⁃HD基因家族中Seita. 7G307300和Seita. 8G007100、Seita. 2G204400和Sei⁃ta. 6G160500、Seita. 2G204500和Seita. 6G16110 0、Seita. 2G200300和Seita. 5G273000属于旁系同源基因,其他ZF⁃HD家族基因均与水稻ZF⁃HD家族基因聚为同一分支末端,属于直系同源基因。表明谷子与水稻ZF⁃HD 蛋白的同源性显然高于拟南芥,亲缘关系更近,并且植物漫长的进化过程中,大部分ZF⁃HD基因均按照物种特异性的方式进行扩展,该现象在植物其他基因家族的研究中也得到了广泛验证[28]。16 个谷子ZF⁃HD基因家族中有87. 5% 的基因不含内含子结构,与拟南芥[9]、茶树[16]中ZF⁃HD家族基因缺乏内含子结构的研究结果相一致,这是ZF⁃HD基因家族的特点。缺乏内含子结构使得ZF⁃HD基因不能进行选择性剪接,从而使ZF-HD 蛋白高度保守,在进化过程中功能不会发生太大的变化,比较固定[29]。保守基序分析将ZF-HD 家族蛋白成员分为两大类,Ⅰ类蛋白缺少Motif2 和Motif4,并且这些基因在进化树中聚类在MIF 分组中,这与研究发现的MIF 亚家族中的基因只拥有锌指结构域但是不具有C 末端的同源域结构域一致[30]。Ⅱ类蛋白中两个基因蛋白序列中保守Motif 的缺失可能是其在长期进化过程中丢失造成的。基因启动子元件分析显示ZF⁃HD基因家族均含有光照响应元件以及丰富的低温诱导、干旱等非生物胁迫响应元件,ABA、水杨酸等激素响应元件。 在对番茄[31],玉米[18]ZF-HD 基因家族启动子元件分析中同样发现许多逆境响应元件,并通过非生物胁迫实验进一步验证该基因家族中部分基因确实响应逆境胁迫,这表明ZF-HD 转录因子这被赋予响应逆境胁迫、调控内源激素的潜在功能,但这些基因在谷子中的具体功能还需要通过试验进一步验证。基因家族成员间常常发生基因复制事件,从而使基因功能具有特异性和多样性,这是推动植物进化的主要动力之一[32,33]谷子中ZF⁃HD家族基因共鉴定出4对片段重复基因,没有串联重复现象,说明片段重复是谷子ZF⁃HD家族基因扩增的主要方式。并且重复事件基因的Ka/Ks也值均小于1,说明这些基因均在纯化选择的作用下进化[34]。谷子ZF-HD家族蛋白成员亚细胞定位预测发现有7个蛋白被预测定位到了细胞质中,5个蛋白定位到在细胞核中。

表4谷子ZF⁃HD家族蛋白亚细胞定位预测Table 4 Prediction of subcellular localization of ZF⁃HDfamily proteins in foxtail millet
基因表达模式能够一定程度上反应基因功能[35]。已有研究发现小麦[36]、白菜[19]及拟南芥[11]的ZF⁃HD基因在花中的表达量很高,陆地棉[37]ZF⁃HD基因家族大部分在胚珠和纤维中表达,玉米[18]ZF⁃HD基因家族大部分在雄穗、雌穗和幼胚中高度表达。本研究中ZF⁃HD家族基因大多在谷子穗和茎中高表达,说明ZF⁃HD家族基因在不同植物的生长发育过程的不同部位发挥着各自独特的作用。已有报道发现ZF⁃HD基因家族响应干旱胁迫,例如在拟南芥受到干旱胁迫时ZHD1基因被诱导高表达从而提高拟南芥的抗旱性[12],烟草ZH⁃HD基因家族中NtZF⁃HD21基因的沉默降低了烟草的抗旱性[17]。田间自然干旱胁迫下,谷子ZF⁃HD家族基因在不同抗旱性品种AN04和YG1早(M)、中(N)、晚(E)3个不同时间点的表达情况分析发现,不同基因的表达模式存在较大差异,部分基因的表达存在昼夜节律的变化,且在抗、感品种中对干旱胁迫的响应模式也不尽相同,表明ZF⁃HD家族基因具有组织表达特异性和时空特异性,并参与谷子干旱胁迫应答响应过程。
4 结论
本研究共鉴定出16 个谷子ZF-HD 转录因子家族成员,分布在8 条染色体上,分为5 个亚家族,大部分家族成员无内含子结构,在核外和细胞核中均有分布。谷子ZF⁃HD基因家族具有明显的组织表达特异性,并参与谷子干旱胁迫应答响应过程。本研究将加深我们对ZF⁃HD基因家族在谷子中转录调控机制的了解,为完善谷子抗逆分子机制研究,提高谷子抗逆性提供理论基础。

