谷子DGAT 基因家族分析及基于WGCNA 发掘甘油三酯合成与调控相关基因
郭宁馨,张丽玲,张雅坤,葛星辰,刘永琪,任雪梅,高建华,韩渊怀*
(1. 山西农业大学 农学院,山西 太谷 030801;2. 山西农业大学 生命科学学院,山西 太谷 030801)
甘油三酯(Triacylglycerol,TAG)是植物主要的脂质储存形式[1],也是重要的能量供体[2]。目前在植物中发现了3 种合成TAG 的途径。第1 种为最主要的Kennedy 途径:首先,2 个脂酰CoA 在甘油-3-磷酸酰基转移酶(Glycerol-3-phosphate acyl⁃transferase,GPAT)和溶血磷脂酸酰基转移酶(Ly⁃sophosphatidic acid acyltransferase,LPAT)的作用下转移到3-磷酸甘油(3-phosphoglycerate,G3P)的sn-1、sn-2 位上形成磷脂酸(Phosphatidic acid,PA);再由磷脂酸磷酸酶(Phosphatidic acid phos⁃phatase,PAP)脱去磷脂酸sn-3 位的磷酸形成甘油二酯(Diacylglycerol,DAG);最后由二酰甘油酰基转移酶(Diacylglycerol acyltransferase,DGAT)催化将另一个脂酰CoA 转移至DAG 的sn-3 位形成TAG[3]。 第2 种为磷脂酰胆碱(Phosphatidylcho⁃line,PC)sn-2 位的脂酰基在磷脂:二酰基甘油酰基转 移 酶(Phospholipid: DAG acyltransferase,PDAT)的作用下被DAG 结合,从而合成TAG。第3 种为DAG 在DGAT 的作用下,利用另一个DAG 分子脱下的脂酰基形成TAG[4]。
DGAT 是植物中TAG 合成的唯一限速酶,对种子含油量、脂肪酸组成及种子重量具有重要作用[5,6]。DGAT基因家族可分为DGAT1、DGAT2、DGAT3 和WSD 四类。DGAT1 与酰基CoA:胆固醇酰基转移酶(Acyl CoA:cholesterol acyltransferase,ACAT)家族序列同源性较高[7],是拟南芥(Arabidopsis thaliana)中甘油三酯合成所必需的[5,8];DGAT2 可在TAG 中选择性积累更多的不饱和脂肪酸。过表达DGAT2,拟南芥中的油脂总含量升高[9];紫苏(Perilla frutescens)[10]和烟草(Nicotiana tabacum)中的不饱和脂肪酸含量升高,而饱和脂肪酸含量下降;另外,烟草中DGAT2 与转录因子ERF 共表达,促进碳源更多地流向油脂和脂肪酸的生物合成[11]。DGAT1 和DGAT2 是2种结构不同的膜结合酰基转移酶,其分布和底物特异性影响了TAG 的合成及脂肪酸组成[12]。WSD 是一种双功能酶,具有DGAT 功能,也在蜡酯的合成中发挥作用。DGAT3 最先由Saha 等人在花生(Arachis hypogae)中鉴定,在细胞质中发挥作用,与DGAT1 和DGAT2 基因相似度较低,与WSD 相似度为13%,但不具有蜡酯合成功能,故归类为DGAT3[7]。DGAT3 倾向于积累更多单不饱和脂肪酸[13]。
谷子(Setaria italica)是一年生禾本科作物,起源于我国北方黄河流域,具有耐旱、耐盐碱、根系发达等特点。谷子籽粒脱壳后为小米。小米营养丰富,含有多酚、氨基酸、黄酮等营养物质以及多种矿质元素;粗脂肪含量高于大米和小麦,约为4. 28%[14],且脂肪酸种类丰富,主要为亚油酸、油酸、棕榈酸和α - 亚麻酸[15],还含有少量的EPA(Eicosapentaenoic acid)、DHA(Docosahexaenoic acid)和花生四烯酸,对人体有益的不饱和脂肪酸占总量的80%。但目前鲜有对谷子中油脂合成的研究,不利于相关基因的挖掘和小米品质的改良。
本研究利用生物信息学方法,对谷子DGAT基因的类别、蛋白特性、保守基序、基因结构、顺式作用元件及表达模式进行了分析,并利用加权基因共表达网络分析(Weighted gene co-expression net-work analysis,WGCNA)方法挖掘了潜在的谷子甘油三酯调控基因,为谷子油脂及脂肪酸的研究提供理论依据。
1 材料与方法
1. 1 谷子DGAT 基因家族成员的鉴定及系统进化树的构建
从MDSI(http://foxtail-millet. biocloud. net/home)数据库下载谷子突变体材料xiaomi[16]的基因组数据。通过两种方式获得谷子DGAT家族基因,一种是在TAIR(https://www. arabidopsis.org/)数据库下载拟南芥DGAT 的蛋白序列,利用TBtools[17]进行BLAST,搜索谷子DGAT(阈值为1e-5);另一种是从Pfam(http://pfam. xfam. org/)数据库下载DGAT基因家族的HMM 模型(PF03982),利用TBtools 在谷子蛋白质组中进行HMM search。 将2 种方法获得的候选蛋白质序列,利用Pfam 进行结构域预测,删除与DGAT 功能无关的基因,最终确定谷子DGAT 家族成员。
从水稻数据库(http://rice. plantbiology. msu.edu/)获取水稻DGAT家族基因的蛋白序列;从玉米 数 据 库(https://maizegdb. org/)获取玉米DGAT 家族基因的蛋白序列;从UniProt(https://www. uniprot. org/)中获取大豆的DGAT家族基因蛋白序列。 利用MEGA-X 软件对拟南芥、水稻、玉米、大豆及谷子的DGAT家族基因进行序列比对,并以邻接法(Neighbor-joining,NJ;bootstrap=1 000)构建系统进化树,利用iTOL(https://itol.embl. de/)对进化树进行美化。
1. 2 谷子DGAT 基因家族成员蛋白理化性质分析
利用ExPASy 网站(https://web. expasy. org/protparam/)分析蛋白的理化性质。利用Softberry(http://linux1. softberry. com/)进行亚细胞定位预测。利用TMHMM 2. 0(www. cbs. dtu. dk/ser⁃vices/TMHMM-2. 0/)进行跨膜区预测。
1. 3 谷子DGAT 基因家族成员的保守基序和基因结构分析
利用MEME 在线网站(https://meme-suite.org/meme/)预测谷子DGAT 的保守基序,基序数目设置为20。 利用在线网站(https://www. ge⁃nome. jp/tools/motif/)预测Motif 的类型。利用TBtools 对谷子DGAT 基因结构进行可视化。
1. 4 谷子DGAT 基因家族成员的启动子顺式作用元件分析
提取谷子DGAT家族基因的上游2 000 bp 序列,提交至PlantCARE 在线网站(http://bioinfor⁃matics. psb. ugent. be/webtools/plantcare/html/)进行启动子顺式作用元件预测,利用TBtools 进行可视化。
1. 5 晋谷21 不同组织中DGAT 基因家族成员的表达模式分析
从MDSI 数据库下载谷子DGAT家族基因在晋谷21(JG21)不同组织的表达量数据,包括:FY(发芽种子-3 天)、D4sh(倒4 叶叶鞘)、D4Y(倒4叶)、FL(旗叶)、J2(倒2 节茎杆)、QYQ(旗叶叶鞘)、R(根)、SXJ(穗颈节)、S1(未成熟种子-S1)、S2(未成熟种子-S2)、S3(未成熟种子-S3)、S4(未成熟种子-S4)、S5(未成熟种子-S5)、d30(种子-成熟后30 天)和d60(种子-成熟后60 天)。利用TB⁃tools 绘制热图,比较基因表达差异。
1. 6 晋谷21 灌浆期籽粒中SiDGAT1 和SiDGAT2 的差异表达分析
对2020 年在山西农业大学试验基地种植的JG21 灌浆期S1(外观鲜绿,内含物呈乳状)和S3(外观黄绿,胚可与固态内含物分离)籽粒进行取样,置于液氮中速冻,保存于-80℃冰箱。 利用Trizol 法提取JG21 籽粒的总RNA,利用Primer Script RT reagent Kit(Takara)试剂盒进行反转录得到cDNA。根据JG21 转录组数据,选择在谷子籽粒中表达量较高的谷子DGAT家族基因,利用Primer6. 0 软件设计引物(表1),进行荧光定量PCR,根据2-ΔΔCt计算基因表达量。
1. 7 谷子DGAT 所在模块的共表达网络构建
从MDSI 数据库获取JG21 的15 个组织表达量数据,利用R 软件(R version 3. 6. 3)中的WGC⁃NA[18]包构建加权基因共表达网络。利用WGC⁃NA 包中的函数pickSoftThreshold 计算权重值,根据无尺度网络原则,选择软阈值power=9。使用函数blockwiseModules=5 000 构建无尺度网络。利 用cytoscape 3. 8. 2[19]绘 制SiDGAT2. 1 和SiDGAT2. 2 所在模块的共表达网络。
2 结果与分析
2. 1 谷子DGAT 的鉴定及系统进化分析
通过BLAST 和HMM search,共鉴定到14 个谷子DGAT 家族基因。将14 个谷子DGAT 与拟南芥、水稻、玉米以及大豆的DGAT 进行蛋白序列比对,构建系统进化树(图1)。结果显示,5 个物种的DGAT家族基因可划分为DGAT1、DGAT2、DGAT3 以及WSD4 个类群。 14 个谷子DGAT中,5 个属于DGAT1,2 个属于DGAT2,7 个属于WSD,谷子中没有DGAT3。依据谷子DGAT 基因类型和在染色体中的位置进行命名。
进一步分析发现,DGAT1 与DGAT2 亲缘关系较近,DGAT3 与WSD 的亲缘关系较近。各类群分支中,谷子基因总是与水稻和玉米基因聚在一起,而与拟南芥、大豆亲缘关系较远。谷子、水稻、玉米同为禾本科,拟南芥为十字花科,大豆为豆科。从DGAT1 中分析发现,谷子与玉米的亲缘关系较水稻更近,因为谷子与玉米同为C4作物,而水稻为C3作物。 DGAT2 中,SiDGAT2. 3、SiDGAT2. 4和SiDGAT2. 5单独聚为一类,表明其可能具有相似且特殊的功能。 WSD 中,Si⁃WSD1和SiWSD4可能与水稻中的WSD 功能更相似,SiWSD3则与玉米中的WSD 功能更接近,SiWSD5、SiWSD6 和SiWSD7 与其它谷子WSD亲缘关系较远,功能可能与其它蛋白有差异。
2. 2 谷子DGAT 的理化性质分析
分析谷子DGAT家族基因的序列特征发现(表2),14 个谷子DGAT 蛋白氨基酸数目在334~701 aa 之间,相对分子质量在37. 10~78. 35 ku 之间,等电点在6. 33~9. 76 之间,大部分蛋白质呈碱性;疏水性在-0. 212~0. 307 之间。亚细胞定位显示,SiDGAT2. 3、SiDGAT2. 4和SiDGAT2. 5定位于叶绿体,其余蛋白定位于内质网。跨膜区预测结果发现,SiDGAT1. 1、SiDGAT1. 2、SiDGAT2. 1、SiDGAT2. 2和SiWSD1含有跨膜区,其余蛋白质未检测到跨膜区。由于SiDGAT1和SiDGAT2是结构不同的膜结合酰基转移酶[20],WSD 是可溶性蛋白或膜结合蛋白[21],膜结合蛋白可能定位于内质网或叶绿体,可溶性蛋白可能定位于胞外。因此推测SiDGAT1. 1、SiDGAT1. 2、SiDGAT2. 1、SiDGAT2. 2和SiWSD1为膜蛋白。
2. 3 谷子DGAT 的保守基序及基因结构分析
将谷子DGAT 蛋白序列提交至MEME 在线网站进行保守基序预测,数目设置为20,并利用在线网站预测motif 的类型(图2)。不同类群之间差异明显,同种DGAT基因间具有相似的保守基序,且所有DGAT基因都有二酰甘油酰基转移酶的保守基序。 2 个SiDGAT1都具有motif12(MBOAT),是一种膜结合的酰基转移酶家族,与前人研究结果一致[3];5 个SiDGAT2都有Motif9(DGAT) ;SiDGAT2. 3、SiDGAT2. 4和SiDGAT2. 5特有motif17,预测为Hydrolase_4;7个SiWSD都含有motif1(WES_acyltransf)、motif4(WES_acyltransf)、motif2(WS_DGAT_C)、motif3(WS_DGAT_C)和motif5(WS_DGAT_C),表明其既有蜡酯合成功能,也在甘油三酯合成中发挥作用。
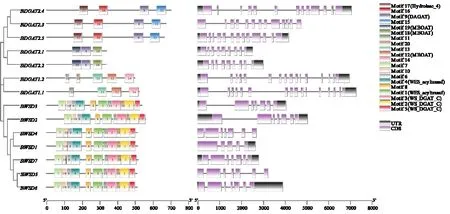
图2 谷子DGAT 家族蛋白保守基序及基因结构Fig.2 Protein conserved motif and sequence structure of DGAT gene family in foxtail millet
基因结构的分析结果显示,SiDGAT1具有16个外显子区;SiDGAT2. 1和SiDGAT2. 2都具有9个外显子区,SiDGAT2. 3、SiDGAT2. 4和SiDGAT2. 5具有13 个外显子区;SiWSD2、Si⁃WSD3、SiWSD4、SiWSD5、SiWSD6和SiWSD7都具有7 个外显子区,而SiWSD1具有5 个外显子区。除SiWSD1外,聚为一簇的基因具有相似的结构。
本研究的目标分析物是合成麝香,对水样的预处理主要包括过滤、萃取和浓缩。采用玻璃纤维滤纸在真空条件下进行水样过滤,使溶解相和颗粒相分离。对于溶解相,量取1.5 L过滤后的水样至分液漏斗中,加入 10 µL 500 ng·mL-1 DnBP-d4 回收率指示物标准溶液,混匀后再加入50 mL二氯甲烷进行液液萃取(3次);对于颗粒相,将玻璃纤维滤纸中的颗粒相样品加入到索氏抽提器中以150 mL二氯甲烷静置萃取24 h。将萃取液过无水硫酸钠以去除剩余水分,收集萃取液于250 mL蒸发瓶中,旋转蒸发浓缩至1 mL左右,最后氮吹浓缩至约 150 µL。
2. 4 谷子DGAT 的启动子顺式作用原件分析
为了探究谷子DGAT家族基因在非生物胁迫中可能存在的调控机制,利用PlantCare 数据库对其上游2 000 bp 序列进行了分析(图3),共鉴定到14 类顺式作用原件,包括:光响应、厌氧诱导、脱落酸响应、MYB 结合位点、生长素响应、玉米醇溶蛋白代谢调节、水杨酸响应、赤霉素响应、昼夜节律响应、胚乳表达、分生组织表达、低温响应和抗逆。SiDGAT2. 2和SiDGAT2. 4启动子区含有的顺式作用原件种类最多(10 种),SiDGAT2. 1和Si⁃WSD2启动子区含有的顺式作用元件数目较少(6种)。所有谷子DGAT 启动子区均包含光响应、厌氧诱导、脱落酸响应和茉莉酸甲酯响应元件。从组成类型特异性来看,大部分基因启动子区都包含MYB 结合位点和分生组织表达元件;约半数基因启动子区含有生长素和赤霉素响应元件;SiDGAT1. 1、SiWSD1、SiWSD3、SiWSD4和Si⁃WSD5的启动子区包含脱落酸响应元件;SiDGAT1. 1、SiDGAT1. 2、SiDGAT2. 2和SiDGAT2. 5启动子区含有低温响应元件;SiDGAT1. 2和SiDGAT2. 3启动子区包含昼夜节律控制元件;SiDGAT1. 1和SiWSD3启动子序列含有栅栏状叶肉细胞分化相关的元件;SiDGAT2. 3和SiDGAT2. 5启动子区序列含有与胚乳表达相关的作用元件;仅SiDGAT2. 4启动子区含有与细胞周期调控相关的作用元件。
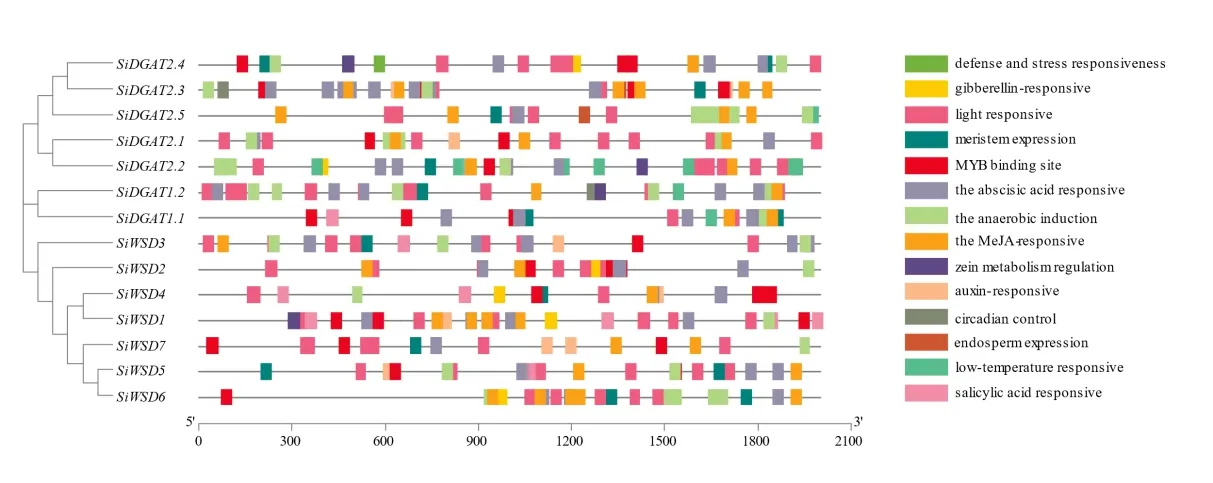
图3 谷子DGAT 家族基因启动子顺势作用元件分布Fig.3 Distribution of cis-acting elements in the promoter region of DGAT gene family in foxtail millet
2. 5 谷子DGAT 的表达模式分析
JG21 不同组织及收获后籽粒中表达模式分析显示(图4),SiDGAT1在谷子各个组织中均有表达;SiDGAT1. 1在灌浆期籽粒和发芽种子种表达量较低,在叶、叶鞘、茎秆和根中表达量较高;SiDGAT1. 2则相反,在S2 中表达量最高。SiDGAT2中,SiDGAT2. 1在旗叶鞘、根、穗下节和S5 中高表达;SiDGAT2. 2整体表达量较高;SiDGAT2. 3和SiDGAT2. 4在发芽3 d 种子和根中表达量较高;未检测到SiDGAT2. 5的表达。Si⁃WSD在灌浆期籽粒中几乎不表达;除SiWSD3外,SiWSD在发芽3 d 的种子中表达量较高;Si⁃WSD2也根中高表达;SiWSD4在旗叶、旗叶鞘、倒4 叶和倒4 叶鞘中高表达,可能与蜡酯合成的功能有关。
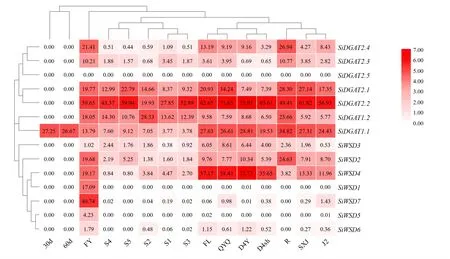
图4 谷子DGAT 基因表达谱Fig.4 Gene expression profiles of DGAT genes in foxtail millet
谷子灌浆期籽粒中(S1~S5),SiDGAT2. 1和SiDGAT2. 2的表达呈上升趋势,且SiDGAT2. 2是所有谷子DGAT基因中在灌浆期籽粒中表达量最高的,表明SiDGAT2在谷子籽粒甘油三酯和脂肪酸的积累中发挥重要作用;SiDGAT2. 2在S2 时期表达量降低,而SiDGAT1. 2在S2 时期表达量最高,表明谷子籽粒灌浆期S2 时SiDGAT1. 2发挥主要作用;SiDGAT1. 1是谷子DGAT 家族基因中唯一在收获后30 d 和60 d 籽粒中表达的基因,可能参与谷子后熟;SiWSD对灌浆期谷子籽粒中甘油三酯和脂肪酸积累的作用较小。
2. 6 晋谷21 籽粒灌浆期SiDGAT1 和SiDGAT2的表达模式分析
为了进一步筛选在谷子籽粒甘油三酯积累过程中发挥重要作用的基因,对JG21 灌浆期S1 和S3 的籽粒进行取样,利用荧光定量PCR 检测了SiDGAT1和SiDGAT2的相对表达量(图5)。结果显示,除SiDGAT2. 5外,其余6 个基因的表达都在S3 显著上调,表明其在谷子籽粒灌浆过程中发挥一定作用。部分基因的表达趋势与转录组分析结果不同,可能是由于取样的差异导致。谷子籽粒灌浆前期,胚形成,胚乳固化,油脂快速积累[22],是甘油三酯积累的重要时期。SiDGAT2. 1和SiDGAT2. 2从S1 至S3 表达量升高了8 倍左右,推测其可能在谷子籽粒甘油三酯积累中发挥重要作用。
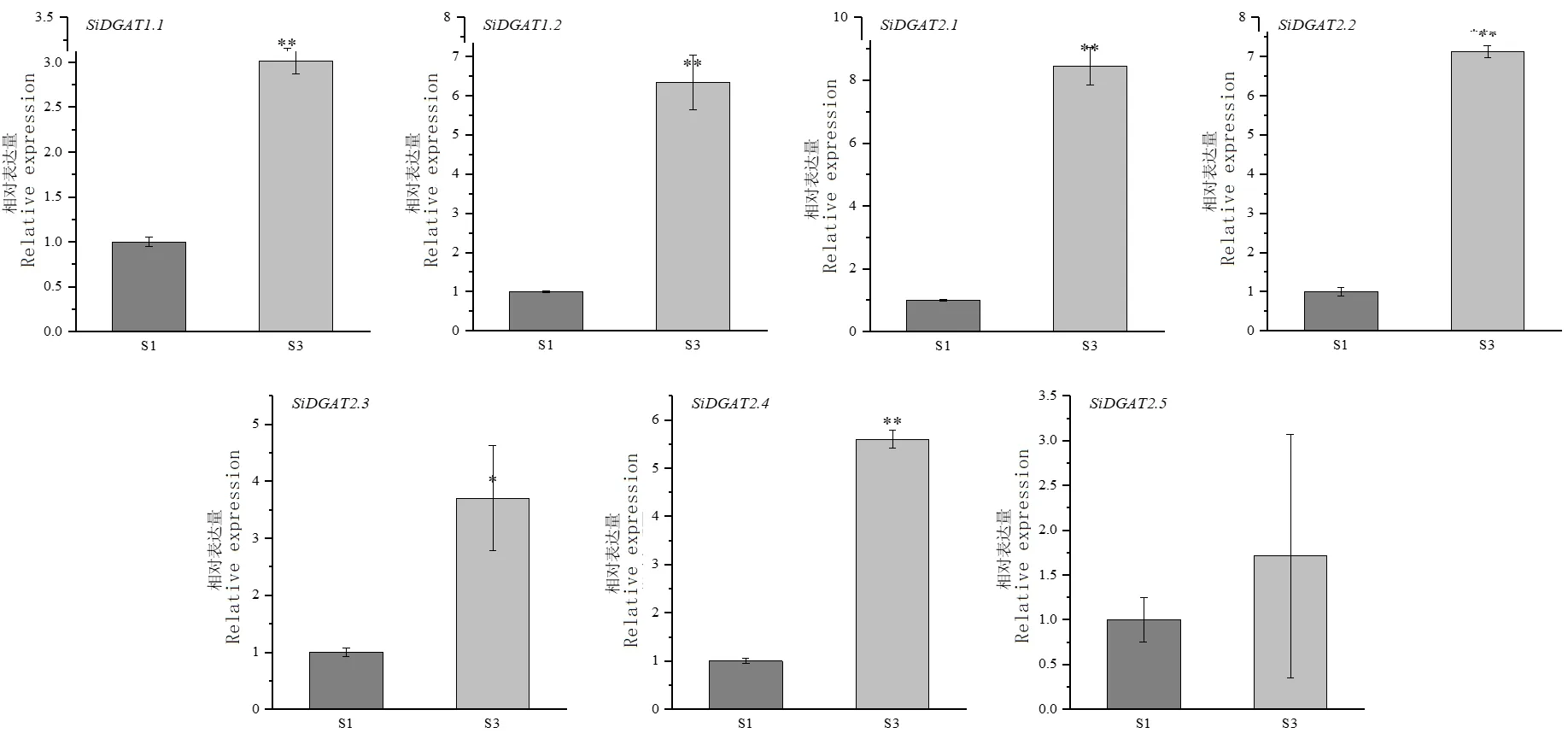
图5 SiDGAT1 和SiDGAT2 在灌浆期谷子籽粒中的表达分析Fig.5 Expression analysis of SiDGAT1 and SiDGAT2 at grain filling stage of foxtail millet
2. 7 谷子DGAT 的共表达网络分析
利用WGCNA 包中的goodSamplesGenes 函数检测并过滤缺失值基因,最终获得29 727 条转录本用于后续加权基因共表达网络分析。选择软阈值power=9 来构建权重基因网络,设置模块最小基因数minModuleSize=30,合并模块参数mergeCutHeight=0. 25,maxBlockSize=6 000,构建加权基因共表达网络模块。最终得到25 个基因共表达网络模块,模块中基因个数17~7 810 不等。13 个谷子DGAT 基因(SiDGAT2. 5被过滤掉)分布在8 个模块中。DGAT2 在谷子籽粒灌浆期发挥着较为重要的作用,因此本研究选取SiDGAT2. 1所在的模块1 和SiDGAT2. 2所在的模块2 进行分析。利用Cytoscape 对模块共表达网络进行可视化(图6),筛选模块的核心基因和转录因子,在水稻数据库及拟南芥数据库中进行同源基因功能注释(表3)。
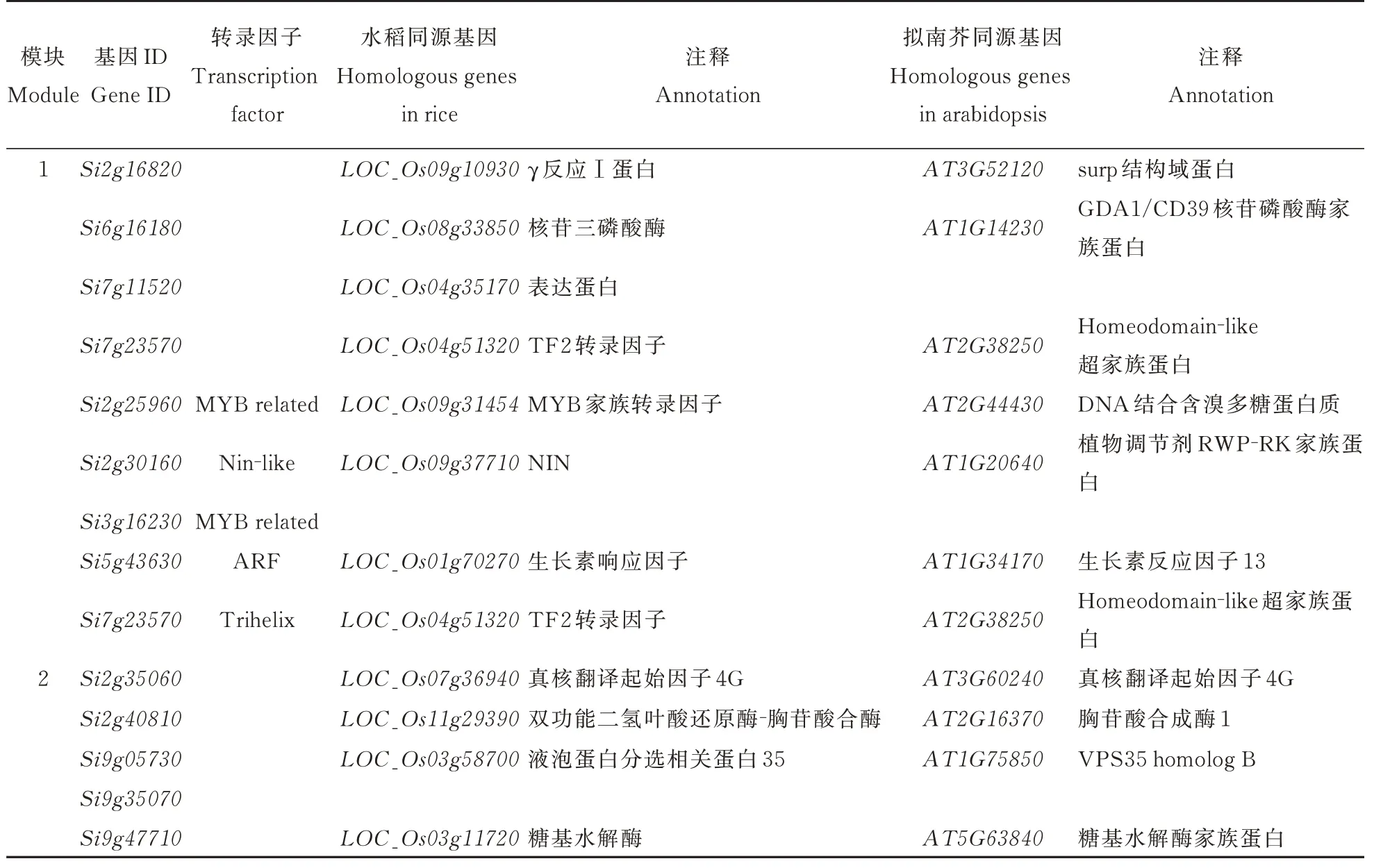
表3 共表达网络核心基因和转录因子注释Table 3 Functional annotation of co-expression network core genes and transcription factors
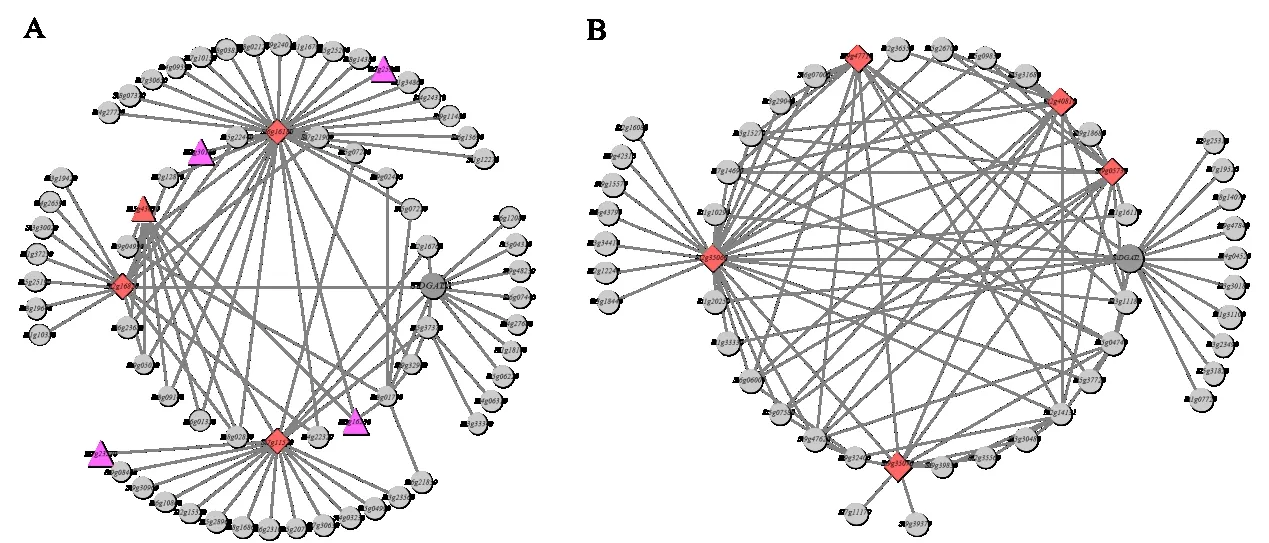
图6 模块1(A)和模块2(B)的共表达网络Fig.6 Co-expression network of module 1(A)and module 2(B)
在模块1 中筛选到5 个核心基因和5 个转录因子。Si5g43630预测为ARF 转录因子,与生长素运输相关,同时也是模块的核心基因,表明其在模块1 中具有重要的作用;Si2g25960和Si3g16230预测为MYB-related 转录因子;Si7g23570预测为Tri⁃helix 转录因子;Si2g30160预测为Nin-like 转录因子。在模块2 中筛选到5 个核心基因,Si9g05730注释为液泡分选蛋白,与生长素运输等生物过程相关[23];Si9g47710注释为糖基水解酶,可能与糖脂的形成有关。
筛选网络中与SiDGAT2相关联的基因、与核心基因高连通性的基因作为候选基因,进行同源基因功能注释(表4)。其中包含脂肪水解酶、磷脂转运酶、甘油醛磷酸脱氢酶、半乳糖酰基甘油合酶等与脂质合成相关的酶;还有含C3HC4 结构域的锌指蛋白,与小麦的干旱和盐胁迫相关[24];含PHD结构域的蛋白,其主要功能是与各种组蛋白修饰特异结合,作为组蛋白密码识别器来调控下游基因的表达[25];含GRAM 和C2 钙/脂结合结构域的蛋白;和含MIF4G 结构域的蛋白。
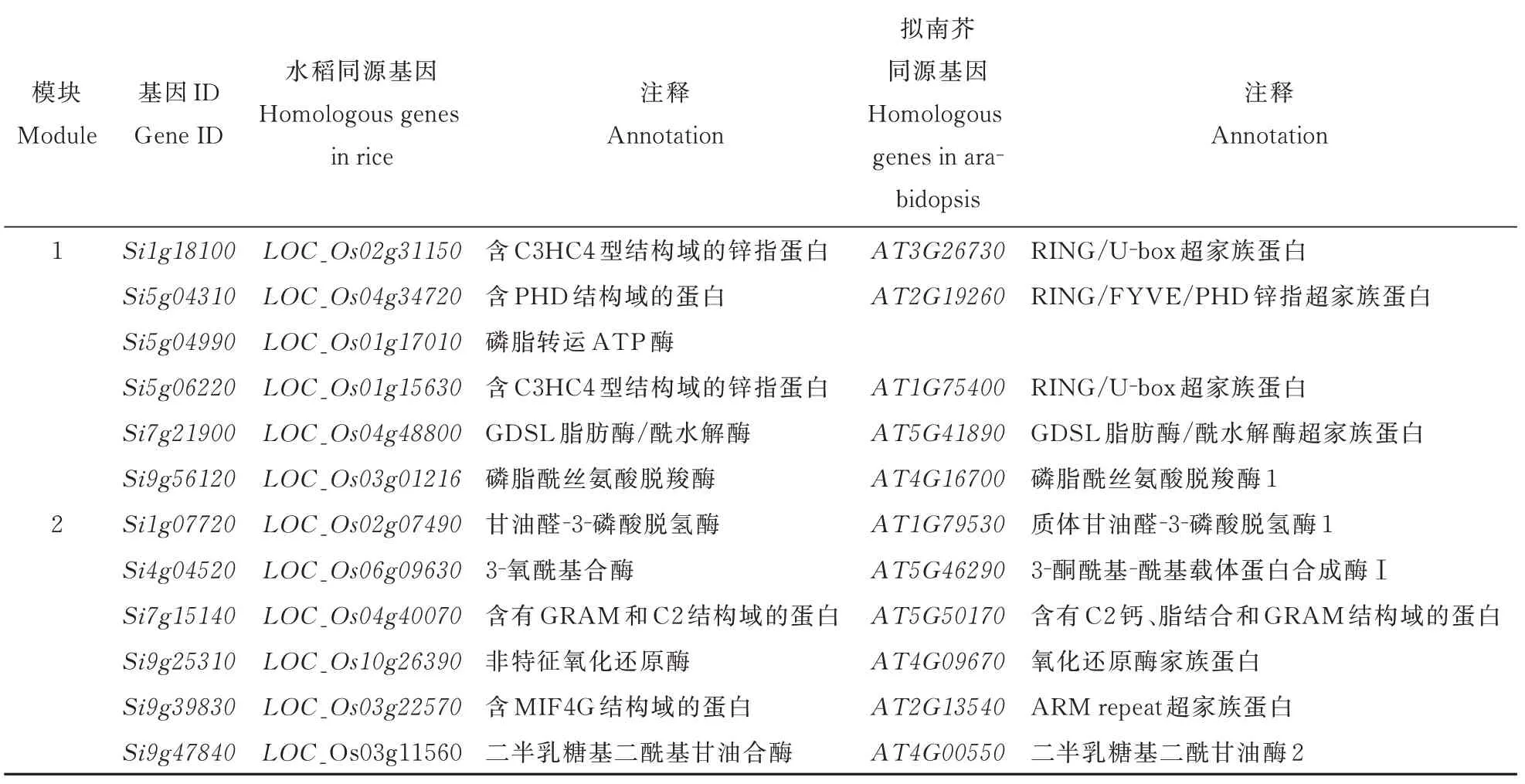
表4 候选基因功能注释Table 4 Functional annotation of candidate genes
3 讨论
本研究通过生物信息学分析鉴定到14 个谷子DGAT基因,并对其进化模式、序列特征、基因结构、亚细胞定位和表达模式进行系统分析,利用WGCNA 挖掘了可能与谷子DGAT2 存在调控关系的候选基因。这14 个谷子DGAT基因属于3 个类群:DGAT1(2 个)、DGAT2(5 个)和WSD(7个),未鉴定到DGAT3。 有研究发现DGAT3 有较高的底物特异性,敲除CsDGAT3-3 基因会导致亚麻荠种子中花生烯酸的积累减少[26]。谷子中花生烯酸C20∶1 较少[15],可能不存在DGAT3 或几乎不表达。
本研究发现谷子DGAT 不仅可能在甘油三酯合成中发挥作用,也可能参与植物逆境、低温等非生物胁迫响应,这与以往研究一致[27]。植物遭遇逆境时膜流动性会发生变化,而脂肪酸与膜流动性有关[28]。 大部分谷子DGAT 启动子区都含有MYB 结合位点,表明谷子DGAT 可能受MYB 转录因子的调控。
双子叶植物中的DGAT1 在灌浆期籽粒中高表达,而在叶和茎中低表达[29~31]。 但本研究中SiDGAT1. 1在灌浆期籽粒中表达量较低,反而是唯一在收获后的种子中表达的DGAT基因,推测在谷子籽粒的后熟过程中具有重要作用。
与DGAT1 相比,DGAT2 更侧重于脂肪酸的积累,在一些含有稀有脂肪酸的植物中,DGAT2更重要[6]。种子中DGAT2 的高表达能显著增加含油量和不饱和脂肪酸的含量[32]。谷子中没有在灌浆期籽粒中特异性高表达的DGAT基因,这可能是小米含油量无法与油料作物相比的原因之一。 谷子中不饱和脂肪酸占比达80%,SiDGAT2. 2在谷子籽粒灌浆期的表达明显高于其他基因,且在灌浆前中期显著上调,可能对谷子籽粒中不饱和脂肪酸的积累具有重要作用。DGAT2 以微粒体形式存在,结合在内质网膜上[33],但本研究中SiDGAT2. 3、SiDGAT2. 4、SiDGAT2. 5的亚细胞定位结果为叶绿体,且在系统进化分析中单独聚为一类,这与以往研究存在差异,但也有研究发现叶片中的TAG 合成发生在叶绿体被膜上,并以质体小球的形式释放到叶绿体基质中[5,34,35],这3 个基因在谷子叶、茎秆等组织中的表达高于在灌浆期籽粒中,推测其主要在叶片的TAG 合成中发挥作用。
WSD 是具有蜡酯合成和二酰甘油酰基转移酶功能的双功能酶。蜡酯主要存在于植物初生芽的角质层,或以较高的浓度积累在种子中[36]。Si⁃WSD主要在叶、茎秆及萌发的种子中表达,其主要作用于蜡酯合成还是甘油三酯合成仍需进一步深入研究。
另外,本研究通过WGCNA 挖掘了与SiDGAT2. 1和SiDGAT2. 2相关联的基因。候选基因中包括MYB-related、ARF、NIN、Trihelix 转录因子,在生长发育、非生物胁迫[37]、氮信号调节[38]等过程中发挥作用;还有各种功能蛋白和酶。通过对候选基因的功能注释,发现DGAT 可能参与多种生物学过程。
4 结论
本研究通过生物信息学分析,鉴定了14 个谷子DGAT基因,分为3 个类群,同一类群基因具有相似的结构和功能;谷子DGAT 基因启动子区包含生长发育、非生物胁迫相关的顺式作用原件;基于不同组织表达模式分析推测2 个SiDGAT2在谷子籽粒甘油三酯积累中发挥着重要作用;利用15份谷子组织转录组数据进行了WGCNA,挖掘了潜在的影响谷子籽粒甘油三酯合成的基因和转录因子,为深入探究谷子甘油三酯和脂肪酸的积累提供依据。

