蜡样芽孢杆菌拮抗菌株的筛选鉴定及其发酵液抗菌活性分析
王 洁,龚国利,闵建红,李 慧
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
蜡样芽孢杆菌(Bacilluscereus)是一种常见的食源性致病菌,其自身可以产生腹泻毒素和呕吐毒素(Cereulide),误食B.cereus污染的食品后,人们会出现呕吐型或腹泻型的食物中毒症状[1-3].在我国生物性食物中毒事件中,由B.cereus引起的细菌性食物中毒事件发生率比较高,仅在沙门氏菌(Salmonellaspp)之下,威胁着公共食品安全[4-6].早些年,人们为防止B.cereus以及各种食源性致病菌的污染,将与此相关的抗生素或半合成抗生素添加到食品中以抑制病原菌生长.但抗生素的滥用使细菌对其产生了耐药性,出现了超级细菌,且对人的身体造成了严重危害.因此,在现阶段,寻找一种既能有效预防病原菌生长又不产生耐药性的新型抗菌物质,已成为众多研究者关注的焦点.而天然抗菌物质因具有抗菌性强和抗菌谱广等优势,受到越来越多人的关注[7].黄现青等[8]研究了常见的抗生素和天然活性物质对B.cereus的抑制效果,结果表明天然活性物质乳酸链球菌素的抑菌效果最好.
青海湖位于我国的西北部,所处环境复杂,生态系统较脆弱,且该区域土壤具有沙漠化和盐碱化现象,是研究极端环境微生物的理想对象[9-11].本研究以青海湖淤泥土壤为实验样品,从中筛选分离出一株对蜡样芽孢杆菌有较强抑制活性的短短芽孢杆菌菌株JH3,并进一步测定了该菌株抗菌物质对热、紫外线、pH和蛋白酶的稳定性.
1 材料和方法
1.1 材料与试剂
1.1.1 主要试剂与设备
土壤样品随机取自中国青海湖淤泥土壤,于4 ℃保存.
蛋白胨、牛肉膏、琼脂粉(北京奥博星生物技术有限公司);DNA marker、Taq DNA聚合酶(北京天根生化科技有限公司);细菌基因组快速提取试剂盒、胰蛋白酶、胃蛋白酶、木瓜蛋白酶、蛋白酶k(上海捷瑞生物工程有限公司).
DYY-11核酸电泳仪(北京市八一仪器厂);TGL-16M高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);BIS-910凝胶成像仪(北京东胜创新生物有限公司);PTC-200TM PCR仪(美国Bio-rad公司).
1.1.2 指示菌与培养基
(1)指示菌:蜡样芽孢杆菌(B.cereus)、大肠杆菌(Escherichiacoli)、藤黄微球菌(Mirococcusluteus)、金黄色葡萄球菌(Staphylococcusaureus)、耐甲氧西林金黄色葡萄球菌(MRSA)和铜绿假单胞菌(Pseudomonasaeruginosa),由陕西科技大学食品与生物工程学院微生物实验室提供.
(2)培养基:NA培养基:牛肉膏5 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂15 g/L,pH7.2;NB培养基:牛肉膏5 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH7.2.
1.2 实验方法
1.2.1 菌株的分离与纯化
取5 g土壤样品添加到100 mL生理盐水中后,进行10倍梯度稀释,取稀释度为10-5、10-6、10-7、10-8的溶液涂布于NA培养基,37 ℃培养24 h.随机挑取菌落特征不同的单菌落划线分离,挑取单菌落贮存备用.
1.2.2 拮抗菌株的初筛
按照Chahad等[12]的方法,在NB培养基中接入蜡样芽孢杆菌,37 ℃,200 rpm培养12 h后,将菌体培养液稀释到1×108cfu/mL,均匀涂布于NA培养基上,再用点种法将分离到的全部菌株点种于NA培养基上.37 ℃培养24 h,测定抑菌活性.
1.2.3 拮抗菌株的复筛
挑选抑菌性状稳定的单菌落,接种于NB培养基,37 ℃,200 rpm发酵培养36 h后,4 ℃、11 000 rpm离心15 min,得发酵上清液.过滤除菌后,采用琼脂扩散法测定其对各指示菌的抑菌活性.选取抑菌活性最显著且最广的菌株贮存备用.
1.2.4 形态学特征
将复筛后的菌株接种于NA培养基,37 ℃培养24 h,观察菌株的外观形态,同时进行革兰氏染色,并用光学显微镜观察菌体的细胞特征.
1.2.5 基于16S rDNA基因的分子生物学鉴定
目标菌株基因组DNA提取:将菌株接种于NB培养基中摇瓶培养后,取5 mL菌液8 000 rpm离心5 min,收集菌体细胞,用TE缓冲液重悬,用细菌基因组试剂盒提取菌株的DNA.后进行16S rDNA基因的PCR扩增:16S rDNA扩增通用引物是:正向引物(27F):5′-AGTTTGATCMTGGCTCAG-3′;反向引物(1492R):5′-GGTTACCTTGTTACGACTT-3′,PCR的反应体系:引物F ,0.5μL;引物R ,0.5μL;2×San Taq PCR Mix,10μL;模板DNA ,2μL;dd H2O,7μL;总反应体系20μL.扩增的各阶段条件为:预变性:94 ℃下处理3 min;变性:94 ℃下处理30 s;退火:60 ℃下处理30 s;延伸:72 ℃下处理1.5 min.30个循环(变性-退火-延伸)后,在72 ℃下再延伸5 min.
PCR扩增结束后,进行琼脂糖凝胶电泳检测,将电泳结束后的凝胶拍照,观察PCR产物有无非特异性条带,以及产物的纯度和DNA片段大小,无误后,将PCR产物送公司(上海生工生物工程有限公司)测定16S rDNA序列.将测得的序列在NCBI上的Gen Bank序列数据库进行Blast比对分析,在基因数据库中进行同源性搜索比对.
1.2.6 系统发育树的构建
找到同源性较高的细菌后,挑出模式菌株,并下载这些菌株的基因序列,利用MEGA(Ver.6.06)软件进行系统发育树的构建,进而确定此菌株的种属信息[13-15].
1.2.7 生理生化鉴定
通过硝酸盐还原、明胶液化、淀粉水解、接触酶、柠檬酸盐利用、产硫化氢、葡萄糖发酵产酸、吲哚和V-P试验,以及5% NaCl下和温度50 ℃时菌株生长情况的试验等对菌株进行生理生化鉴定.具体方法参照《伯杰细菌鉴定手册》[16]和《常见细菌系统鉴定手册》[17].
1.2.8 抗菌物质的制备
采用饱和硫酸铵沉淀菌株发酵上清液,得到抗菌粗提物后,再经离子交换层析(DEAE-52)与凝胶过滤层析(Sephadex G-100)分离纯化,得到抗菌物质[18,19].
1.2.9 抗菌物质的热稳定性试验
将抗菌物质纯化物分别在30 ℃、50 ℃、70 ℃、90 ℃和100 ℃水浴中放置20 min,冷却后,检测其对蜡样芽孢杆菌的抑菌活性.
1.2.10 抗菌物质的紫外照射敏感性试验
将抗菌物质纯化物在距离30 W紫外灯30 cm处各照射30、60、90、150、180和240 min后[20],检测其对蜡样芽孢杆菌的抑菌活性.
1.2.11 抗菌物质的蛋白酶稳定性试验
将抗菌物质纯化物分别以5 mg/mL的木瓜蛋白酶、胰蛋白酶、蛋白酶k、胃蛋白酶37 ℃处理2 h后,检测其对蜡样芽孢杆菌的抑菌活性.
1.2.12 抗菌物质的酸碱稳定性试验
用1 mol/L HCl和NaOH溶液将抗菌物质稀释液的pH值分别调到3~11的范围,静置一段时间后,将各个溶液的pH值调回中性且保证体积相同,检测样品对蜡样芽孢杆菌的抑菌活性.
2 结果与讨论
2.1 拮抗菌株的分离筛选结果
从青海湖的淤泥土壤中初步分离到3株抑制蜡样芽孢杆菌生长的拮抗菌株.用点种法进行初筛,发现a菌株的抑菌活性时有时无,不稳定,b、c两菌株抑菌效果较好(图1).用琼脂扩散法进行复筛发现,菌株c抑菌活性较菌株b更好(表1),对大肠杆菌和铜绿假单胞菌的抑菌活性显著强于b(P<0.01),且对表中所有指示菌均有较强的抑制作用,抑制蜡样芽孢杆菌生长的能力最强(图2).把菌株c作为接下来的实验用菌,并命名为“JH3”.
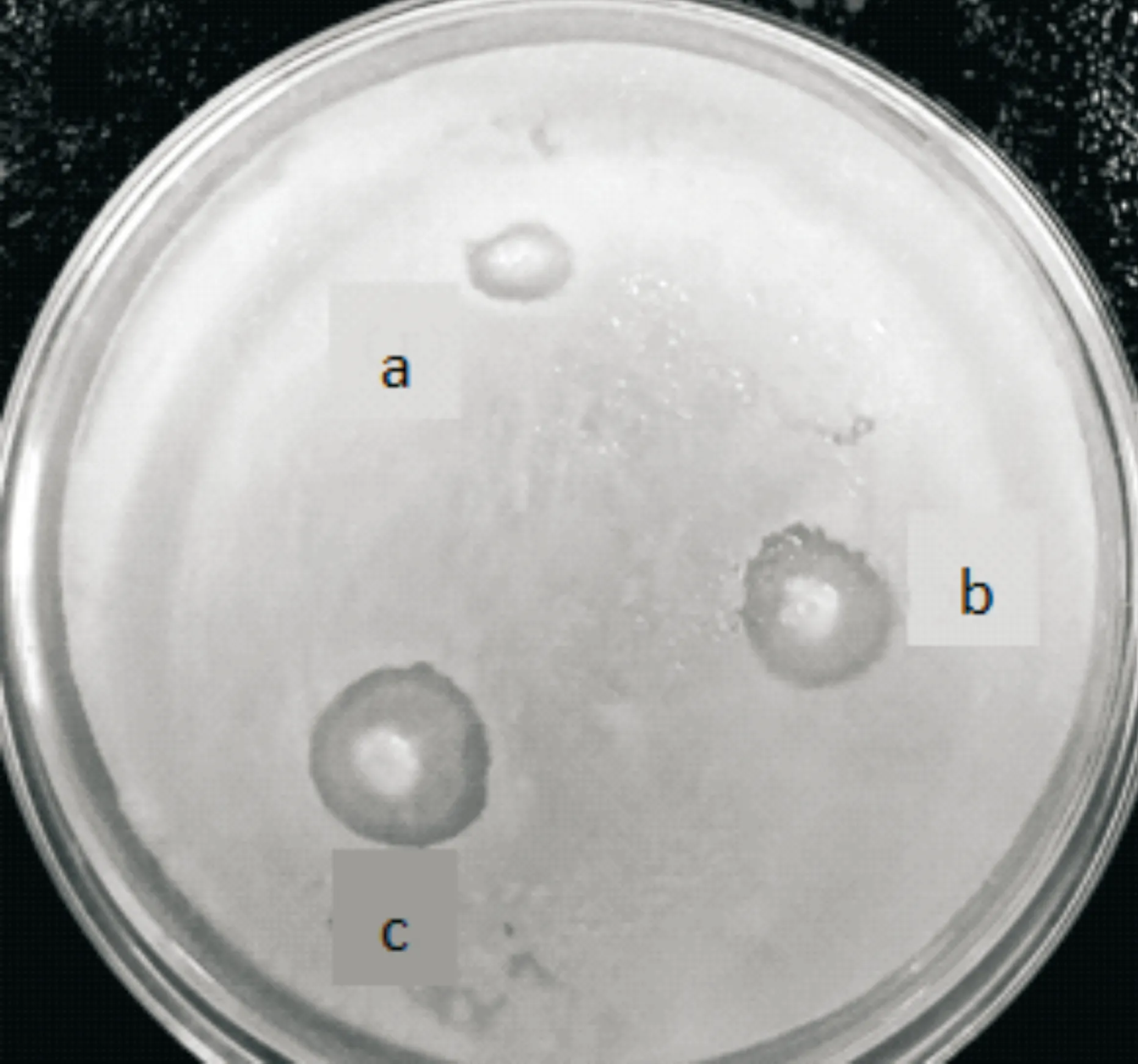
图1 拮抗菌株的筛选及其抑菌活性测定
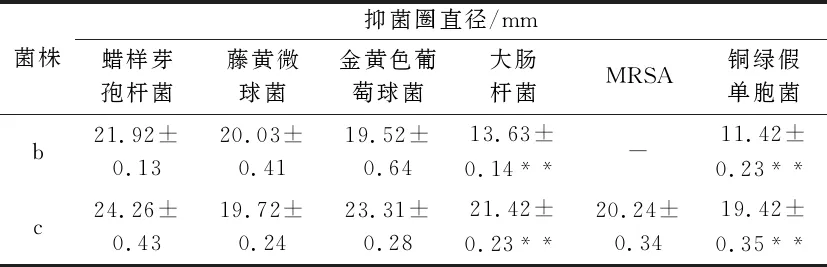
表1 菌株发酵液对指示菌的抑菌作用

图2 菌株JH3发酵液对蜡样芽孢杆菌的抑菌效果
2.2 拮抗菌株JH3的鉴定结果
2.2.1 形态学特征
由图3可知,在NA培养基上生长的菌株JH3形成的单菌落是亮白色,接近圆形,不透明且有光泽,没有色素产生;通过革兰氏染色后,菌体细胞是蓝紫色的,为革兰氏阳性菌.细胞呈短杆状.
(a)菌落形态
2.2.2 基于16S rDNA基因的分子生物学鉴定
对菌株JH3的基因进行PCR扩增后,进行琼脂糖凝胶电泳检测,发现在1 500 bp附近出现单一的PCR条带,条带明亮且清晰,说明PCR扩增得到的目的DNA片段纯度较高,可送至公司对菌株JH3的16S rDNA进行测序.
2.2.3 系统发育树的构建
将菌株JH3的16S rDNA基因序列(登录号MF787615.1)和NCBI数据库中已知细菌比较,发现菌株JH3的基因序列和短芽孢杆菌属(Brevibacillus)的短短芽孢杆菌(B.brevis)同源性为100%.以与菌株JH3同源性较高的细菌的基因序列为基础,采用MEGA6.06绘制菌株JH3的系统进化发育树(图4).从图可以看出,和菌株JH3基因序列同源性最高的是短短芽孢杆菌(Brevibacillusbrevisstrsin NBRC100599).按照Wu等[21]的研究,基因序列同源性高于99%的两株菌,可把它们归属为同一种,由此初步确定菌株JH3为短短芽孢杆菌.
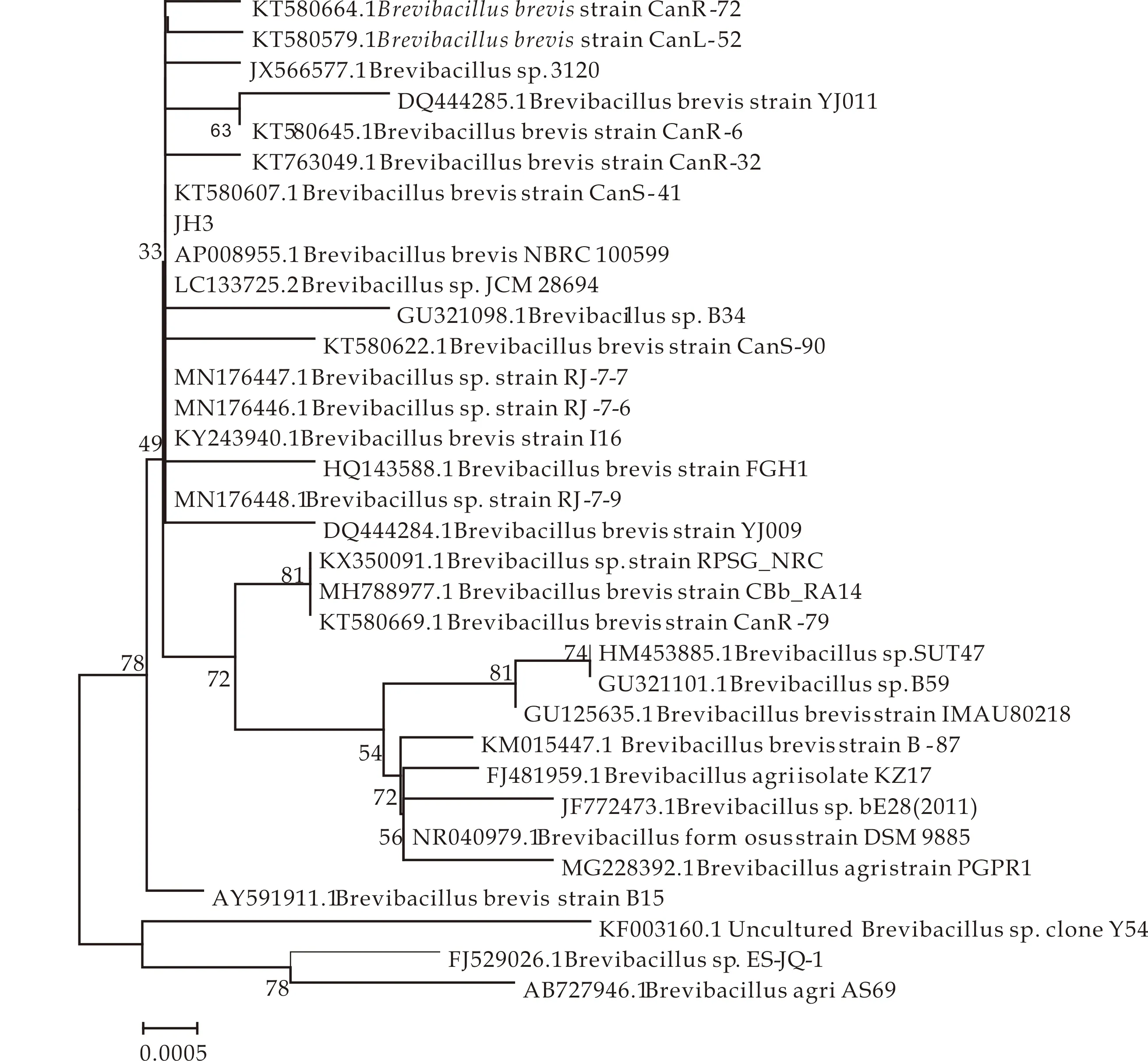
图4 菌株JH3的系统进化发育树
2.2.4 生理生化鉴定
为进一步确定JH3菌株具体的种,用生化试验对其进行验证(表2).对照细菌鉴定手册,并结合上述形态学观察、革兰氏染色、16S rDNA分子生物学鉴定实验结果,最终确定菌株JH3是短芽孢杆菌属的短短芽孢杆菌.

表2 菌株JH3生理生化鉴定结果
2.3 抗菌物质稳定性分析
2.3.1 抗菌物质的热稳定性试验
不同温度处理20 min后,测定抗菌物质对蜡样芽孢杆菌的抑菌活性.在30 ℃~90 ℃之间,与对照组相比,各温度对抗菌物质抑菌活性的影响较小;温度为100 ℃时,抑菌活性显著降低(P<0.05),是对照组的76.03%(图5),说明该抗菌物质热稳定性较好.
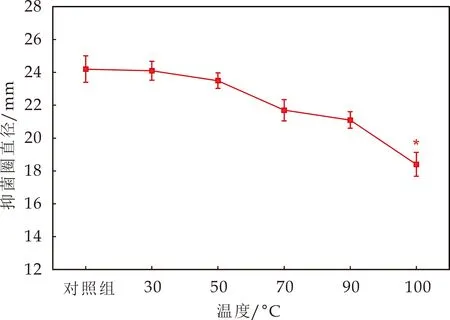
图5 温度对抗菌物质抑菌活性的影响
2.3.2 抗菌物质的紫外照射敏感性试验
探究该抗菌物质的紫外线照射敏感性发现,在紫外灯下照射30~150 min,与对照组相比,抗菌物质的抑菌活性变化很小;照射150~240 min,抑菌活性显著降低(P<0.05)(图6),说明该抗菌物质可在150 min内耐受紫外线照射.

图6 紫外线照射对抗菌物质抑菌活性的影响
2.3.3 抗菌物质的酸碱稳定性试验
探究该抗菌物质的酸碱稳定性发现,在不同pH(3~11)条件下,抗菌物质对蜡样芽孢杆菌仍有较强的抑菌活性.在pH为3时,抑菌活性最低,pH在3~5时,与对照组相比,抑菌活性显著降低(P<0.05);当pH为6~11时,与对照组相比,抗菌物质的抑菌活性略微下降(图7),说明该抗菌物质对酸碱具有一定的耐受性.
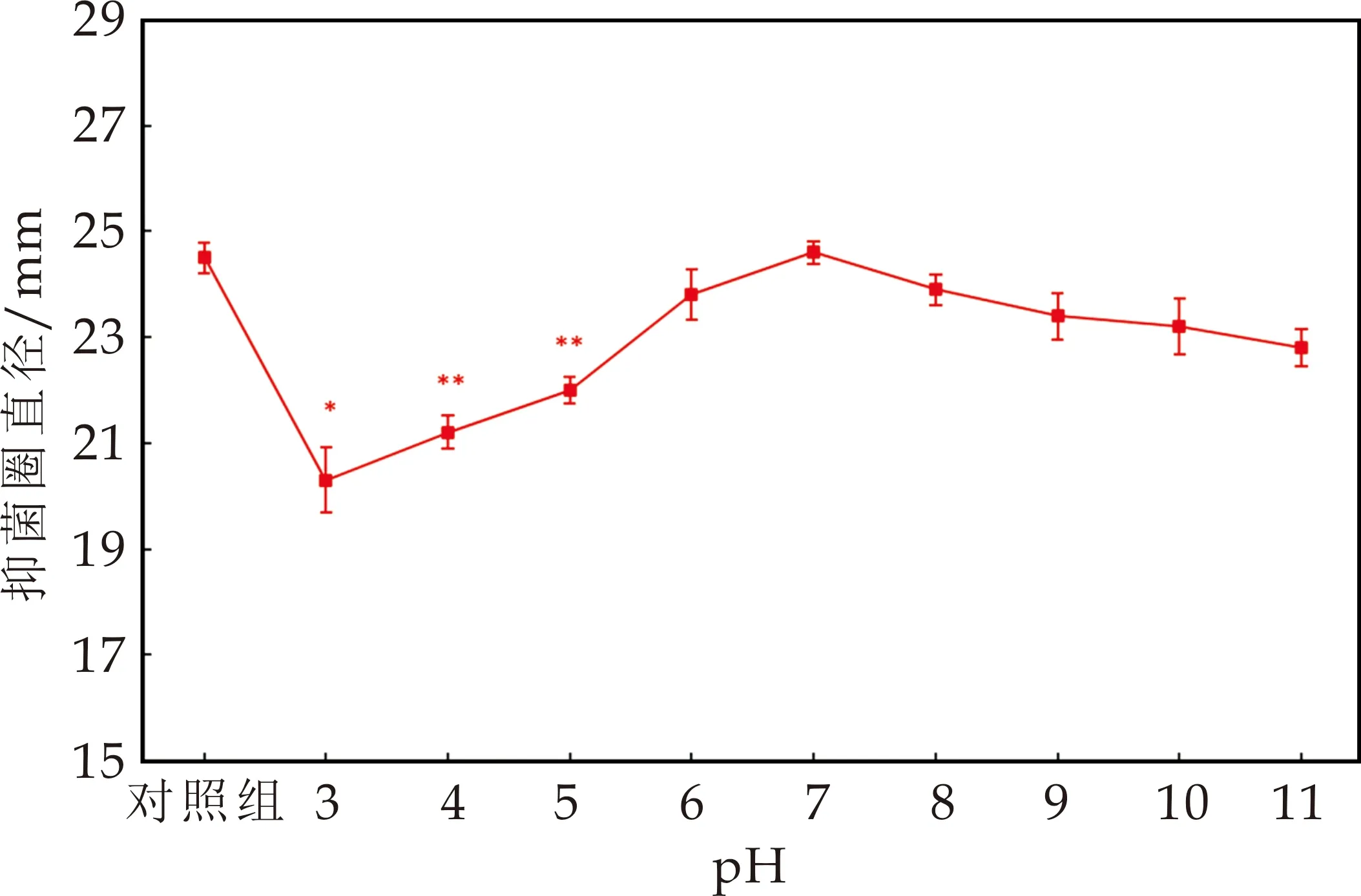
图7 pH对抗菌物质抑菌活性的影响
2.3.4 抗菌物质的蛋白酶稳定性试验
研究常见的蛋白酶对抗菌物质的稳定性影响发现,与对照组相比,胰蛋白酶处理后的抗菌物质对蜡样芽孢杆菌的拮抗作用显著变小(P<0.05).而木瓜蛋白酶、蛋白酶k和胃蛋白酶对抗菌物质的稳定性影响较小(图8).

图8 蛋白酶对抗菌物质抑菌活性的影响
3 结论
本研究从青海湖的淤泥土壤中初步分离到3株抑制蜡样芽孢杆菌生长的拮抗菌株,将其中一株拮抗效果最好的菌株JH3鉴定为短短芽孢杆菌(B.brevis).对其抗菌物质理化性质的研究结果表明,该物质有较好的热稳定性,对紫外线照射不敏感,对酸碱有一定的耐受性.胰蛋白酶对该抗菌物质的稳定性影响较大,而木瓜蛋白酶、蛋白酶k和胃蛋白酶影响较小.本实验可为该抗菌物质后续在食品工业中的应用研究提供基础数据和参考.

