微生物代谢合成呋喃酮的培养条件和酶学调控研究进展
潘百玲,戴凌燕,刘微,彭辉,邓景致,李志江,3,4
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江八一农垦大学生命科学技术学院;3.黑龙江省杂粮加工及质量安全工程技术研究中心;4.北大荒现代农业产业技术省级培育协同创新中心)
2,5-二甲基-4-羟基-3(2H)-呋喃酮(HDMF),商品名为呋喃酮,广泛分布在自然界生物中。在浓度较高时HDMF具有焦糖香味,由于在浓度较低时呈现清香的草莓、菠萝香味,又可称为菠萝酮或草莓酮。HDMF作为一种调味香料,与同类产品相比具有更低的香味阈值(0.04 ppb)[1],并且具有极高的商业价值,被广泛应用于食品、饮料、烟草、化妆品等各种行业中[2]。HDMF虽然广泛存在于天然产物中,但由于其含量很低,不能满足日常所需,所用的多为人工合成产品。
在欧洲和美国,将物理方法和生物合成法(酶催化或微生物发酵法)生产的香料标记为“天然”的调味剂和芳香剂等[1]。天然的HDMF与人工合成的HDMF相比,香气纯正、浓厚,且安全性高,具有不可替代性。随着人们对天然产品的需求不断提高以及对HDMF的广泛应用,市场上对HDMF的需求量也越来越大,尤其是食品界对天然HDMF的需求量日益增加。因此,利用生物合成法生产天然HDMF是现阶段研究和应用的主要趋势,并且具有良好的发展前景。
1 呋喃酮的制备方法
目前,HDMF的生产方法主要包括溶剂提取法、化学合成法和微生物合成法。HDMF天然提取法可以从菠萝、草莓等水果中直接提取分离,但含量均较低,且分离、提取成本较高,因此天然提取法不适用于大量生产天然HDMF。关于HDMF的化学合成方法已得到广泛研究,但化学合成的HDMF存在合成步骤较多、产物的香气特征不佳、得率不高以及存在溶剂残留等问题,不宜用于食品、饮料等产品中。
生物合成法在食品生产中应用比较广泛[3-5],但生物合成法生产HDMF的研究还属于探索阶段,主要以微生物代谢合成为代表。目前研究发现能够代谢合成HDMF的微生物主要包括酵母菌和乳酸菌两种类型,其发酵所利用的碳源大多为1,6-二磷酸果糖,而1,6-二磷酸果糖成本较高,但利用D-果糖(FDP)可以代替1,6-二磷酸果糖。微生物发酵生产HDMF步骤简单,将微生物在固定培养基中和特定条件下进行培养,通过次级代谢合成HDMF。因此,为满足人们对天然呋喃酮香料的需求,微生物合成法生产HDMF已成为替代其他生产方法的新型生产技术手段。
2 代谢合成呋喃酮的微生物种类及分子机制
目前,生物方法合成HDMF主要以微生物代谢为主,主要有鲁氏酵母、毕赤酵母和乳酸菌等,其中关于鲁氏酵母研究的最多。
2.1 鲁氏酵母
2.1.1 鲁氏酵母代谢合成呋喃酮
鲁氏酵母(Zygosaccharomyces rouxii)是一种能在高盐或高糖条件下生长繁殖的一种酵母菌。鲁氏酵母在参与酱油酿造的过程中能够产生呋喃酮类等香味物质,对酱油独特风味的形成起到重要的作用[6-7]。Sugawara等[8]研究也表明这种风味物质存在于味噌发酵食品中,其形成是鲁氏酵母的酶促生化反应。目前已知最重要的HDMF生物合成途径就是通过鲁氏酵母代谢产生。Hecquet等[9]研究表明,鲁氏酵母在含有D-1,6-二磷酸-果糖和D-葡萄糖的营养液中可以合成呋喃酮。在添加10%(w·v-1)D-1,6-二磷酸-果糖和5%(w·v-1)D-葡萄糖培养基中,培养11 d后得到的HDMF最高浓度约80 mg·L-1。Li等[10]研究表明D-果糖调控后的鲁氏酵母菌在培养到第5 d时,其主要的香味物质酮类和酯类等开始增加,实验组的HDMF含量达到对照组的7.5倍;当调控进行到至7 d时,产物之间差距变小,说明呋喃酮的合成与D-果糖调控有关。继续对D-果糖产生呋喃酮的分子机制进行研究,发现随着D-果糖的消耗,糖酵解(EMP)和磷酸戊糖途径(PPP)中HDMF合成的初级代谢产物逐渐增加。这表明,D-果糖可以通过EMP和PPP途径生成呋喃酮。近些年关于酵母菌代谢途径的研究越来越多,对于呋喃酮类物质生物合成途径及其机理的阐述仍不完整。
2.1.2 鲁氏酵母细胞通过EMP碳代谢途径合成HDMF
糖酵解途径(EMP)是一种厌氧途径,由于是酵母合成HDMF必不可少的代谢途径,因此在酵母代谢中糖酵解途径起到了非常重要的作用。EMP需要多种酶类共同作用,而这些酶类物质在EMP中可以促进反应的进行、调节能量并在环境改变时进行信号传导,因此在EMP中起到了关键性的作用[11]。这些酶中包含的三种重要的单向酶:磷酸果糖激酶(PFK1,EC 2.7.1.11)、丙酮酸激酶(PK,EC 2.7.1.40)以及己糖激酶(HK,EC 2.7.1.1)。在鲁氏酵母细胞中,HK将D-果糖转化为6-磷酸-D-果糖,将葡萄糖催化为6-磷酸葡萄糖。葡萄糖-6-磷酸被磷酸葡萄糖异构酶(G6PI,EC 5.3.1.9)催化为果糖-6-磷酸,然后在磷酸果糖激酶的作用下磷酸化为果糖-1,6-二磷酸,这步反应是不可逆的[12]。在醛缩酶(FBA,EC 4.1.2.13)作用下果糖-1,6-二磷酸裂解成三磷酸甘油醛(GAP)和二羟基磷酸丙酮(DHAP)[13]。磷酸二羟基丙酮被认为是HDMF的前体物质。
2.1.3 鲁氏酵母细胞通过PPP途径合成HDMF
磷酸戊糖途径(PPP)作为鲁氏酵母细胞中糖代谢的关键途径,为鲁氏酵母菌的代谢提供了必不可少的条件[10]。PPP包括氧化和非氧化两个过程,当PPP在氧化过程中,6-磷酸葡萄糖脱氢酶(G6PDH,EC 1.1.1.49)使6-磷酸葡萄糖氧化为6-磷酸葡萄糖内酯,进而在6-磷酸葡糖酸内酯酶(6PGL,EC 3.1.1.31)的作用下又催化为葡萄糖酸-6-磷酸,随后又在6-磷酸葡萄糖酸脱氢酶(6GPDH)的作用下氧化为5-磷酸核酮糖[10]。G6PDH和6PGDH作为该途径的不可逆酶,可以用来与NADPH一起来调节磷酸戊糖途径的代谢效率。PPP途径的非氧化反应的方向取决于代谢底物和产物的相对含量。转酮酶(TKT,EC 2.2.1.1)和转醛酶(TALDO,EC 2.2.1.2)是介导非氧化性PPP可逆反应的两种关键酶。在TKT的作用下,核酮糖-5-磷酸和木糖-5-磷酸转化为三磷酸甘油醛和7-磷酸景天庚酮糖[10](S7P)的过程是可逆的;而在TALDO的作用下,S7P和GAP转化为4-磷酸赤藓糖和果糖-6-磷酸是不可逆的[10],然而果糖-6-磷酸是参与糖酵解途径合成HDMF前体物。
2.2 毕赤酵母
毕赤酵母(P.capsulata)既是一种嗜甲基酵母菌,也是一种嗜好有氧生长的菌株,可在碳源仅为甲醇的营养液中快速生长。其生长的pH在3.0~8.0之间,对乙醇具有耐受性,这使它有较好的发酵基础。因此可以更有利于使其实现高密度发酵培养,其菌体密度可高达100 g·L-1干细胞[14]。
早期研究发现,毕赤酵母菌可以通过转化利用L-(+)-鼠李糖代谢合成HDMF。Roscher等[15]对荚膜毕赤氏酵母(P.capsulata)利用廉价碳源L-(+)-鼠李糖产生HDMF进行了研究,研究表明毕赤酵母在当培养基中含有酪蛋白和鼠李糖时可以产生HDMF,产量最高约为2 mg·L-1,此时培养到第4 d;而未添加鼠李糖培养基中未检测HDMF,从而推断HDMF产生于L-(+)-鼠李糖加热后中间产物。张海林等[16]从酒曲中筛选到一株季也蒙毕赤氏酵母,经紫外诱变、亚硝基胍诱变处理后所得HDMF产量为92.5 mg·L-1。王鹏霄[2]从菠萝、草莓等水果中分离筛选到利用D-果糖产HDMF的毕赤酵母和汉逊酵母,产量分别可达6.84 mg·L-1和10.96 mg·L-1。
2.3 乳酸菌
乳酸菌是食品发酵方向研究较多的一类益生菌,乳酸菌及其代谢产物已在食品、医药、等领域得到广泛应用。在食品行业,乳酸菌的利用是不可缺少的,如酸奶的制备、肉类和蔬菜的发酵制品以及一些酒的生产[17],目前乳酸菌是食品发酵工业研究较多的一类益生菌,也可产呋喃酮。Kowalewska等[18]发现,在生长有瑞士乳酸杆菌(Lactobacillus helveticus)的氨基酸脱脂牛奶培养基中能够产生HDMF。Preininger等[19]证实,乳酸菌L.helveticus和L.delbrueckii分别在乳清粉水悬液中培养7 d后产生598μg·L-1和427μg·L-1HDMF。Hayashida等[20]对一株广泛用于乳酪生产的菌种——乳酸乳杆菌乳酸亚种L.cremoris产HDMF能力进行了研究,结果显示,在添加谷氨酸钠的培养基中补充核糖或半乳糖均有HDMF产生,而只有在添加半乳糖的培养基HDMF产量较高,培养到第3 d时产量可达到1.17 mg·L-1。
综上所述,微生物代谢合成HDMF的研究还在探索阶段,主要菌种为鲁氏酵母菌,其次为毕赤酵母菌和乳酸菌,但HDMF的合成机理尚不清楚。利用鲁氏酵母生菌代谢合成HDMF是目前最常用的HDMF生物合成途径,而利用毕赤氏酵母和乳酸菌生物合成HDMF的研究较少。
3 调控微生物合成呋喃酮的培养条件对其产量的影响
3.1 渗透压
3.1.1 NaCl浓度
微生物代谢合成HDMF时会受到一些外界环境的影响。一些盐类、糖类的添加就是为了改变其渗透压从而影响代谢物的合成。有研究发现酵母菌产呋喃酮类物质时,NaCl的添加对酵母菌产呋喃酮有较大影响。周亚男等[21]在对鲁氏酵母产HDMF发酵条件进行优化时发现,酵母菌产HDMF的能力随NaCl浓度增加呈现先上升后下降趋势。当添加NaCl浓度为180 g·L-1时,HDMF含量最高为6.69 mg·L-1。当NaCl浓度继续升高时,HDMF产量出现明显下降趋势,可能因为培养基中渗透压增大,当渗透压过大时,影响菌体生长。Hauck等[22]也发现,培养基中NaCl浓度高有利于HDMF的合成,用其他高渗物质代替NaCl时,则效果较差。冯杰等[23]利用酱油中筛选的埃切假丝酵母进一步研究发现,培养基在200 g·L-1的NaCl浓度条件下菌体的浓度达到最高,而NaCl浓度为220 g·L-1时HDMF产量和菌体浓度最高,当NaCl浓度为240 g·L-1。
时HDMF产量最低。Hecquet等[9]在研究鲁氏酵母时,发现高浓度NaCl有利于鲁氏酵母合成HDMF。经实验获得一株耐高渗透压酵母菌株SX-21,并观察在不同浓度NaCl条件下合成HDMF的能力,在添加14%NaCl的培养基中,菌种生长较慢,需发酵培养10 d,在含有16%NaCl的培养基中,菌种生长被抑制,虽然高浓度的NaCl对SX-21酵母菌株合成HDMF有较大的促进作用,但浓度不宜过高。
3.1.2 FDP浓度
有研究发现,D-果糖、乳糖、鼠李糖都能促进HDMF的生成,而添加FDP则更有利于HDMF合成。Hecquet等[9]研究发现,FDP是鲁氏酵母代谢合成呋喃酮较好的前体物质。研究外源添加FDP对酵母合成呋喃酮的影响,在含有12%NaCl的培养基中添加12%FDP,其合成呋喃酮的量与添加10%FDP相当,说明培养基中添加10%FDP时呋喃酮产量已经达到最高,而超过该浓度时产量受到抑制。Hecquet等[9]也发现,在含有10%FDP的YPD培养基中培养酵母达到11 d时,HDMF的浓度高达80 mg·L-1。与外源添加FDP的试验相比,HDMF生成不能由酵母自身生成的FDP转化,只能由外源添加的FDP转化生成[24]。由此可知,外源添加FDP有利于HDMF的合成,HDMF的产量随FDP的浓度增加而增加,但当浓度超过10%时HDMF的产量受到抑制。
3.2 初始p H值
各种微生物都有其生长的最适pH值,低于或高于最适pH值都会使微生物的生长受到抑制。张海林等[16]在研究NTG-SX-103酵母菌发酵产HDMF时发现,初始pH对微生物合成HDMF有较大影响,在培养基起始pH为3.8条件下酵母菌生长缓慢,而当起始pH值为5.8时生成HDMF的产量最高,达到101 mg·L-1。当起始pH5.8为时,与起始pH为4.6时相比,菌体的总量相差不大,但HDMF产量提升了1.7倍。因此,起始pH值对酵母生成HDMFF有较大的影响。
3.3 摇床转速
张海林等[16]研究发现,HDMF产量随着摇床转速的升高而升高。HDMF的产量在摇床转速为250 r·min-1时达到最大值,是在培养菌株时摇床转速为0时的4.4倍,产量相对较低,是摇床转速为150 r·min-1时的1.4倍。因此,摇床转速对菌株生成HDMF有着较大的影响。
3.4 发酵温度
张海林等[16]研究发现,其筛选的NTG-SX-103酵母菌的最高耐受温度为40℃,一旦温度高于40℃时,酵母的生长便会受到抑制。以添加100 g·L-1FDP和80 g·L-1NaCl的麦汁为出发培养基,考察温度对NTG-SX-103生产HDMF的影响时发现,在不同发酵温度下发酵液中的菌体浓度基本一致,当温度为26℃时HDMF最高产量为90.2 mg·L-1,当温度为38℃时最低为85.5 mg·L-1。王鹏霄[2]对筛选出的P3株菌(毕赤酵母)发酵温度对产HDMF的影响进行研究,发现当温度为34℃时,HDMF产量最高为32.46 mg·L-1;当温度为38℃时其产量最低,仅为21.58 mg·L-1。康远军[25]在高耐性鲁氏酵母高密度发酵研究中发现,鲁氏酵母的最佳发酵温度为28℃,而最佳发酵温度既适合菌体的生长,又适合代谢产物的合成。因此,发酵温度对HDMF的生产有着一定的影响。
3.5 接种量
张海林等[16]向添加了80 g·L-1NaCl和100 g·L-1FDP麦汁的培养基中分别接入浓度为2%、4%、6%、8%的菌种,同时培养7 d后发现不同接种量的条件下菌体浓度基本没有太大的变化。在接种量为4%时最高HDMF产量为92.6 mg·L-1,最低HDMF产量为87.6 mg·L-1,所以接种量对NTG-SX-103菌株生成HDMF影响较小。接种量的变化只影响前期培养的菌体浓度,对后期发酵的菌体浓度则基本不受到影响,而HDMF作为次级代谢产物在发酵后期生成,接种量对HDMF的生成影响较小。周亚男等[21]研究发现随着酵母菌数增加,除酵母菌浓度为5×107cfu·mL-1时,生成HDMF含量最低为0.74 mg·L-1,其他不同浓度生成HDMF的含量相差不大,最高为4.93 mg·L-1,最低为4.06 mg·L-1,最佳酵母菌浓度可选为5×108cfu·mL-1,接种量为5×108cfu·mL-1时的HDMF含量最高[21]。因此,不同接种量对生成HDMF的影响较小。
3.6 不同碳源
张海林等[16]以添加80 g·L-1NaCl的13 Bé麦汁为培养基,分别添加葡萄糖、FDP、乳糖、鼠李糖和麦芽糖,麦汁培养基为空白对照,研究不同碳源对HDMF产量的影响。发现以FDP为碳源时HDMF的产量达到45.6 mg·L-1,以其它糖类为碳源时HDMF的产量在14~17 mg·L-1。由此可知,FDP能更好的促进HDMF的生成,FDP是HDMF的前体物质,对HDMF的生成影响很大。
4 调控微生物合成呋喃酮的关键酶
4.1 己糖激酶HK
催化己糖磷酸化的酶统称为己糖激酶,是植物和其他有机体代谢活动的重要调控酶。HK既调控植物体内贮存糖和游离糖的利用率,也调控糖酵解和磷酸戊糖途径的代谢速率[26]。糖代谢进入细胞后的第一步就是由特定的糖激酶催化磷酸化,因此HK在生物体糖代谢的过程中起着重要作用。在糖代谢合成HDMF途径中(图1),D-葡萄糖或D-果糖在HK的催化下形成6-磷酸葡萄糖或6-磷酸果糖,是糖代谢途径的重要中间产物,广泛地存在于动植物和一些微生物体中,并且是磷酸戊糖支路的起始物[10]。而糖酵解途径和磷酸戊糖途径参与生物合成呋喃酮途径,葡萄糖-6-磷酸和果糖-6-磷酸是重要代谢产物,因此己糖激酶在微生物法合成HDMF中起到重要作用。
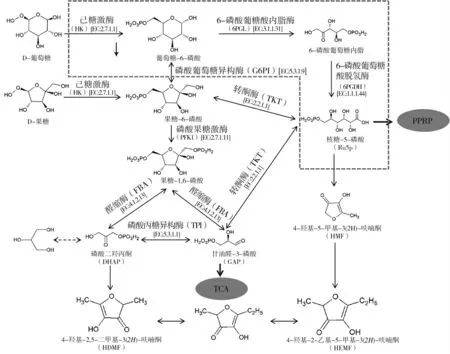
图1 从葡萄糖和果糖开始的呋喃酮代谢合成路线图Fig.1 The metabolic synthesis route of furanones starting from glucose and fructose
4.2 醛缩酶FBA、磷酸果糖激酶PFK1和6-磷酸葡萄糖酸脱氢酶6PGDH
已经阐述了糖酵解途径和磷酸戊糖途径参与生物合成呋喃酮途径,PFK1作为EMP中的关键酶,将果糖-6-磷酸催化为FDP。在EMP途径中的FBA将FDP可逆地转化为DHAP和GAP。6PGDH可以在PPP途径中催化6-磷酸-D-葡萄糖酸氧化为核酮糖-5-磷酸。并对它们进行了酶活的测定,发现在添加FDP的培养基中的PFK1活性在发酵7 d时相对于对照组显著提高;在发酵5 d时,YPD+Fru组中的FBA较YPD组显著上调2.45倍(P<0.001),在添加FDP的培养基中的6PGDH在发酵5 d和7 d时高于YPD组(P<0.001)。因此,Li等[10]认为PFK1、FBA和6PGDH作为D-果糖合成呋喃酮过程中的关键酶。
4.3 转酮酶TKT
转酮酶是磷酸戊糖途径中的关键酶,催化磷酸酮糖与磷酸醛糖之间的相互转移[27]。转TKT参与了芳香族氨基酸的前体物质合成,因此是芳香化合物合成过程中的关键酶。TKT将戊糖磷酸途径与糖酵解途径紧密地联系在一起,根据细胞代谢的需求切换反应的方向,提供不同的代谢产物,当细胞对5-磷酸核糖的需求超过NADPH时,TKT可与其它分子一起将糖酵解途径产生的果糖-6-磷酸和甘油醛-3-磷酸通过反向磷酸戊糖途径转化为核糖-5-磷酸,反之TKT可与其它分子一起将核糖-5-磷酸通过磷酸戊糖途径转化为果糖-6-磷酸和甘油醛-3-磷酸。细胞中超过85%的核糖-5-磷酸是由转酮酶参与产生的,而该途径可逆(图1)。因此转酮酶在微生物法合成HDMF中起到重要作用。
4.4 磷酸丙糖异构酶TPI
磷酸丙糖异构酶是糖酵解过程中重要的异构酶,催化二羟丙酮磷酸和D-甘油醛-3-磷酸之间的可逆转化[28],糖酵解途径参与生物合成HDMF的途径,且二羟丙酮磷酸为HDMF的重要前体物质(图1),因此磷酸丙糖异构酶在HDMF的生物合成途径中有着重要作用。
4.5 6-磷酸葡萄糖酸内酯酶6PGL和磷酸葡萄糖异构酶G6PI
在PPP途径的前三个步骤中,涉及到了葡萄糖6-磷酸脱氢酶、6-磷酸葡萄糖酸内酯酶和6-磷酸葡萄糖酸脱氢酶三种酶,在他们的作用下可将葡萄糖6-磷酸转化为5-磷酸核酮糖[10]。核糖-5-磷酸会在TKT的作用下还原成果糖-6-磷酸和甘油醛-3-磷酸,而果糖-6-磷酸在PFK1和FBA的作用下可逆地裂解为DHAP和GAP(图1)。6-磷酸葡萄糖异构酶也是糖代谢中重要的异构酶和氧化还原酶,它催化葡萄糖-6-磷酸和果糖-6-磷酸之间相互转化。因此,在生物合成HDMF途径中,6-磷酸葡萄糖酸内酯酶6PGL和磷酸葡萄糖异构酶G6PI也有着重要作用。
4.6 乙醇脱氢酶ADH
甲基扭曲杆菌(Methylobacterium xtorquens)菌株可以在草莓的培养过程中分离得到,当该菌对草莓的愈伤组织进行处理后,相比于未处理过的组织,其HDMF的含量明显增高。Zabetakis等[29]研究表明,可以从草莓愈伤组织和甲基扭曲杆菌中分别得到两种分子量不同的ADH,并探讨了两种ADH在合成HDMF过程中的作用,发现甲基扭曲杆菌分泌的ADH更有利于HDMF的合成[1],所以认为ADH在微生物合成HDMF中起到重要的作用。
4.7 醌氧化还原酶QOR
草莓氧化还原酶早期被认为是醌氧化还原酶(QOR),是一种成熟诱导的负生长素调节酶,催化草莓果实中关键风味物质HDMF的形成[30]。草莓中HDMF的直接前体显示为4-羟基-5-甲基-2-亚甲基-3(2H)-呋喃酮(HMMF),而草莓QOR被认为负责还原HMMF的α,β-不饱和键,形成芳香活性化合物HDMF。QOR在果实中积累薄壁组织,主要在果实生长和成熟的后期表达,与果实中的呋喃酮产生平行存在。QOR对与呋喃酮生产相关的环境刺激作出反应,在黑暗中,草莓果实在25℃时的QOR表达水平和HDMF产量均比15℃时高[30],低温贮藏时,HDMF的浓度和QOR蛋白丰度也显著低于室温贮藏下的水平。因此,QOR的调节对于调控HDMF含量是很重要的。
5 展望
随着生活水平的提高,人们对食品安全非常看重,“绿色”“天然”产品的关注度更高。综上所述,利用生物合成法生产的呋喃酮香料就属于“天然香料”的范畴,其产品的污染小、成本较低、产品香气突出,且可持续发展。通过大量的研究发现,通过对菌株培养条件的改变以及有关酶的调控来提高呋喃酮的产量,所以,利用生物合成法生产商业价值较高的HDMF具有非常重要的前景。但目前生物合成法生产HDMF还属于基础理论研究阶段,产业化生产还没有实现,并且利用微生物法合成的HDMF所用的前体物质成本较高,降低生产的成本并且提高HDMF产量是目前研究急需解决的问题。
虽然目前国内外有关HDMF的生物合成技术研究不多,但是随着市场对天然呋喃酮香料需求量的不断增加,采用微生物合成法生产价格昂贵、产量低的天然HDMF将成为研究的热点之一。随着分子生物学、酶工程、基因工程等技术的不断完善,为生物合成法生产HDMF提供了更有力的技术支撑和研究保障。可以利用构建基因工程菌改变菌种的功能性状使其达到高产HDMF的目的,这将成为未来提高HDMF产量的一个研究方向。

