造血干细胞移植儿童体内伏立康唑与钙调神经磷酸酶抑制剂的相互作用
杨梦婕,王梅,桂环
(苏州大学附属儿童医院,江苏苏州 215000)
侵袭性真菌感染是异体造血干细胞移植(HSCT)术后常见的并发症之一[1]。伏立康唑是一种三唑类抗真菌药物,对念珠菌和曲霉菌均有强大的杀菌活性,广泛用于防治HSCT术后真菌感染[2]。伏立康唑主要通过细胞色素P450(CYP450)2C19(CYP2C19)代谢,也有小部分通过CYP2C9和CYP3A4代谢,是CYP450抑制剂。因此,伏立康唑可能会增高通过CYP450同工酶代谢的药物如钙调磷酸酶抑制剂环孢素(CsA)和他克莫司(FK506)的血药浓度[3]。CsA及FK506属于免疫抑制剂,常规用于接受HSCT的患者,以预防移植物抗宿主病和移植排斥反应[4]。从药物代谢机制可以推测,伏立康唑与CsA及FK506之间存在明显的药物相互作用,且已被写入药品说明书。由于CsA及FK506的治疗指数较小,血药浓度的增加可能导致较大的副作用,从而限制了临床应用。因此,监测CsA及FK506血药浓度对于同时接受伏立康唑治疗的患者非常重要[5-6]。目前,伏立康唑对HSCT患者CsA或FK506血药浓度的影响仅限于一些小样本研究和病例报告,在儿童群体开展的研究则更少。已有的证据[5,7-8]显示,当同时给予伏立康唑时,CsA和FK506的血药浓度会明显增加,且增幅存在显著个体差异,这种个体差异可能是由于CYP3A4和CYP2C19活性的异质性所致[9-12]。此外,伏立康唑血药浓度与CsA或FK506血药浓度增幅之间的相关性研究证据有限[13]。因此,本研究就以上问题进行探讨,为临床合理用药提供参考。
1 资料和方法
1.1 一般资料
本研究采用前瞻性队列研究方法,经苏州大学附属儿童医院医学伦理委员会审核通过,于2017年10月至2018年9月在苏州大学附属儿童医院进行。纳入标准:接受同种异体HSCT的2~14岁患儿,已经接受了稳定剂量的CsA或FK506治疗,并开始使用伏立康唑预防侵袭性真菌感染。排除标准:(1)体质量≥50 kg;(2)肝肾功能不全;(3)正在接受其他与伏立康唑、CSA或FK506有明显相互作用的药物治疗。共纳入患儿31例,平均年龄7岁,体质量24 kg(12~49 kg),基础疾病以急性髓系白血病、急性淋巴细胞白血病、再生障碍性贫血为主,见表1。
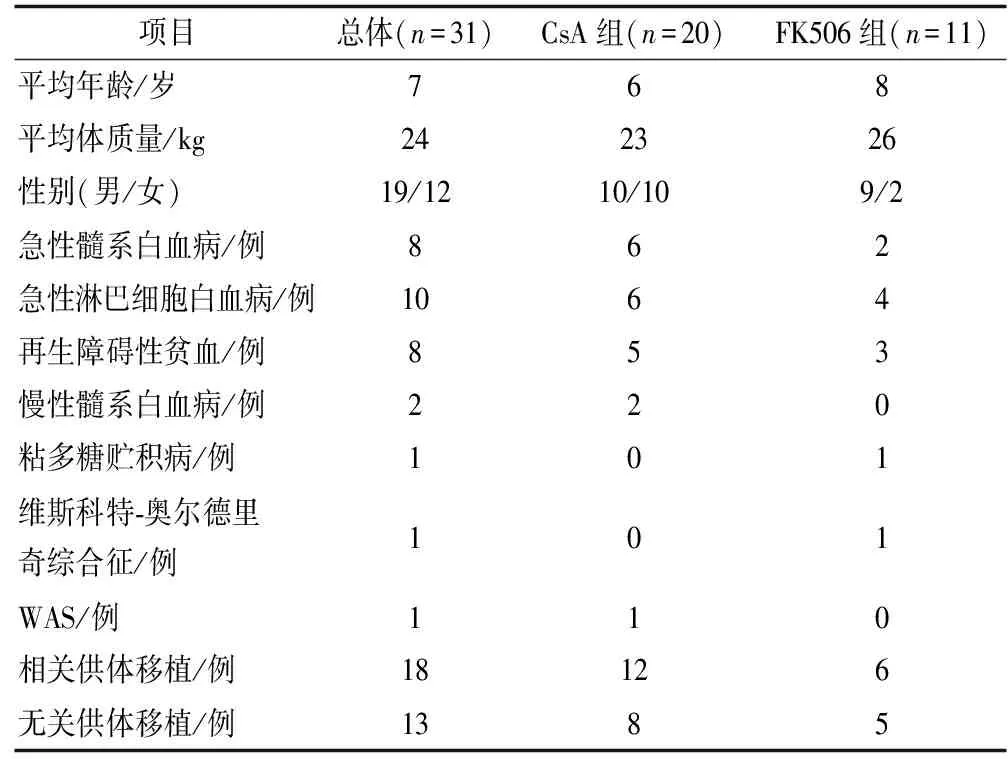
表1 一般资料
1.2 给药方案分组
我院使用的伏立康唑有2个品种:伏立康唑(中国Yibang)和伏立康唑(美国Vfend)。根据药品说明书确定儿童给药方案:Yibang,4 mg/kg,q12h;Vfend,2~11岁7~8 mg/kg,12~14岁4 mg/kg,q12h。并结合患儿年龄进行分组:A组,2~5岁使用Yibang;B组,2~5岁使用Vfend;C组,6~11岁使用Yibang;D组,6~11岁使用Vfend;E组,12~14岁使用Yibang;F组,12~14岁使用Vfend。
1.3 血药浓度监测
使用标准酶放大免疫测定技术(EMIT),在伏立康唑给药前1 d和给药后5~8 d分别测量CsA或FK506血药浓度。以浓度/剂量(C/D)值[血药浓度(ng/mL)/给药剂量(mg/kg)]客观反映血药浓度的变化情况。伏立康唑血药浓度测定采用超高效液相色谱-串联质谱法[14],利用Acquity UPLC超高效液相色谱仪及Vevo TQS三重四级杆串联质谱仪(美国Waters公司)检测伏立康唑给药第6天后的血清谷浓度。
1.4 不良反应评价
伏立康唑的药物不良反应包括视力障碍、幻视、肝酶升高、皮疹和精神症状。药物不良反应的关联性评价基于常见不良反应术语评定标准(CTCAE)[15]。患儿每天常规监测生化指标,包括血肌酐、直接胆红素、间接胆红素、总胆红素、碱性磷酸酶、丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)。
1.5 统计学方法
应用Wilcoxon秩和检验比较伏立康唑给药前后CsA或FK506的C/D,以Spearman等级相关系数评估CsA或FK506的C/D变化与伏立康唑血药浓度之间的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 联用伏立康唑对CsA或FK506的C/D影响
患儿合并使用伏立康唑后,CsA或FK506的血药浓度均升高。CsA的C/D在使用伏立康唑后5~8 d为60.47(22.94~180.38),比伏立康唑给药前的19.15(7.23~52.87)增加了215.75%(10.16%~706.35%)(P<0.01)。FK506的C/D在使用伏立康唑后5~8 d为243.24(46.15~828.00),比伏立康唑给药前的71.70(15.62~168.00)增加了239.24%(89.66%~615.00%)(P<0.01)。
2.2 伏立康唑血药浓度与CsA或FK506的C/D增幅的相关性
CsA组患儿伏立康唑血药浓度为(2.35±2.06)μg/mL,与CsA的C/D增幅之间无相关性(r=0.193,P>0.05);FK506组患儿伏立康唑血药浓度为(1.84±1.81)μg/mL,与FK506的C/D增幅呈正相关(r=0.643,P<0.05)。见图1。

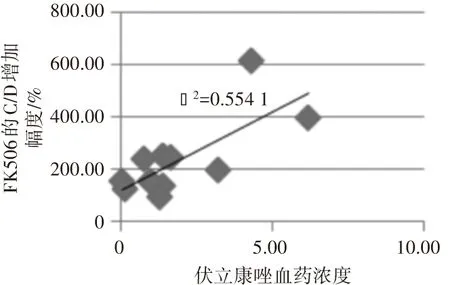
图1 伏立康唑血药浓度与CsA或FK506的C/D增幅的相关性
2.3 伏立康唑安全性评估
31例患儿药物不良反应发生率为19.4%(6/31)。根据CTCAE标准,6例患儿发生的药物不良反应最可能与伏立康唑有关,其中4例心率增快(1例合并视觉障碍),1例肝酶升高,1例恶心呕吐。本研究期间患儿未见寒颤、发热、头痛、幻觉或皮疹发生。出现不良反应的患儿伏立康唑稳态血药谷浓度均<5.5 mg/L,药物不良反应症状最终改善或消失,由不良反应导致的伏立康唑停药百分比为6.5%(2/31)。
3 讨论
本研究在评估血药浓度变化时,参考使用浓度-时间曲线下面积或钙调磷酸酶抑制剂的剂量减少比例,但这些参数无法定量,因为它们只侧重于钙调磷酸酶抑制剂浓度或剂量一个方面。因此,本研究使用C/D来定量评估药物相互作用,同时反映钙调神经磷酸酶抑制剂的浓度和剂量,可提供更具临床相关性的数据。
本研究结果显示,在接受同种异体HSCT患儿群体中,同时使用伏立康唑会与钙调神经磷酸酶抑制剂CsA及FK506发生显著的药物相互作用,导致CsA或FK506的血药浓度增加,该现象与药品说明书相关提示相符。对于接受同种异体HSCT的患儿,临床医师需要不断地权衡钙调神经磷酸酶抑制剂的毒性和移植物抗宿主病(GVHD)或移植物排斥反应的发生风险,为防止钙调神经磷酸酶抑制剂的浓度达到毒性阈值,在同时使用伏立康唑时,会按照药品说明书推荐,将CsA剂量降低至1/2或将FK506剂量降低至1/3。然而,本研究结果显示,伏立康唑与钙调神经磷酸酶抑制剂的药物相互作用程度存在较大的个体差异,且伏立康唑对CsA和FK506血药浓度的影响程度(C/D增幅)相当(P>0.05)。因此,钙调磷酸酶抑制剂的减量比例应通过定期监测患儿血药浓度来个体化确定。
伏立康唑与钙调磷酸酶抑制剂之间药物相互作用的个体差异原因有待阐明,一种可能的解释是患者CYP450活性的个体差异[9-12]。伏立康唑由3种独立的酶CYP2C9、CYP2C19和CYP3A4代谢。CYP2C19是负责伏立康唑代谢的主要酶,具有基因多态性,导致伏立康唑在不同个体中代谢速度不同。儿童随着年龄的增长,酶活性不断变化。伏立康唑作为酶抑制剂及CYP3A4的底物,浓度越高,CYP3A4的活性降低越多。
伏立康唑儿童推荐剂量比成人高,且与年龄相关。原研药品说明书儿童推荐剂量:2~<12岁或12~14岁且体质量<50 kg,负荷量9 mg/kg,2剂后维持量8 mg/kg,q12h;12~14岁且体质量≥50 kg,负荷量6 mg/kg,维持量4 mg/kg。我院使用的2个品种伏立康唑Yibang和Vfend说明书推荐剂量不同可能是由于国产药品Yibang尚无足够的儿童群体临床试验数据支撑药品说明书的更新。本研究发现,2个品种伏立康唑在各自说明书剂量下,对CsA和对FK506血药浓度的影响程度相当,伏立康唑血药浓度与CsA的C/D增幅之间无相关性,而与FK506的C/D增幅呈正相关。提示有必要在未来的研究中扩大样本,以获得更客观的数据。
综上所述,伏立康唑与钙调神经磷酸酶抑制剂之间的药物相互作用存在较大个体差异,在同时使用钙调神经磷酸酶抑制剂和伏立康唑时,应该密切监测血药浓度以指导剂量调整,保障用药的有效性和安全性。

