紫叶李胶理化性质及其对小球藻生长的影响
唐红枫,汤云峰,宋玉凯,严一平,贝斯康,曾 颖,黄 艳
(武汉东湖学院生命科学与化学学院,湖北 武汉 430212)
桃胶是由蔷薇科植物桃或山桃的树皮分泌的,在食品工业、医药工业、化学工业等都有着一定的应用价值[1-2]。目前对桃胶的研究主要集中在加工工艺及桃胶多糖等方面,关于不同种类桃胶的研究与开发较少。我国桃胶资源十分丰富,但大部分桃胶没有得到有效利用,并且由于桃胶的产生会影响桃树果实质量,所以在桃树的种植中尽可能避免桃胶的产生[3-4]。因此,有必要开发新品种桃胶并加以充分利用。紫叶李胶是由装饰树种紫叶李的树干分泌的,与常见的桃胶产生方式完全相同,因此紫叶李胶也属于桃胶中的一种[5]。鉴于此,作者选取紫叶李产生的紫叶李胶作为研究材料,比较紫叶李胶与市售桃胶在理化性质方面的差异,探究紫叶李胶对重金属胁迫下小球藻生长的影响,为后期紫叶李胶的开发应用提供理论依据。
1 实验
1.1 材料
紫叶李胶、襄阳紫血桃胶、昆明山桃胶、丽水水蜜桃胶等4种胶样,40 ℃烘干至恒重,粉碎,过100目筛,备用。
1.2 紫叶李胶与市售桃胶的理化性质测定
1.2.1 可溶性蛋白质含量及溶解度的测定
称取0.1 g胶粉,加入20 mL 60 ℃ ddH2O,超声(100 W,60 ℃)30 min使之溶解,6 000 r·min-1离心10 min,取上清液,测定可溶性蛋白质含量。将沉淀和离心管放入烘箱烘干,称量沉淀和离心管(不带盖)的总质量,记为m1;洗净离心管后称量空管(不带盖)质量,记为m2,按式(1)计算溶解度[g·(100 mL)-1]:

(1)
1.2.2 可溶性多糖含量的测定
按1.2.1方法取胶粉溶解、离心,取上清液,采用苯酚-硫酸法测定可溶性多糖含量。
1.2.3 黏度的测定
按1.2.1方法取胶粉溶解、离心,取上清液,置于25 ℃恒温水浴中使用黏度计测定多次,取平均值,按式(2)计算黏度(η,mPa·s):
η=(tη0)/t0
(2)
式中:t、t0分别为胶液、纯溶剂的流出时间,s;η0为纯溶剂的黏度,mPa·s。
1.2.4 溶胀度的测定
称取0.2 g胶粉2份;向50 mL烧杯中加入10 mL 60 ℃温水,边搅拌边加入胶粉,然后将烧杯中的胶液转入离心管中,并用10 mL 水冲洗烧杯倒入离心管,摇匀,浸泡2 d,中途换一次水。溶胀完毕前加入水的体积记为V1,溶胀完毕后记录离心管中的液面高度,将上清液倒入量筒中记录体积,记为V2,按式(3)计算溶胀度(ESR):
(3)
式中:ms为溶胀平衡后桃胶的质量,g;md为桃胶干重,g;ρ水为水的密度,mg·mL-1。
1.3 紫叶李胶对小球藻生长的影响
1.3.1 含紫叶李胶培养基的制备
称取20 g紫叶李胶胶粉溶入1 L BG11培养基中,静置1 d后取上清,得到紫叶李胶胶液。分别取BG11培养基和紫叶李胶胶液,按表1比例配制含有紫叶李胶的培养基[6],每组设置3个平行,以不加紫叶李胶胶液的培养基为空白对照,灭菌备用。
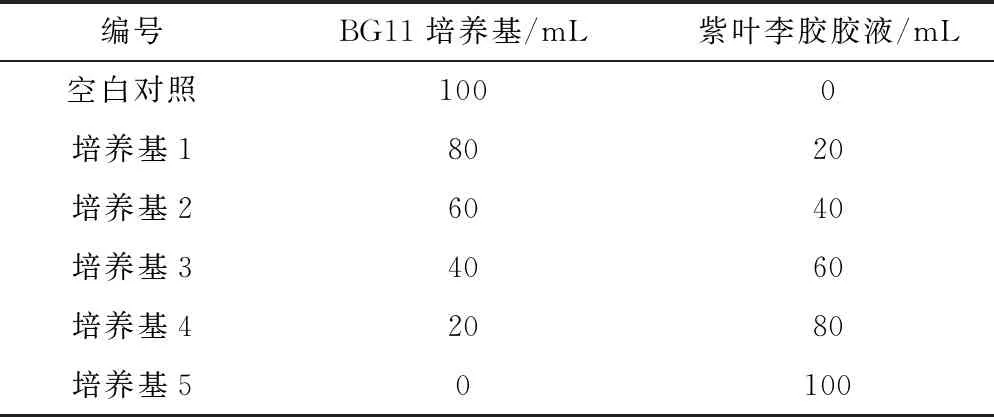
表1 含紫叶李胶培养基的配制比例
1.3.2 小球藻的培养
以10%的接种量将小球藻接种至培养基中,用无菌滤膜封口,于温度25 ℃、光照强度6 000 Lx[7]、光暗比12 h∶12 h[8]条件下培养6 d,每天定时摇匀3次,测定吸光度(A680值)及蛋白质含量。
1.3.3 蛋白质含量的测定
取10 mL培养液,3 000 r·min-1离心10 min,弃上清,加入2 mL蒸馏水吹打均匀,冰浴冷却下使用超声波细胞破碎仪超声(60%功率)破碎3 min,取1.5 mL细胞破碎液,6 000 r·min-1离心5 min,取1 mL上清,使用考马斯亮蓝G250法测定蛋白质含量[9-11]。
1.4 紫叶李胶对铜离子胁迫下小球藻生长的影响[12]
分别取BG11培养基、紫叶李胶胶粉、硫酸铜,按表2比例配制含有紫叶李胶和铜离子的培养基,每组设置3个平行,以不加硫酸铜为空白对照,灭菌备用。

表2 含紫叶李胶和铜离子培养基的配制比例
将含有紫叶李胶和铜离子的培养基灭菌后静置1 d,取10 mL上清作为后续测定吸光度的空白对照。
小球藻的培养以及培养液吸光度、蛋白质含量的测定同1.3方法。
2 结果与讨论
2.1 紫叶李胶与市售桃胶的理化性质(表3、图1)
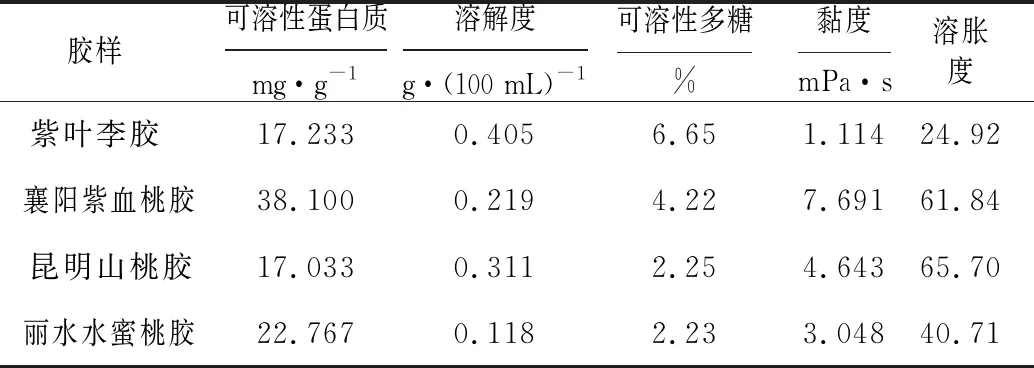
表3 紫叶李胶与3种市售桃胶的理化性质

图1 紫叶李胶与3种市售桃胶的理化性质对比
由表3可知,襄阳紫血桃胶、昆明山桃胶、丽水水蜜桃胶等3种桃胶的理化性质相对比较均衡,而紫叶李胶的理化性质的特征极为突出,溶解度大、可溶性多糖含量高、可溶性蛋白质含量低、溶胀度小、黏度小。紫叶李胶中的多糖可能由大部分小分子多糖和小部分大分子多糖组成[13],小分子多糖中的亲水基团更易与水结合,导致紫叶李胶溶解度大;大分子多糖相互交联,但由于含量较少造成多糖分子链展开后的吸水量少,导致紫叶李胶溶胀度小[14]。
2.2 紫叶李胶对小球藻生长的影响
以10%的接种量将小球藻接种至含紫叶李胶培养基中,通过吸光度和蛋白质含量的变化考察紫叶李胶对小球藻生长的影响,结果如图2所示。
由图2可以看出,小球藻在含紫叶李胶培养基中培养,生长增殖速度随着培养时间的延长逐渐加快,A680值逐渐升高,但培养5 d后,生长增殖速度减慢,A680值升幅减缓,可能是由于小球藻的生长达到了稳定期。所以,根据前5 d的数据来分析紫叶李胶对小球藻生长的影响。空白对照组的小球藻生长增殖速度及蛋白质含量增速最慢,培养基3组的小球藻生长增殖速度最快,培养基5组的蛋白质含量增速最快。说明紫叶李胶对小球藻的生长增殖及蛋白质合成都有明显的促进作用,当紫叶李胶含量为12 g·L-1(培养基3)时,其对小球藻生长增殖的促进效果最显著;当紫叶李胶含量为20 g·L-1(培养基5)时,其对小球藻蛋白质合成的促进效果最显著。
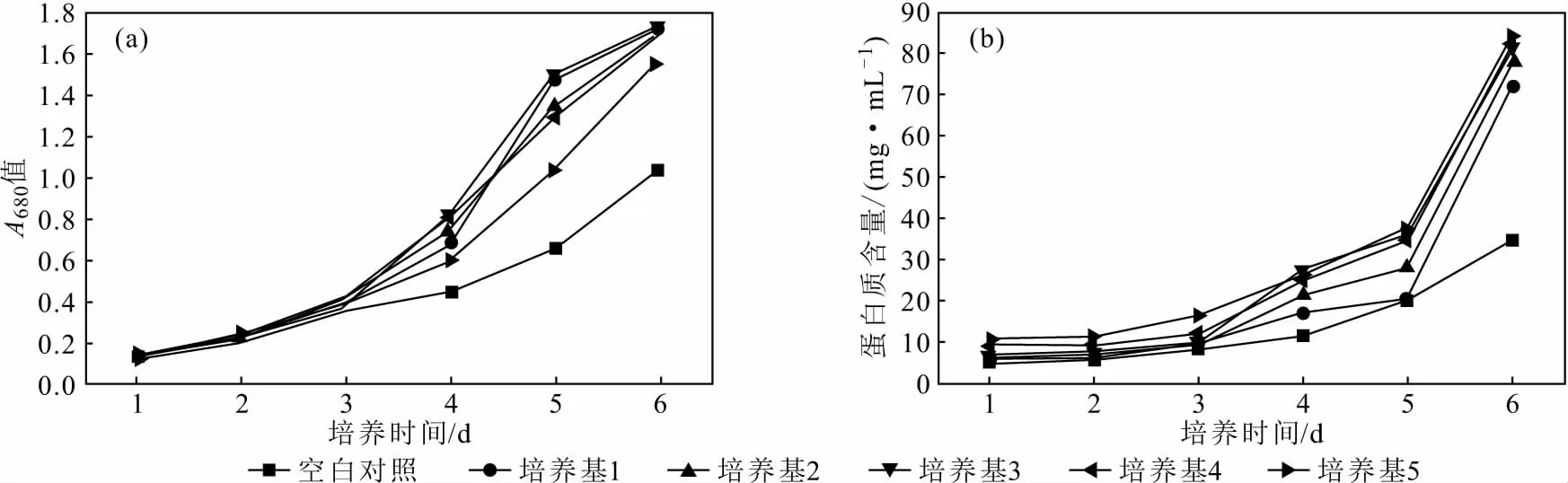
图2 小球藻在含紫叶李胶培养基中生长时的吸光度变化曲线(a)及蛋白质含量变化曲线(b)
2.3 紫叶李胶对铜离子胁迫下小球藻生长的影响
以10%的接种量将小球藻接种至含紫叶李胶和铜离子培养基中,通过吸光度和蛋白质含量的变化考察紫叶李胶对铜离子胁迫下小球藻生长的影响,结果如图3所示。
由图3a可以看出,铜离子对小球藻的生长增殖在整体上有一定抑制效果。小球藻在仅含铜离子培养基(培养基6)中培养1~2 d时,出现了快速增殖的现象,这是由于,小球藻为了抵抗铜离子的胁迫通过大量增殖来对铜离子进行富集,以降低铜离子的浓度;但当铜离子浓度过高时,小球藻在进行大量增殖后仍受到铜离子的胁迫,所以培养后期小球藻的生长增殖速度仍不理想[15]。而在含铜离子培养基中添加紫叶李胶后,小球藻的生长增殖速度明显加快,其中培养基10组的小球藻的生长增殖速度及蛋白质含量增速最快。由于紫叶李胶是由大分子多糖相互交联缠绕形成的半透明胶状物质,具有良好的吸附性,由此推测紫叶李胶降低小球藻在高浓度铜离子环境中受铜离子胁迫的影响可能是由于,紫叶李胶存在由大分子多糖相互交联形成的网状结构,能够吸附铜离子[16-18],从而达到降低铜离子浓度的效果,使小球藻能够正常生长增殖。
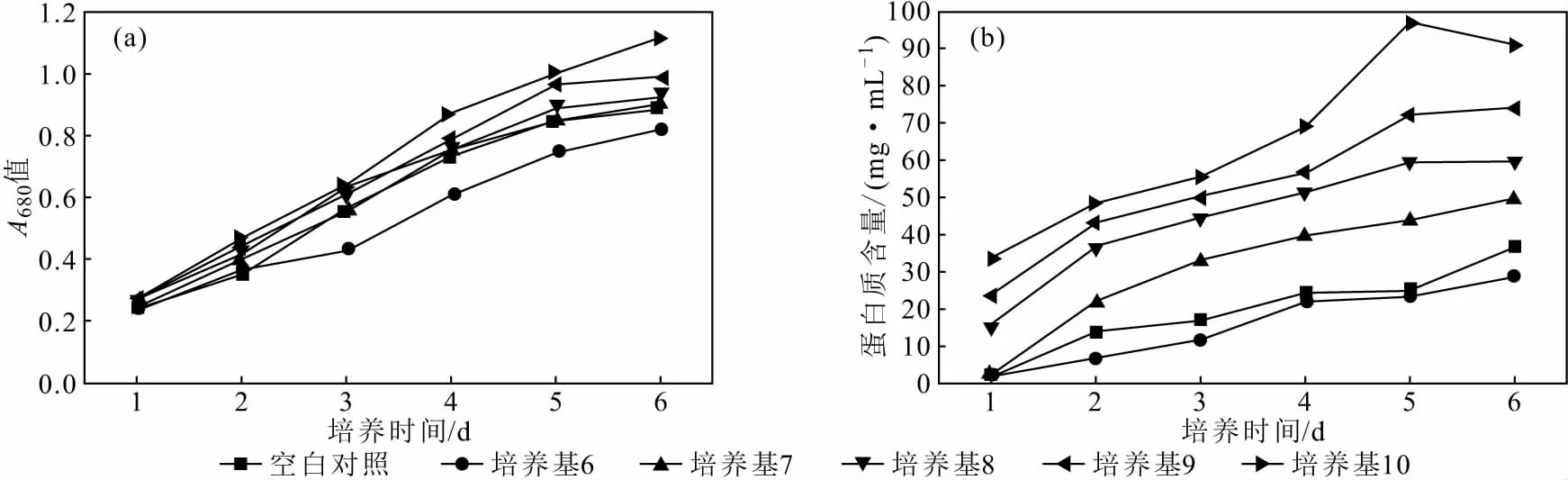
图3 小球藻在含紫叶李胶和铜离子培养基中生长时的吸光度变化曲线(a)及蛋白质含量变化曲线(b)
3 结论
通过比较紫叶李胶与市售桃胶在理化性质方面的差异,发现紫叶李胶是一种理化性质极为特殊的桃胶,具有溶解度大、可溶性多糖含量高、可溶性蛋白质含量低、溶胀度小、黏度小的特点,对小球藻的生长增殖及蛋白质合成都有着显著的促进作用,并且具有一定的抗逆作用,能够在高浓度铜离子环境中解除铜离子的胁迫,使小球藻保持正常生长。紫叶李胶具有一些与普通桃胶不同的理化性质,可对其进行深入研究或性质改良,并推广应用,这也是开发新品种桃胶的有效途径。

