植物CDPK信号转导途径及其互作组分的功能研究进展∗
周子馨,兰海燕
(新疆大学 生命科学与技术学院 新疆生物资源基因工程重点实验室,新疆 乌鲁木齐 830017)
0 引言
钙离子作为植物信号转导途径中的第二信使,其游离态几乎参与植物的所有生长发育过程[1].而作为钙离子信号响应元件的CDPK是一类钙依赖的蛋白激酶,它通过磷酸化作用将信号传递给下游组分并引起相关基因的表达,在植物生长发育以及多种胁迫响应过程中发挥积极作用[2].CDPK信号途径与逆境应答密切相关,目前对CDPK基因和蛋白的研究较为深入,但对其互作组分及功能的研究比较有限.本文基于前人的相关研究进展,对植物CDPK信号途径及其互作组分的生物学功能进行综述,以期为相关研究提供借鉴.
1 CDPK信号转导途径
1.1 CDPK是重要的Ca2+感受器
植物细胞中的多种信号转导途径均依赖信号分子进行信息交流,包括钙离子、脂质小分子、cAMP(cyclic adenosine monophosphate)、cGMP(cyclic guanosine monophosphate)等,其中游离的钙离子作用范围最广[3].Williamson和Ashley[4]对海藻细胞内钙信号的研究首次发现胞内游离的Ca2+可能对细胞功能的调节具有重要作用.植物细胞内的钙离子浓度受到多种钙结合蛋白的调控,如钙调素(Calmodulin,CaM)、类钙调神经素B亚基蛋白(Calcineurin B-like Proteins,CBLs)、CDPKs等[5].CaM是最典型的钙结合蛋白,它作为钙信号的“应答感受器”能迅速响应胞质中钙离子浓度变化,并维持胞内钙离子的稳态[6].CaM和CBL以无激酶活性的形式存在,只在结合Ca2+后被激活进而与靶蛋白相互作用并使其磷酸化,从而调控植物生长发育或响应逆境胁迫[7−8].CBL能与其特定的作用底物CIPKs(CBL-interacting protein kinases)形成CBL-CIPKs信号系统,在Ca2+信号转导通路中发挥重要作用[8].
CDPKs是最具特点的新型Ca2+传感器,同时具有Ca2+结合活性和激酶活性[5],能够直接结合胞质中的Ca2+,将钙信号转化为磷酸化反应[5,9].外源添加Ca2+时,拟南芥AtCPK12能够磷酸化转录因子ABF1(ABA-responsive element-binding factor 1)、ABF4以及蛋白磷酸酶2C(PP2C),而无外源Ca2+时则不发生磷酸化作用[10].CDPK信号通路在植物生长发育过程中参与多种细胞活动,包括初级代谢、次级代谢、应激反应、离子和水的运输以及转录和信号转导等过程[11],但不同CDPK具有不同的内源底物,因而在信号传递过程中发挥不同的生物学功能.
1.2 CDPK通过磷酸化传递信号
在外界信号刺激下,植物胞质游离Ca2+浓度变化激活CDPKs,将钙信号级联放大并作用于下游组分,经磷酸化或自磷酸化作用使植物产生各种生理响应[12].大量实验证明CDPK的N端可变区存在许多自磷酸化位点[13],对其在细胞内的定位、底物特异性结合以及蛋白质之间的相互作用有重要影响[14].烟草NtCDPK1的N端可变区6Ser和21Thr的自磷酸化可降低其结合并进一步磷酸化底物RSG(repression of shoot growth)的能力[15].CDPKs的自磷酸化除了作用于Ser/Thr残基,也存在于酪氨酸残基上.在大豆GmCDPKβ中首次发现24Tyr的自磷酸化降低了该蛋白激酶的活性[16].CDPKs的非自磷酸化作用更为普遍,AtCPK12通过磷酸化转录因子ABI2进而调控下游组分[10].Lee等发现NtCDPK1在体内磷酸化26S蛋白酶体的调节亚基NtRpn3,从而响应激素信号并共同参与细胞分裂、分化及凋亡等过程[17].此外,CDPKs还受到上游激酶的调控,AtCPK11在体外能够磷酸化AtCPK24,因此,推断AtCPK11/24可能与MAPKs(mitogen-activated protein kinase)一样在磷酸化级联反应中发挥作用[18],类似的还有NtCDPK2/3[19].
1.3 CDPK广泛参与胁迫信号网络
生物和非生物胁迫以及一些胞内刺激会引起胞质Ca2+水平升高,当Ca2+传感器识别钙信号后进一步作用于下游互作蛋白,进而引起一系列生理响应(见图1)[20].Ca2+传感器(CDPKs)能够直接或间接地调控下游重要的靶蛋白,如离子通道、转运蛋白、转录因子或一些其他信号通路相关的蛋白质[21].在拟南芥中,AtCPK4/11作为ABA信号途径的负调控因子发挥功能,参与种子萌发、幼苗生长、气孔运动和盐胁迫耐受等过程[22].过表达水稻OsCDPK7/13/21后,转基因植株对盐、旱、冷胁迫的耐受性增强[23−25].除了目前研究较为深入的拟南芥、水稻等植物外,近期通过植物基因组学分析发现,大部分黄麻(Chorchorus capsularis)CDPKs在盐、旱胁迫下表达量显著增加,表明CDPKs在植物应对不利环境的过程中发挥重要作用[26].通常多种信号途径之间存在交叉作用,例如一些保卫细胞信号转导蛋白既是CDPKs的底物,又能作为SnRK2(SNF1-related kinases 2)的底物,这些转导蛋白包括KAT1(Arabidopsis inward rectifier K+channel 1)、SLAC1(slowly activating anion channel)、RBOHs(respiratory burst oxidase homolog)、ABFs等,可能二者作用位点不同[27].CDPKs和MAPK两种信号通路间也可能存在交互作用,当植物受到刺激后,通常CDPKs和MAPKs均能被激活.例如,当番茄(Lycopersicon esculentum)受伤时,CDPKs和MAPKs能在不同位点磷酸化番茄LeACS2(1-aminocyclopropane-1-carboxylic acid synthase),其结果对维持该蛋白的稳定是必需的[28].CDPKs与其他信号途径协同作用为植物应对外界胁迫和调节自身免疫等方面提供了更多的可能.

图1 植物细胞中的Ca2+信号调控网络(该图引自参考文献[20],稍作修改)Fig 1 Ca2+ signal regulatory network in plants
2 CDPKs的结构、分类及表达与定位
2.1 CDPKs的结构
典型的CDPK蛋白结构主要由四部分组成,包括N端可变区、Ser/Thr激酶域、自抑制域(连接域)以及类钙调素结合域(见图2A)[2,5,29].其中,N端可变区的结构域长度变化较大,同源性不高,但对底物的识别起作用,该结构对CDPKs的亚细胞定位及调控植物生长发育十分重要[5].激酶域具有典型的Ser/Thr蛋白激酶的保守催化序列,在不同物种间同源性较高,替换催化中心附近的氨基酸通常会降低激酶活性,且可能影响对底物的特异性结合[30].自抑制域具有高度保守性,大多由20∼30个氨基酸残基组成.类钙调素结合域作为Ca2+感受器,通常具有四个EF手型,分为N端和C端两部分,C端的钙亲和力高于N端[5,31].在Ca2+浓度较低的静息状态下,C端能够结合钙离子,并与自抑制域相互作用稳定蛋白构象.与此同时,自抑制域上的假底物与激酶域上的活性位点结合阻止进一步识别底物[32−33].当Ca2+浓度升高时,钙调素结构域N端也与钙离子结合,并与自抑制域相互作用,通过蛋白构象变化使得自抑制域脱离,释放出激酶域的活性位点[30].此时,钙调素C端与N端可变区和激酶域的N端结合,钙调素N端靠近激酶域的C端(见图2B)[29].
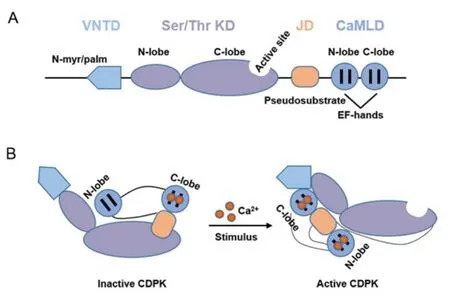
图2 植物CDPKs的结构(A)和激活机制(B)(该图引自参考文献[29],稍作修改)Fig 2 Structures (A) and activation mechanism(B) of plant CDPKs
2.2 CDPKs的分类
CDPKs是多基因编码的蛋白家族,迄今为止,在高等植物、原生动物、卵菌和绿藻中均发现该蛋白,但是在动物和真菌中尚未报道[34].随着植物基因组的测序以及对CDPKs的研究不断深入,不同植物中的CDPK家族成员组成逐渐被揭示,如拟南芥(Arabidopsis thaliana)[35]有34个CDPKs成员,水稻(Oryza sativa)[36]有31个,小麦(Triticum aestivum)[37]有20个,在烟草(Nicotiana tabacum)[38]、玉米(Zea mays)[39]、番茄(Solanum lycopersicum)[40]等植物中也陆续发现CDPKs.在高等植物中CDPKs分为四个主要的进化家族(I-IV),对拟南芥CDPKs基因家族的34个成员进行进化分析发现,第IV家族最早形成一个单独的进化枝,第III组与第I、II 组又分别形成一个进化枝,而I组和II组之间的进化关系最近(见图3),这与Valmonte等[34]得出的结论一致.值得注意的是,Zhu等[22]发现第I家族中AtCPK4和AtCPK11两个基因同源性很高,具有功能冗余现象.
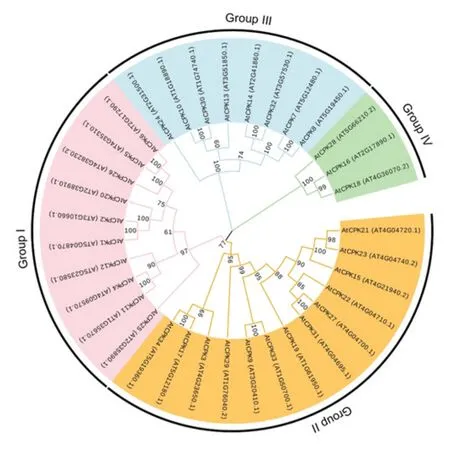
图3 拟南芥CDPKs基因家族的进化分析Fig 3 Phylogenetic analysis of CDPKs gene family in Arabidopsis thaliana
2.3 CDPKs基因的表达模式
CDPKs在细胞、组织、器官中具有多种表达模式,可能参与特定的信号途径.例如,AtCPK17/34只能在花粉中表达,参与调控花粉管的生长[41−42],而AtCPK3/6在保卫细胞中显著表达,参与调控气孔运动[43].马铃薯StCDPK1受发育过程的调控,在形成块茎时表达[44].CDPKs在种子形成和萌发过程中也发挥重要作用,檀香木CDPKs参与胚胎发育和种子萌发过程[45],而过表达水稻OsCDPK2后会抑制种子形成,导致发育提前终止[46].拟南芥AtCPK12在根、茎、叶等多种组织中均表达,但在干种子中则不表达[10].AtCPK10在根、茎、叶、花和角果等组织或器官中表达[47].CDPKs的时空表达差异表明其可能参与植物的不同生长发育过程,在复杂的细胞调控网络中发挥功能.
2.4 CDPKs蛋白定位与功能的关系
亚细胞定位对于CDPKs识别底物和确定作用范围十分重要.CDPKs分布广泛,包括胞质、细胞核、质膜、内质网、过氧化物酶体、脂质体等[7,48].其中大部分定位于质膜、液泡膜、内质网膜等部位,这种膜定位是由N端可变域的豆蔻酰化位点(在N端第2位的甘氨酸残基)和棕榈酰化位点(在N端第4/5位的半胱氨酸残基)的酰化作用介导的[5].烟草NtCDPK5定位于细胞膜,当单突变豆蔻酰化、棕榈酰化位点或两个位点双突变后,导致膜定位功能丧失[49].水稻OsCPK18的N端豆蔻酰化位点突变后,膜定位效应丧失[50].AtCPK9蛋白定位于质膜,当豆蔻酰化位点(在N端第2位的甘氨酸残基)突变为丙氨酸后,该蛋白定位于细胞质中,同样也说明豆蔻酰化位点对膜定位的重要性[51].N端豆蔻酰化作用由翻译后修饰完成并维持蛋白的膜定位,而半胱氨酸残基上的棕榈酰化的可逆性为蛋白质在细胞膜和胞质或细胞核之间穿梭提供了可能[7,19].AtCPK6通过作用于SLAC1调节各种刺激下的气孔运动,当豆蔻酰化和棕榈酰化位点发生突变后,其稳定的膜定位消失,同时丧失对SLAC1的调节功能,表明AtCPK6的膜定位对其调控SLAC1是必需的[52].Kobayashi等[53]发现马铃薯StCDPK5定位于质膜,其N端发生磷酸化作用后激活底物StRBOHB,但突变其N端的豆蔻酰化和棕榈酰化位点后,StCDPK5丧失质膜定位和体内激活StRBOHB的能力[54],以上研究表明,CDPK的N端酰化作用对其膜定位及行使功能十分重要.
3 CDPKs的互作组分及功能
3.1 CDPKs的互作组分
3.1.1 CDPKs对底物的特异性识别
CDPKs对底物特异性识别受到激酶活性位点和底物磷酸化位点周围氨基酸序列相互影响[55].烟草NtCDPK1能够负调控转录因子RSG,参与赤霉素的反馈调节.将其N端可变区的氨基酸突变(10R-A)后,虽仍具有激酶活性,但结合RSG的能力和磷酸化作用均降低[56].此外,有研究表明自磷酸化作用可以防止底物过度磷酸化,改变CDPKs对底物的偏好.NtCDPK1的自磷酸化作用(6S和21T)降低其对RSG的亲合力,同时降低了磷酸化效率[15].结构域删除和交换实验表明,N端可变结构域在底物特异性识别过程中具有至关重要的作用[56].替换NtCDPK1和AtCPK9(二者同源性较高)的N端可变域,发现NtCDPK1的N端可变域赋予AtCPK9结合RSG的能力和激酶活性[56].烟草NtCDPK2和NtCDPK3结构域交换实验也证实,磷酸化作用仅由各自的N端可变结构域决定[19].值得注意的是,一些CDPKs及底物在细胞的不同环境下可能发挥不同的生理功能.比如AtCPK21/AtCPK23能够激活保卫细胞离子通道蛋白SLAC1/SLAH3从而促进气孔关闭[57−58],但cpk21/cpk23突变体植株也表现出较强的干旱耐受性[59−60].CDPKs的内源底物种类众多,包括转录因子、热激蛋白、通道蛋白以及多种酶类,底物的多样性决定了功能的多样性,这些底物在基因表达、酶代谢、离子和水分的跨膜运输、细胞骨架的动态变化等方面均发挥调节作用[35],因而CDPKs在植物生长发育以及胁迫响应等过程中具有重要的生理功能(见表1).
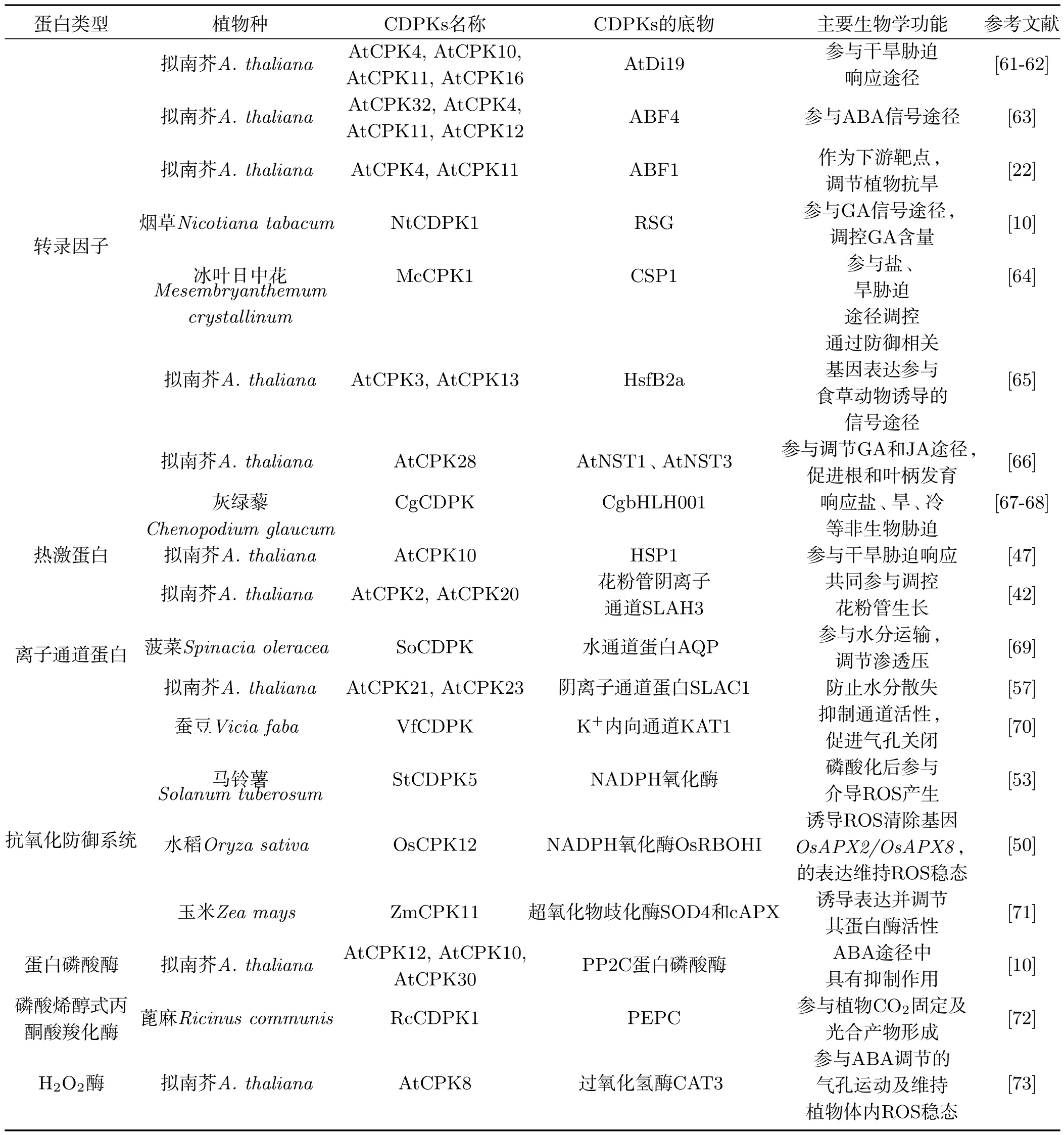
表1 高等植物中部分CDPKs的作用底物及功能Tab 1 Substrates of some CDPKs and its functions in higher plants
3.1.2 互作的实质及生物学意义
CDPKs通过磷酸化调节不同底物蛋白的活性,进而调控基因表达、维持离子平衡和ROS稳态[74].磷酸化是一种普遍的翻译后修饰,其可直接或间接激活胞质内的转录因子,转位进入细胞核发挥作用[55].BZR1(brassinazole resistant1)是BR(brassinolide)信号转导途径中重要的转录因子,其定位与磷酸化状态紧密相关.GSK3-like蛋白激酶(glycogen synthase kinase-3-like kinase)BIN2通过调节BZR1与14-3-3蛋白的相互作用,诱导BZR1从细胞核进入细胞质,且随后保留在细胞质中,这一过程受BIN2磷酸化的直接调节[75].BR处理或BZR1的磷酸化位点和14-3-3蛋白的识别位点发生突变后促使BZR1转位至细胞核,进而调控下游BR响应基因的表达[75].烟草NtCDPK1磷酸化转录因子RSG第114位丝氨酸,促进14-3-3蛋白结合RSG[76],这种相互作用负调控RSG,将其限制在细胞质而不能进入细胞核调控靶基因.当NtCDPK1表达被抑制后,其磷酸化作用以及从细胞核到细胞质的转位均受到影响[77−78].AtCPK32能够在体外磷酸化ABF4,其磷酸化位点(110S)对二者之间的相互作用是必需的,过表达AtCPK32能通过影响ABF4进而调控ABA响应基因的表达[63].灰绿藜CgCDPK与转录因子CgbHLH001能在细胞膜上发生相互作用,且体外条件下前者使后者发生磷酸化,当CgbHLH001上预测的磷酸化位点(96S)发生突变后二者相互作用消失,推测CgCDPK可能通过对CgbHLH001的磷酸化促使其转位到细胞核,从而调控下游基因的表达[67−68].以上研究表明,CDPKs的磷酸化对其相互作用及发挥生物学功能具有重要意义,因此深入研究CDPKs底物的特异性及互作的分子机制对于阐明CDPK信号途径十分必要.
3.2 互作组分的生物学功能
3.2.1 参与非生物胁迫的响应
CDPKs在响应盐、旱、冷等非生物胁迫过程中发挥重要作用,常涉及ABA信号途径以及ROS清除等过程[36].ABA作为植物中的主要激素之一,广泛参与植物生长发育及各种胁迫响应过程.植物细胞在不利环境下ABA含量增多,促使植物感知并应对外界刺激.干旱胁迫下ABA依赖的气孔关闭是防止水分损失的重要机制,许多CDPKs参与调节气孔运动.AtCPK10与HSP1相互作用,参与ABA/Ca2+信号对气孔保卫细胞内向整流型K+通道的调控[47].AtCPK8通过AtCAT3抑制保卫细胞的内向整流型K+通道而参与ABA/Ca2+调控的气孔关闭作用[73].AtCPK13通过调节保卫细胞通道蛋白KAT1和KAT2的表达减小气孔开度[79].过表达AtCPK32后植株对ABA信号更加敏感,导致种子萌发率降低[63].当植物受到胁迫后会诱导ROS产生,低浓度的ROS能够作为信号分子介导多种反应,而过量的ROS则会对细胞造成氧化损伤.NADPH氧化酶广泛参与ABA诱导的ROS产生和ABA诱导的气孔关闭[48].马铃薯StCDPK4/5通过磷酸化NADPH氧化酶促进ROS的产生[80],拟南芥AtCPK5/6以及AtCPK4/11也具有类似的功能[81].油菜BnaCPK2与NADPH氧化酶RbohD相互作用,共同参与ROS产生并调控细胞死亡过程,过表达BnaCPK2导致ROS过量积累和细胞死亡[82].在拟南芥中过表达AtCPK1后导致NADPH氧化酶Rboh的活性升高[83],其转基因株系对盐、旱胁迫的耐受性增强[84],并通过对底物ORE1(oresara1,衰老的主要调控因子)的直接磷酸化作用调控细胞死亡[85].
3.2.2 参与生物胁迫的响应
植物除了应对多种非生物胁迫,还要防御病虫害等生物胁迫侵害.大量研究表明,在各种植物/病原体互作系统中胞质Ca2+流入是病原菌诱导信号转导途径的关键早期步骤.植物对病原体的响应通常受病原体编码的激发子(如枝孢霉Avr9)和植物编码的受体(如番茄Cf-9抗性蛋白)之间的相互识别所激活.Romeis等[38,86]在Cf-9转基因烟草中发现,当Cf-9与Avr9互作后激活了CDPK的表达,并作为抗原诱导反应中重要的钙传感器发挥功能.将CDPK基因沉默后发现植物丧失Cf-Avr诱导的特异性超敏反应,表明CDPK对于介导Cf-9/Avr9诱导的植物防御体系不可或缺[38].AtCPK5/6还通过调控乙烯生物合成酶ACS基因的表达来调节乙烯的产生,从而应对灰霉病感染[87−88].在拟南芥叶细胞中,细菌激发子flg22(a 22 amino acid peptide of flagellin)能够瞬时激活多个CDPKs的活性,如AtCPK4、AtCPK5、AtCPK6 和AtCPK11,它们可作为早期转录过程的信号调节器[81].突变其中某些基因后(如cpk5 cpk6双突变体;cpk5 cpk6 cpk11三突变体;cpk4 cpk5 cpk6 cpk11四突变体),早期ROS产生减少,表明这4个基因共同调控flg22介导的ROS损伤及对病原菌的防御,提示CDPKs在PAMP(pathogenassociated molecular patterns)信号途径中起重要作用[81].对17个拟南芥CPK单突变体进行遗传筛选发现,cpk3和cpk13突变体中草食动物诱导的植物防御素基因PDF1.2的表达量显著降低;CPK3/13在体外能够磷酸化转录因子HSFB2a,且在烟草叶片中瞬时表达后能进一步激活PDF1.2的表达[65].不仅如此,AtCPK3还参与多种防御途径,是植物响应真菌及其他病害的必需组分[89],如激活状态下的AtCPK3通过磷酸化Rem1.3(Remorins)上的74S/86T/91S位点抑制病毒PVX(potato virus X)的细胞增殖[90].
4 展望
CDPKs作为植物中重要的蛋白激酶,在识别Ca2+信号后通过对底物的磷酸化参与多种信号途径的调节,从而发挥重要的生物学功能.本文从CDPKs对Ca2+信号的敏感性、结构和分类、表达模式和亚细胞定位以及互作蛋白的功能等不同方面,综述了CDPKs通过蛋白磷酸化传递Ca2+信号从而调控植物细胞代谢并响应环境胁迫的机制.尽管很多CDPKs在体外能磷酸化各种蛋白底物,但CDPKs磷酸化作用的具体机制,包括CDPKs与其底物相互作用的实质及生物学意义、磷酸化与信号转导的相关性等方面还有待深入探索.鉴定植物CDPKs的内源底物并分析其特异的调控功能将为研究CDPKs信号途径的作用机制提供新的证据,并为改良农作物奠定科学理论基础.

