AAO工艺中活性污泥胞外聚合物的电化学特性
王先宝,陈甜甜,高楚玥,张雨笛,谢怡俐,孙 静,孙福乐,张安龙
(1.陕西科技大学 环境科学与工程学院,陕西 西安 710021;2.西安市第五再生水厂,陕西 西安 710021)
0 引言
胞外聚合物(Extracellular Polymeric Substance,EPS)是微生物在生长和代谢过程中自身分泌产生的一类高分子聚合物,其组成与污水处理系统的运行方式有较大相关性[1],一部分来自于微生物细胞代谢的分泌,一部分来源于外界环境中的化合物[2].根据EPS在微生物细胞外空间分布特征可将EPS分为溶解型EPS和结合型EPS.结合型EPS具有双层结构,内层由紧密结合型EPS(Tightly Bound EPS,TB-EPS)组成,其具有一定的形状;外层由松散结合型EPS(Loosely Bound EPS,LB-EPS)组成,是一个松散、没有明显边缘的黏液层[2].
长期以来,关于EPS的研究主要集中于其对重金属和有机污染物的吸附和络合作用.EPS中存在羧基、巯基、羟基及含磷基团等官能团能够吸附重金属[3,4],污泥中溶解性EPS吸附重金属能力比结合型EPS高[5];由于EPS带负电荷,因而能够吸附部分有机污染物,如苯类、染料和腐殖酸[6].但近年来,学者们发现EPS中含有氧化还原介体(如腐殖酸、细胞色素c、黄素等),这类物质能作为电子载体参与胞外电子传递过程.Cao等[7]采用蛋白质组学法发现EPS中含有20种氧化还原蛋白,其中有两种是与胞外电子转移有关的单胞菌MR-1c型细胞色素MtrC和OmcA的同系物;Yang等[8]研究表明Geobacter 生物膜提取的EPS中含有细胞色素c、血红素蛋白等氧化还原活性物质;Li等[9]研究表明EPS中血红素结合蛋白是 S.oneidensis 和 P.putida菌的关键氧化还原产物.
目前研究表明EPS通过参与胞外电子传递可将多种高价态重金属离子(如U(VI)和Cr(VI))还原成低价态毒性相对较小的或容易被固定的状态[10,11],减少对环境的危害;这对有机污染物和重金属等物质的污染修复有着重大应用潜力,因此,学者们越来越关注EPS的氧化还原特性.有研究表明EPS能够介导种间直接电子传递提高污泥厌氧消化产甲烷过程,李青[12]的研究表明EPS的介导和电子传递作用是针铁矿加速甲烷产率的主要原因;Zhu等[13]研究发现EPS中的黄酮在针铁矿-产甲烷体系中发挥重要作用;Hu等[14]的研究表明EPS提高了体系中核黄素和细胞色素c含量,并降低体系电阻、提高电子转移能力从而促进污泥产甲烷性能.
目前,EPS氧化还原特性的研究以电活性微生物为主,关于活性污泥EPS氧化还原特性的研究较少.Lu等[15]采用不同提取方法探究活性污泥EPS电化学特性,研究结果表明EPS含有氧化还原活性物质,通过电化学方法证明其具有一定的电子转移能力.有研究表明不同运行工艺及不同生化单元中污泥EPS的组成和性能存在一定差异,然而目前关于不同生物处理单元EPS电化学特性的研究尚未见报道.
同时,目前研究将EPS作为一个整体探讨其电化学性质,并未对分层EPS的电化学特性进行解析.因此,本研究以城市污水处理厂中AAO工艺中厌氧池、缺氧池和好氧池中污泥为研究对象,采用加热法分别提取LB-EPS和TB-EPS,通过循环伏安、计时安培等电化学方法考察EPS中氧化还原物质,旨在揭示AAO工艺各单元活性污泥中不同类型EPS的氧化还原性能.
1 实验部分
1.1 实验原料
污泥样品取自西安市某污水处理厂,该厂设计处理能力为40 万m3/d,采用AAO工艺.以AAO中厌氧池、缺氧池和好氧池的污泥作为研究对象.采集的污泥样品均在1.5 h内运至实验室,使用之前储存在4 ℃的冰箱中,所有试验均在采集污泥样品后一周内完成.
1.2 实验方法
1.2.1 EPS提取
活性污泥中LB-EPS和TB-EPS采用改良后的加热方法[16].首先,在600 rmp,10 min的条件下将活性污泥离心,倒去上清液,加入70 ℃的0.9% NaCl溶液至原体积,然后将混合物置于摇床上80 r/min振荡1 min,在4 ℃,8 000 g下离心15 min,将上清液经0.45μm滤膜过滤得到LB-EPS;将提取LB-EPS后的污泥重新悬浮于0.9% NaCl溶液中,将混合液置于60 ℃水浴锅中加热30 min,在4 ℃,9 000 g下离心20 min,上清液经0.45μm膜过滤得到TB-EPS,置于4 ℃下保存待用.
1.2.2 EPS组分测定
EPS中多糖(Polysaccarides,PS)含量采用苯酚-硫酸法测定;蛋白质(Proteins,PN)和腐殖酸(Humin Acid,HA)含量采用修正的Folin-酚法测量;DNA采用二苯胺法进行测定.其中EPS总量为PS、PN、HA和DNA之和,单位为mg·g-1(以VSS计).所有测试结果为重复3次的平均值.
1.2.3 电化学特性测定
采用电化学工作站(辰华660E)进行循环伏安、计时电流和电化学阻抗谱试验,以玻碳电极为工作电极,饱和甘汞电极为参比电极,Pt网为对电极.进行电化学测试之前,向电解液中持续通入氮气5 min,使其维持在一个近乎无氧的状态.循环伏安试验中扫描速度为50 mV/s,电势扫描范围为-1.0 V至+0.5 V.进行计时电流法试验时,测量电子接受能力(Electron-accepting Capacity,EAC)时设置的还原电位为Eh=-0.6 V,电子供给能力(Electron-donating Capacity,EDC)的氧化电位为Eh=+0.5 V.电化学阻抗谱试验中开路电压值设为初始电压,高频为106Hz,低频为0.1 Hz.
1.2.4 光谱扫描
采用UV2600A紫外可见分光光度计扫描不同处理单元污泥LB-EPS和TB-EPS溶液.采用1.0 cm的石英比色皿,以超纯水作空白,扫描区间为200~500 nm.采用三维荧光光谱仪(爱丁堡FS5)测定LB-EPS和TB-EPS的组分和物质结构,激发波长Ex为220~500 nm,其增量为5 nm,发射波长Em为230~600 nm,其增量为1 nm,响应时间为0.1 s.
2 结果与讨论
2.1 EPS的化学组分
本试验采用加热法提取LB-EPS和TB-EPS.由表1可知,TB-EPS中组分含量高于LB-EPS.以厌氧池污泥为例,LB-EPS和TB-EPS总量分别为18.39 mg·g-1和76.96 mg·g-1,其中DNA占比分别为4.57%和8.07%.Liao等[17]的研究表明DNA在EPS总量的2%~15%内,可认为EPS在提取过程中没有发生严重破裂.因此,本试验采用的加热法没有引起严重的细胞裂解.PN含量占EPS总量的60%~75%,是两类EPS的主要成分部分,这与温丹丹等[18]的研究结果一致,而袁冬琴等[19]的研究结果表明PS是EPS的主要组成部分,造成EPS组成的不同主要是由于其容易受到进水水质、工艺类型、运行参数提取方式等诸多因素影响[20-23],樊鹏超等[24]的研究也表明EPS中PS、DNA和HA含量与水质情况、运行参数及工艺类型存在一定的相关性.此外,LB-EPS和TB-EPS含有一定量的HA,HA中存在大量氧化还原功能基团,可作为微生物和污染物间的电子穿梭体或直接作为微生物厌氧呼吸的电子受体参与电子传递[25].
AAO不同单元污泥提取的EPS中各组分含量略有差异.由表1可知,EPS总量随着AAO工艺沿程减少,可能是由于随着AAO工艺运行,废水所能提供的可供微生物消耗的物质逐渐减少,使其消耗EPS内部储存的营养进行生命供给,使得PN、PS含量降低[26].
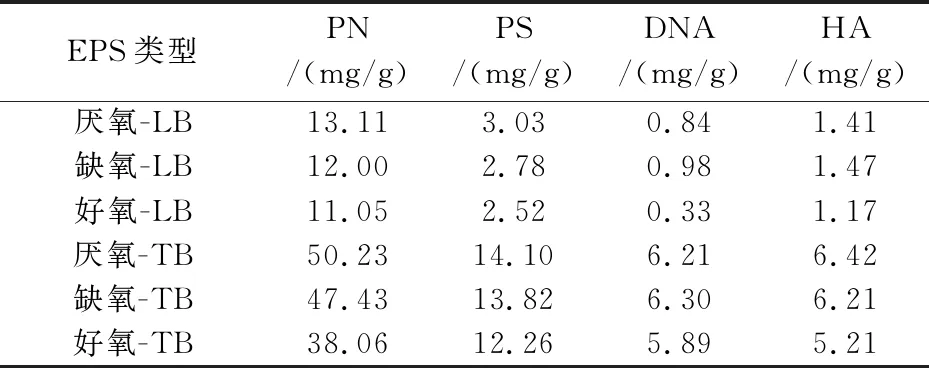
表1 活性污泥分层EPS组分含量
2.2 EPS的电化学特性分析
2.2.1 循环伏安
循环伏安法可以用来检测EPS的氧化还原活性和电化学特性.图1(a)、(b)分别为AAO工艺活性污泥LB-EPS和TB-EPS的循环伏安图.从图1中可看出,LB-EPS和TB-EPS在-0.3 V附近均有一个氧化峰,其峰值电流大小基本相同,张恩华[27]的研究表明该峰可能属于结合态黄素/Mtrc的氧化峰,但其对应的还原峰在本试验中没有观察到,可能是由于溶液中有多个相对含量较近的氧化还原物质时,其循环伏安由于电位分布较宽,其对应的氧化还原峰表现得不明显[15].此外,LB-EPS和TB-EPS在-0.7 V处有一个还原峰,该峰随着AAO工艺运行逐渐减小,说明其含量逐渐降低.
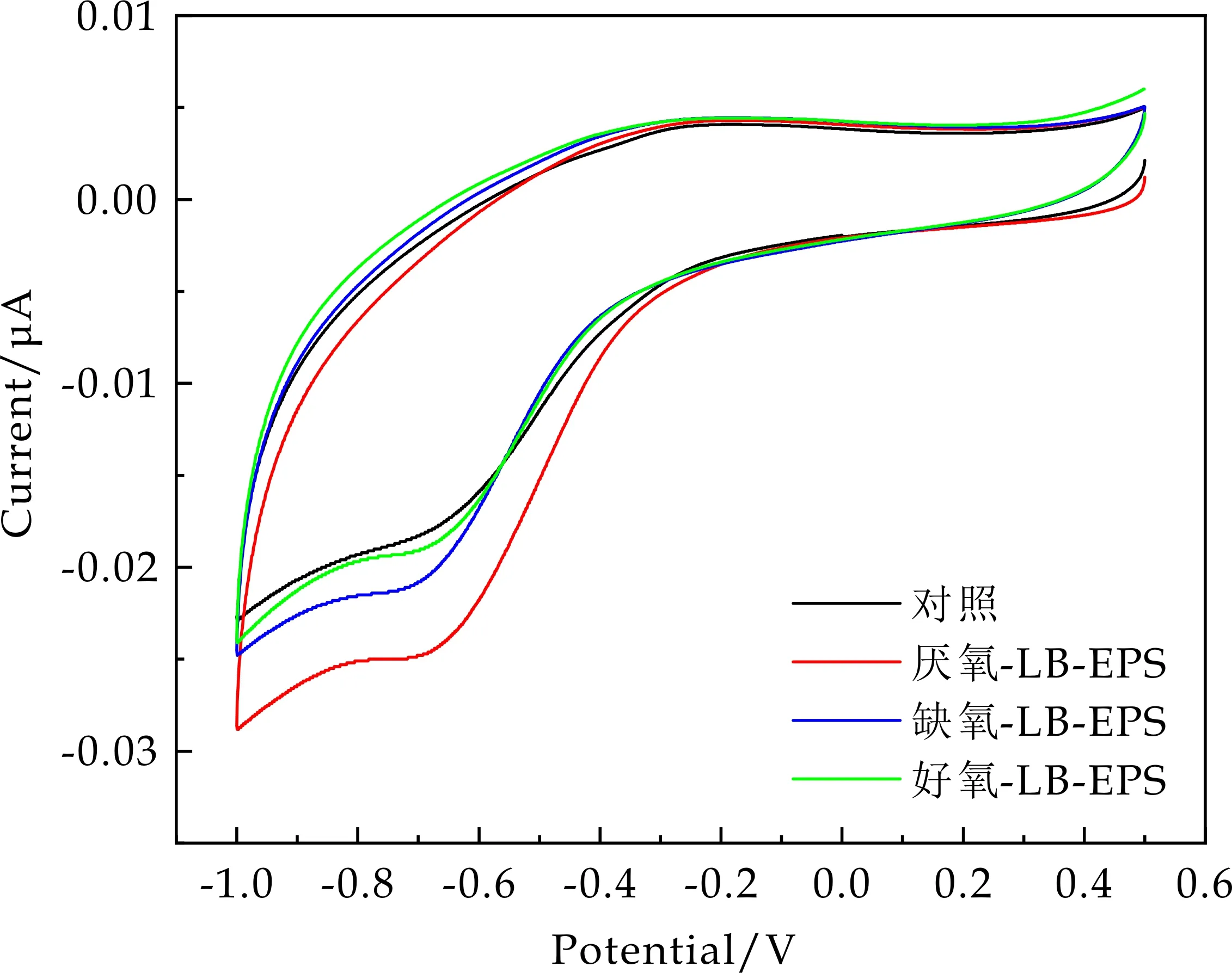
(a)LB-EPS循环伏安图
2.2.2 EPS的电子转移能力
为了进一步验证活性污泥提取的EPS是否具有电子转移能力,进行了计时电流法.从图2中可看出,LB-EPS和TB-EPS均有一定的电子转移能力.由图2(a)可知,三种LB-EPS的EDC值相差不大,EAC值大小依次为缺氧池>好氧池>厌氧池,说明缺氧池污泥LB-EPS含有更高的电子转移能力;而厌氧池、缺氧池和好氧池污泥TB-EPS的电子转移能力依次为0.652μmole-·g-1、0.640μmole-·g-1和0.676 mole-·g-1;有研究表明电子转移能力依赖于EPS中氧化还原组分的含量[28],说明好氧池污泥TB-EPS中含有更多的氧化还原物质.
本试验中活性污泥EPS的EAC和EDC值分别为0.373~0.568μmole-·g-1和0.066~0.113μmole-·g-1,与Ye等[29]研究结果相近;但与其他文献中报道的电活性微生物EPS相比,本试验所采用的活性污泥EPS的电子转移能力较低,可能是由于电活性微生物中含有更多可以导电的细胞色素c类蛋白、黄素类物质[30].此外,本试验中的LB-EPS和TB-EPS的EAC值均高于EDC值,与Lu等[15]的研究结果一致,可能是由于EPS中氧化还原物质主要以氧化态的形式存在[30].
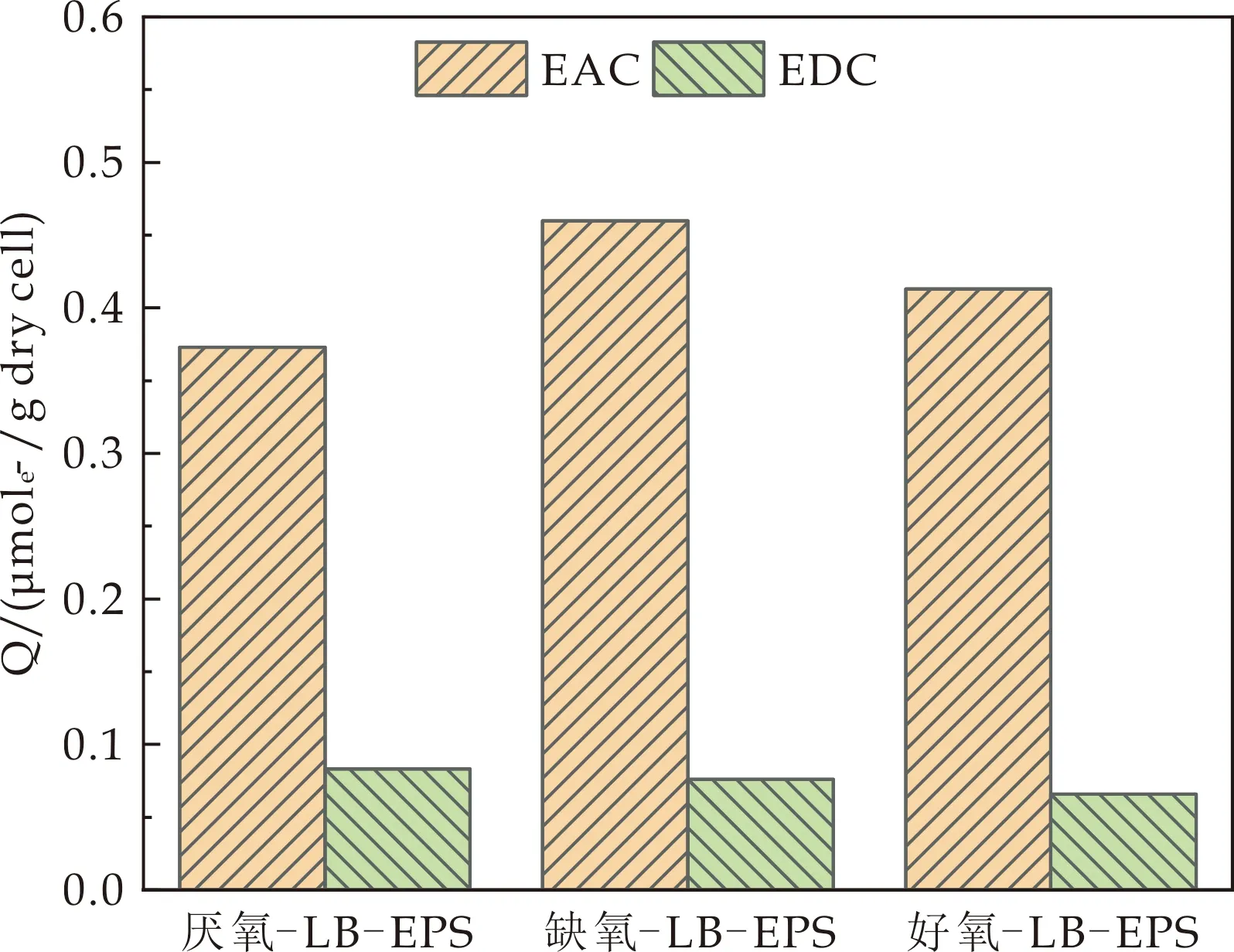
(a)LB-EPS的电子转移能力图
2.2.3 电化学阻抗谱
图3是LB-EPS和TB-EPS的电化学阻抗谱图,并对其进行等效电路拟合.等效电路主要由Rs、CPE、Rf和Rct组成,其中Rs代表溶液电阻.由表2可看出,TB-EPS中各电阻值小于LB-EPS中的,这可能是由于TB-EPS中含有更多腐殖质类物质,使得电子能够更有效的传递从而降低电阻.对于LB-EPS 而言,缺氧池中Rf和Rct最小,其次是好氧池,该结论与计时电流法相对应.TB-EPS的Rf和Rct值由大到小依次是缺氧池、厌氧池和好氧池,说明好氧池污泥TB-EPS的电阻最小,电子转移能力更大,推测认为其含有更多的氧化还原介体.
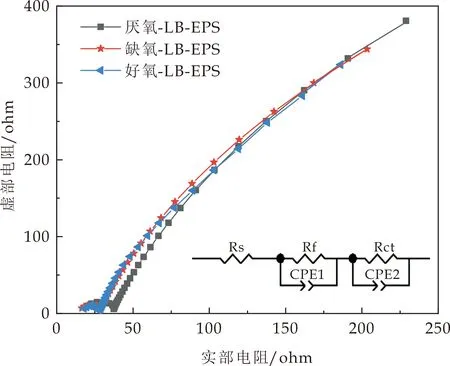
(a)LB-EPS的电化学阻抗谱图
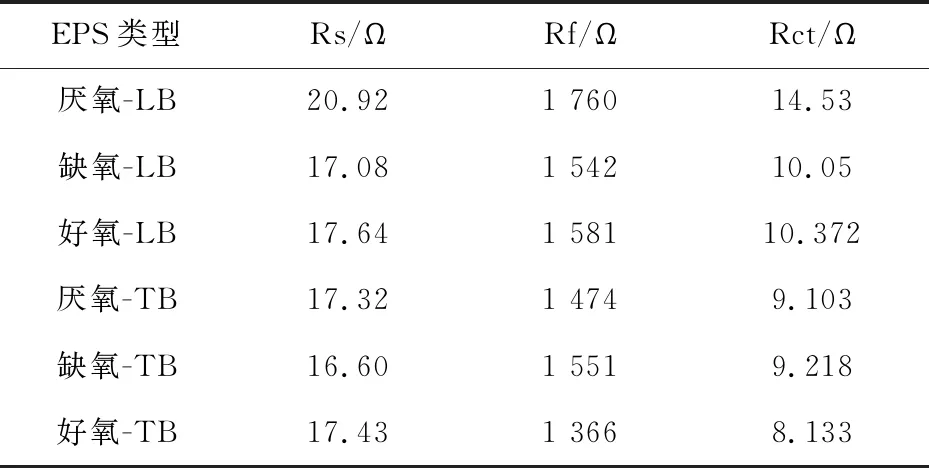
表2 LB-EPS和TB-EPS的电阻值
2.3 EPS的紫外扫描
图4展示了不同类型EPS的紫外-可见光谱图.由图4可以看出,LB-EPS和TB-EPS在254 nm(UV254)处有一个清晰的峰.UV254值反映的是水体中存在的腐殖质类有机物及含有C=C双键和C=O双键的芳香族化合物等物质的含量[15].一般来说,UV254值越大,其对应的芳香度就越大、腐殖化程度越深.TB-EPS中的UV254值远远高于LB-EPS,说明TB-EPS中含有更多的有机质,与前面EPS中组分总量相对应.
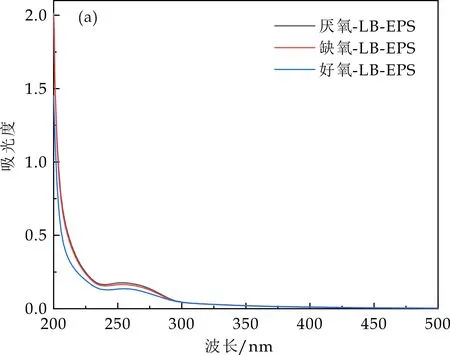
(a)LB-EPS的紫外扫描
有文献表明EPS中还含有少量的细胞色素c,可以利用紫外可见光谱来探究该物质是否存在.图4(c)表明TB-EPS在402 nm处有个特征吸收峰,该峰的位置与氧化态细胞色素c一致[30].厌氧池、缺氧池和好氧池LB-EPS在402 nm处的吸光度分别为0.011、0.011和0.010,而其对应的TB-EPS的吸光度分别为0.292、0.280和0.210,说明活性污泥中绝大部分细胞色素c位于TB-EPS.有研究表明以铁离子为中心的卟啉环细胞色素c蛋白是介导电子传递的关键组分,TB-EPS中含有较高浓度的细胞色素c是其含有更高的电子转移能力的原因之一.此外,细胞色素c的吸光度随着AAO工艺的运行逐渐降低,说明AAO工艺活性污泥EPS中细胞色素c含量沿程减少.
2.4 EPS的三维荧光扫描
EEM可用来进一步检测LB-EPS和TB-EPS的组分分布.由图5可看出,EPS中主要存在两个明显的特征峰peak A (Ex/Em:230/310-350)和peak B (Ex/Em:280-290/310-350),这2个峰属于络氨酸、色氨酸蛋白类物质[8,15],说明AAO工艺中活性污泥EPS主要以蛋白类物质为主,这与先前采用化学方法测定EPS组分的结论一致.此外,还有peak C (Ex/Em:230-245/450)和peak D (Ex/Em:340-350/440-450),这些峰属于类富里酸和类腐殖酸[31,32].研究表明富里酸的三维荧光强度与电子转移能力具有较高的相关性,富里酸的存在可以作为自然环境有机废水中具有电子传递能力活性的重要依据[32].LB-EPS中Peak C相对峰强度大小依次是:缺氧池>好氧池>厌氧池,说明缺氧池中存在相对较多的富里酸,即缺氧池活性污泥LB-EPS具有更大的电子转移能力活性,这与计时电流法测定的研究结果一致.
从图5可看出,TB-EPS中peak B的荧光强度随着AAO工艺运行沿程减小,表明PN含量逐渐降低.而peak D峰值由大到小依次是:好氧池>厌氧池>缺氧池,说明HA含量先减小后增加,与前文比色法测定结果不一致,这是由于荧光光谱比色谱法具有更高的灵敏度[21,33].HA是一类典型的具有氧化还原能力的物质,其氧化还原能力很大程度上归因于其结构中醌官能团,是HA中重要且普遍存在的荧光团[15].EEM和计时电流结果表明AAO工艺活性污泥EPS中HA的含量与其电子转移能力相时应,因此,可以推测出腐殖质类物质是活性污泥EPS参与电子转移过程中的重要组成部分.
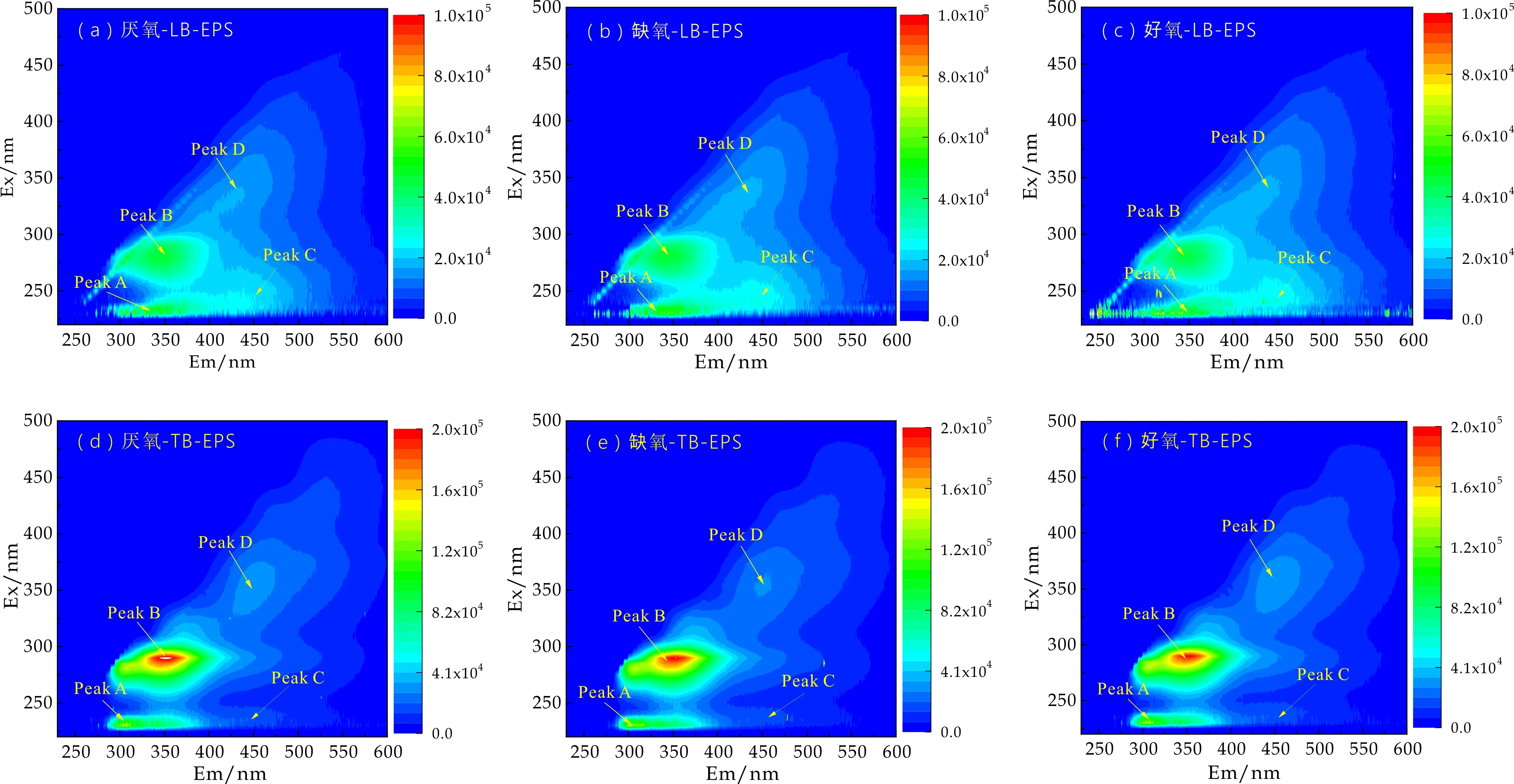
(a)~(c)LB-EPS的三维荧光图 (d)~(f)TB-EPS的三维荧光图图5 LB-EPS和TB-EPS的三维荧光图
3 结论
(1)在AAO工艺中,PN是活性污泥EPS的重要组成部分,TB-EPS各组分含量高于LB-EPS,LB-EPS和TB-EPS总量沿程逐渐减少.
(2)循环伏安试验表明活性污泥EPS中存在氧化还原物质,计时电流试验表明LB-EPS的电子转移能力大小依次为缺氧池>好氧池>厌氧池,TB-EPS的电子转移能力强弱依次是好氧池>厌氧池>缺氧池.
(3)紫外可见光谱研究表明AAO工艺中活性污泥EPS中含有细胞色素c,绝大部分细胞色素c位于TB-EPS中,并且细胞色素c含量随着AAO工艺流程逐渐减少.
(4)EEM图结果表明蛋白类物质是LB-EPS和TB-EPS的主要荧光物质.对于LB-EPS而言,缺氧池污泥中含有更多的富里酸和腐殖质类物质,其次是好氧池;对于TB-EPS而言,腐殖质类物质的荧光强度依次是好氧池>厌氧池>缺氧池,与其电子转移能力一致,因此推测富里酸和腐殖质类物质是EPS参与电子转移过程中的主要物质.

