麝香草酚包合物的制备工艺优化及其评价
常大伟,雷 琦,闫 瑾,王虎玄
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
麝香草酚(Thymol),又名百里香酚,具有刺激性气味,极易溶于乙醇、乙醚、氯仿等溶剂中[1].麝香草酚是牛至精油和百里香精油的主要活性成分,已被证实具有抗氧化、抗菌、抗癌、抗炎、抗痉挛等多种活性[2].因此,麝香草酚可以作为一种很有前途的抗菌剂应用于食品保藏、功能性食品和医药制剂中.例如,Esquivel-Chávez通过添加不同量的麝香草酚,有效地抑制了接种到芒果伤口的微生物菌丝的生长以及降低了芒果的腐烂程度[3].然而,麝香草酚水溶性低、挥发性高、芳香气味强,限制了它的广泛应用[4].
环糊精与客体形成包合物是一种应用较为广泛的方法,用此方法可以极大地克服某些物质的一些缺点,如水溶性差、生物利用度差、气味难闻等[5].环糊精与客体之间通过分子间作用力结合,使得客体分子部分或全部进入主体,形成包合物[6].其中,β-CD是环糊精中最常用的壁材,因为它易于生产、成本较低、空腔大小适宜且它的外表亲水、内腔亲油,有利于包合疏水性物质[7].目前,制备包合物的方法有多种,如饱和水溶液法、超声波法、超临界流体法、研磨法等[8].在这些方法中,饱和水溶液法被认为是获得包合物的最常用方法之一,具有简单和高效的优点,由于滤饼含水较少,缩短了获得包合物的干燥时间,更有利于降低包合物干燥过程中的能耗和热降解[9].因此,本实验采用饱和水溶液法制备麝香草酚-β-CD包合物.虽然甘永江等[10]在研究中测定了麝香草酚在β-CD及其衍生物溶液中的溶解度,绘制相溶解度曲线,并比较了不同烷基化β-CD对麝香草酚的增溶作用,但是对于包合物在高温下的稳定性没有研究.
本文在单因素实验的基础上,采用响应面法对工艺参数进行优化,建立最佳的制备工艺,同时对包合物进行表征,对包合物的高温稳定性、溶解性进行评价,以解决麝香草酚在生产加工中水溶性差、易挥发及缓释等问题.
1 材料和方法
1.1 材料与试剂
麝香草酚(89-83-8),上海阿拉丁生化科技股份有限公司;β-CD,国药集团化学试剂有限公司;无水乙醇(分析纯),天津市天力化学试剂有限公司.
1.2 仪器与设备
UV-2600型紫外可见分光光度计,龙尼柯(上海)仪器有限公司;UV-1800型紫外可见分光光度计,上海美普达仪器有限公司;加热磁力搅拌器,苏州赛恩斯仪器有限公司;L500-A台式低速离心机,湖南湘仪实验室仪器开发有限公司;DZF型真空干燥箱,北京科伟永兴仪器有限公司;WH-3微型漩涡混合仪,上海沪西分析仪器厂有限公司;真空傅里叶红外光谱仪,德国布鲁克(Bruker)公司;Smart Lab 9kW X射线衍射仪,日本理学Rigaku.
1.3 实验方法
1.3.1 麝香草酚标准曲线的制作
麝香草酚无水乙醇溶液(1.0 mg/mL)在200~500 nm扫描,确定最大吸收波长.
准确称取麝香草酚20 mg置于容量瓶中,加入无水乙醇定容至20 mL进行溶解,配制得到质量浓度为1 000μg/mL的储备液.精密量取储备液1 mL,并用蒸馏水稀释,得到10μg/mL、20μg/mL、40μg/mL、50μg/mL、60μg/mL、80μg/mL、100μg/mL质量浓度梯度的标准溶液.在最大吸收波长下,测定上述标准溶液的吸光度.以质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,并通过最小二乘法拟合出线性回归方程.
1.3.2 包合物制备工艺
采用饱和水溶液法制备包合物[11],称取适量的β-CD,加入蒸馏水,使用磁力搅拌器加热至完全溶解,然后在磁力搅拌下加入一定量的麝香草酚溶液,并在一定温度下搅拌数小时,完毕后置4 ℃冰箱过夜,第二天抽滤,经无水乙醇洗涤2~3次后,置于25 ℃真空干燥箱中12 h,干燥至恒重,得到疏松的包合物粉末.
1.3.3 单因素实验
选取壁芯比(摩尔比)、搅拌时间、搅拌温度作为影响包合物的三个因素.分别进行单因素实验,计算各单因素的包合率和载量.
(1)壁芯比
选取壁芯比(摩尔比)因素水平为0.5∶1、1∶1、1.5∶1、2∶1、2.5∶1、搅拌时间为2.5 h、搅拌温度为50 ℃,进行单因素实验.
(2)搅拌时间
选取壁芯比(摩尔比)因素水平为1∶1、搅拌时间为0.5 h、1.5 h、2.5 h、3.5 h、4.5 h、搅拌温度为50 ℃,进行单因素实验.
(3)搅拌温度
选取壁芯比(摩尔比)因素水平为1∶1、搅拌时间为2.5 h、搅拌温度为30 ℃、40 ℃、50 ℃、60 ℃、70 ℃,进行单因素实验.
1.3.4 响应面试验
在单因素实验结果的基础上,选择对包合率影响较大的壁芯比A、搅拌温度B、搅拌时间C为考察因素,以包合率Y为指标,利用Design Expert软件建立的Box-Behnken试验设计方法,对包合物的包合条件进行优化.响应面试验的因素水平如表1所示.

表1 响应面因素水平表
1.3.5 包合率和载量
将放置过夜的包合物溶液抽滤,并用无水乙醇洗涤两次,以洗去未被包合的麝香草酚,记录滤液的体积,将滤液进行离心,离心条件选择4 000 r/min、5 min.之后用紫外分光光度计测定吸光度,根据建立的标准曲线方程计算得到未被包合的麝香草酚的质量.可用以下式(1)、(2)计算包合率和载量.
(1)
式(1)中:W0是初始加入麝香草酚的质量,g;W1是微胶囊中的麝香草酚的质量,g;CE是包合率,%.
(2)
式(2)中:W1是微胶囊中的麝香草酚的质量,g;W2是初始加入β-CD的质量,g;LC是载量,%.
1.4 包合物的表征
1.4.1β-CD及其形成的包合物的红外光谱
采用红外光谱法测定β-CD、麝香草酚、物理混合物、包合物.光谱范围为4 000~400 cm-1,分辨率 4 cm-1,扫描累加次数32次.
1.4.2 XRD
将β-CD、麝香草酚、物理混合物、包合物测定,扫描速度8 °/min,扫描范围5 °~60 °.
1.5 增溶倍数
分别称取包合物0.5 g和麝香草酚0.1 g置于装有8 mL蒸馏水的50 mL的离心管中,使包合物和麝香草酚在水溶液中达到饱和状态,放入37 ℃恒温摇床中避光振荡24 h,使得溶解达到平衡.静置过夜,使用0.22μm的微孔膜进行过滤,将滤液用蒸馏水适当稀释,在237 nm测定麝香草酚的含量,计算出包合物中麝香草酚的溶解度及增溶倍数[12].每种物质重复测量3次.
1.6 高温稳定性
为了使麝香草酚与包合物中麝香草酚的释放形成鲜明对比,分别称取麝香草酚10.0 g、麝香草酚-β-CD包合物5.0 g于直径为90 mm的玻璃皿中,置于100 ℃的烘箱中,麝香草酚每隔10 min测量一次质量,包合物每隔1 h测量一次质量,并按照以下公式(3)、(4)进行计算释放率,一式三份.
(3)
(4)
式(3)、(4)中:Y1是麝香草酚的释放率,%;m0是麝香草酚初始时刻的质量,g;mt是t时刻麝香草酚的质量,g;Y2是包合物中麝香草酚的释放率,%;M0是包合物中麝香草酚初始时刻的质量,g;Mt是包合物中t时刻麝香草酚的质量,g.
2 结果与讨论
2.1 麝香草酚标准曲线
2.1.1 最大吸收波长的选择
图1是麝香草酚在在200~500 nm波长处进行扫描结果图.从图1可知,麝香草酚的最大吸收波长为237 nm.

图1 麝香草酚的最大吸收波长
2.1.2 麝香草酚的标准曲线
图2是麝香草酚的标准曲线图,以麝香草酚的浓度为横坐标,吸光度值为纵坐标.由图2可知,麝香草酚的标准曲线方程为:y=0.004 7x+0.021 4,其中x表示麝香草酚溶液的浓度,y表示麝香草酚溶液在237 nm处的吸光度值.R2=0.997 8,表明在所选取的浓度范围内麝香草酚溶液的浓度与吸光度值具有较好的线性关系.

图2 麝香草酚的标准曲线
2.2 单因素实验
2.2.1 壁芯比对包合率和载量的影响
图3是壁芯比对包合率和载量的影响.由图3可得,随着壁芯比的提高,包合率逐渐增大.韦永琴[13]也得到同样的结果,随着主客投料摩尔比的增加包合率先迅速增加后略有增加,其原因可能是在摩尔比小于1∶1时,芯材还没有完全进入空腔,当达到1∶1时芯材几乎全部进入空腔,因此包合率迅速增加,再增加壁芯比使得包合率略有增加.载量随着壁材的增加而减小,因为β-CD的空腔的大小及数量是恒定的,因此当壁材持续增加,包合的芯材不变,使得载量持续降低.

图3 壁芯比对包合率和载量的影响
2.2.2 搅拌时间对包合率和载量的影响
图4表示的是搅拌时间对包合率和载量的影响.从图4可以明显地观察到,随着搅拌时间的延长,包合率和载量先增大后降低.当搅拌时间少于2.5 h时,芯材与壁材没有完全接触,芯材很难较好地分散在β-CD的空腔中,导致包合效果不好,而随着搅拌时间延长,包合反应逐渐达到平衡,包合率增大[14].包合物通过分子作用力结合,而这种结合力较弱,当大部分麝香草酚被包合时,继续延长搅拌时间会破坏已经形成的作用力,导致包合率降低[15].
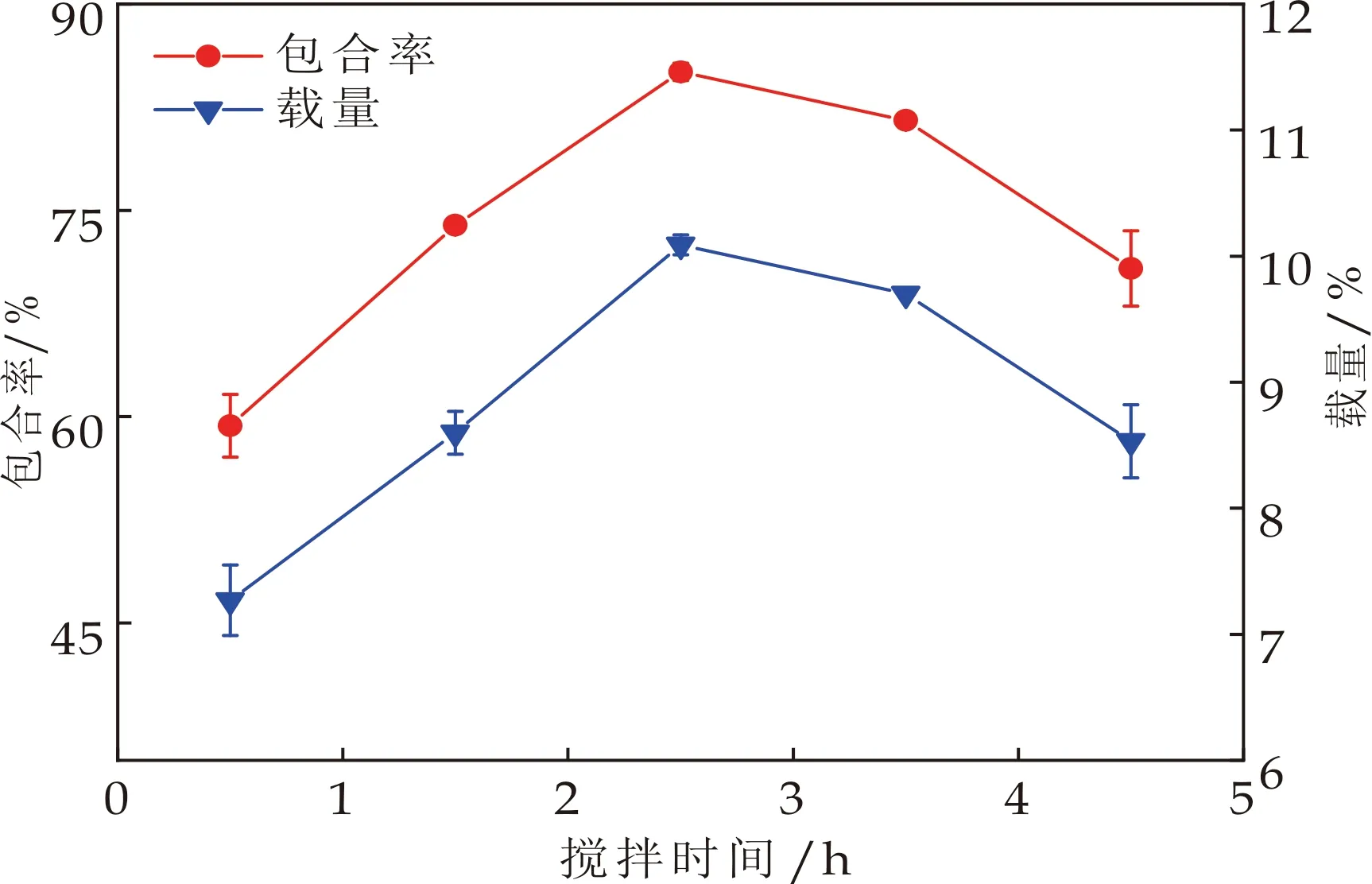
图4 搅拌时间对包合率和载量的影响
2.2.3 搅拌温度对包合率和载量的影响
图5是搅拌温度对包合率和载量的影响.从图5可以看出,随着温度的升高,包合率和载量呈现先增大后降低的趋势.从30 ℃升高到50 ℃,分子运动加快,分子的碰撞几率增大,麝香草酚进入β-CD空腔的几率增大,使得包合率和载量增大[16].而温度继续升高,包合率和载量降低的原因是包合反应是放热反应,当达到平衡温度后温度继续升高不利于反应向正反应方向进行,因此包合率和载量会降低[17].
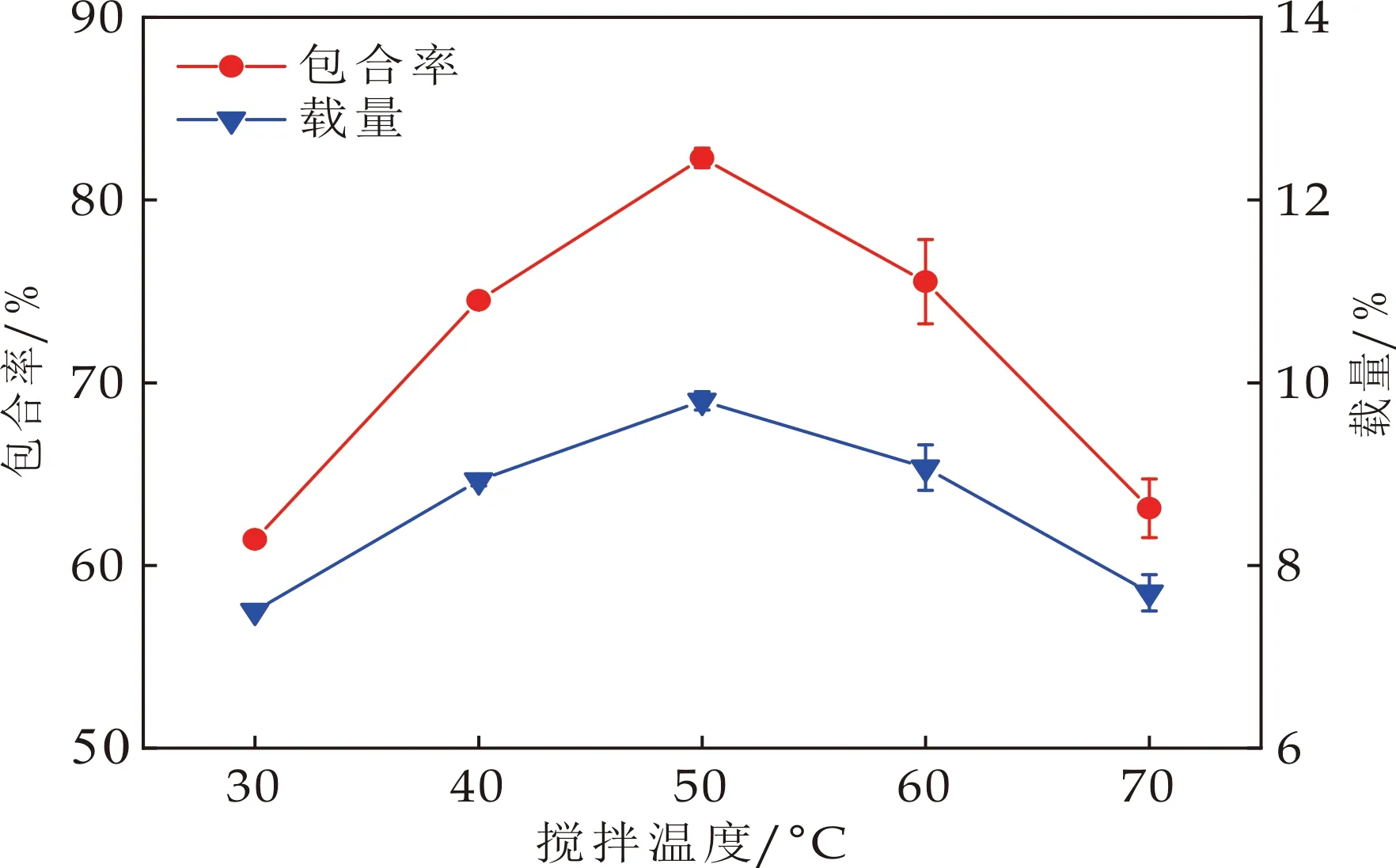
图5 搅拌温度对包合率和载量的影响
2.3 响应面优化分析
在单因素实验结果的基础上进行了响应面优化试验,响应面试验设计及结果如表2所示,采用Design-Expert软件对试验数据进行分析,得到麝香草酚-β-CD包合物的包合率与各自变量的模拟方程为:

表2 响应面试验设计及结果
Y=81.22+8.77A-1.30B+0.65C+0.52AB+0.30AC+207BC-8.79A2-5.52B2-3.40C2
回归模型方差分析表(如表3所示),根据表中F值的大小可以判断各个因素对包合率影响的大小,F值越大,对包合率的影响越大[18].因此各因素对包合物包合率的影响程度是:壁芯比A>搅拌温度B>搅拌时间C.此外,从表中也可得知,该模型的P<0.01,表明该模型为极显著.决定系数为R2=0.977 0说明此模型的拟合情况较好,回归方程代表性较好.从回归方程各项方差分析结果还可看出该方程的失拟项P值为0.143 6,不显著,表明该方程对试验拟合程度好、误差小,可用该回归方程代替试验真实点对试验结果进行分析和预测,因此该模型适用于饱和水溶液法制备麝香草酚-β-CD包合物工艺参数优化.

表3 方差分析结果表
图6是各因素交互作用对包合率影响的响应面图和等高线图.由图6可知,搅拌时间和搅拌温度的等高线呈椭圆形,表明两者的交互作用显著;壁芯比和搅拌温度的等高线呈椭圆形,说明两者的交互作用显著;壁芯比和搅拌时间的等高线图接近圆形,说明两者的交互作用不显著.
通过回归模型预测的包合物制备最优条件:壁芯比1.25,搅拌温度49.24 ℃,搅拌时间2.59 h,包合率预测83.49%.为了验证可靠性,按照上述最佳工艺调整试验实际方案为:壁芯比1.25∶1,搅拌温度50 ℃,搅拌时间2.6 h.平行操作3次.结果显示,平均包合率为84.51%,实际值与预测值相差不大,模型真实可靠.
之前,Tao等[19]的文章也有相似的研究,但是在他的研究中,包合条件是在25 ℃搅拌48 h,得到包合物的包合率为74.57%~82.55%,由此得知搅拌温度与搅拌时间在一定程度上会影响包合效果.本研究通过优化实验,包合率达到84.51%,包合率与Tao等的研究相比有所提高,并且缩短了搅拌时间,降低了麝香草酚的损失.
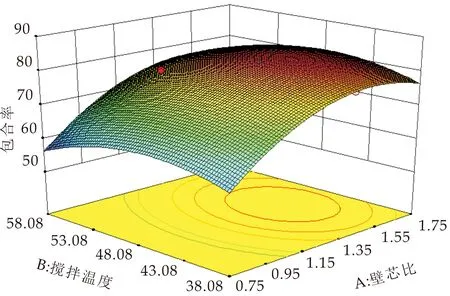
(a)壁芯比与搅拌温度响应面图
2.4 包合物的表征
2.4.1 傅里叶红外光谱
该方法通常用于确定主体中客体分子的存在,以及它们之间的相互作用[20].对于β-CD,2 906 cm-1处吸收峰与C-H伸缩的振动有关;1 155 cm-1和1 031 cm-1处的吸收峰分别与C-O-C非对称伸缩和对称伸缩的振动有关[21].图7是β-CD、麝香草酚、物理混合物、包合物的傅里叶红外光谱图,图7中麝香草酚的红外光谱图显示在3 224 cm-1处是O-H振动收缩;2 958 cm-1、2 927 cm-1是C-H的振动收缩;1 621 cm-1、1 585 cm-1、1 517 cm-1、1 459 cm-1处对应C=C的伸缩振动;1 157 cm-1、1 108 cm-1、1 091 cm-1、1 058 cm-1的吸收峰归因于C-O伸缩振动.图7中物理混合物的红外光谱还可以观察到麝香草酚特征峰,但在包合物的光谱中麝香草酚的特征峰消失或减弱,例如,图7中在2 958 cm-1处的亚甲基的C-H不对称伸缩消失了这是因为β-CD中OH基团的伸缩振动覆盖了麝香草酚在此处的吸收峰[22],证明了麝香草酚-β-CD包合物的形成.包合物的图谱中1 689~1 551 cm-1处的特征峰明显减少,这是因为麝香草酚分子进入在β-CD空腔中,从而减少了麝香草酚分子的运动[23].

图7 β-CD、麝香草酚、物理混合物、包合物的傅里叶红外光谱图
2.4.2 XRD
特征峰在光谱中的出现、特征峰的升高或降低都是包合物形成的证据[24].
图8是β-CD、麝香草酚、物理混合物、包合物的XRD图.从图8所示的物理混合物和麝香草酚的XRD衍射图可以看出,麝香草酚在7.97 °、16.63 °、18.87 °、20.48 °、20.75 °和25.54 °处出现特征峰.由图8物理混合物的衍射图可以看出麝香草酚的特征峰还较明显,并且物理混合物的衍射图谱与β-CD的衍射图谱相似,表明麝香草酚与β-CD之间没有络合作用.图8中包合物的XRD衍射图谱中,麝香草酚在7.97 °、25.54 °和10.58 °处的特征峰消失,在7.25 °处出现新峰,表明β-CD与麝香草酚发生了络合作用.这些峰的变化说明麝香草酚经β-CD包埋使得β-CD的结构由笼型结构转向通道型结构,进一步证实了包合物的形成[25].

图8 β-CD、麝香草酚、物理混合物、包合物的XRD图
2.5 增溶倍数
表4是37 ℃下麝香草酚与包合物中麝香草酚的溶解度.从表4中得出,麝香草酚在37 ℃时的溶解度为0.47±0.02 mg/mL,而包合物中的麝香草酚在37 ℃时的溶解度为0.67±0.3 mg/mL.包合物中麝香草酚的溶解度与未被包合的麝香草酚的溶解度相比增加了1.43倍,表明β-CD能够增加麝香草酚在水中的溶解度.在Gürten等[26]的研究中也有相近的结果,替莫唑胺是一种水溶性低的抗癌药物,并且它的稳定性较差,经过β-CD包合后,替莫唑胺的溶解度提高了1.25倍,从而提高药物的利用度.

表4 37 ℃下麝香草酚与包合物中麝香草酚的溶解度
2.6 高温稳定性
图9是100 ℃下麝香草酚与包合物中麝香草酚的释放率图.从图9(b)得出,麝香草酚在100 ℃下120 min时的释放率高达91.6%,而在图9(a)中包合物中麝香草酚在2 h的释放率只有13.7%,麝香草酚的释放率远远高于包合物中麝香草酚的释放率,表明包合后β-CD保护了麝香草酚,提高了麝香草酚的高温稳定性.同时也可以观察到100 ℃下包合物在7 h后释放率达到15.20%,而麝香草酚在2 h时释放率达到91.6%,几乎全部释放,由此可见将麝香草酚包合有一定的缓释性.

(a)包合物中麝香草酚在100 ℃的释放率
3 结论
本研究对麝香草酚-β-CD包合物制备过程中的壁芯比、搅拌时间以及搅拌温度进行了优化,以制备包合率较高的包合物.结果显示,以壁芯比为1.25∶1、搅拌温度为50 ℃、搅拌时间为2.6 h时,制备出包合率较高的包合物,此时包合率达到84.51%.同时,利用傅里叶红外光谱和XRD表征手段证明了包合物的形成.此外,与单独的麝香草酚相比,在β-CD的包合作用下,提高了麝香草酚的高温稳定性及水溶性,也表明麝香草酚-β-CD包合物具有一定的缓释性.

