基于网络药理学探讨缓衰方对慢性肾脏病心肾保护作用的机制
刘童童 王宇阳 王倩 冒慧敏 占永立


摘要 目的:探討缓衰方对慢性肾脏病(CKD)心肾保护作用的机制。方法:基于中药系统药理学数据库与分析平台(TCMSP)检索缓衰方中5味中药的有效活性成分并获得相应的预测靶点;通过GEO数据库、GeneCards数据库和人类孟德尔遗传数据库(OMIM)检索与CKD和心血管疾病(CVD)相关的靶点,并对药物靶点和疾病靶点进行映射取交集作为缓衰方对CKD患者心肾保护作用的关键靶点。基于String数据库对关键靶点进行蛋白质-蛋白质相互作用(PPI)网络分析,并通过拓扑分析得到缓衰方对CKD患者心肾保护作用的核心靶点,基于autodock软件对缓衰方的活性成分和核心靶点作分子对接,分析成分和靶点的结合能力。并对关键靶点进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)通路富集分析。结果:共得到缓衰方有效活性成分105种,预测靶点135个,得到CKD疾病相关靶点1 436个,CVD疾病相关靶点744个。共得到缓衰方对CKD心肾保护作用的关键靶点53个,拓扑分析得到核心靶点18个,分子对接结果显示缓衰方的11个活性成分和10个核心靶点平均最低结合能为-6.58 kcal/mol,其中豆甾醇、槲皮素与PTGS2靶点蛋白结合能最高。共得到对氧含量的反应、细胞对药物的反应、循环系统中的血管过程等1 275个GO富集结果和低氧诱导因子-1(HIF-1)信号通路、肿瘤坏死因子(TNF)信号通路、白细胞介素-17(IL-17)信号通路等76条KEGG信号通路。结论:缓衰方通过多成分、多靶点、多信号通路途径实现对CKD的心肾保护作用。
关键词 网络药理学;缓衰方;慢性肾脏病;心血管疾病;活性成分;靶点;信号通路;作用机制
Abstract Objective:To explore the mechanism of the heart and kidney protective effect of Huan Shuai Formula on the chronic kidney disease(CKD).Methods:We searched for targets related to CKD and Cardiovascular Disease(CVD) through GEO database,GeneCards database and Human Mendelian Inheritance Database(OMIM),and map drug targets and disease targets to take the intersection as a slowing down prescription as the key target of cardio-renal protection in CKD patients.The protein-protein interaction(PPI) network analysis of key targets was based on the String database,and topological analysis was used to obtain the core targets of the heart and kidney protection of CKD patients.Based on the autodock software,molecular docking of the active ingredients and core targets of the Huan Shuai formula was performed,and the binding ability of the ingredients and the targets was analyzed.And we carried out GO(Gene Ontology) biological process enrichment analysis and Genome Encyclopedia(KEGG) pathway enrichment analysis for key targets.Results:A total of 105 active components,135 predicted targets,1 436 CKD disease related targets and 744 CVD disease related targets were obtained.A total of 53 key targets for the cardio-renal protection of CKD by Yan shuai Formula were obtained,and 18 core targets were obtained by topological analysis.The molecular docking results showed that the average minimum binding energy of 11 active ingredients and 10 core targets of Yan Shuai Formula was-6.58 kcal/mol,of which stigmasterol and quercetin had the highest binding energy to PTGS2 target protein.A total of 1275 GO enrichment results,hypoxia inducible Factor-1(HIF-1) signaling pathway,Tumor Necrosis Factor(TNF) signaling pathway,Interleukin-17(Interleukin-17,IL-17),the 76 KEGG signal pathways were obtained.Conclusion:Huan Shuai Formula can protect the heart and kidney function of CKD through multi-component,multi-target and multi signal pathway.
Keywords Network pharmacology; Huan Shuai Formula; Chronic kidney disease; Cardiovascular disease; Active components; Targets; Signaling pathway; Mechanism
中圖分类号:R242;R692文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.20.004
慢性肾脏病(Chronic Kidney Disease,CKD)已成为全球共同关注的公共卫生问题,全世界超过13.4%的成年人患有CKD[1]。在我国,成年人CKD的发病率约为10.8%[2]。心血管疾病(Cardiovascular Disease,CVD)为CKD常见的并发症,超过64.5%的CKD患者患有不同程度的CVD,约为健康人群的2~4倍[3-4]。有研究表明,随着CKD的进展,CVD的发生风险显著增加,终末期肾脏疾病(End Stage Renal Disease,ESRD)患者CVD的发生率可达80%[5]。CKD患者血脂异常、血压控制不佳等传统CVD危险因素导致动脉硬化和心肌重构是CVD形成的基本病变,临床主要表现为冠状动脉粥样硬化性心脏病、心律失常、慢性心力衰竭等[6-8]。CKD肾素-血管紧张素-醛固酮系统(Renin-angiotensin-aldosterone System,RAAS)激活、蛋白尿、肾小球滤过率下降、贫血、全身营养不良等非传统CKD危险因素,可加速CVD进展;而心输出量的减少和静脉压的增加,使肾脏灌注减少,导致肾功能丢失加速。CKD和CVD的相互影响使伴有CVD的CKD患者死亡率高达50%,为健康人群的10~30倍,是CKD死亡的首要因素[9]。由此可见,CKD患者防治CVD至关重要。
缓衰方以黄芪、丹参、当归、大黄、白花蛇舌草为核心组成,具有益气活血、解毒降浊之效。临床和实验研究发现,缓衰方能够有效改善CKD患者的生命质量,延缓CKD患者进入终点事件(透析、全因死亡、血清肌酐双倍增加)的时间[10-11]。在长期临床实践中我们发现,缓衰方可显著减轻CKD患者胸闷、胸痛、心悸等CVD症状。然而目前关于缓衰方对CKD心肾保护作用的有效活性成分、作用靶点和作用机制尚未完全阐明。因此,本研究拟采用网络药理学的方法从分子水平方面研究和分析缓衰方对CKD患者心肾保护作用的有效活性成分、潜在靶点和作用机制,以期为缓衰方的应用和开发提供科学依据。
1 资料与方法
1.1 缓衰方活性成分及靶点的筛选 通过检索中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php),收集缓衰方中“黄芪”“丹参”“当归”“大黄”“白花蛇舌草”5味中药的活性成分,根据活性成分的药物毒代动力学参数进行筛选,以类药性(Drug-like,DL)≥0.18和口服生物利用度(Oral Bioavailability,OB)≥30%的化合物作为缓衰方的有效活性成分。同时根据TCMSP数据库整理有效活性成分所涉及的靶点,并通过Uniprot数据库(https://www.uniprot.org)进行靶点信息比对和靶点名校正。
1.2 CKD和CVD疾病相关靶点的检索 GEO数据库是全球最大的公共基因表达数据库,具有较全面的高通量分子数据。以关键词“chronic kidney disease”在GEO数据库中检索与CKD相关的靶点,选择物种为人类(Homo Sapiens),对得到的基因靶点进行整理并找出差异基因靶点。同时分别在GeneCards数据库(https://www.genecards.org)和人类孟德尔遗传数据库(OMIM,https://www.omim.org)检索与CKD和CVD相关的疾病靶点,保留相关评分(Relevance Score)≥25的疾病相关靶点。
1.3 蛋白质-蛋白质相互作用网络构建 利用半编程性质的脚本性软件R project(×64 3.6.1)对缓衰方活性成分所预测的靶点和CKD、CVD相关的疾病靶点进行映射,获得3个靶点数据的交集作为缓衰方对CKD心肾保护作用的关键靶点进行机制探讨。使用Bisogenet数据库(http://stringdb.org)构建关键靶点的蛋白质-蛋白质相互作用(Protein Protein Interaction,PPI)网络,设定物种为人类(Homo Sapiens),基于Cytoscape(Version 3.7.2)软件的cytNCA插件计算PPI网路中各节点的度中心性(Degree Centrality,DC)、中介中心性(Betweenness Centrality,BC)和紧密中心性(Closeness Centrality,CC)等信息并进行拓扑分析,选取DC、BC和CC值均高于均值的靶点作为核心靶点。基于Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov)查找缓衰方药物活性成分的3D结构,并进行能量最小化处理,利用RCSB PDB数据库(http://www.rcsb.org)查找核心靶点的相关蛋白晶体结构,利用PyMOL(Version 1.7.2)软件对靶点蛋白进行去水、加氢处理,并以对心肾血管具有保护作用的厄贝沙坦(Irbesartan)作为阳性对照,基于autodock(Version 1.5.6)软件对缓衰方药物活性成分和靶点相关蛋白进行分子模拟对接,并计算最低结合能(Binding Affinity),最低结合能≤-5 kcal/mol则说明药物活性成分和靶点蛋白对接较好,结合能的绝对值越大说明活性成分与靶点蛋白结合越好[12]。
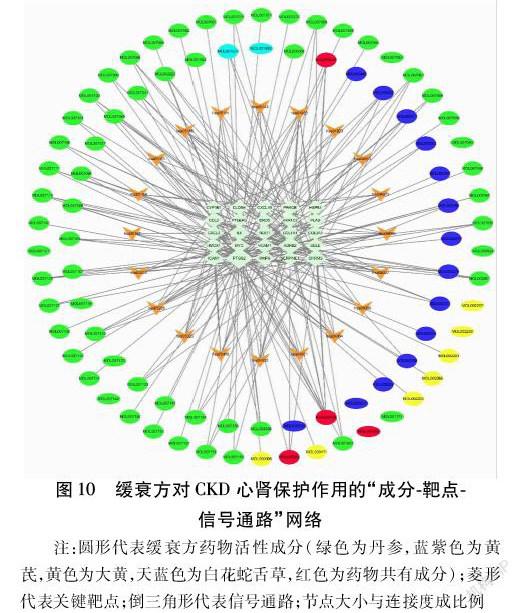
1.4 网络分析 基于bioconductor数据库(http://www.bioconductor.org)对缓衰方心肾同治作用的关键靶点进行基因本体(Gene Ontology,GO)生物学过程富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,保留P<0.05,Q<0.05的富集结果,获得关键靶点参与的生物过程(Biological Process,BP)、细胞组分(Cellular Component,CC)、分子功能(Molecular Function,MF)和作用信号通路。基于Cytoscape软件,构建“成分-靶点-通路”网络,对缓衰方活性成分、靶点和疾病之间的相互关系进行分析。
2 结果
2.1 缓衰方的活性成分及靶点 共得到缓衰方的活性成分105种,包括大黄的活性成分16种、丹参的活性成分65种、白花蛇舌草的活性成分7种、黄芪的活性成分20种、当归的活性成分2种。其中当归、白花蛇舌草共属活性成分1种,丹参、白花蛇舌草共属活性成分1种,黄芪、白花蛇舌草共属活性成分1种,大黄、当归、白花蛇舌草共属活性成分1种。见图1。共得到预测靶点1 988个,其中白花蛇舌草预测靶点200个、大黄预测靶点146个、丹参预测靶点1 177个、当归预测靶点77个、黄芪预测靶点388个。经过剔重后得到靶点135个,预测靶点超过35个的活性成分共有18种。见表1。
2.2 CKD和CVD的疾病相关靶点 共得到CKD疾病相关靶点1504个,其中来自GEO数据库485个(上调靶点240个,下调靶点245个)、GeneCards数据库591个、OMIM数据库428个;CVD疾病相关靶点795个,其中来自GeneCards数据库322个、OMIM数据库473个。经过剔重后共等到CKD疾病相关靶点1 436个,CVD疾病相关靶点744个。见图2。
2.3 蛋白质-蛋白质相互作用(PPI)网络构建 共得到缓衰方对CKD心肾保护作用的关键靶点53个。见图3。基于Cytoscape软件对得到的关键靶点进行PPI网络分析,共得到53个蛋白节点,361条边,平均度值为13.6。对PPI网络进行拓扑分析,共得到DC、BC、CC均大于均值的核心靶点18个。见表2。基于Autodock软件对预测靶点超过40个的缓衰方活性成分和前10个核心靶点进行分子模拟对接,结果显示缓衰方各活性成分和靶点蛋白对接的平均最低结合能为-6.58 kcal/mol,与阳性药物和核心靶点对接的最低结合能比较无明显差异;除豆甾醇、β-谷甾醇与IL1β靶点蛋白对接的结合能外,其余最低结合能均≤-5 kcal/mol。见图4。其中豆甾醇、槲皮素与PTGS2的结合能绝对值最高,其分子对接模式见图5。
2.4 富集分析 共得到缓衰方对CKD心肾保护作用的GO富集结果1 275个,其中BP1 172个、CC 43个、MF 60个。生物过程主要包括对氧含量的反应(Response to Oxygen Levels)、细胞对药物的反应(Cellular Response to Drug)、循环系统中的血管过程(Vascular Process in Circulatory System)、血压的调节(Regulation of Blood Pressure)、对营养水平的反应(Response to Nutrient Levels)等;细胞组分主要有膜微区(Membrane Microdomain)、膜区(Membrane Region)等;分子功能主要包括丝氨酸型内肽酶活性(Serine-type Endopeptidase Activity)、类固醇激素受体(Steroid Hormone Receptor Activity)等。见图6。GO富集分析的生物过程中关键靶点的参与情况见图7。共得到KEGG信号通路76条,其中与心肾疾病相关的信号通路包括:低氧诱导因子-1(Hypoxia Inducible Factor-1,HIF-1)信号通路、肿瘤坏死因子(Tumor Necrosis Factor,TNF)信号通路、白细胞介素-17(Interleukin-17,IL-17)信号通路、磷脂酰肌醇3-激酶(Phosphatidylinositol-3-kinases,PI3K)/蛋白质丝氨酸-苏氨酸激酶(Protein-serine-threonine Kinase,AKT)信号通路、内分泌抵抗、血小板活化、细胞骨架等。见表3。各信号通路之间的相互关系网络见图8,信号通路与关键靶点的相互关系网络见图9。对缓衰方有效活性成分、关键靶点参与CKD心肾保护作用的信号通络构建“成分-靶点-通路”网络图。见图10。
3 讨论
CKD属于中医学“虚劳”“水肿”“尿浊”等病的范畴,其病机多以本虚标实、虚实夹杂为特点:本虚以肺脾肾亏虚为主,标实则多为水湿痰瘀阻滞。邪伏不去,影响气机升降出入,久蕴乃成浊毒。脉为血之府,浊毒随气血游行,侵损脉络。心主血脉,浊毒积蓄,导致心失司用,使机体并发“胸痹”“关格”“溺毒”。《证治准绳》提出关格的治则当遵循“治主当缓,治客當急”。因此,CKD并发CVD的治则当以补肾活血、化浊解毒为要。临床实践发现,CKD的进展与中医“浊毒”的致病特点密切相关,使用芳香、渗湿、通腑、辛开苦降等化浊解毒的治法对延缓CKD的进展有较好的治疗作用[13]。缓衰方由黄芪、丹参、当归、大黄、白花蛇舌草5味药物组成,方中黄芪为补气要品,《药性赋》言黄芪可“温分肉而实腠理,益元气而补三焦”,当归、丹参补血活血,黄芪合当归、丹参补气活血而不留瘀,白花蛇舌草为清热解毒之品,配以大黄荡涤出新,全方合伍共奏益气活血、去浊解毒之功。研究发现,CKD患者尿毒症毒素在体内蓄积是并发CVD的重要原因[14]。药理学研究发现,活血解毒的中药可有效减少尿毒症毒素的蓄积从而延缓CKD、CVD进展[15-16]。
本研究共检索出缓衰方中有效活性成分105种,得到预测靶点135个,其中缓衰方对CKD心肾保护作用的关键靶点53个,拓扑分析得到核心靶点18个,包括IL6、EGF、VEGFA、IL1β、CCL2等,这些靶点均与CKD、CVD的发生和进展密切相关[17]。分子对接研究发现,缓衰方有效活性成分和靶点蛋白的结合较好,其中PTGS-2与活性成分的结合能绝对值最高。PTGS-2是人体重要的炎症介质,CKD尿毒症毒素的蓄积刺激炎症介质的表达,进而导致PTGS-2等炎症介质表达上调,促使PTGS-2基因编码COX-2蛋白,引起血管钙化,血管钙化是CKD、CVD的共同病理改变[18-21]。研究发现,COX-2抑制剂能够有效改善血管钙化[22]。缓衰方的活性成分通过与关键靶点的结合,对CKD患者的心肾起到保护作用。研究发现,槲皮素可以抑制核因子κB(Nuclear Factor-κB,NF-κB)途径的激活,改善尿毒症毒素诱发的内皮细胞损伤,改善动脉粥样硬化,从而发挥对CKD的心肾保护作用[23-25];豆甾醇、β-谷甾醇等植物甾醇类活性成分也具有较好的抗炎抗氧化作用[26]。
通过GO富集分析和KEGG信号通路富集分析发现,与炎症相关的TNF信号通路、IL-17信号通路、PI3K/AKT信号通路、核因子κB信号通路等参与了缓衰方对CKD的心肾保护作用,提示缓衰方可能通过抑制炎症介质的级联反应,来达到对CKD的心肾保护作用;同时,HIF-1信号通路、血小板活化、内分泌抵抗、肌动蛋白细胞骨架的调节等信号通路也可能参与了缓衰方对CKD的心肾保护作用。低氧诱导因子(Hypoxia Inducible Factors,HIFs)对炎症反应和血管内皮损伤有着重要的调节作用,脯氨酸羟化酶(Proline Hydroxylase,PHD)抑制剂可促进CKD患者HIFs的激活,进而对CKD的心肾起到保护作用[27-29]。有学者发现,CKD血瘀证患者存在血小板活化现象,血小板活化或聚集可激活多种信号通路,介导CKD心肾损伤[30-31]。胰岛素抵抗(Insulin Resistance,IR)与血管功能障碍密切相关[32]。有研究表明,IR通过对内皮细胞的调节增加CKD患者发生CVD的风险,槲皮素、大黄素等中药活性成分可以有效干预IR相关信号通路,降低CKD患者发生CVD的风险[33-34]。另外我们前期研究发现,益气活血解毒中药(黄芪、当归、白花蛇舌草等)可以抑制肌动蛋白细胞骨架的重排,恢复肌动蛋白微丝的正常排布,改善CKD足细胞损伤引发的蛋白尿[35]。
综上所述,本研究基于网络药理学的研究方法发现,缓衰方可通过多成分、多靶点、多信号通路实现对CKD的心肾保护作用,其中一些信号通路已在前期的研究中得到验证。后续研究中,我们将基于上述研究结果对缓衰方的心肾同治作用机制进行临床及基础研究,以揭示和阐明缓衰方对CKD心肾保护作用的确切机制。
参考文献
[1]Hill NR,Fatoba ST,Oke JL,et al.Global prevalence of chronic kidney disease-A systematic review and meta-analysis[J].PLoS One,2016,11(7):e0158765.
[2]Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:A cross-sectional survey[J].Lancet,2012,379(9818):815-822.
[3]Saran R,Robinson B,Abbott KC,et al.US renal data system 2019 annual data report:epidemiology of kidney disease in the united states[J].Am J Kidney Dis,2020,75(1):A6-A7.
[4]陈晓农,潘晓霞,俞海瑾,等.慢性肾脏病患者心血管疾病患病率调查[J].上海医学,2009,32(9):769-773.
[5]Thompson S,James M,Wiebe N,et al.Cause of death in patients with reduced kidney function[J].J Am Soc Nephrol,2015,26(10):2504-2511.
[6]Malluche HH,Blomquist G,Monier-Faugere MC,et al.High parathyroid hormone level and osteoporosis predict progression of coronary artery calcification in patients on dialysis[J].J Am Soc Nephrol,2015,26(10):2534-2544.
[7]Górriz JL,Molina P,Cerverón MJ,et al.Vascular calcification in patients with nondialysis CKD over 3 years[J].Clin J Am Soc Nephrol,2015,10(4):654-666.
[8]賈凤玉,孟建中.慢性肾脏病(透析)患者的心血管疾病诊疗指南解读[J].中国血液净化,2011,10(10):570-575.
[9]Hickson LJ,Negrotto SM,Onuigbo M,et al.Echocardiography criteria for structural heart disease in patients with end-stage renal disease initiating hemodialysis[J].J Am Coll Cardiol,2016,67(10):1173-1182.
[10]Li S,Rao XR,Dai XW,et al.Beneficial effects of Fu-Zheng-Qu-Zhuo oral liquid combined with standard integrated therapy in patients with chronic kidney disease(stage 3-4):A randomized placebo-controlled clinical trial[J].Medicine(Baltimore),2017,96(28):e7448.
[11]Li S,Rao XR,Song JY,et al.Effects of Huanshuai Recipe Oral Liquid on restructuring glomerular microvasculature and expression of vascular endothelial growth factor in subtotal nephrectomized rats[J].Chin J Integr Med,2010,16(3):239-246.
[12]刘福和,陈少军,倪文娟.川芎中抗血栓活性成分的计算机虚拟筛选研究[J].中国药房,2017,28(16):2182-2196.
[13]王宇阳,马放,占永立.基于“浊毒”理论论治慢性肾脏病[J].中医杂志,2019,60(16):1374-1377.
[14]Tomlinson J,Wheeler DC.The role of trimethylamine N-oxide as a mediator of cardiovascular complications in chronic kidney disease[J].Kidney Int,2017,92(4):809-815.
[15]方敬爱.从中西医结合的角度探讨结肠透析治疗慢性肾脏病[J].中国中西医结合杂志,2019,39(7):773-775.
[16]陶芳,孔薇.基于肠-肾轴理论研究中药灌肠治疗慢性肾脏病机制的思路探讨[J].天津中医药,2019,36(10):973-976.
[17]Rayego-Mateos S,Rodrigues-Diez R,Morgado-Pascual JL,et al.Role of epidermal growth factor receptor(EGFR) and its ligands in kidney inflammation and damage[J].Mediators Inflamm,2018,2018:8739473.
[18]Dou L,Sallée M,Cerini C,et al.The cardiovascular effect of the uremic solute indole-3 acetic acid[J].J Am Soc Nephrol,2015,26(4):876-887.
[19]Ye Y,Bian W,Fu F,et al.Selenoprotein S inhibits inflammation-induced vascular smooth muscle cell calcification[J].J Biol Inorg Chem,2018,23(5):739-751.
[20]Demer LL,Tintut Y.Inflammatory,metabolic,and genetic mechanisms of vascular calcification[J].Arterioscler Thromb Vasc Biol,2014,34(4):715-723.
[21]Agharazii M,St-Louis R,Gautier-Bastien A,et al.Inflammatory cytokines and reactive oxygen species as mediators of chronic kidney disease-related vascular calcification[J].Am J Hypertens,2015,28(6):746-755.
[22]Radi ZA,Khan KN.Cardio-renal safety of non-steroidal anti-inflammatory drugs[J].J Toxicol Sci,2019,44(6):373-391.
[23]Vera M,Torramade-Moix S,Martin-Rodriguez S,et al.Antioxidant and anti-Inflammatory strategies based on the potentiation of glutathione geroxidase activity prevent endothelial dysfunction in chronic kidney disease[J].Cell Physiol Biochem,2018,51(3):1287-1300.
[24]Guo SX,Sun JJ,Zhuang Y.Quercetin alleviates lipopolysaccharide-induced inflammatory responses by up-regulation miR-124 in human renal tubular epithelial cell line HK-2[J].Biofactors,2020,46(3):402-410.
[25]Cao YC,Hu JL,Sui JY,et al.Quercetin is able to alleviate TGF-β-induced fibrosis in renal tubular epithelial cells by suppressing miR-21[J].Exp Ther Med,2018,16(3),2442-2448.
[26]Al-Okbi SY,Mohamed DA,Hamed TE,et al.Prevention of renal dysfunction by nutraceuticals prepared from oil rich plant foods[J].Asian Pac J Trop Biomed,2014,4(8):618-627.
[27]Liu M,Ning X,Li R,et al.Signalling pathways involved in hypoxia-induced renal fibrosis[J].J Cell Mol Med,2017,21(7):1248-1259.
[28]Abe H,Semba H,Takeda N.The roles of hypoxia signaling in the pathogenesis of cardiovascular diseases[J].J Atheroscler Thromb,2017,24(9):884-894.
[29]Tanaka T,Eckardt KU.HIF activation against CVD in CKD:novel treatment opportunities[J].Semin Nephrol,2018,38(3):267-276.
[30]陳可冀,薛梅,殷惠军.血小板活化与冠状动脉粥样硬化性心脏病和血瘀证的关系[J].首都医科大学学报,2008,29(3):266-269.
[31]凌丝丝,曾艳,李仕正,等.薤白皂苷对ADP诱导血小板源性细胞外囊泡炎症反应的影响[J].中药材,2019,42(9):2157-2162.
[32]Doris TC,Gerald FW,Ashley BI,et al.Insulin resistance and vascular dysfunction in chronic kidney disease:mechanisms and therapeutic interventions[J].Nephrol Dial Transplant,2015,32(8):1274-1281.
[33]侯敬涛,赖德源.胰岛素抵抗与肾脏病的关系[J].国际内科学杂志,2008,35(2):90-92,104.
[34]吴薇,杨晶晶,万毅刚,等.慢性肾脏病胰岛素抵抗的发病机制、治疗策略及中药的干预作用[J].中国中药杂志,2017,42(1):49-55.
[35]马放,刘慧洁,陈静,等.益气清热膏通过肌动蛋白骨架重排保护嘌呤霉素氨基核苷大鼠足细胞损伤机制[J].中华中医药杂志,2019,34(5):2175-2179.
(2020-05-27收稿 责任编辑:张乐杰)

