子宫颈鳞癌患者中mTOR、PI3K及p70S6K的表达及临床价值
夏 露,颜林志,黄 敏,梅 洁,屈王蕾
(温州医科大学附属第二医院妇科,浙江 温州,325000)
宫颈癌是女性生殖系统最常见的肿瘤之一。尽管近年来宫颈癌的早期筛查以及HPV疫苗的应用降低了其发病率,但目前宫颈癌仍出现了发病群体逐渐年轻化且预后差的趋势。在宫颈癌的众多病理类型中,鳞癌约占80%~85%,因此,针对子宫颈鳞癌发生发展中相关分子标志物的研究成为了目前的热门领域[1]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是机体内多种恶性肿瘤细胞增殖、分化的重要信号通路中心枢纽,磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)以及p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase,p70S6K)是mTOR信号通路中上游和下游的重要调控因子,当其出现不同程度的改变后,均会引发mTOR信号通路的改变,导致机体内多种肿瘤的发生[2]。目前对于上述通路中相关蛋白在子宫颈鳞癌的发生发展中所起到的作用尚不清楚[3]。因此,本研究旨在于探讨子宫颈鳞癌组织中mTOR、PI3K以及p70S6K的表达与正常组织的差异,以及三者之间的相关性,为子宫颈鳞癌的诊断以及靶向性治疗提供理论依据。
1 资料与方法
1.1 一般资料
选取2017年1月1日至2021年1月1日于温州医科大学附属第二医院妇科住院手术治疗并经病理学诊断证实为子宫颈鳞癌的组织标本80例作为观察组,另随机选取同期在本院进行阴道镜活检并经病理学诊断证实为正常子宫颈的组织标本80例作为对照组。纳入标准:①手术治疗前未进行放化疗治疗;②临床资料信息完善。观察组年龄为27~73岁,根据世界卫生组织(World Health Organization,WHO)对子宫颈鳞的组织学分级标准[4],含高分化(G1)及中分化(G2)共54例,低分化(G3)26例;根据按照国际妇产科联盟(the International Federation of Gynecology and Obstetrics,FIGO)的临床分期标准[5],含Ⅰ期62例,Ⅱ期18例;含间质浸润深度≥1/2者36例,间质浸润深度<1/2者44例;含淋巴结转移患者30例,无淋巴结转移者50例。本研究通过医院伦理委员会审查。
1.2 研究方法
1.2.1主要试剂
本研究采用的检测试剂盒包括兔抗人mTOR单克隆抗体、兔抗人PI3K单克隆抗体、兔抗人p70S6K单克隆抗体、DAB显色试剂盒以及免疫组化试剂盒,上述试剂盒均购自北京博奥森公司。
1.2.2检测方法
所有相关抗体检测均按照试剂盒中的使用说明书严格操作。将患者的组织标本采用4%的中性甲醛进行相关固定,常规脱水后用石蜡进行包埋,切片厚度为4μm。将所得切片紧贴于涂有防脱胶的载玻片上,然后进行脱蜡水化,PBS浸泡,时间为5min,再进行高压抗原修复。采用过氧化氢去离子水孵育15min后滴入山羊血清15min。将三种抗体所使用工作液浓度均调整为1∶250,采用PBS进行冲洗,再加入生物素化二抗15min后PBS冲洗,再加入辣根酶进行链酶卵白素标记,置于室温15min后PBS冲洗。立即加入DAB显色剂,在显微镜下对时间、脱水以及封片操作进行掌握。
1.2.3结果判定
所有切片结果的阅读及判定均由2名资深的病理科医生独立进行。mTOR、PI3K以及p70S6K在细胞质内均呈现出黄色或棕黄色信号表示为阳性。选择5个以上高倍视野中计数>1000个细胞中的肿瘤细胞,根据染色程度和染色范围进行评分[6]:染色强度为未着色或淡染记1分,中度染色记2分,强染色记3分;染色范围根据阳性细胞所占比例计算,<10%记1分,10%~25%记2分,26%~50%记3分,51%~75%记4分,>75%记5分。将染色强度以及染色范围评分进行相加,≤3分者为阴性,>3分者为阳性。
1.3 统计学方法
采用SPSS 26.0统计学软件进行数据的统计和分析。计数资料以例数(百分比)[n(%)]表示,两组间比较采用χ2检验,两变量间的相关性分析采用Spearman等级相关性分析法,以P<0.05表示差异具有统计学意义。
2 结果
2.1 mTOR、PI3K及p70S6K在子宫颈鳞癌组织中的表达
正常宫颈组织中mTOR、PI3K及p70S6K的表达率极低,分别为10.00%、1.25%和1.25%。子宫颈鳞癌组织中mTOR、PI3K及p70S6K的表达率较高,分别为72.50%、66.25%和53.75%。经对比,子宫颈鳞癌组织中mTOR、PI3K及p70S6K的表达率均显著高于对照组(χ2值分别为64.475、75.584、55.298,P<0.05),见表1。
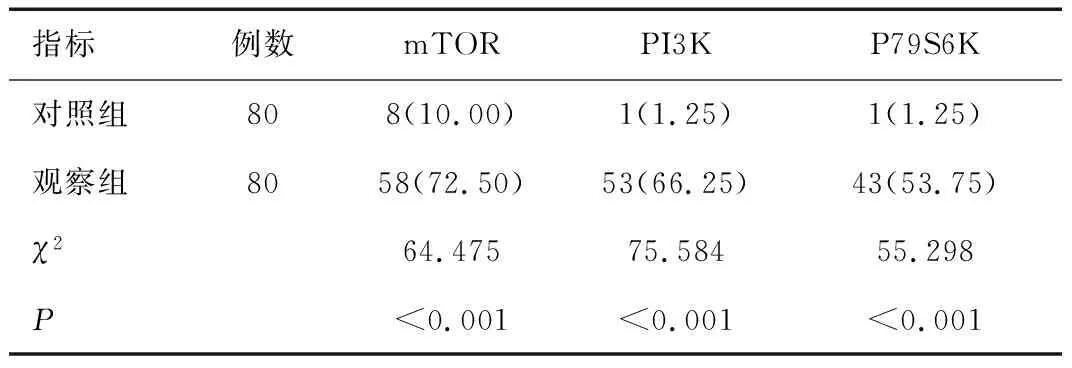
表1 两组患者mTOR、PI3K以及 p70S6K在组织中的阳性表达率[n(%)]Table 1 Positive expression rates of mTOR,PI3K and p70S6K in the tissues of two groups[n(%)]
2.2 mTOR、PI3K及p70S6K的阳性表达与宫颈鳞癌临床病理特征的关系
经对比,子宫颈鳞癌组织中mTOR的表达与间质浸润深度、淋巴结转移均有关(χ2值分别为15.810、7.373,P<0.05);PI3K的表达与组织学分级、淋巴结转移均有关(χ2值分别为12.626、4.747,P<0.05);p70S6K的表达与淋巴结转移有关(χ2=11.241,P<0.05),见表2。

表2 不同病理特征间mTOR、PI3K及p70S6K的阳性表达情况比较[n(%)]Table 2 Comparison of positive expression status of mTOR,PI3K and p70S6K among different pathological features[n(%)]
2.3 子宫颈鳞癌组织中mTOR、PI3K及p70S6K表达的相关性
Spearman秩相关分析显示,子宫颈鳞癌组织中mTOR的表达与PI3K、p70S6K均呈显著正相关(r值分别为0.522、0.323,P<0.05),见表3。

表3 mTOR、PI3K以及p70S6K表达的相关性分析(n)Table 3 Correlation analysis of expression of mTOR,PI3K and p70S6K(n)
3 讨论
宫颈癌是女性生殖系统高发的恶性肿瘤类型,其中鳞癌占比约为80%~85%,其整个病理发生发展过程较为复杂。针对宫颈癌生物分子机制的探索,有助于进一步了解期病理发生发展的过程和机制,为宫颈癌的基因治疗提供科学的理论依据。
3.1 子宫颈鳞癌组织中mTOR的表达及其临床价值
mTOR是机体内广泛分布的一种蛋白激酶,其对于生物体细胞的生长、分化以及存活起到了至关重要的作用,同时也是多条信号通路的中心枢纽。既往研究发现[7],mTOR信号通路中主要由2条上游通路以及2条下游通路组成。其中上游通路中最为重要的为PI3K/Akt/mTOR通路,当PI3K被磷酸化后,能够激活Akt,激活后的Akt能够使mTOR产生应答,进一步调节下游靶点p70S6K的活性,促使肿瘤细胞达到快速增值,肿瘤细胞G1期显著缩短,肿瘤迅速生长。同时研究还指出,mTOR通路在人体中多种肿瘤的发生中起到一定的作用,如乳腺癌、结肠癌等[8]。本研究同样发现,mTOR在子宫颈鳞癌患者中的表达率显著高于正常人,且与间质浸润深度以及淋巴结转移有关。此外,部分研究还指出mTOR的表达还与预后相关,mTOR表达阳性是影响患者预后的独立危险因素[9]。
3.2 子宫颈鳞癌组织中PI3K的表达及其临床价值
PI3K是mTOR通路中重要的上游信号分子,当肿瘤细胞受到生长因子的刺激时,细胞内的PI3K会进行磷酸化形式的激活,形成磷酸磷脂酰肌醇(phosphatidylinositol 3-phosphate,PIP3),其能够与细胞内的Akt以及磷酸肌醇依赖激酶(3-phosphoinositide-dependent protein kinase 1,PDK1)结合,从而改变细胞内Akt的结构,导致Akt的活化,当活化的Akt与PI3K将信号传导至mTOR时,会进一步促进细胞周期蛋白的上调,细胞有丝分裂加速,肿瘤生长较快[10]。既往研究已证实PI3K是一种癌基因,与人体内多种肿瘤的发生有关,且其表达会随组织分化程度及临床分期的不同而不同,当组织分化越低,其表达则出现上调,同时在淋巴结转移的患者中显著增高[11]。本研究也发现,PI3K在子宫颈鳞癌患者中的表达显著高于正常人,且与组织学分级和淋巴结转移密切相关。
3.3 子宫颈鳞癌组织中p70S6K的表达及其临床价值
p70S6K是丝/苏氨酸蛋白激酶中的一类,同时也是mTOR信号通路中下游的重要靶点之一,当活化的mTOR与其相关蛋白结合后,进一步促进下游的p70S6K磷酸化后活化,细胞内蛋白质合成增加,细胞有丝分裂随之增加[12]。本研究发现,子宫颈鳞癌患者组织中p70S6K的表达显著高于正常人,且与淋巴结转移密切关相关,提示p70S6K是子宫颈鳞癌发生发展过程中的重要调节分子,且可能参与淋巴结的转移过程。此外,本研究结果还显示mTOR与PI3K、mTOR与p70S6K的表达均呈现显著正相关,提示三者间在子宫颈鳞癌的发生发展过程中起到了一定的协同作用,共同调节了肿瘤细胞的增殖与分化,但是对于三者间协同作用的具体机制尚不清楚[13]。
综上所述,mTOR、PI3K以及p70S6K在子宫颈鳞癌患者中的表达均显著高于正常人,同时mTOR与PI3K、mTOR与p70S6K的表达均呈现显著正相关,有望成为未来靶向治疗的新方向。

