CPT2在卵巢上皮癌组织中的表达及临床意义
张晓红,杨 红
(空军军医大学西京医院妇产科,陕西 西安 710032)
卵巢癌是致死率最高的女性生殖系统恶性肿瘤,由于卵巢癌起病隐匿和广泛的腹膜转移,75%的患者在诊断时已是中晚期,导致卵巢癌成为预后最差且死亡率最高的妇科肿瘤[1]。脂肪酸代谢增强是恶性肿瘤的特异性代谢表型,有研究表明卵巢癌细胞中脂代谢增强[2-3]。还有研究发现,线粒体脂肪酸β氧化增强是多种癌症的重要能量来源[4]。
肉碱棕榈酰转移酶系统(carnitine palmitoyl transferase system,CPTs)是参与脂肪酸β氧化调控的线粒体定位酶[5]。CPTs家族由两个独立的蛋白组成,分别是位于线粒体外膜的CPT1和位于线粒体内膜的CPT2。很多研究报道了CPT1过表达与人类多种类型的肿瘤进展密切相关[6-7]。此外,最近的两项研究也证实了CPT2在肝细胞癌的发生过程中发挥了关键作用[8-9]。然而,CPT2在其他类型癌症(包括卵巢癌)中的表达和生物学作用在很大程度上仍然是未知的。因此,本研究将分析CPT2在卵巢上皮癌组织中的表达及临床意义,初步探讨CPT2在卵巢上皮癌发病中的意义。
1 材料与方法
1.1 材料
收集2015年3月至2016年12月在西京医院接受治疗的20例卵巢上皮癌患者的新鲜组织标本作为病例组,术前未行任何治疗,术后病理明确诊断,同时收集癌旁组织标本作为对照组。收集2010年1月至2014年8月就诊于西京医院的121例初治卵巢上皮癌患者的组织病理石蜡切片作为病例组;选择经病理确诊的对侧正常卵巢组织或癌旁组织的病理石蜡切片作为对照组。所有患者术后给予紫杉醇类+铂类联合化疗,临床资料收集完整,随访至少5年。样本的收集经过患者知情同意和空军军医大学伦理委员会批准。
卵巢癌细胞株A2780、SKOV3、ES2、HEY和正常卵巢上皮细胞株IOSE80为西京医院妇产科实验室库存细胞,直接复苏使用。细胞培养所需的DMEM和RPMI1640培养基为实验室自行配制,使用前加入胎牛血清和青链霉素。
1.2 方法
1.2.1实时荧光定量PCR
对新鲜组织使用专用RNA试剂盒提取RNA,反转录合成cDNA。以U6为内参照,每组设3个复孔。按照以下流程进行PCR反应:预变性95℃ 5min;扩增95℃变性1min,55℃退火2min,72℃延伸1min,设置35次循环;溶解曲线95℃ 15s,60℃1min,95℃ 15s。2-△△Ct法计算各组细胞中CPT2的mRNA相对量,实验重复3次。实时荧光定量PCR(quantitative reverse transcription polymerase chain reaction,qRT-PCR)反应相关引物见表1。

表1 qRT-PCR反应相关引物
1.2.2 Western blot
提取组织蛋白,试剂盒进行蛋白浓度测定后,加入5×Loading进行100℃煮沸蛋白变性。配制10%分离胶,按照每孔60~160μg量上样,80V电压电泳,待分子Marker分开后调电压至120V,100V恒压转膜1h,使用TBST配制含有5%脱脂奶粉的封闭液,室温摇床上孵育1h。按照Marker上显示的分子量进行裁膜,一抗4℃过夜孵育,第二天室温复温30min,使用TBST溶液清洗3次/5min,随后孵育二抗1h,再使用TBST溶液洗膜3次/5min,发光处理结果。CPT2抗体购自abcam(EPR13626),使用浓度1∶1 000。β-actin抗体购自Proteintech(20536-1-AP),使用浓度1∶1 000。
1.2.3免疫组化
将组织切片依次置于二甲苯与不同浓度的酒精溶液中进行水化;切片水化后分别加入过氧化氢与BSA溶液进行处理;随后依次加入稀释过的一抗、二抗与苏木素;最后,切片经脱水、透明、封片和晾干后即可在显微镜下对染色结果进行半定量分析。CPT2抗体购自abcam(EPR13626),使用浓度1∶200。
根据阳性细胞的百分率将染色结果分为5个等级,将染色强度分为4个级别,总分=染色阳性率评分×强度评分。将总分≤1分、>1~ ≤4分、>4~ ≤8分、>8分分别定义为阴性(-)、弱阳性(+)、中度阳性(++)、强阳性(+++),阴性和弱阳性代表低表达,其余为高表达。
1.3 统计学方法
应用SPSS 22.0软件对数据进行分析。独立样本资料采用Student′st检验;计数资料用例数(百分率)[n(%)]表示,采用χ2检验;总生存期采用Kaplan-Meier分析方法检验,以P<0.05为差异有统计学意义。
2 结果
2.1 qRT-PCR检测卵巢癌细胞和20对卵巢上皮癌组织中CPT2的表达
应用qRT-PCR实验方法检测4株卵巢癌细胞、1株正常卵巢上皮细胞、20对卵巢上皮癌组织及癌旁组织中CPT2的表达,结果显示:卵巢癌细胞与正常卵巢上皮细胞、卵巢上皮癌组织与癌旁组织相比,CPT2 mRNA表达均较低,差异均有统计学意义(细胞:t=4.381,P<0.05;组织:t=5.380,P<0.05),见图1。
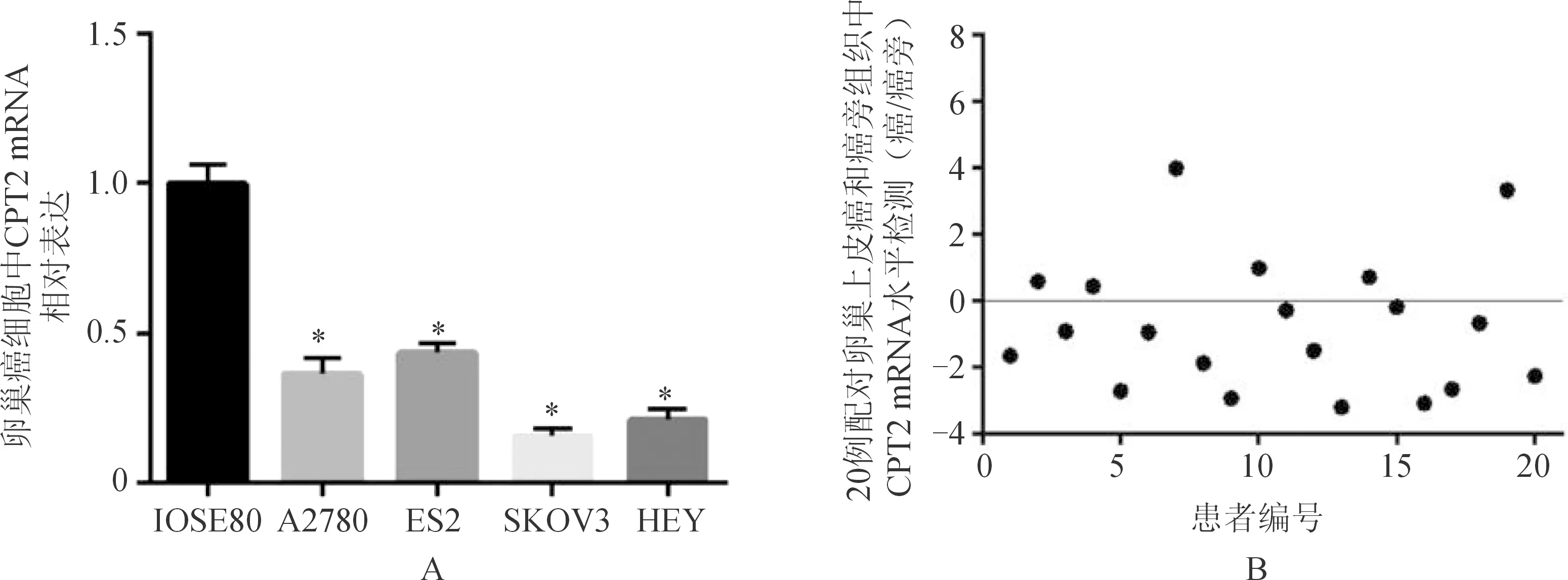
注:A为与正常卵巢上皮细胞IOSE80相比,卵巢癌细胞中CPT2表达较低,*P<0.05;B为与癌旁组织相比,卵巢上皮癌组织中CPT2表达较低。
2.2 Western blot检测卵巢癌细胞和20对卵巢上皮癌组织中CPT2的表达
应用Western blot实验方法检测卵巢癌细胞和20对卵巢上皮癌组织及癌旁组织中CPT2的表达,结果显示:卵巢癌细胞[(0.76±0.08)μg/L]与正常卵巢上皮细胞[(1.24±0.14)μg/L]、卵巢上皮癌组织[(3.00±0.15)μg/L]与癌旁组织[(5.27±0.26)μg/L]相比,CPT2蛋白表达均较低,差异均有统计学意义(细胞:t=10.258,P<0.05;组织:t=23.915,P<0.05),见图2、图3。

注:A为Western blot检测卵巢癌细胞与正常卵巢上皮细胞中CPT2的表达;B为Western blot检测20对卵巢上皮癌组织与癌旁组织中CPT2的表达(T:癌组织;P:癌旁组织)。
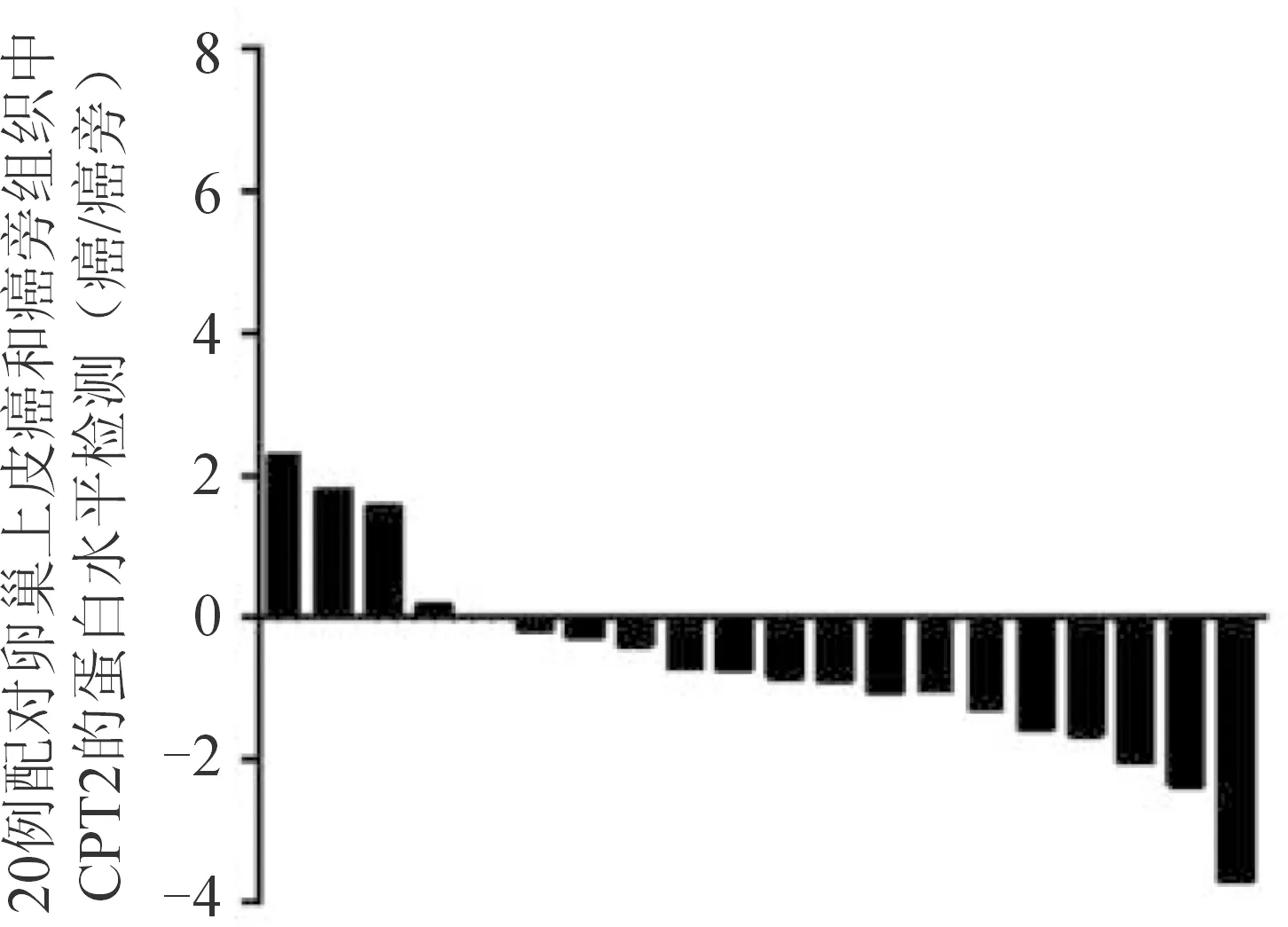
图3 20对卵巢上皮癌与癌旁组织中CPT2的蛋白水平检测结果(相对表达率用log2表示)
2.3 免疫组化检测卵巢上皮癌组织中CPT2的表达
对121例卵巢上皮癌患者的石蜡病理切片进行免疫组化染色,结果显示:与癌旁组织相比,卵巢上皮癌组织中的CPT2表达显著较低,差异有统计学意义(t=3.730,P<0.05),见图4。
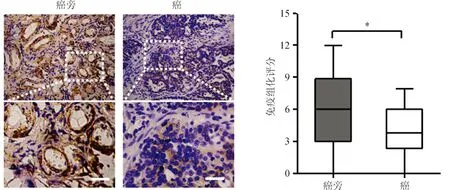
注:*P<0.05。图4 癌旁组织和卵巢上皮癌组织中CPT2的表达(放大倍数×200和×400)
2.4 卵巢上皮癌患者临床病理参数与CPT2表达水平的关系
在121例卵巢上皮癌患者中,Ⅰ型卵巢癌47例,CPT2低表达占29.8%,Ⅱ型卵巢癌74例,CPT2低表达占59.5%,两者比较差异有统计学意义(P<0.001);Ⅲ~Ⅳ期97例,CPT2低表达占57.7%,Ⅰ~Ⅱ期24例,CPT2低表达占8.3%,两者比较差异有统计学意义(P<0.001);低分化93例,CPT2低表达占59.1%,高中分化28例,CPT2低表达占10.7%,两者比较差异有统计学意义(P<0.001);有网膜转移53例,CPT2低表达占58.5%;无网膜转移68例,CPT2低表达占39.7%,两者比较差异有统计学意义(P<0.05);有淋巴结转移69例,CPT2低表达占65.2%,无淋巴结转移52例,CPT2低表达占26.9%,两者比较差异有统计学意义(P<0.05);说明CPT2表达与卵巢上皮癌分型、分期、组织学分级、有无网膜转移和淋巴结转移有关联,见表2。
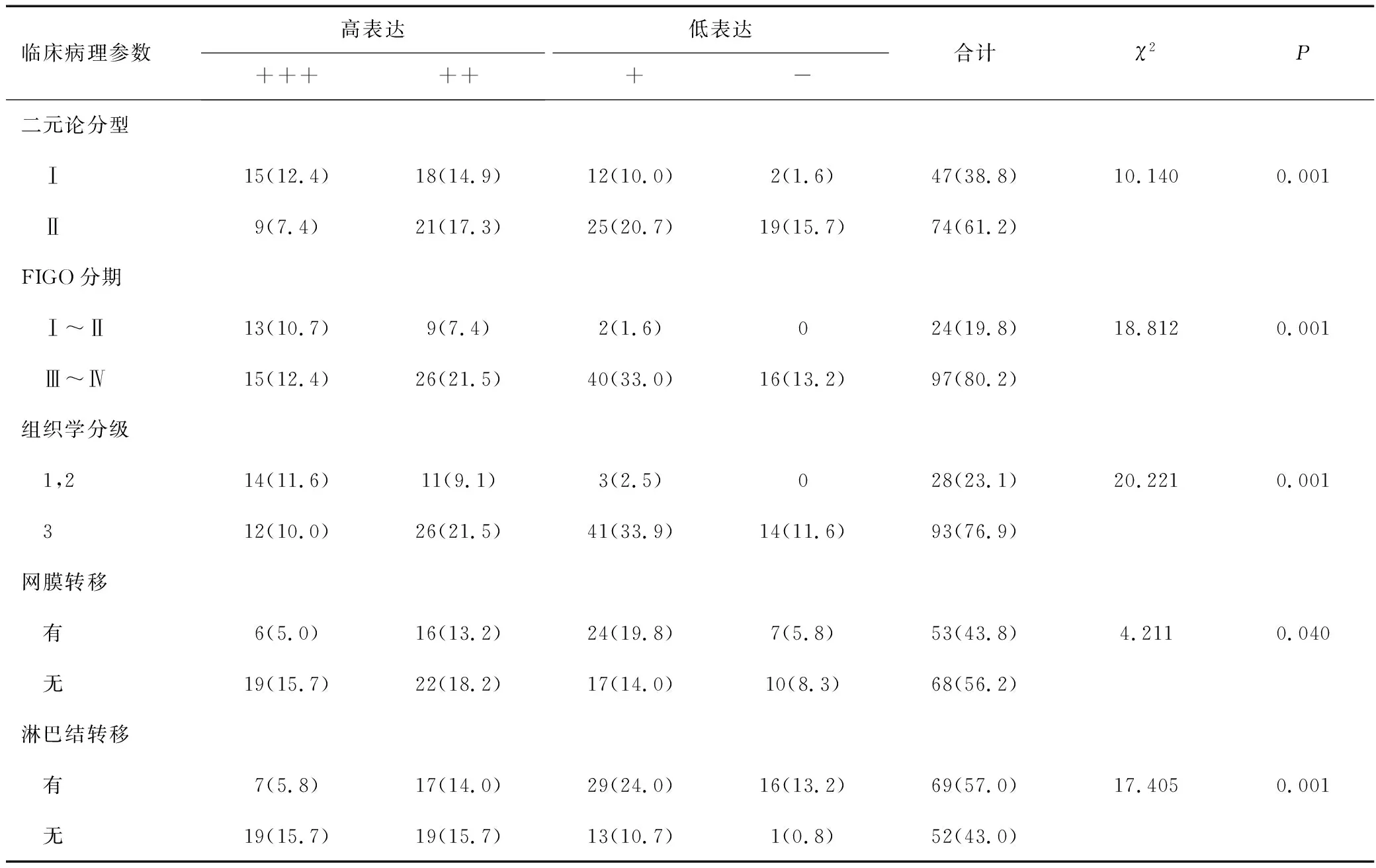
表2 CPT2表达水平与121例卵巢上皮癌患者临床病理参数的比较结果[n(%)]
2.5 卵巢上皮癌患者的预后与CPT2表达水平的关系
生存分析曲线显示,与CPT2高表达的卵巢上皮癌患者相比,CPT2低表达的患者总体生存期(OS)明显较短,差异有统计学意义(χ2=4.781,P=0.029),见图5A;Kaplan Meier生存预后分析也证实这一结果(HR=0.790,95%CI:0.650~0.950,P=0.011),见图5B;以上说明在卵巢上皮癌组织中,CPT2的低表达与患者的不良预后显著关联。
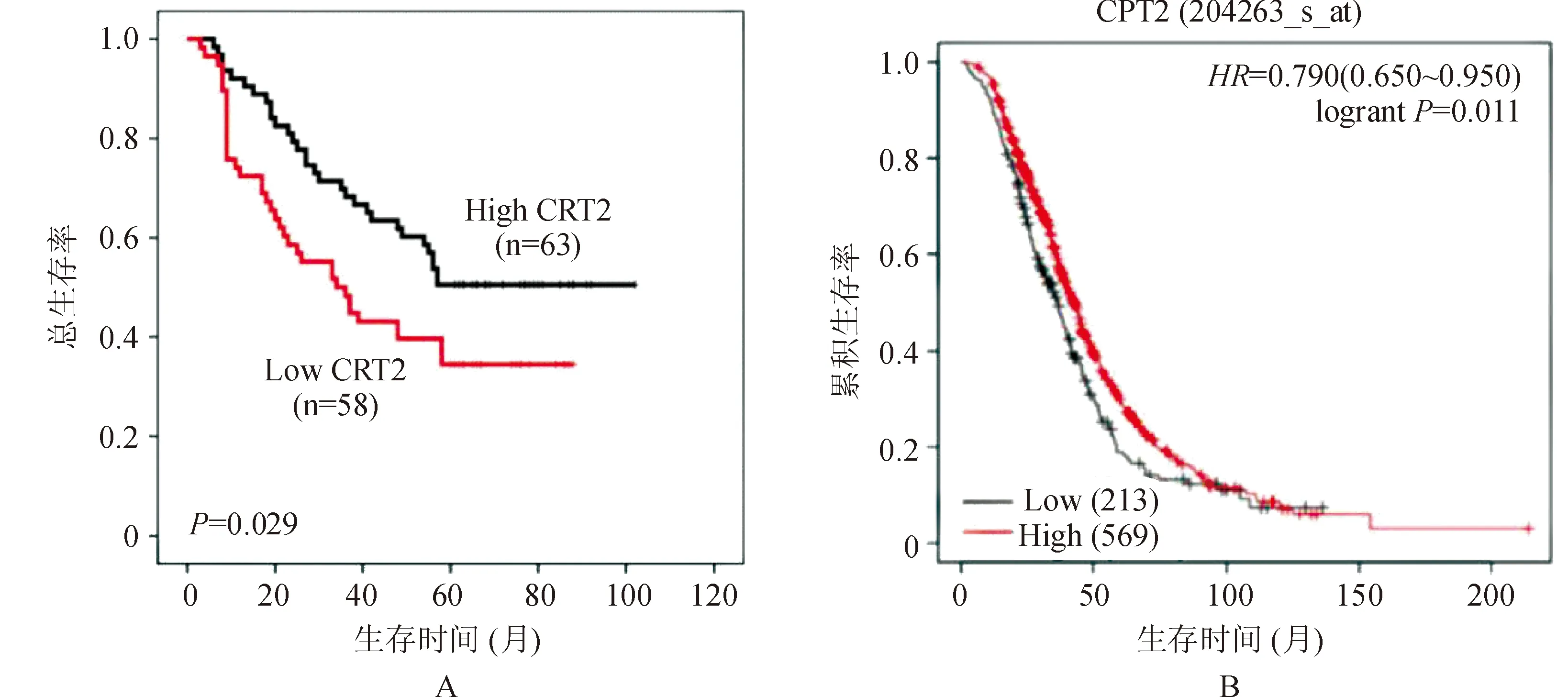
注:A为总生存率分析;B为Kaplan-Meier plot生存曲线。
3 讨论
3.1 不同类型癌组织中CPTs的表达
脂代谢异常与肿瘤的发生密切相关。本研究中发现,脂肪酸β氧化限速酶CPT2在卵巢癌细胞和卵巢上皮癌组织中的mRNA、蛋白水平均表达下调,提示CPT2在卵巢癌细胞的基因或转录水平均表达下调。然而,最近有研究报道,NKX2-8通过表观遗传学抑制脂肪酸β氧化的关键酶,包括CPT1A和CPT2[10]。因此,NKX2-8等几个翻译后因子也可能参与卵巢癌细胞中CPT2的下调,但尚需进一步证实。CPT2的下调与卵巢上皮癌患者生存期较差显著关联。既往研究也报道了CPT2在肝癌组织中下调,且与肿瘤的组织学分化显著相关[8-9]。相反,CPT1亚单位CPT1A和CPT1C的表达被证明是过表达的,并在几种不同类型的人类恶性肿瘤中发挥潜在致癌基因的功能,包括结直肠癌[11]、甲状腺乳头状癌[12]和肺癌[13]。这些差异可能是由于CPT1在线粒体外膜,而CPT2在线粒体内膜,并在不同的肿瘤类型中发挥不同的作用所致,这仍然需要进一步研究探索。
3.2 CPT2在癌组织中发挥促癌作用
卵巢癌细胞和卵巢上皮癌组织中CPT2的显著下调提示其可能对卵巢癌的发生具有潜在的促癌作用。与本研究结果一致的是,既往关于肝细胞癌的研究也报道了CPT2沉默可以促进肝癌细胞生长的转移能力,进一步研究表明CPT2通过增强硬脂酰辅酶A去饱和酶-1(SCD-1)介导的脂肪生成来抑制肿瘤的生长转移[8]。此外,CPT2沉默还可诱导顺铂耐药细胞的化疗耐药,提示CPT2可能导致应激诱导的细胞死亡[9]。与CPT2相比,CPT1A和CPT1C在结直肠癌细胞和甲状腺乳头状癌中均有促进肿瘤生长和转移的作用[11-12]。以CPT1A为治疗靶点可提高鼻咽癌[14]放疗的疗效。总之,这些发现表明CPTs功能障碍在肿瘤进展中起着至关重要的作用。
综上所述,CPT2在卵巢癌细胞和卵巢上皮癌组织中表达下调,且与不良预后有关,提示CPT2可能发挥重要的肿瘤抑制作用,表明CPT2可作为卵巢上皮癌治疗的潜在预后标志物和干预靶点。

