不同护色处理对山药多糖的结构和免疫活性的影响
严静,曾丽萍,李俊健,黄达荣,黎攀,2,杜冰,2*
1(华南农业大学 食品学院,广东 广州,510642) 2(岭南现代农业科学与技术广东省实验室,广东 广州,510642)
山药又称为怀山药、淮山、薯蓣等,为薯蓣科薯蓣属植物,是传统的药食同源原料,因其有较好的药用价值和可口的风味而深受喜爱[1]。山药富含多糖、氨基酸、淀粉、脂肪酸、多酚和皂苷等活性成分[2],其中多糖为山药最主要成分之一。山药多糖具有降血糖、抗肿瘤、心肌细胞保护和抗氧化等多种生物活性,具有广阔的应用前景和商业价值[3-6]。
山药中的含水量较高,难以长期保存,因此人们往往将其进行深加工或干制处理,以延长其保质期[7-8]。但由于山药中的多酚氧化酶和多酚类物质的含量较高[9],在加工过程中极易发生褐变。褐变不仅会影响山药的外观,还会使山药的营养价值降低。目前对山药褐变的护色措施较多采用的是含硫护色剂,亚硫酸钠等含硫护色剂不仅可以抑制褐变,还具有一定的漂白抑菌效果。尽管采用含硫护色剂能取得较好的护色效果,但可能会使山药中的残硫量超标,导致出现食品安全问题,影响人体健康[10]。故研究者也在尝试采用无硫护色剂护色,如柠檬酸、D-异 抗坏血酸、氯化钙等,但相关研究表明三者复配时护色效果较好,单一使用时护色效果较差[11]。本课题组将产乳酸芽孢杆菌发酵液和亚硫酸钠溶液作为护色剂对山药进行护色处理,比较二者护色能力和对山药粗多糖免疫活性的影响,发现发酵液护色(fermentation color-protection,CYF)不仅能有效抑制山药中过氧化物酶(peroxidase,POD)和多酚氧化酶(polyphenol oxidase,PPO)的活性,且抑制能力强于亚硫酸钠护色(sodium nitrite color-protection,CYN),发酵液护色还能提高山药多糖的免疫活性,说明产乳酸芽孢杆菌护色液是一种有效的非硫护色方法,有一定的应用价值[12]。
不同的加工或提取方式均会使多糖的结构发生改变,从而影响多糖的活性[13],研究者较多研究不同提取工艺对山药多糖活性的影响[14]。而护色作为山药加工中的重要环节,不同护色处理对山药多糖结构和免疫活性的影响却鲜见报道。在之前的研究基础上,对山药粗多糖进行分离纯化得到3个组分:清水组分、0.1 mol/L NaCl组分、0.3 mol/L NaCl组分,采用CYF、CYN等不同处理方式,进一步探究不同护色处理的同一组分和同一护色处理的不同组分的山药多糖的结构特性和免疫活性,为山药的新型护色工艺进一步研究奠定基础。
1 材料与方法
1.1 材料与试剂
山药,华南农业大学三角市;乳酸芽孢杆菌(Bacillussp.)DU-106,筛选自传统发酵奶酪,现由华南农业大学新资源食品及功能性原料评价及研究中心鉴定及保藏,并委托广州市微生物所制成1×1012CFU/g 的菌粉,作为发酵实验使用;RAW264.7细胞,中大细胞库。
间羟基联苯,广州化学试剂厂;葡萄糖醛酸,广东光华化学厂有限公司;牛血清蛋白,北京中科质检生物技术有限公司;葡萄糖标准品,广州分析测试中心科力技术开发公司;单糖标准品,广州分析测试中心科力技术开发公司;胎牛血清,法国Biowest公司;DMEM高糖培养基,Gibco公司;脂多糖(lipopolysaccharide,LPS),齐云生物试剂有限公司;CCK-8试剂盒,日本同仁化学研究所;细胞因子试剂盒,上海酶联生物科技有限公司。
1.2 仪器与设备
SH型CO2细胞培养箱,上海善志仪器设备有限公司;LC-20AT型高效液相色谱仪,日本岛津公司;GC6890型气相色谱-质谱仪,美国安捷伦公司;HH-8型数显恒温水浴锅,金坛友联仪器研究所;Laborata 4000型旋转蒸发仪,德国 Heidolph 公司;DGG-9070B型鼓风干燥箱,上海森信实验仪器有限公司;UV759型紫外分光光度计,上海精密科学仪器有限公司;ANKE TDL-5-A型离心机,上海安亭分析仪器有限责任公司;Labserv K3型酶标仪,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 发酵护色液的制备
乳酸芽孢杆菌发酵护色液:分别称取乳清粉20 g、硫酸镁1 g、磷酸氢二钾2 g、硫酸锰0.5 g和葡萄糖10 g溶解于一定量的水中,加水定容至1 L,分装灭菌,得发酵培养基。将乳酸芽孢杆菌粉接种至发酵培养基中,接种量为0.1%,置于180 r/min,37 ℃的摇床中发酵,采用0.22 μm滤膜过滤,得乳酸芽孢杆菌发酵液,将所得的乳酸芽孢杆菌发酵液按照一定比例加水混合均匀,得乳酸芽孢杆菌发酵护色液[12]。
亚硫酸钠对照组护色液:配制0.1%(质量分数)的亚硫酸钠溶液。
清水护色(water color-protection, CYH)液:对照组,采用等量一级水。
1.3.2 不同护色处理山药的粗多糖提取
挑选无病虫斑的山药块茎,用清水冲洗,切成薄片,分别用不同护色液护色后,置于烘箱烘干,得干山药片。将干山药片粉碎后过20目筛,按料液比1∶60(g ∶mL),沸水浸提2 h 2次,抽滤,用3倍体积的95%(体积分数,下同)乙醇沉淀,4 ℃静置过夜,沉淀物用少量75%乙醇冲洗2遍后,3 000 r/min离心10 min, 得到的沉淀用少量水溶解。按4∶1的体积比加入Sevage试剂去蛋白,采用2 000 Da透析袋在4 ℃ 下用一级水透析,每12 h换1次水。透析后的多糖溶液真空冷冻干燥48 h,得到粗多糖样品。其中,清水浸泡处理的山药所得到的粗多糖命名为清水山药粗多糖(CYH);同理,亚硫酸钠溶液护色处理的山药所得到的粗多糖为亚硫酸钠山药粗多糖(CYN),发酵护色液处理的山药所得到的粗多糖为发酵液山药粗多糖(CYF)。
1.3.3 不同护色处理山药的粗多糖纯化
3种山药粗多糖(CYH、CYN、CYF)经过阴离子交换柱DEAE-Sepharose Fast Flow,在不同浓度NaCl洗脱液下进行分离纯化。分别采用清水洗脱、0.1 mol/L NaCl溶液洗脱、0.3 mol/L NaCl溶液洗脱下得到了3个组分:清水组分、0.1 mol /L NaCl组分、0.3 mol/L NaCl组分,分别命名为CYHA-1、CYNA-1、CYFA-1;CYHA-2、CYNA-2、CYFA-2;CYHA-3、CYNA-3、CYFA-3,重复收集后将其冻干。9种不同的山药多糖(CYHA-1、CYHA-2、CYHA-3、CYNA-1、CYNA-2、CYNA-3、CYFA-1、CYFA-2、CYFA-3)经过葡聚糖凝胶柱纯化后,分别命名为CYH-1、CYH-2、CYH-3、CYN-1、CYN-2、CYN-3、CYF-1、CYF-2、CYF-3。
1.3.4 山药多糖的结构鉴定
1.3.4.1 山药多糖分子质量测定
采用高效凝胶渗透色谱法测定山药多糖的分子质量。测定条件为:流动相为磷酸缓冲液;进样量20 μL; 流速为0.5 mL/min;洗脱时间80 min;色谱柱:TSK-GelG5000PWXL与G3000PWXL串联使用。选用标准品的重均分子质量分别为:1 000、5 000、25 000、 150 000、270 000 Da,根据分子质量和色谱图保留时间绘制标准曲线。以保留时间为横坐标,以相对分子质量的对数为纵坐标绘制标准曲线y=-0.281 2x+8.503 8,R2=0.978 9。根据线性回归方程计算山药多糖的分子质量。
1.3.4.2 山药多糖的单糖组成
参考黄晓兰等[15]的方法并稍作修改。将山药多糖水解并乙酰化后用 GC-MS分析其单糖组成,将核糖、阿拉伯糖、鼠李糖、葡萄糖、甘露糖、木糖、半乳糖等单糖对照品同时乙酰化进行对照。
程序升温条件为:180 ℃保留1 min,20 ℃/min升温至280 ℃保留10 min,40 ℃/min升温至300 ℃保留10 min。载气(氮气/空气),柱流速1.8 mL/min,压力150 kPa;色谱柱:Agilent HP-5MS。
1.3.4.3 山药多糖的红外光谱分析
称量9种山药多糖样品各5 mg,分别与200 mg溴化钾在干燥环境下充分混合研磨,模具中压片,在4 000~400 cm-1进行红外光谱扫描,对所得的红外图谱进行分析。
1.3.4.4 山药多糖的糖醛酸含量
采用硫酸-间羟基联苯法[16]测定糖醛酸含量,葡萄糖醛酸标准曲线为y=0.021 6x+0.021 4,R2=0.999 3。
1.3.4.5 山药多糖的刚果红实验
多糖样品溶液与刚果红溶液混合后,加入不同浓度的NaOH溶液,浓度梯度从0~0.5 mol/L,混合体系在室温下反应25 min后,采用紫外分光光度计在400~600 nm波长内进行扫描[17]。
1.3.5 山药多糖的免疫调节活性研究
1.3.5.1 RAW264.7细胞的培养
RAW264.7细胞培养在含10%胎牛血清的DMEM培养基中,在5%(体积分数) CO2、37 ℃的培养箱中培养,取处于对数生长期的细胞进行试验。
1.3.5.2 CCK-8法检测细胞增殖活性
参照CHEN等[18]的方法,略有更改。采用CCK-8法检测细胞增殖活性,将RAW264.7细胞以密度1.0×105个/mL 在96孔板中每孔加入100 μL的细胞悬浮液,将培养板置于37 ℃、体积分数为5% CO2培养箱中孵育24 h。然后按不同组别加入100 μL梯度质量浓度(1 000、500、250、125、62.5、31.25、15.625 μg/mL)的山药多糖培养液孵育24 h。孵育24 h后,在每孔中加入10 μL CCK-8溶液,摇动4 h。在450 nm处测定吸光度,计算RAW264.7细胞增殖率。
实验分为试验组、空白对照组和LPS对照组,试验组为在含10%胎牛血清的DMEM培养基中加入不同质量浓度梯度(1 000、500、250、125、62.5、31.25、15.625 μg/mL)的山药多糖;空白对照组为含10%胎牛血清的DMEM培养基;LPS对照组为LPS浓度为1 μg/mL, 采用10%胎牛血清的DMEM培养基溶解。
细胞增殖率按式(1)计算:

(1)
式中:OD实验组为实验组在450 nm下的OD值;OD空白对照组为空白对照组在450 nm下的OD值。
1.3.5.3 不同护色处理的山药多糖对RAW264.7细胞分泌细胞因子的影响
根据制造商的说明使用ELISA试剂盒检测细胞培养基中肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)、细胞白介素-1β(interleukin-1β, IL-1β)、细胞白介素-6(interleukin-6, IL-6)的含量。
1.3.5.4 不同护色处理的山药多糖对RAW264.7细胞释放NO的影响
根据制造商的说明采用NO检测试剂盒测定细胞上清液中NO的水平,试剂盒采用的是Griess法。
1.4 数据处理
数据结果采用Excel2016、Origin9.1、DPS 7.0和GrapPad Primsm8等统计分析软件进行数据分析并作图。与空白对照组对比显著用*表示,P<0.05,极显著用**表示,P<0.01。
2 结果与分析
2.1 不同护色处理对山药多糖的结构的影响
2.1.1 不同护色处理对山药多糖的分子质量的影响
分子质量的测定是分析多糖特点和结构的重要手段,多糖的分子质量大小与其性质如溶解度、黏性有关,同时也与其生物活性密切相关[19]。不同护色处理的山药多糖的分子质量如表1所示。由表1可知,9种山药多糖的分布宽均较小,即分布宽度较窄,说明多糖的分子质量均一性较好,由此也说明多糖的纯度较高。同一护色处理的山药所制备的3种不同组分的多糖(如CYF-1、CYF-2、CYF-3)中,清水组分CYF-1的分子质量最小,而0.3 mol/L NaCl洗脱所得的组分(CYF-3)的分子质量最大。说明在同一护色处理的山药中,随着洗脱液浓度的增大,其洗脱下来的组分的分子质量也随之增大。

表1 不同护色处理的山药多糖的分子质量
不同护色处理的山药在同一浓度的洗脱液洗脱下的多糖组分中(如CYN-1、CYN-1、CYF-1),经过乳酸芽孢杆菌发酵液护色和亚硫酸钠护色处理的山药多糖的分子质量较为接近,但与清水护色处理的山药多糖的分子质量差异较大。而且不同护色处理对山药多糖分子质量的影响在不同组分中影响不同,0.3 mol/L NaCl组分(CYH-3、CYN-3、CYF-3)的山药多糖经不同护色处理分子质量差异最大。由此表明,不同护色处理会使得山药多糖的分子质量发生改变。
2.1.2 不同护色处理对山药多糖的单糖组成的影响
不同护色处理的山药多糖的单糖组成如表2所示。由表2可知,山药多糖主要由甘露糖、葡萄糖、鼠李糖、阿拉伯糖、木糖、半乳糖、核糖组成。

表2 不同护色处理的山药多糖的单糖组成
CYH-1、CYN-1、CYF-1中葡萄糖的含量最高,其次是甘露糖,而鼠李糖、核糖、木糖和阿拉伯糖的含量均较低,不足2%,CYH-1、CYN-1、CYF-1的单糖组成没有明显差异。山药多糖中的葡萄糖含量较高,可能是由于山药中的淀粉含量高[20]。在CYH-2、CYF-2中,葡萄糖的含量最高,其次半乳糖;而在CYN-2中,葡萄糖的含量最高,其次是甘露糖,说明CYH-2、CYN-2、CYF-2的单糖组成存在差异。而在CYH-3、CYN-3、CYF-3中,不同护色处理对山药多糖的单糖组成影响更加显著。CYH-3中,半乳糖含量最高,其次是鼠李糖,甘露糖含量最低;CYN-3中,半乳糖含量最高,其次是阿拉伯糖,木糖含量最低;CYF-3中,半乳糖含量最高,其次是葡萄糖,核糖含量最低。由上可得,不同护色处理会使山药多糖的单糖组成发生改变,且不同护色处理对于山药多糖的单糖组成的影响在个别组分中影响明显,特别是0.3 mol/L NaCl组分。
2.1.3 不同护色处理对山药多糖的刚果红实验结果的影响
多糖的生物活性不仅与其分子质量和单糖组成有关,还与其结构有关。研究表明多糖的抗肿瘤活性不仅与多糖的一级结构有关,更与高级结构有关[21],在多糖的空间结构中,刚果红可以与具有3股螺旋结构的多糖进行络合,形成络合物的最大吸收波长与刚果红溶液的最大吸收波长相比将会发生红移,并且随着NaOH浓度的增加,其最大吸收波长会先增大后减小[22-23]。不同护色处理的山药多糖与刚果红混合后,混合溶液的最大吸收波长随NaOH浓度的变化曲线如图1所示。

图1 不同护色处理的山药多糖的刚果红实验结果
由图1可知,刚果红溶液的最大吸收波长为495 nm, 而在不同护色处理的山药多糖中,CYH-3、CYN-3、CYF-3与刚果红的混合溶液的最大吸收波长分别为503、502、504 nm,高于刚果红溶液的最大吸收波长,说明CYH-3、CYN-3、CYF-3具有3股螺旋结构。随着NaOH的浓度升高,混合溶液的最大吸收波长逐渐降低,表明3股螺旋结构遭到了破坏。其他山药多糖如CYH-1、CYH-2、CYF-1、CYF-2、CYN-1、CYN-2与刚果红混合溶液的最大吸收波长与刚果红溶液的最大吸收波长相似,表明CYH-1、CYH-2、CYF-1、CYF-2、CYN-1、CYN-2不具有3股螺旋结构[24-25]。
2.1.4 不同护色处理对山药多糖的红外图谱的影响
红外光谱是分析多糖结构有利的工具,可根据多糖的特征吸收峰鉴定多糖的结构。不同护色处理山药多糖的红外图谱如图2所示。3 600~3 200 cm-1处强而宽的吸收峰是O—H的伸缩振动;1 400~1 200 cm-1处是C—H的变角振动,与2 930 cm-1处的C—H的伸缩振动构成了糖环的特征吸收,以上这些特征吸收峰是多糖类物质的一般特征,说明该物质为糖类物质。9种山药多糖在这些位置均有强吸收峰,说明9种山药多糖符合糖类物质的一般特征[26]。

A-清水对照组;B-亚硫酸钠对照组;C-发酵护色组
在CYH-2、CYN-2、CYF-2中,CYH-2在1 736 cm-1处的吸收峰为酯羰基伸缩振动,含糖醛酸的多糖样品在1 750~1 700 cm-1内会产生吸收,说明CYH-2含有糖醛酸。若多糖中糖醛酸残基含量较低,糖醛酸的特征吸收峰有可能被掩盖,在红外图谱中难以发现其特征峰,所以仍需采用其他方法探究糖醛酸的存在[27]。CYF-2在853 cm-1处存在特征吸收峰,说明其含有α-型糖苷键。CYH-2在1 200~1 000 cm-1出现2个吸收峰,说明其单糖组成中可能含有呋喃糖;而CYF-2、CYN-2在此区间出现3个吸收峰,则表明其单糖组成中可能含有吡喃糖。在CYH-3、CYN-3、CYF-3中,CYN-3在1 145 cm-1处特征吸收峰分别为羧酸基的对称伸缩振动引起[28];CYF-3和CYH-3在890 cm-1附近具有强吸收峰,表明其含有β-型糖苷键。由红外谱图得,不同护色处理的山药多糖的结构有一定的差异。
2.1.5 不同护色处理对山药多糖糖醛酸含量的影响
9种山药多糖的糖醛酸含量如图3所示。研究表明糖醛酸具有清除DPPH自由基和超氧阴离子自由基的作用,故糖醛酸含量的高低可能会影响多糖的生物活性[29]。由图3可知,由同一护色处理的山药中分离纯化得到的不同组分多糖(如CYF-1、CYF-2、CYF-3)可知,0.3 mol/L NaCl洗脱液洗脱得到的组分多糖的糖醛酸含量最高,而清水组分多糖的糖醛酸含量最低。

图3 不同护色处理的山药多糖的糖醛酸含量
而对比不同护色处理的同一组分多糖的糖醛酸含量也具有差异。其中,在0.3 mol/L NaCl的洗脱液洗脱下得到的组分多糖的糖醛酸含量差异最大,发酵液护色组和亚硫酸钠护色组的糖醛酸含量显著高于清水护色组,与HUANG等[30]和张志红[31]的研究结果一致。说明不同护色处理对山药多糖的糖醛酸含量有一定影响。
2.2 不同护色处理对山药多糖的免疫活性的影响
2.2.1 不同护色处理对山药多糖刺激细胞增殖的影响
不同护色处理山药多糖对细胞增殖率的影响如图4所示。由图4可知,随着山药多糖质量浓度的增加(15.625~1 000 μg/mL),对RAW264.7细胞没有显示出明显的毒性。故将山药多糖的质量浓度选定在15.625~1 000 μg/mL,用于后续研究。

A-清水组分;B-0.1 mol/L NaCl组分;C-0.3 mol/L NaCl组分
2.2.2 不同护色处理对山药多糖刺激巨噬细胞分泌TNF-α水平的影响
不同护色处理的山药多糖对RAW264.7细胞分泌抗TNF-α的影响如图5所示。由图5可知,与对照组相比,9种山药多糖均能刺激RAW264.7细胞分泌TNF-α,呈现出明显的浓度依赖性。在高浓度刺激下,RAW264.7细胞分泌TNF-α的水平更高。

A-清水组分;B-0.1 mol/L NaCl组分;C-0.3 mol/L NaCl组分
在CYH-1、CYN-1、CYF-1中,多糖质量浓度在125~1 000 μg/mL时,CYF-1刺激RAW264.7细胞分泌TNF-α的水平最高;多糖质量浓度在15.625~62.5 μg/mL时,CYH-1、CYN-1、CYF-1诱导分泌TNF-α的水平没有明显差异。当多糖质量浓度低于125 μg/mL 时,CYF-2和CYH-2刺激RAW264.7细胞分泌TNF-α的量明显高于CYN-2。在CYH-3、CYN-3、CYF-3中,CYH-3和CYF-3在各浓度下诱导分泌TNF-α的能力无显著性差异,但分泌能力均高于用CYN-3。
总体来说,9种山药多糖均能促进TNF-α的分泌,并呈现浓度依赖性。在特定浓度下,发酵液护色组的促进效果与清水护色组相似,并显著优于亚硫酸钠护色组,这可能是因为亚硫酸钠护色处理的多糖组分下调ERK1/2、JNK蛋白磷酸化的表达和MAPK信号通路有关,导致免疫调节活性下降[32]。
2.2.3 不同护色处理对山药多糖刺激巨噬细胞分泌IL-6水平的影响
不同护色处理的山药多糖对RAW264.7 IL-6的影响如图6所示。由图6可知,9种山药多糖均能诱导分泌IL-6,IL-6的分泌量随着多糖浓度的增加而增加,呈现剂量浓度依赖。在CYH-1、CYN-1、CYF-1中,CYF-1刺激RAW264.7细胞分泌IL-6的水平大于CYN-1;在质量浓度为31.25~1 000 μg/mL 时,CYH-2、CYN-2、CYF-2诱导分泌IL-6的水平无显著差异,但当多糖质量浓度仅为15.625 μg/mL时,CYN-2诱导分泌IL-6的能力远低于CYH-2和CYF-2。CYH-3、CYN-3、CYF-3诱导分泌IL-6的水平在各个浓度下均无显著差异,但CYF-3诱导分泌IL-6的能力更强。
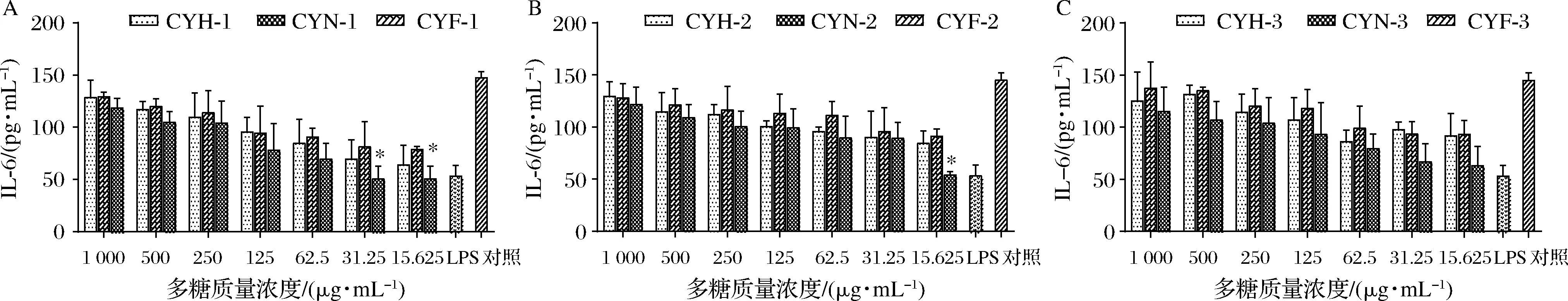
A-清水组分;B-0.1 mol/L NaCl组分;C-0.3 mol/L NaCl组分
由6可知,不同护色处理的山药多糖均能诱导IL-6的产生,具有浓度依赖性。并且在特定浓度下,发酵护色组的山药多糖诱导分泌IL-6的能力强于亚硫酸钠护色组,这可能与发酵液护色的山药多糖的糖醛酸含量升高,单糖组成中甘露糖含量增多有关,使其免疫活性增强[33]。
2.2.4 不同护色处理对山药多糖刺激巨噬细胞分泌IL-1β水平的影响
不同护色处理山药多糖对刺激RAW264.7细胞分泌白介素-1β(IL-1β)的影响如图7所示。由图7可知,9种山药多糖对RAW264.7细胞分泌IL-1β有显著促进作用,但是浓度依赖性不强。
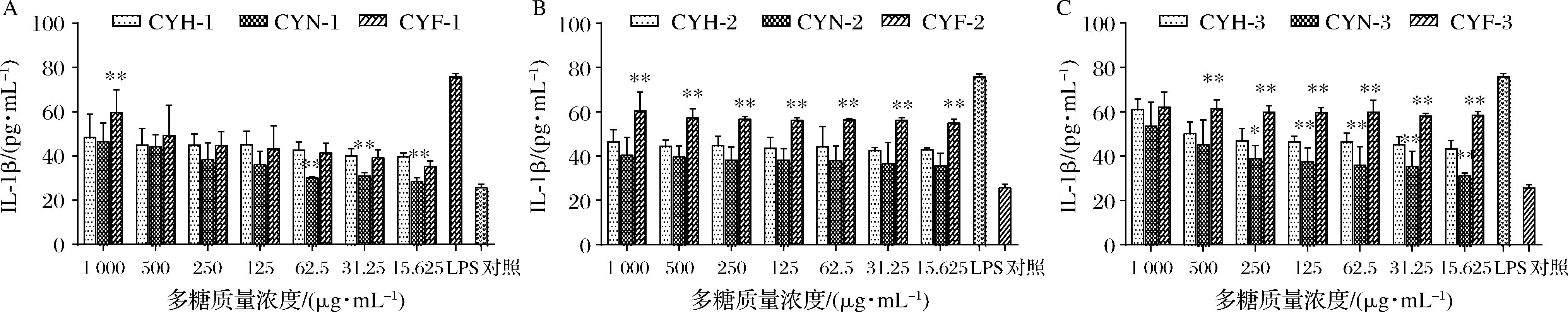
A-清水组分;B-0.1 mol/L NaCl组分;C-0.3 mol/L NaCl组分
在高浓度下,CYH-1、CYN-1、CYF-1诱导分泌IL-1β的水平无显著差异,但当多糖质量浓度低于125 μg/mL时,CYN-1对刺激细胞分泌IL-1β的水平显著低于CYF-1和CYH-1;在特定质量浓度下,CYF-2诱导分泌IL-1β的能力显著强于CYH-2和CYN-2;多糖质量浓度在15.625~500 μg/mL内,CYF-3诱导分泌IL-1β的水平显著大于CYN-3。由上可得,不同护色处理的山药多糖均能促进细胞因子IL-1β的分泌,且发酵护色组促进分泌IL-1β的水平最高,说明采用发酵液护色可以提高山药多糖的免疫活性。
2.2.5 不同护色处理对山药多糖刺激巨噬细胞释放NO水平的影响
NO是RAW 264.7细胞杀伤肿瘤细胞,参与抵抗细菌、真菌及寄生虫等感染的炎症反应的重要因子,近年的研究表明[34],RAW264.7细胞在受到刺激后产生NO,在免疫过程中起重要作用。9种山药多糖对RAW264.7细胞释放NO的影响如图8所示。由图8可知,与对照组相比,9种山药多糖均能促进NO的释放,并呈现一定的浓度依赖性。在CYH-1、CYN-1、CYF-1中,CYH-1和CYF-1促进NO释放的能力明显优于CYN-1。多糖质量浓度在125~1 000 μg/mL时,CYH-2、CYF-2释放NO的水平显著优于CYN-2;多糖质量浓度为15.625~63.5 μg/mL时,RAW264.7细胞释放NO水平没有显著差异,CYH-3、CYN-3、CYF-3也呈现同样的变化规律。由此可得,在高浓度下,发酵护色处理的山药多糖诱导巨噬细胞释放NO的水平强于亚硫酸钠护色处理的山药多糖,说明发酵护色的山药多糖可作为潜在的免疫刺激剂,诱导细胞因子的产生。

A-清水组分;B-0.1 mol/L NaCl组分;C-0.3 mol/L NaCl组分
3 结论
本实验通过水提醇沉提取粗多糖,经阴离子交换柱和葡聚糖凝胶柱纯化后,均能得到3种山药组分多糖:清水组分、0.1 mol/L NaCl组分、0.3 mol/L NaCl组分。经过不同护色处理(清水护色处理、亚硫酸钠护色处理、发酵液护色处理)的山药多糖的结构存在显著差异,其中0.3 mol/L NaCl 组分的差异最明显,CYH-3、CYN-3、CYF-3 在分子质量、单糖组成、糖醛酸含量上都存在明显差异。
相比于对照组,不同护色处理的山药多糖均能促进RAW264.7细胞分泌TNF-α、IL-6、IL-1β、NO,但对不同细胞因子的影响,可能因为RAW264.7细胞分泌不同的细胞因子所涉及的信号通路不同,因此不同护色处理的山药多糖对RAW264.7细胞分泌细胞因子的影响不同。经过不同护色处理,山药多糖的免疫活性存在显著差异。其中,在特定浓度下,发酵液护色处理的山药多糖的免疫活性明显强于亚硫酸钠护色处理的山药多糖。